Циклофосфамид при красной волчанке
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапи
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапии метилпреднизолоном (МП) и циклофосфаном (ЦФ) у больных с волчаночным нефритом, поражением центральной нервной системы (ЦНС) и цитопеническим кризом способствует ускорению сроков достижения клинического улучшения. Патофизиологическим обоснованием для применения ударных доз метилпреднизолона является его способность активно влиять на систему иммунитета и подавлять воспалительные реакции. Один из важнейших эффектов ударных доз КГ — подавление активности нейтрофилов и моноцитов и способность вызывать транзиторную перераспределительную лимфопению. Угнетающее воздействие мегадоз кортикостероидов на функцию В-лимфоцитов приводит к стойкому снижению продукции иммуноглобулинов, а следовательно, и аутоантител, а также к уменьшению образования патологических иммунных комплексов. Из других важных компонентов механизма действия ударных доз КГ заслуживают внимания воздействие на систему цитокинов-интерлейкинов-1,6, фактора некроза опухоли, металлопротеиназ и липокортина, ингибиция экспрессии и функциональной активности Fc и СЗ рецепторов мононуклеарных фагоцитов.
Консервативная терапия с использованием подавляющих доз преднизолона и цитостатиков, назначаемых внутрь, у некоторых больных улучшает клиническую картину, но почти не влияет на жизненный прогноз, особенно в случаях прогрессирующего волчаночного нефрита, церебрального криза и геморрагического пневмонита. Однократное трехдневное применение ПТ МП может за сравнительно короткое время уменьшить клиническую и лабораторную активность при нефротическом синдроме. Однако 5-летняя выживаемость пациентов, как правило, не превышает 60%. Другими словами, ударные дозы МП прекрасно зарекомендовали себя в качестве фактически ургентной терапии, с успехом применяющейся в ситуациях, непосредственно угрожающих жизни пациента, при нарастании симптоматики и в случаях неэффективности или невозможности использования консервативной схемы лечения.
Практически при всех прогрессирующих хронических заболеваниях, в том числе и аутоиммунных, жизненный и социальный прогноз в огромной степени зависит от системного, программного подхода к терапии.
Различные схемы и программы интенсивной терапии у больных СКВ стали появляться уже с середины 80-х годов и сводились к назначению ПТ в ежемесячном режиме в течение полугода. Несколько позже появилась схема программного назначения ПТ в комбинации с циклофосфаном: 1 г циклофосфана может быть добавлен к стандартной пульс-терапии обычно на 2-3-й день лечения или дополнительно к метипреду при ежемесячном режиме. Показанием для комбинированного использования циклофосфана и метипреда является манифестная высокоактивная СКВ с выраженными иммунологическими нарушениями. Программное применение пульс-терапии ЦФ у больных быстро прогрессирующим люпус-нефритом впервые в стране предложила группа исследователей во главе с профессором И. Е. Тареевой. Согласно этой методике, ЦФ вводится внутривенно из расчета 1 г на 1 м 2 поверхности тела 1-2 раза в месяц в течение года. По сравнению с пероральным назначением ЦФ эта программа позволяет добиться хороших и стабильных результатов более чем у 70% больных с прогрессирующим нефритом. Особенно важным представляется то, что внутривенное введение мегадоз ЦФ оказывает значительно меньшее токсическое воздействие на эпителий мочевого пузыря и костный мозг, практически не вызывая геморрагических циститов и агранулоцитоза.
Другое направление интенсивной терапии ревматических заболеваний — экстракорпоральные методы лечения: плазмаферез (ПФ) и практически все сорбционные технологии, гемо- и плазмосорбция. В современном исполнении ПФ осуществляется с помощью центрифужной или мебранной технологии с удалением 40-60 мл плазмы на 1 кг веса больного. Для замещения потери белка используется альбумин или свежезамороженная плазма. Стандартные курсы ПФ состоят из 3-6 процедур, проводимых последовательно или с короткими интервалами, с суммарной эксфузией плазмы до 15 л.
Интерес к ПФ у ревматологов возник на рубеже 60-80-х годов после фундаментальных исследований, посвященных иммунокомплексной природе СКВ, изучению механизмов иммунокомплексного поражения органов и тканей и патогенетической роли антител к нативной ДНК. Представлялось вполне рациональным уменьшить степень тканевых повреждений за счет удаления из циркуляции иммунных комплексов (ЦИК), антител к ДНК (а-ДНК), криоглобулинов и цитокинов.
Первые попытки применения терапевтического ПФ у больных СКВ продемонстрировали возможности этого метода в первую очередь в ситуациях, когда кортикостероидная и иммуносупрессивная терапия оказывается неэффективной, при наличии высокого уровня ЦИК, а-ДНК, криоглобулинемии, цитопениях. Выявлена прямая зависимость между адекватным удалением из циркуляции патологических белковых структур и клиническим эффектом, изучены механизмы деблокирования РЭС и повышения естественного клиренса.
Эффективность плазмафереза (от нескольких процедур до многократно повторяемых серий при неблагоприятном течении СКВ) хорошо известна и доказана в ходе многочисленных, в основном зарубежных, исследований 80-90-х годов. Пока не получено убедительных данных об эффективности ПФ у больных люпус-нефритом. Результаты проведенных в США и Канаде открытых и контролируемых испытаний весьма противоречивы.
Идея синхронной ИТ материализовалась уже в 80-х годах и является практически неотъемлемой частью лечения некоторых системных васкулитов, синдрома Гудпасчера, Вегенера, Хаммана-Ричи, криоглобулинемической пурпуры и поражения центральной и периферической нервной системы при болезни Шегрена. Первые успешные попытки применения синхронной ИТ у больных СКВ были предприняты в 1984 году в Японии, России и Германии: за рубежом — плазмаферез в комбинации с ЦФ, в России — ПФ в комбинации с пульс-терапией МП и ЦФ.
В Институте ревматологии начиная с середины 80-х изучалась эффективность синхронного применения ПФ и пульс-терапии МП и ЦФ у 56 больных СКВ с неблагоприятным жизненным прогнозом. Методика проведения синхронной интенсивной терапии (СИТ) заключалась в следующем: в течение первого месяца больным проводились три процедуры ПФ с удалением не менее 1500 мл плазмы за сеанс, интервалы между процедурами составляли 5-6 дней. После каждой процедуры назначался внутривенно 1 г метипреда, а после второй процедуры к МП добавлялся 1 г ЦФ. Далее в течение года через каждые 3 месяца проводилась одна процедура ПФ с последующим введением 1 г МП и 1 г ЦФ. Основу группы составляли молодые женщины, в подавляющем большинстве с небольшим сроком заболевания, с развернутой клиникой СКВ. Почти у каждого пациента наблюдался прогрессирующий волчаночный нефрит, более чем у половины — нефротический синдром, церебропатия, у трети больных на фоне криоглобулинемии наблюдался распространенный генерализованный васкулит кожи и слизистых оболочек. Высокая клиническая активность сопровождалась значительным повышением уровня антител к ДНК, ЦИК и гипокомплементемией.
Особо следует подчеркнуть, что у половины больных этой группы стандартная терапия, включавшая в себя массивные дозы кортикостероидов и иммунодепрессантов, была неэффективной, а почти трети пациентов адекватная терапия вообще не проводилась.
Многолетнее наблюдение за этой группой больных по окончании 12-месячной СИТ позволило сделать заключение о ее высокой эффективности. Среди этих пациентов 5-летняя выживаемость составила 81%. Наиболее показательными оказались результаты применения СИТ в группе из 12 подростков, у которых течение волчанки, как правило, приобретает фатальный характер. За весь период наблюдения состояние, близкое к клинико-лабораторной ремиссии, было отмечено у 8 из 12 больных, у 2 пациентов эпизодически наблюдались кратковременные обострения СКВ. Ежедневная доза преднизолона составляла от 2,5 до 15 мг, у одной пациентки кортикостероиды были полностью отменены. Большинству больных удалось вернуться к нормальной жизни, учебе, посильной работе, некоторые пациентки вышли замуж и имеют здоровых детей.
Таким образом, программа синхронной интенсивной многомесячной терапии оказывает значительное влияние на клинико-лабораторные проявления и существенно улучшает жизненный и социальный прогноз у больных СКВ с прогностически неблагоприятным вариантом течения. Синхронное назначение ПФ и внутривенное введение ударных доз МП и ЦФ могут использоваться по жизненным показаниям в случаях так называемого волчаночного криза — при тромбоцитопенической пурпуре, церебральной коме, развитии тромбозов, инфарктов и инсультов у больных с антифосфолипидным синдромом и геморрагическим пневмонитом. В этих ситуациях проведение СИТ обычно ограничивается 3-4 последовательными процедурами — вплоть до купирования ургентной ситуации. В случаях с заведомо неблагоприятным долгосрочным жизненным прогнозом — прогрессирующий гломерулонефрит или поражение ЦНС, язвенно-некротический васкулит, острое начало болезни у подростка — требуется проведение длительных программ СИТ.
Нам представляется, что возможности программной СИТ далеко не исчерпаны. Перспективным может оказаться добавление в схему внутривенного иммуноглобулина, моноклональных антител и интерферонов, применение которых способно блокировать образование аутоантител и патологических ЦИК. Весьма актуальным остается индивидуальный подбор программы с более частым (ежемесячным, еженедельным) назначением плазмафереза и ПТ. Особенно важным аспектом, обеспечивающим возможность проведения более длительных и полноценных курсов экстракорпоральных процедур, является внедрение новых технологий обработки плазмы, таких, как каскадная фильтрация и иммуносорбция, применение которых позволяет сводить к минимуму потерю альбумина и селективно удалять из циркуляции патологические аутоантитела и иммунные комплексы.
Русское название
Латинское название вещества Циклофосфамид
Химическое название
Брутто-формула
Фармакологическая группа вещества Циклофосфамид
Нозологическая классификация (МКБ-10)
Код CAS
Характеристика вещества Циклофосфамид
Белый кристаллический порошок. Растворим в воде: 40 г/л, мало растворим в спирте, бензоле, этиленгликоле, четыреххлористом углероде, диоксане; трудно растворим в эфире и ацетоне. Молекулярная масса – 279,10.
Фармакология
Биотрансформируется в печени с образованием активных метаболитов, оказывающих алкилирующее действие. Алкилирующие метаболиты атакуют нуклеофильные центры белковых молекул, образуют поперечные сшивки между нитями ДНК и блокируют митоз опухолевых клеток. Обладает широким спектром противоопухолевой активности. Иммунодепрессивное действие проявляется в подавлении пролиферации лимфоцитарных клонов (преимущественно B-лимфоцитов), участвующих в иммунном ответе. При длительном применении (в течение нескольких лет) возможно развитие вторичных злокачественных опухолей (отдаленный эффект): миело- и лимфопролиферативные заболевания, рак мочевого пузыря (особенно у больных с геморрагическим циститом), рак почечной лоханки (отмечен у больного, находившегося на лечении по поводу церебрального васкулита).
Имеются многочисленные сообщения об угнетении функции половых желез у больных, применяющих циклофосфамид (зависит от дозы, продолжительности введения и сочетания с другими противоопухолевыми средствами); у некоторых больных бесплодие может быть необратимым. При назначении в препубертатном возрасте вторичные половые признаки у девочек и мальчиков обычно развиваются нормально, менструальные циклы у девочек проходят регулярно и впоследствии наступает беременность, но у мальчиков возможна олигоспермия или азооспермия, повышение секреции гонадотропина, атрофия яичек. Имеются сообщения о том, что у девочек отмечалось развитие фиброза яичников и полное исчезновение половых клеток после длительного лечения в позднем препубертатном возрасте. Введение мужчинам до зачатия ребенка приводило к появлению пороков развития сердца и конечностей у детей. Применение во время беременности у женщин приводило как к рождению здоровых детей, так и детей с пороками развития (отсутствие пальцев рук и/или ног, пороки развития сердца, грыжи), а также к уменьшению массы тела новорожденных.
Проявляет канцерогенные свойства при введении экспериментальным животным. Использование циклофосфамида во время беременности у животных (мыши, крысы, кролики, обезьяны) в дозах, соответственно составляющих 0,02; 0,08; 0,5 и 0,07 дозы, рекомендуемой для человека, выявило наличие тератогенных свойств.
Хорошо всасывается после приема внутрь (биодоступность 75%). Мало связывается с белками (12–14%), но для некоторых активных производных связывание составляет 60% и более. Биотрансформируется в печени (включая начальную активацию и последующее превращение) с образованием активных метаболитов. Проходит через плацентарный барьер, проникает в грудное молоко. Т1/2 циклофосфамида — 3–12 ч. После в/в введения время достижения Cmax в плазме (для метаболитов) составляет 2–3 ч. Экскретируется в основном с мочой в виде метаболитов (хлоруксусная кислота, акролеин и др.) и в неизмененном виде (5–25%); удаляется при проведении диализа. На фоне почечной недостаточности усиление выраженности токсических эффектов не наблюдалось.
Имеются данные о применении циклофосфамида при гломерулонефрите, системной красной волчанке, неспецифическом аортоартериите, дерматомиозите, рассеянном склерозе, гранулематозе Вегенера.
Применение вещества Циклофосфамид
Мелкоклеточный рак легкого, рак яичников, шейки и тела матки, молочной железы, мочевого пузыря, предстательной железы, семинома яичка; нейробластома, ретинобластома, ангиосаркома, ретикулосаркома, лимфосаркома, хронический лимфо- и миелолейкоз, острый лимфобластный, миелобластный, монобластный лейкоз, лимфогранулематоз, неходжкинские лимфомы, миеломная болезнь, опухоль Вильмса, опухоль Юинга, саркома мягких тканей, остеогенная саркома, герминогенные опухоли, грибовидный микоз; аутоиммунные заболевания, включая системные заболевания соединительной ткани, в т.ч. ревматоидный артрит, псориатический артрит, аутоиммунная гемолитическая анемия, нефротический синдром, подавление реакции отторжения трансплантата.
Противопоказания
Гиперчувствительность, тяжелые нарушения функции почек, гипоплазия костного мозга, лейкопения (число лейкоцитов менее 3,5·10 9 /л) и/или тромбоцитопения (число тромбоцитов менее 120·10 9 /л), выраженная анемия, выраженная кахексия, терминальные стадии онкологических заболеваний, беременность, кормление грудью.
Ограничения к применению
Оценка соотношения риск-польза необходима при необходимости назначения в следующих случаях: ветряная оспа, опоясывающий герпес и другие системные инфекции, нарушение функции почек (мочекаменная болезнь, подагра и др.), печени, тяжелые заболевания сердца, угнетение функции костного мозга, инфильтрация костного мозга опухолевыми клетками, гиперурикемия, цистит, адреналэктомия, предшествующая цитотоксическая или лучевая терапия, пожилой и детский возраст.
Применение при беременности и кормлении грудью
Противопоказано при беременности.
Категория действия на плод по FDA — D.
На время лечения следует прекратить грудное вскармливание.
Побочные действия вещества Циклофосфамид
Со стороны органов ЖКТ : анорексия, стоматит, сухость во рту, тошнота, рвота, диарея, боль в желудке, желудочно-кишечные кровотечения, геморрагический колит, токсический гепатит, желтуха.
Со стороны нервной системы и органов чувств: астения, головокружение, головная боль, спутанность сознания, нарушение зрения.
Со стороны сердечно-сосудистой системы и крови (кроветворение, гемостаз): миелодепрессия, лейкопения, агранулоцитоз, тромбоцитопения, анемия, кровотечения и кровоизлияния, прилив крови к лицу, кардиотоксичность, сердечная недостаточность, сердцебиение, геморрагический миоперикардит, перикардит.
Со стороны респираторной системы: одышка, пневмонит, интерстициальный пневмосклероз.
Со стороны мочеполовой системы: геморрагический цистит, уретрит, фиброз мочевого пузыря, атипия клеток мочевого пузыря, гематурия, учащенное, болезненное или затрудненное мочеиспускание, гиперурикемия, нефропатия, отеки нижних конечностей, гиперурикозурия, некроз почечных канальцев, аменорея, угнетение функции яичников, азооспермия.
Со стороны кожных покровов: алопеция, гиперпигментация (ногтей на пальцах рук, ладоней), в/к кровоизлияния, покраснение лица, сыпь, крапивница, зуд, гиперемия, отечность, боль в месте инъекции.
Прочие: анафилактоидные реакции, болевой синдром (боль в спине, боку, костях, суставах), лихорадочный синдром, озноб, развитие инфекций, синдром неадекватной секреции АДГ , микседема (отечность губ), гипергликемия, повышение активности трансаминаз в крови.
Взаимодействие
Эффект усиливают хлорпромазин, трициклические антидепрессанты, барбитураты, теофиллин, гормоны щитовидной железы, индукторы микросомальных ферментов печени (повышают образование алкилирующих метаболитов), ослабляют ( в т.ч. токсическое действие) — глюкокортикоиды и хлорамфеникол. Другие миелотоксичные препараты, лучевая терапия, аллопуринол могут потенцировать угнетение функции костного мозга. Ослабляет эффективность иммунизации инактивированными вакцинами; при использовании вакцин, содержащих живые вирусы, усиливает репликацию вируса и побочные эффекты вакцинации. Может повышать (в результате угнетения синтеза факторов свертывания крови в печени и нарушения образования тромбоцитов) или понижать активность антикоагулянтов непрямого действия. Ослабляет эффект (повышает концентрацию мочевой кислоты) противоподагрических препаратов (аллопуринола, колхицина, пробенецида или сульфинпиразона) при лечении гиперурикемии и подагры (необходима корректировка доз последних). Увеличивает кардиотоксичность цитарабина, доксорубицина, усиливает блокаду нервно-мышечной передачи, вызванную сукцинилхолином. Урикозурические средства увеличивают риск нефропатии, иммунодепрессанты (азатиоприн, хлорамбуцил, глюкокортикоиды, циклоспорин, меркаптопурин) — риск развития вторичных опухолей и инфекций. На фоне ловастатина у больных после трансплантации сердца повышается риск острого некроза скелетных мышц и острой почечной недостаточности.
Передозировка
Симптомы: тошнота, рвота, выраженная депрессия костного мозга, лихорадка, синдромом дилатационной кардиомиопатии, полиорганной недостаточности, геморрагический цистит и др.
Лечение: госпитализация, мониторинг жизненно важных функций; симптоматическая терапия, в т.ч. назначение противорвотных средств; при необходимости — переливание компонентов крови; введение стимуляторов кроветворения, антибиотиков широкого спектра действия, витаминотерапия (пиридоксин в/м 0,05 г и др.).
Пути введения
Внутрь, в/в , в/м , в полости (внутрибрюшинно или внутриплеврально).
Меры предосторожности вещества Циклофосфамид
Применение возможно только под наблюдением врача, имеющего опыт химиотерапии. Следует строго соблюдать режим дозирования, в т.ч. в определенное время суток (особенно при комбинированной терапии) и не удваивать последующую дозу, если предыдущая пропущена. Для приготовления препаратов с целью применения у новорожденных не рекомендуется использовать разбавители, содержащие бензиловый спирт, т.к. возможно развитие смертельного токсического синдрома: метаболический ацидоз, угнетение ЦНС , нарушение дыхания, почечная недостаточность, гипотензия, судороги, внутричерепное кровоизлияние.
До начала и во время лечения (с небольшими интервалами) необходимо определение уровня гемоглобина или гематокрита, числа лейкоцитов (общее, дифференциальное), тромбоцитов, азота мочевины, билирубина, креатинина, концентрации мочевой кислоты, активности АЛТ , АСТ , ЛДГ , измерение диуреза, удельной плотности мочи, выявление микрогематурии. Выраженная лейкопения с наиболее низким числом лейкоцитов развивается через 7–12 дней после введения препарата. Уровень форменных элементов восстанавливается спустя 17–21 день. При уменьшении числа лейкоцитов менее 2,5·10 9 /л и/или тромбоцитов — менее 100·10 9 /л лечение необходимо прекратить до устранения симптомов гематотоксичности. Кардиотоксическое действие наиболее выражено (при дозах 180–270 мг/кг) в течение 4–6 дней.
В течение всего курса лечения рекомендуется переливать кровь (100–125 мл 1 раз в неделю). С целью профилактики гиперурикемии и нефропатии, обусловленной повышенным образованием мочевой кислоты (часто возникают в начальный период лечения), перед терапией циклофосфамидом и в течение 72 ч после его применения рекомендуется адекватное потребление жидкости (до 3 л в сутки), назначение аллопуринола (в некоторых случаях) и применение средств, подщелачивающих мочу. Для профилактики геморрагического цистита (может развиться в течение нескольких часов или спустя несколько недель после введения) следует принимать утром (основная часть метаболитов выводится до сна), как можно чаще опорожнять мочевой пузырь и применять Уромитексан. При появлении первых признаков геморрагического цистита лечение прекращается до устранения симптомов заболевания.
С целью ослабления диспептических явлений возможен прием циклофосфамида в малых дозах в течение 1 сут . Частичная или полная алопеция, наблюдаемая во время лечения, обратима и после завершения курса лечения нормальный рост волос восстанавливается (структура и цвет могут быть изменены). При появлении следующих симптомов: озноб, лихорадка, кашель или охриплость, боль в нижней части спины или в боку, болезненное или затрудненное мочеиспускание, кровотечения или кровоизлияния, черный стул, кровь в моче или кале следует немедленно проконсультироваться с врачом.
Возникновение тромбоцитопении обусловливает необходимость крайней осторожности при выполнении инвазивных процедур и стоматологических вмешательств, регулярного осмотра мест в/в введений, кожи и слизистых оболочек (для выявления признаков кровоточивости), ограничения частоты венопункций и отказа от в/м инъекций, контроля содержания крови в моче, рвотных массах, кале. Таким пациентам необходимо с осторожностью бриться, делать маникюр, чистить зубы, пользоваться зубными нитями и зубочистками, осуществлять профилактику запора, избегать падений и других повреждений, а также приема алкоголя и ацетилсалициловой кислоты, повышающих риск желудочно-кишечных кровотечений. Следует отсрочить график вакцинации (проводить по прошествии 3–12 мес после завершения последнего курса химиотерапии) больному и проживающим с ним членам семьи (следует отказаться от иммунизации пероральной вакциной против полиомиелита). Рекомендуется исключить контакт с инфекционными больными или использовать неспецифические мероприятия для профилактики инфекций (защитная маска и т.п.). Во время лечения следует использовать адекватные меры контрацепции. В случае контакта препарата с кожей или слизистыми оболочками необходимо тщательное промывание водой (слизистые оболочки) или водой с мылом (кожа). Растворение, разведение и введение препарата проводится обученным медицинским персоналом с соблюдением защитных мер (перчатки, маски, одежда и др.).
Особые указания
При выполнении диагностических тестов (кожная проба на кандидоз, эпидемический паротит, трихофитию, туберкулиновая проба) возможно: подавление положительной реакции, а при проведении метода Папаниколау — получение ложноположительных результатов. Раствор для инъекций с использованием нелиофиолизированного или лиофилизированного порошка готовят путем добавления воды для инъекций (стерильной или бактериостатической, с использованием в качестве консерванта только парабена) во флаконы (концентрация циклофосфамида составляет 20 мг/мл). Приготовленный раствор устойчив при комнатной температуре в течение 24 ч, в холодильнике — 6 дней. Для введения путем в/в инфузии добавляют в растворы для парентерального введения. Если раствор приготовлен не на бактериостатической воде, следует его использовать в течение 6 ч. При химиотерапии у новорожденных детей в качестве разбавителя исключается использование бензилового спирта.
Учебная медицинская литература, онлайн-библиотека для учащихся в ВУЗах и для медицинских работников
Системная красная волчанка (СКВ) — системное полисиндромное воспалительное заболевание соединительной ткани, развиваюшееся преимущественно у девушек и молодых женщин на фоне генетически обусловленного дефекта иммунорегуляторных процессов, приводящего к неконтролируемой продукции антител к собственным клеткам и их компонентам.
Лечебная программа при СКВ.
- Режим.
- Диета.
- Лечение гормональными иммунодепрессантами.
- Лечение негормональными иммунодепрессантами.
- Иммунотерапия.
- Интенсивная терапия.
- Лечение аминохинолиновыми соединениями.
- Применение НПВС.
- Лечение антикоагулянтами и антиагрегантами.
- Эфферентная терапия.
- Лечение люпус-нефрита.
- Диспансеризация.
1. Режим
Режим больного СКВ зависит от характера течения, степени активности заболевания, выраженности системных проявлений. Лечение в фазе обострения проводится в стационаре, при тяжелом течении (особенно при развитии диффузного миокардита, эндокардита; люпус-нефрита), высокой активности процесса рекомендуется постельный режим; в случае диффузного миокардита — строгий постельный режим до улучшения состояния, показателей гемодинамики и ликвидации недостаточности кровообращения.
При хроническом течении СКВ и минимальной активности процесса лечение проводится амбулаторно.
2. Лечебное питание
В питании больного следует предусмотреть достаточное количество витамина С, витаминов группы В, ненасыщенных жирных кислот. При развитии недостаточности кровообращения, поражении почек необходимо ограничить потребление поваренной соли, жидкости.
3. Лечение гормональными иммунодепрессантами
Этиологическое лечение СКВ в настоящее время невозможно. Патогенетическая терапия является ведущей и направлена на подавление иммунокомплексной патологии.
Гормональные иммунодепрессанты — глюкокортикоиды — являются лекарствами первого ряда при СКВ.
В. А. Насонова указывает, что обоснована необходимость применения длительной терапии глюкокортикоидами, позволяющей сохранить или продлить жизнь многим больным, значительно улучшить прогноз этого заболевания — от безнадежного до вполне удовлетворительного. Следует учесть, что неадекватное прерывистое лечение глюкокортикоидами сопровождается развитием синдрома отмены с последующими еще более тяжелыми обострениями.
Адекватное лечение глюкокортикоидами в подавляющих дозах, длительное применение их в поддерживающих дозах дает возможность добиться длительной ремиссии. Эффект глюкокортикоидов обусловлен их способностью подавлять иммунокомплексный воспалительный процесс и аутоиммунные реакции.
Абсолютным показанием к назначению глюкокортикоидов является острая, подострая форма СКВ и обострение хронической СКВ. Из всех глюкокортикоидных препаратов наибольшее значение имеет преднизалон, обладающий достаточно высоким терапевтическим эффектом и вызывающий сравнительно нетяжелые побочные реакции при многолетнем приеме. Лучшей переносимостью и хорошим терапевтическим эффектом обладает метилпреднизолон (урбазон). Он значительно реже, чем другие глюкокортикоиды, вызывает поражение ЖКТ (стероидные эрозии и язвы).
Согласно данным В. А. Насоновой, лечение СКВ преднизолоном проводится следующим образом. Доза препарата зависит от остроты течения и активности процесса.
При остром течении с самого начала заболевания, а при подостром и хроническом течении при II и III ст. активности патологического процесса назначаются глюкокортикоиды.
Преднизолон в подавляющей дозе 40-50 мг в сутки назначают при остром и подостром течении (III ст. активности), а при нефротическом синдроме или менингоэнцефалите — в дозе 60 мг в сутки и более.
При подостром течении II ст. активности, а также при хроническом течении II-III ст. активности подавляющая доза может быть меньше 30-40 мг, при I ст. активности — 15-20 мг в сутки. Продолжительность приема преднизолона в подавляющей дозе определяется степенью выраженности клинико-лабораторных признаков (обычно не менее 3 месяцев, а при необходимости — до 6 месяцев и более). В случаях длительной терапии большими дозами глюкокортикоидов можно применять следующую альтернирующую методику приема этих препаратов. При снижении клиниколабораторных признаков активности до II ст. (обязательно исчезновение полиартрита, полисерозита, миокардита) суточную дозу преднизолона можно давать следующим образом: 20 мг утром между 8 и 9 ч после завтрака, два приема по 10 мг в дневные часы (в 12 и 14 ч) после легкого обеда. Достигнув эффекта, дозу преднизолона снижают постепенно: сначала дневную (в 14 ч), затем назначаемую в полдень (в 12 ч), затем утреннюю (после 8 ч утра) (табл. 12).
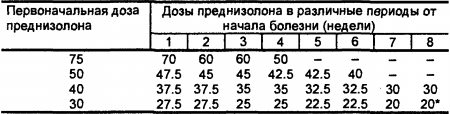
Табл. 12. Примерная схема снижения доз преднизолона (в мг) при достижении терапевтического эффекта. * Далее очень медленно — по 2.5 мг через 1-3 месяца (по показателям общего состояния больного и лабораторных исследований).
Чрезвычайно важен подбор поддерживающей дозы преднизолона, т.е. той наименьшей дозы, которая позволяет поддерживать клинико-лабораторную ремиссию. Преднизолон в поддерживающей дозе 5-10 мг в сутки назначается годами. Для уменьшения побочных явлений преднизолона (кушингоидный синдром, атрофия мышц, артериальная гипертензия, гипокалиемия, остеопороз коры надпочечников) при длительной терапии принимаются удвоенные поддерживающие дозы через день.
Критериями эффективности лечения преднизолоном являются: уменьшение активности патологического процесса, устранение или значительное уменьшение выраженности висцеральных проявлений, особенно со стороны почек, стабилизация течения заболевания.
Величина поддерживающей дозы глюкокортикоидов является одним из критериев глубины клинико-лабораторной ремиссии:
чем меньше поддерживающая доза, тем надежнее ремиссия. Величина поддерживающей дозы 15-20 мг может указывать на активность процесса и на необходимость увеличения дозы, а также, возможно, на целесообразность применения цитостатиков.
Причины неэффективности глюкокортикоидноЙ терапии: нерегулярность приема, неадекватная доза, позднее начало лечения, тяжелая степень иммунокомплексной органной патологии.
При отсутствии преднизолона можно применять триамцинолон, дексаметазон, исходя из паритета : 1 таблетка этих препаратов равна 1 таб летке преднизолона.
О побочных системных действиях глюкокортикоидной терапии см. гл. “Лечение ревматоидного артрита”.
4. Лечение негормональными иммунодепрессантами
Негормональные иммунодепрессанты обладают противовоспалительным эффектом, способностью подавлять иммунокомплексный противовоспалительный процесс и аутоантителообразование.
Показания к назначению цитостатиков:
- высокая активность процесса и быстропрогрессирующее течение;
- активный нефротический и нефритический синдромы;
- генерализованный васкулит (поражение легких, ЦНС, язвенное поражение кожи);
- недостаточная эффективность глюкокортикоидноЙ терапии;
- необходимость быстро уменьшить подавляющую дозу преднизолона из-за плохой переносимости и выраженности побочных действий (подростковый и климактерический возраст больных, значительная и быстрая прибавка в массе тела, тяжелая артериальная гипертензия, стероидный сахарный диабет, психоз, выраженный остеопороз с признаками спондилопатии, аваскулярные некрозы костей);
- необходимость уменьшить поддерживающую дозу преднизолона, если она превышает 15-20 мг в сутки;
- глюкокортикостероидная зависимость.
Наиболее часто применяют азатиоприн (имуран) и циклофосфамид в дозе 1-3 мг на 1 кг массы тела, т.е. от 100 до 200 мг в сутки в сочетании с 30 мг преднизолона. Указанные дозы назначают в течение 2-2.5 месяца (обычно в стационаре), а затем переходят на поддерживающие дозы 50-100 мг в сутки в течение многих месяцев и лет. К этому времени обычно удается снизить дозу глюкокортикоидов.
Критериями эффективности лечения цитостатиками являются:
- исчезновение или уменьшение клинических признаков болезни, в первую очередь нефрита;
- исчезновение или уменьшение кортикостероидной зависимости;
- стойкое снижение активности СКВ и отсутствие в дальнейшем рецидивов;
- предотвращение прогрессирования люпус-нефрита.
Наиболее эффективным цитостатиком при лечении СКВ является циклофосфамид. При высокой активности патологического процесса целесообразно начать лечение с циклофосфамида, но учитывая наибольшую его активность через 4-5 недель следует перейти на азатиоприн или лейкеран для дальнейшего лечения (В. А. Насонова, 1989).
В последние годы стали применять одновременно несколько цитосгатиков: азатиоприн + циклофосфами д (1 мг/кг в д ень внутрь) в сочетании с малыми дозами преднизолона; комбинация азатиоприна внутрь с внутривенным введением циклофосфамида (по 1000 мг/м 2 поверхности тела каждые 3 месяца). При таком комбинированном лечении замедляется прогрессирование люпус-нефрита. Предложена также методика только внутривенного введения циклофосфамида п о 1000 м г/м 2 1 раз в месяц в первые полгода, затем по 1000 мг/м 2 каждые 3 месяца в течение полутора лет на фоне низких доз преднизолона. М. М. Ивановой (1994) установлено, что циклофосфамид более эффективно снижает протеинурию и уменьшает изменения мочевого осадка, синтез антител к ДНК, азатиоприн — наиболее эффективен при диффузном поражении кожи.
О побочных действиях цитостатиков см. в гл. “Лечение ревматоидного артрита”.
5. Иммунотерапия
Разрабатываются следующие методы иммунотерапии СКВ: применение антиидиотипических моноклональных анти-СD4-антител при люпус-нефрите; внутривенное введение иммуноглобулинов (по 0.4 г/кг в сутки в течение 5 дней при выраженных формах СКВ с тромбоцитопенией); лечение любензаритом (подавляет синтез антител к ДНК, ингибирует синтез IgM-ревматоидного фактора); внутривенное введение рекомбинантных препаратов интерферона (а, у) ежедневно в течение 3 недель, а затем дважды в неделю в течен ие 2 м есяцев.
6. Интенсивная терапия
К интенсивной терапии СКВ относятся: пульс-терапия ударными дозами метилпреднизолона, комбинированная пульс-терапия метилпреднизолоном и циклофосфаном.
Показания:
- неэффективность пероральной (даже массивной) глюкокортикоидноЙ терапии, особенно при нефротическом синдроме;
- быстрое прогрессирование болезни и неэффективность обычной терапии СКВ.
Методика пульс-терапии : вводят внутривенно капельно п о 1000 мг метилпреднизолона в 100 м л изотонического раствора натрия хлорида в течение 3 дней подряд. В капельницу добавляют 5000 ЕД гепарина.
Во время пульс-терапии и после нее больные продолжают принимать внутрь ту же дозу преднизолона, что и прежде.
Под влиянием пульс-терапии быстро улучшается функциональное состояние почек, исчезают эритематозная сыпь на лице, капилляриты, полиартрит, в целом наблюдается выраженная положительная клиническая динамика.
Во время пульс-терапии возможны побочные явления: повышение АД, зуд и гиперемия кожи, судорожные подергивания, нарушения ритма сердца, описаны случаи внезапной остановки сердца. Учитывая это, пульс-терапия преднизолоном назначается строго по показаниям и в ходе ее проведения необходимо тщательно контролировать работу сердца.
R. Lugmani (1993) рекомендует после пульс-терапии применять циклофосфамид в дозе 200 мг в неделю в течение 3-6 месяцев в сочетании с преднизолоном в дозе 20-25 мг в сутки.
Этот вид интенсивной терапии применяется при СКВ с тяжелым, торпидным к лечению нефротическим синдромом и генерализованным васкулитом.
Методика: в первый день внутривенно капельно в 100 мл изотонического раствора натрия хлорида в течение 30-40 мин вводя т 1000 мг метилпреднизолона и 1000 мг циклофосфана, в последующие два дня больному вводят капельно по 1000 мг м етилпреднизолона, в капельницу добавляют 5000 ЕД гепарина.
Больным с высоким АД вводят гипотензивные и мочегонные средства. Начиная с четвертого дня, больным назначается преднизолон в той же дозе, что до пульс-терапии, но не ниже 40 мг в сутки в сочетании со средними дозами цитостатиков.
Метод комбинированной пульс-терапии метилпреднизолоном и циклофосфаном высокоэффективен, приводит к значительному клиническому улучшению, особенно это заметно у больных с нефротическим синдромом (снижается или нормализуется АД, повышается диурез, уменьшаются альбуминурия и отеки).
Побочные действия те же, что при пульс-терапии метилпреднизолоном, кроме того, возможны выпадение волос, лейкопения.
7. Лечение аминохинолиновыми соединениями
Механизм действия аминохинолиновых соединений описан в гл. “Лечение ревматоидного артрита”.
Эти препараты назначают больным хронической СКВ прежде всего при поражении кожи, суставов: делагил по 0.25-0.5 г в сутки и плаквенил по 0.2-0.4 г в сутки. Лечение продолжается длительно — месяцы, годы.
Кроме того, аминохинолиновые соединения могут применяться при люпус-нефрите. В. А. Насонова рекомендует в этом случае плаквенил по 0.2 г 4-5 раз в день (всего 0.8-1 г) в течение длительного времени — до года и более.
Аминохинолиновые соединения могут применяться в сочетании с глюкокортикоидами, что позволяет уменьшить дозы препаратов. При лечении аминохинолиновыми соединениями возможны побочные явления: лейкопения, анемия, алопеция, дегенерация сетчатки, диспептические явления. Лечение проводится под контролем анализа крови и исследования состояния глазного дна.
8. Применение НПВС
НПВС обладают выраженным противовоспалительным действием, умеренным иммунодепрессантным эффектом, стабилизируют лизосомальные мембраны.
НПВС назначаются при подостром течении (в ранней стадии) и хроническом течении СКВ, преимущественно при наличии артрита. Эти препараты применяются в обычных терапевтических дозах (как при ревматоидном артрите) длительно, до исчезновения воспаления в суставах и нормализации температуры тела. Однако при лечении НПВС необходимо учитывать нередкое развитие побочных эффектов (см. гл. “Лечение ревматоидного артрита”).
9. Лечение антикоагулянтами и антиагрегантами
Антикоагулянты и антиагреганты в комплексной терапии СКВ применяют при наличии поражения почек, ДВС-синдрома, при нарушениях микроциркуляции.
Из антикоагулянтов рекомендуется гепарин — 10,000-20,000 ЕД в сутки (4 инъекции под кожу живота) в течение нескольких месяцев.
В качестве антиагрегантов используются курантил в суточной дозе 150-200 мг, трентал — 400-600 мг в течение нескольких месяцев.
10. Эфферентная терапия
К эфферентной терапии относятся плазмаферез и гемосорбция.
Плазмаферез — метод эфферентной, экстракорпоральной терапии, направленной на освобождение организма от продуктов метаболизма, циркулирующих иммунных комплексов путем удаления плазмы больного.
Показанием к назначению плазмафереза при СКВ является наиболее тяжелое течение, когда обычная терапия глюкокортикоидами, включая и пульс-терапию метилпреднизолоном, а также применение цитостатиков, оказывается неэффективной.
На курс лечения рекомендуется от 3 до 5 процедур плазмафереза при однократном удалении 800-1000 мл плазмы.
Гемосорбция — экстракорпоральный метод очищения крови путем пропускания ее через колонку с гранулами активированного угля. Метод обладает иммунокорригирующим действием, а также повышает чувствительность клеток крови и тканей к действию глюкокортикоидов.
Показания к гемосорбции при СКВ:
- сохраняющаяся активность СКВ, несмотря на большие дозы глюкокортикоидов и цитостатиков;
- активный люпус-нефрит;
- упорный суставной синдром;
- васкулиты кожи с изъязвлениями;
- невозможность увеличения дозы глюкокортикоидов из-за развившихся осложнений.
М. М. Иванова (1985), учитывая высокую эффективность и хорошую переносимость гемосорбции, рекомендует проводить ее на ранней стадии болезни для более активного воздействия на иммунопатологическую реактивность.
На курс лечения рекомендуется от 3 до 5 процедур гемосорбции, проводимых еженедельно с применением отечественных активированных углей ИГИ, АДБ, ГСУ.
Плазмаферез и гемосорбция проводятся на фоне приема глюкокортикоидов и цитостатиков.
11. Лечение люпус-нефрита
Люпус-нефрит у больных СКВ может принимать тяжелое течение и определять прогноз.
Основными методами лечения люпус-нефрита являются:
- лечение глюкокортикоидами с начальной суточной дозой преднизолона 60-80 мг;
- пульс-терапия метилпреднизолоном;
- комбинированная терапия глюкокортикоидами и цитостатиками;
- пульс-терапия метилпреднизолоном и циклофосфаном;
- лечение аминохинолиновыми соединениями;
- применение гепарина и антиагрегантов;
- плазмаферез, гемосорбция;
- диета № 7 с коррекцией содержания белка в зависимости от уровня его потерь с мочой за сутки при нефротическом синдроме.
М. М. Иванова (1995) предлагает при недостаточной эффективности пульс-терапии проводить лечение метилпреднизолоном внутривенно по 250 мг в сутки в течение еще 2-3 недель.
При развитии у больного ХПН лечение проводится та к, как это описано в гл. “Лечение хронической почечной недостаточности”.
12. Диспансеризация
Диспансеризация больных СКВ осуществляется ревматологом, а при его отсутствии — терапевтом.
Частота наблюдений врачом: при минимальной активности — 2 раза в год, при II ст. активности — 4 раза в год.
ЛОР-врач, стоматолог, гинеколог офтальмолог осматривают больных 2 раза в год; невропатолог, психиатр, нефролог — по показаниям.
Перечень и частота необходимых лабораторных и инструментальных исследований при диспансеризации:
- клинический анализ крови, общий анализ мочи — 4-6 раз в год;
- число тромбоцитов — 2 раз а в год;
- при применении цитостатических препаратов — ежемесячный контроль анализов, рентгенография (флюорография) органов грудной клетк и 2 раза в год;
- рентгенография суставов — по показаниям;
- биохимическое исследование крови (фибриноген, серомукоид, белковые фракции, мочевина) — не реж е 2 раз в год;
- ЭхоКГ и ФКГ — по показаниям;
- исследование крови на содержание волчаночных клеток и антинуклеарного фактора — 2 раза в год.
Основным лечением является применение глюкокортикоидов и цитостатиков в индивидуально подобранных дозах; при III ст. активности — обязательно стационарное лечение.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Читайте также:


