Интоксикация от зубных протезов
Клинические проявления хронической стоматогенной интоксикации и ее диагностика
Клинические симптомы могут проявляться разнообразно, в зависимости от иммунобиологического состояния (реактивности) организма человека и перенесенных им ранее общесоматических заболеваний. Наибольшую трудность для диагностики составляют больные, у которых хроническая стоматогенная интоксикация протекает без выраженного нарушения общего состояния. Она может обнаруживаться случайно при изучении клинического анализа крови. И. Г. Лукомский (1955) указывает на три группы клинически определяемой связи одонтогенного очага с другими поражениями систем организма: первая группа —стоматогенная инфекция и интоксикация преобладают в клинической картине болезни и находятся в причинной связи с заболеваниями других органов (чаще при хроническом тонзиллите, хроническом гранулирующем периодонтите); вторая группа — стоматогенная интоксикация сопутствует основному хрониосептическому заболеванию, не являясь его единственным причинным фактором (нередко при выраженных стадиях пародонтита и пародонтоза); третья группа — при отсутствии видимой связи между одонтогенным очагом и хрониосептическим состоянием организма. По степени активности очаги
инфекции подразделяют на активные, ремиссионные и инволютивные.
К субъективным проявлениям хронической стоматогенной (ротовой) интоксикации относятся головная боль, головокружение, чувство тяжести в голове, быстрая утомляемость и общая слабость (адинамия), дрожание рук, потливость, плохой сон.
Из объективных проявлений ведущими служат стойкий подъем температуры (чаще субфебрильная), явление упорного лимфаденита в области подчелюстных и подбородочных лимфатических узлов, а также характерные изменения в картине крови. Анализ морфологического состава периферической крови дает представление о степени выраженности локального воспалительного процесса и, кроме того, о защитных силах организма.
При хронической интоксикации отмечается лабильность лейкоцитарной формулы (лимфо- и моноцитоз, лейкопения, эозинофилия). Уменьшается количество гемоглобина и снижается количество эритроцитов (вторичная анемия). СОЭ возрастает до 40 мм/ч и более. Отмечаются сдвиги в белковых фракциях крови за счет увеличения процента глобулинов.
Для определения нарушений капиллярного кровообращения в очаге воспаления были предложены: 1) методика капилляроскопии; 2) гистаминовая проба; 3) электротест; 4) проба на конгорот; 5) определение чувствительности к адреналину; 6) вакцинодиагностика и некоторые другие.
Из перечисленных методов более доступна гистаминовая проба. Ее проводят в виде гистаминового подслизистого теста, для чего в слизистую оболочку десны в области предполагаемого хронического одонтогенного очага вводят 0,3—0,5 мл ги-стамина (1 : 1000). Через 1—2 ч в области пораженного периодонтитом зуба появляются самопроизвольные боли и боль при накусывании на зуб (положительная перкуторная реакция).
Ремки (1967) предложил конъюнктивальную гистаминовую пробу, для чего в конъюнктивальный мешок закапывают 1 — 2 капли гистамина в разведении 1 : 100 000 или 1 :500 000. При наличии в челюстно-лицевой области очагов хронической интоксикации через 1 мин появляется выраженное расширение капилляров и покраснение слизистой оболочки глазного яблока и века. Указанная реакция не сопровождается какими-либо неприятными ощущениями и исчезает через 10 мин.
Однако, по мнению многих авторов, чувствительность этой пробы недостаточна высока, так как положительная реакция может наблюдаться у лиц с аллергическими заболеваниями.
Кожный электротест Стендаля и Гелена (1955) заключается в определении болевой чувствительности и появлении очага гиперемии на коже и слизистой оболочке десны в области одонтогенного очага интоксикации. Это явление связано с функциональным нарушением и морфологическими изменениями в нервно-сосудистом аппарате слизистой оболочки или кожи, расположенной непосредственно над местом хронического стоматогенного очага.
Лечение. При стоматогенных очагах инфекции и интоксикации оно должно быть строго индивидуально. Больной с подозрением на ротовую интоксикацию должен быть тщательно обследован (желательно в условиях стационара). Выявление одонтогенных очагов производится по следующей схеме: 1) клинически выявляют все зубы с некротизированной пульпой и находящиеся под искусственными коронками; 2) производят рентгенологическое обследование всех корней и каждого в отдельности зуба, подозреваемого на первичный инфекционный очаг; 3) выявляют десневые и пародонтальные карманы, особенно те, которые вызывают обострение воспалительного процесса (абсцессы); 4) исследуют регионарные лимфатические узлы (подбородочные, подчелюстные, шейные) ; 5) производят анализ крови; 6) делают гистаминовую пробу, электротест и т. д.
При всех проявлениях стоматогенной инфекции и интоксикации радикальная ликвидация патологических очагов в полости рта должна рассматриваться как метод этиологического, патогенетического и симптоматического лечения тех или иных общесоматических заболеваний. Общая установка в вопросе лечения первичного очага сводится к признанию необходимости его возможно раннего удаления. Однако при наличии сопутствующего основного заболевания необходимо согласовывать с терапевтом (ревматологом, кардиологом и другими специалистами) проведение санационных мероприятий в полости рта, а также объем вмешательства и условия проведения (амбулаторно или в стационаре).
На первом этапе стоматологической санации целесообразнее производить хирургическое удаление всех инфекционных околозубных очагов воспаления — разрушенных зубов и корней, гранулем, радикулярных кист, расшатанных зубов с глубокими костными пародонтальными карманами, а также третьих моляров, поддерживающих хроническое течение перикоронита и др. При этом следует учитывать как характер деструктивного процесса в околозубных тканях, так и степень проходимости корневых каналов, анатомическую сохранность коронки зуба. В целях сохранения однокорневых зубов с гранулирующим и гранулематозным периодонтитом осуществляют резекцию верхушки корня. Что касается многокорневых зубов, то при решении вопроса об их сохранении следует считаться с опасностью, которую могут принести депульпированные зубы с недопломбированными каналами. Чаще такие зубы удаляют или проводят гемисекцию с удалением тех корней, которые не могут быть качественно заполнены пломбировочным материалом. Не подлежат сохранению одно- и многокорневые зубы при полном исчезновении опорного аппарата и кости лунки, а также если около них регулярно образуются пародонтальные абсцессы (развившиеся стадии пародонтита).
Стоматологическое радикальное вмешательство должно сочетаться с лечением основного заболевания, а также десенсибилизирующей и общеукрепляющей терапией. Клинические проявления возможных обострений обычно ликвидируются на 3—4-й день после хирургического удаления оральных очагов инфекции, нормализация же биохимических показателей чаще задерживается на 1,5—2 нед.
Второй этап санации полости рта предусматривает консервативное лечение кариеса и его осложнений, а также болезней пародонта, хронических заболеваний слизистой оболочки рта. Подобное консервативное лечение оказывается более эффективным после предварительного удаления выявленных очагов.
Профилактикой хронической стоматогенной интоксикации является плановая санация полости рта как у организованного населения (в детских садах, школах, на промышленных предприятиях и т. д.), так и у всех лиц, обратившихся за стоматологической помощью. Высококвалифицированная стоматологическая помощь должна оказываться и больным, находящимся на диспансерном наблюдении и лечении в общетерапевтических клиниках. Учитывая, что длительно протекающие стоматологические заболевания снижают защитные силы организма, необходимо 2 раза в год проводить профилактические осмотры, которые позволяют выявить новые инфекционные локальные очаги хронической инфекции и интоксикации организма и своевременно провести их консервативное или хирургическое лечение.
У 97 из 131 больного заболевания органов желудочно-кишечного тракта развились спустя 1—3 года после протезирования. Объективными тестами таких заболеваний вследствие влияния металлических зубных протезов послужили показатели содержания микроэлементов биологических сред (слюна, желудочный сок, кровь, моча) по сравнению с контрольной группой обследованных.
У больных, которым проводили лечение болезней желудочно-кишечного тракта, не устраняя разнородность металлов в полости рта, в желудочном соке, крови было достоверно увеличено содержание марганца, меди, свинца, никеля, в моче — железа, меди.
У лиц же, подвергшихся комбинированной терапии (лечение заболеваний желудочно-кишечного тракта и ортопедическое), отмечено значительное снижение содержания микроэлементов в желудочном соке, крови и моче.
В результате лечения при помощи протезов из серебряно-палладиевых сплавов улучшилась функция вкусовых рецепторов языка натощак, повысился уровень функциональной мобильности (в норме после еды происходит мобилизация половины вкусовых рецепторов языка), восстановился гастролингвальный рефлекс.
Анализ историй болезни 90 больных токсическим стоматитом показал, что у 82 (91%) отмечались жжение и сухость под пластмассовым протезом. У 13 больных (14,4%) протезы были некачественными. Цвет пластмассы изменился у 16 больных (17,7%). Важно, что 57 из 90 больных (71%), пользовавшихся съемными протезами на беззубую верхнюю челюсть и нижнюю челюсть при частичной потере зубов, ощущали жжение под верхним протезом.
При хроническом токсическом действии акрилатов возможны изменения органов желудочно-кишечного тракта: нарушение моторики, дискинезия, обострения хронического гастрита, колита.
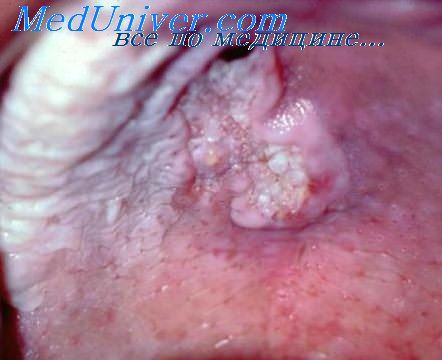
При постановке диагноза аллергического стоматита мы использовали следующие методы: определение в слюне гаптенов — никеля, хрома, кобальта — методом химико-спектрального анализа, клинический анализ периферической крови до снятия протезов (элиминация) и спустя 2—3 нед после снятия и после ортопедического лечения, СПТ на никель, хром, кобальт, реакцию ретракции кровяного сгустка, РСАЛ, реакцию тройного розеткообразования для оценки функционального состояния рецепторного аппарата лимфоцитов, определение концентрации сывороточных IgA, IgM, IgG по Манчини, определение гаптенсвязывающих антител к хрому, никелю, кобальту, марганцу в РСК.
Выявлению аллергического заболевания, возникшего под воздействием акриловых протезов, в значительной степени способствует использование методов диагностики со специфическими аллергенами — провокационных проб и аллергических тестов.
Кожные (аппликационные, скарификационно-компрессные) пробы на акриловую пластмассу, по нашим данным, недостаточно информативны: в 98% случаев результаты отрицательные, что не согласуется с клинической картиной.
Экспозиционно-провокационная проба заключается в выведении протеза из полости рта (экспозиция во времени) и введении его туда же (провокация). Анализ данных показал, что экспозиционно-провокационная проба положительна не только у больных с аллергией, но и при токсико-химическом и механическом воспалении.
Лейкопеническая проба (определение количества лейкоцитов в крови у больного без протезов и после двухчасового ношения протеза) у больных аллергическим стоматитом, вызванным акрилатами, характеризуется уменьшением количества лейкоцитов в крови — лейкопенией. Лейкопеническая проба является и дифференциальным тестом, так как при воспалении, обусловленном механическим раздражителем, и при токсико-химической реакции лейкопеническая проба отрицательна.
Наши исследования показали, что при диагностике аллергического заболевания необходимо проводить в совокупности несколько тестов (лейкопеническая, тромбоцитопеническая пробы, клинический анализ крови).
Мы использовали результаты клинического анализа периферической крови, проводимого у больных в динамике. Клинический анализ крови у 166 больных с пластмассовыми протезами показал, что при аллергическом стоматите отмечаются лейкопения, лимфоцитоз, моноцитоз, уменьшение содержания сегментоядерных нейтрофилов.
Тест химического серебрения внутренней поверхности акрилового протеза (реакция серебряного зеркала) достаточно прост и информативен. Экранирование поверхности акрилового протеза от слизистой оболочки создает благоприятные условия для купирования контактного воспаления. Проба положительна у больных аллергическим стоматитом и с токсической реакцией на акрилаты, отрицательна — при механическом воспалении. Устранения аллергена съемного протеза можно добиться методом металлизации акрилового протеза (золочение, палладирование) и стеклования.
Установлено, что при аллергическом стоматите, вызванном акриловым протезом, содержание гистамина в плазме крови и слюне возрастает. Содержание же серотонина в плазме крови уменьшается по сравнению с нормой. Металлизация пластмассового протеза приближает к норме содержание гистамина и серотонина в плазме крови и слюне. Однако методика определения этих показателей довольно сложна, требует применения специальной аппаратуры.

Восстановление зубного ряда с помощью протезирования – распространенная стоматологическая услуга. Пациентам на выбор предложен широкий спектр разнообразных материалов для коронок: некоторые из них могут провоцировать аллергическую реакцию. Рассмотрим подробнее, как понять, что аллергия на зубную коронку и что с этим делать.
Как понять, что есть аллергия на зубную коронку или зубные протезы, симптомы?
Аллергия – это чрезмерно активная реакция организма на тесный контакт с каким-либо веществом (аллергеном). У многих людей возникает аллергия на зубные протезы, симптомы при этом ярко-выражены. Чаще всего у человека появляются:
- болезненные ощущения во время приема пищи;
- чувство жжения в ротовой полости (зоне языка и слизистых оболочек);
- повышенное слюноотделение;
- отечность гортани, десен и носа;
- кожная сыпь;
- появление горького или кислого привкуса;
- незначительное повышение температуры тела (до 37,5 О С);
- першение в горле с кашлем;
- сильное кровотечение десен.
Аллергическая реакция, как правило, не возникает в день фиксации зубных коронок или протезов. Она появляется спустя несколько месяцев, а иногда и лет после установки. У некоторых людей аллергия возникает во время смены старых коронок на новые конструкции.
Аллергия на металлокерамические коронки
Металлокерамика пользуется большим спросом в стоматологии. Коронки на ее основе характеризуются высокой прочностью, эстетикой и продолжительным сроком службы. С их помощью удается восстановить жевательные моляры и зубы, входящие в зону улыбки.
Такие коронки имеют в своем составе керамику и металл. Их единственный недостаток – вероятность развития аллергической реакции (за счет металла в составе). Рассмотрим подробнее, какие металлы провоцируют аллергию, и какие факторы повышают ее появление.
Причины аллергии на протезы зубов: материалы, которые вызывают реакцию
Чаще всего у человека появляется аллергия на металлокерамические коронки и металлические коронки с напылением. Вероятность развития аллергической реакции связана с металлом, входящим в состав коронки. Чаще всего она наблюдается на кобальт, реже – на хром и никель.
Как показывает практика, золото не провоцирует появление аллергии. Однако за счет высокой стоимости и низкой эстетики, в современной стоматологии его редко используют для протезирования.
Среди главных причин развития аллергических реакций отмечают:
- низкий иммунитет;
- травмы слизистой оболочки;
- изменение теплообмена между конструкцией и десной (мономер легче проникает в кровь);
- повышенная чувствительность к определенному металлу;
- возраст пациента (у детей аллергические реакции диагностируют крайне редко);
- активность аллергена.
Существует ряд провоцирующих факторов. В том случае, если конструкция не плотно прилегает к десне, в процессе жевания может появиться эффект трения. Он сопровождается локальным повышением температуры. Мягкие ткани становятся рыхлыми, сосуды расширяются. Это приводит к усиленному впитыванию веществ. В такой ситуации важно незамедлительно сменить конструкцию.
У каждого протеза свой срок эксплуатации. По его истечению материал, из которого он изготовлен, начинает постепенно разрушаться. Даже при тщательном уходе за конструкцией, ее требуется своевременно менять. Эксплуатация протеза после окончания срока годности может привести к аллергической реакции.
При наличии ряда патологий или резкой смены климата у человека изменяется кислотный состав слюны (значительно повышается кислотность), в результате чего способен начаться процесс окисления (гальванический синдром).

Если у человека меняется состав слюны на фоне некоторых заболеваний, это может спровоцировать развитие аллергии на коронки
Зачастую наблюдается реакция на окрашенные конструкции (для повышения эстетики). В том случае, если аллергическая реакция появилась сразу в день установки коронок, велика вероятность, что материал, из которого они изготовлены, не послужил причиной. Спровоцировать недуг могли препараты, используемые врачом-ортопедом во время протезирования (к примеру, анестезирующее вещество).
Какие методы диагностики?
При обнаружении вышеописанных симптомов следует незамедлительно записаться на консультацию к врачу-ортопеду. Дополнительно может потребоваться осмотр у других специалистов (в зависимости от симптоматики) – аллерголога, дерматолога, иммунолога и эндокринолога. При подозрении аллергической реакции на протез врач должен оценить:
- состав и вязкость слюны;
- видимые дефекты;
- изменение оттенка и стадию износа конструкции.
Для диагностики врач собирает стоматологический и аллергологический анамнез. Аллергологический анамнез включает установление наследственной предрасположенности человека к аллергии. Важно уточнить, страдает ли он экземой, аллергическим ринитом, бронхиальной астмой и иными патологиями.
Для подтверждения диагноза назначают лабораторные анализы: внутрикожные, провокационные, аппликационные. К примеру, для выявления контактной аллергии на никель или хром используют спиртовые растворы солей металлов.

При подозрении на аллергию обязательно изучают состав слюны
Часто прибегают к элиминационной и экспозиционной пробе, когда на время вынимают протез и наблюдают за реакцией. Основываясь на результатах диагностики и симптоматики, врач назначает наиболее целесообразную терапию.
Первая помощь и методы лечения
Главная задача при появлении аллергической реакции состоит в скорейшем устранении ее источника. При съемной конструкции сделать это просто, достаточно изъять ее. В случае с зубными коронками следует записаться на прием к врачу-ортопеду. До этого момента рекомендуется полоскать рот антисептическими растворами.

Чтобы исключить возможность развития аллергии, рекомендуется использовать безметалловые протезы
Что такое гипоаллергенные коронки?
Гипоаллергенными коронками признаны изделия из безметалловой керамики. Благодаря отсутствию металлической основы у человека не возникает индивидуальной непереносимости. Конструкция характеризуется высокой эстетикой и надежностью, среди недостатков – высокая стоимость.
Она может быть выполнена из фарфора, диоксида алюминия или диоксида циркония. Во всех случаях исключена вероятность появления аллергической реакции.
Помимо металлических, металлокерамических и керамических изделий, существуют пластмассовые коронки. В состав некоторых пластмасс входят мономеры и полимеры, провоцирующие аллергию. В такой ситуации следует использовать современную безакриловую пластмассу. Это полностью гипоаллергенный материал.
Врачу-стоматологу, чаще всего ортопеду, приходится сталкиваться с заболеваниями обусловленными токсическим влиянием химических соединений протезных материалов на ткани полости рта.
Биологическая активность химических соединений материалов зубных протезов определяется физико-химическими свойствами веществ, особенностями механизма действия, путей поступления их в организм, содержанием и временем их влияния. В зависимости от количества химического вещества оно может быть безвредным для организма, действовать как лекарство или яд.
Химические вещества стоматологических материалов (нержавеющие стали, амальгамы, хромокобальтовые сплавы, пластмассы акриловой группы и др.) могут вызывать токсические повреждения.
Количество химического вещества, поступающего из материалов зубных протезов в ткани полости рта, кровь, зависит от объемного кровотока органа [Лужников Е. А., 1982]. С увеличением содержания разнородных стоматологических материалов в полости рта количество токсических веществ в слюне и крови может повышаться. Токсическое действие стоматологических материалов зависит также от продолжительности пребывания их в полости рта. Поступление токсинов в организм через полость рта во многом определяется неодинаковой проницаемостью слизистых оболочек для различных веществ, а также зависит от наличия заболеваний желудочно-кишечного тракта. Установлено, что при патологии органов пищеварительной системы изменяется проницаемость слизистой оболочки полости рта для различных метаболитов, а также ее трофика [Скляр В. Е., Генесина Т. И., 1980]. При заболевании печени резко повышается чувствительность организма ко многим чужеродным веществам. В клетках печени, эндоплазматическом ретикулуме сосредоточены ферменты, катализирующие превращения чужеродных веществ [Гадаскина И. Д., 1970].
Механизм токсического влияния соединения тяжелых металлов складывается из местного и резорбтивного действия. Местное действие проявляется деструкцией тканей слизистых оболочек. В основе резорбтивного действия лежит блокирование функционально активных групп белков и структурных белков.
По современным представлениям, большинство ядов (химических веществ) реализуют свое токсическое действие путем нарушения ферментативных систем. Известно около 100 ферментов, активность которых может тормозиться при блокировании в их молекулах SH-rpynn. С веществами, содержащими SH-группы, связаны важнейшие биохимические превращения: проведение нервного импульса, тканевое дыхание, проницаемость клеточных мембран, мышечное сокращение и др. [Торчинский Ю. М., 1971]. В результате реакции ионов металлов с SH-группами образуются слабо диссоциирующие, нерастворимые соединения — меркаптиды. Одновалентные металлы реагируют по схеме:

Двухвалентные металлы блокируют две SH-группы:

Сульфгидрильные группы белков, аминокислоты могут легко окисляться. Например, контакт с галоидами (йод) приводит к образованию дисульфидов: R—S—S—R. Тяжелые металлы обладают разным сродством к сульфгидрильным группам [Левина Э. Н., Чекунова М. П., 1970]. К ядам-металлам, блокирующим сульфгидрильные группы биомолекул, относятся ртуть, свинец, мышьяк, кадмий, сурьма.
В результате взаимодействия металлов с окислительно-восстановительными системами клетки, при котором осуществляется перенос электронов, валентность металлов меняется. При этом переход в состояние низшей валентности обычно связывают с уменьшением токсичности металлов. Например, ионы шестивалентного хрома (Сr 6+ ) переходят в организме в малотоксичную трехвалентную форму (Сr 3+ ).
Ряд металлов (ртуть, кадмий, медь, никель и др.) активно связывается с биокомплексами, в первую очередь с функциональными группами ферментов (—SN, —NH2, —СООН и др.), что обусловливает избирательность их биологического действия. При этом металлы оказывают стимулирующее или угнетающее влияние на них (Оксенгендлер Г. И., 1982]. Металлы разрушают структуру клеточных оболочек, что приводит к выходу из клеток калия и проникновению в нее натрия и воды.
Основными сферами избирательной токсичности соединений тяжелых металлов являются эпителий почек, печени, кишечника, эритроциты и нервные клетки, где наблюдается повышенная концентрация химических веществ [Лужников Е. А., 1982].
Клеточные рецепторы — это компоненты белковых, мукополисахаридных или липидных молекул, которые расположены внутри или на поверхности клетки и которые взаимодействуют с токсическим (химическим) веществом. В токсикологии клеточные рецепторы отождествляются с активными центрами ферментов, что отличает их от рецепторов иммунокомпетентных клеток, взаимодействующих с антителами, аллергенами и медиаторами аллергического воспаления.

В полости рта сплавы металлов подвергаются электрохимическому процессу (коррозия), следствием чего является выход ионов металлов в слюну, слизистые оболочки полости рта, кровь. Нами установлено, что из нержавеющей стали (главным образом, припоя) в слюну дополнительно поступают микропримеси железа, меди, марганца, никеля, хрома и др. Содержание титана, олова, хрома, никеля в количестве меньше 1•10 -6 % является субпороговым и не оказывает заметного влияния на организм (табл. 5). Однако длительное пользование протезами может приводить к токсическому раздражению рецепторного аппарата слизистых оболочек полости рта субпороговыми дозами микропримесей металлов.

Концентрация микроэлементов в слюне больных с протезами из хромокобальтовых сплавов также меняется: увеличивается содержание хрома, никеля, кобальта, железа. Наиболее высокие концентрации этих микропримесей отмечены в слюне лиц с признаками непереносимости вследствие развития токсической реакции (табл. 6).
Увеличение содержания химических элементов (микропримесей) в слюне связано с высокими значениями отрицательных электрохимических потенциалов хромокобальтовых сплавов, нержавеющей стали, сдвигом рН в кислую сторону.
По данным С. Разуддинова (1974), в смешанной слюне при интактном зубном ряде и нормальной слизистой оболочке удельная активность фермента лактатдегидрогеназы (ЛДГ) в 6 раз выше, чем кислой фосфатазы (КФ). Последняя же в свою очередь более активна, чем глутаматтрансаминаза (ГПТ). Наибольшей активностью обладает щелочная фосфатаза (ЩФ). У практически здоровых лиц, пользующихся мостовидными протезами из нержавеющей стали, в смешанной слюне происходит существенное снижение активности глутаматоксалоацетаттрансамилазы (ГОТ) и глутаматпируваттрансаминазы (ГПТ), что можно рассматривать как реакцию биохимической адаптации к зубным металлическим протезам [Ретенберг Ю. С., 1963].

Установлено, что нержавеющая сталь изменяет активность амилазы слюны [Рубежова И. С., 1960; Бахтиярова-Романенко А. Т., 1967, и др.]. Отмечаются значительное ингибирование трансаминаз и активация фосфатаз (КФ, ЩФ). Эта же закономерность прослеживается в слизистой оболочке полости рта: активность КФ увеличивается вдвое, содержание ЩФ повышается умеренно по сравнению с контрольной группой (табл. 7).
На активность ферментов смешанной слюны влияют различные сплавы металлов и их сочетания. Установлено, что активность, и удельная активность КФ смешанной слюны у лиц, имеющих протезы из золота в комбинации с нержавеющей сталью, более высока (р 0,05), но была существенно выше, чем у лиц с протезами из золота (р 0,05). Повышение активности ЩФ наблюдалось лишь при развитии токсического стоматита.
Наибольшее изменение активности и удельной активности обеих трансаминаз отмечается у лиц с протезами из нержавеющей стали и из золота в комбинации с нержавеющей сталью. В обоих случаях снижение активности аминотрансфераз достоверно по сравнению с контролем (р 0,05).
Удельная активность лактатдегидрогеназы снижена у лиц с протезами из нержавеющей стали (р
В анамнезе у 22 больных отмечена лекарственная болезнь. Не установлена связь между токсическим стоматитом, обусловленным металлами и заболеваниями сердечно-сосудистой системы (r >0,11). Клиническая картина развивается в первые дни введения металлических протезов в полость рта. У 35 больных (38,5%) срок пользования металлическими протезами составил до 5 лет.

Степень выраженности жжения языка, губ, десен различна. У одних больных жжение носит мучительный характер, приближаясь к типу каузалгий, у других жжение выражено нерезко. Жжение во рту может сопровождаться головной болью, раздражительностью, плохим сном. Нередко такие больные начинают лечение у невропатолога, а затем их направляют к стоматологу.
При осмотре полости рта обнаруживается, что наиболее выражены изменения языка: при наличии явлений атрофии нитевидных сосочков кончика языка на гладком кончике языка видны грибовидные сосочки в виде красноватых точек. Иногда отмечаются гиперемия губ и незначительный отек языка, губ, слизистых оболочек полости рта.
При осмотре металлических конструкций в полости рта выявляются окисные пленки в местах паек, поры, шероховатости, изменение цвета золотых протезов, коронок, мостовидных и бюгельных протезов из нержавеющей стали и хромокобальтового сплава.
После снятия мостовидных протезов секреторная деятельность нормализуется через 1—3 дня в случае гиперсаливации и значительно позже (через 1 мес и более) при гипосекреции. По-видимому, гиперсаливация является своеобразной защитной реакцией на раздражитель — металлические протезы.
Специальные исследования слюны на микроэлементы [Гожая Л. Д., 1972] позволили установить прямую зависимость между качественным составом, количественным содержанием микроэлементов слюны и клиникой токсических реакций.
Спектрограмма слюны является тестом объективной оценки электрохимических процессов в полости рта. Спектрограмма слюны лиц с металлическими протезами из нержавеющей стали при выраженном электрохимическом процессе характеризуется увеличением количественного содержания железа, меди, марганца, серебра, алюминия, титана и др.
На спектрограмме слюны у лиц с протезами из хромо-кобальтового сплава, при выраженном электрохимическом процессе возрастает содержание хрома, кобальта и др. Если в полости рта имеются протезы из нержавеющей стали и золота и происходит коррозия, то в слюне увеличивается содержание золота, меди и серебра. В этом случае на спектрограмме слюны видны аналитические линии золота (267 нм), меди (324 нм) и серебра (328 нм).
Нами определены критические значения (nкр) содержания металлов (для меди nкр>1 • 10 -3 %, для свинца, кадмия nКр= 1 • 10 -6 %), превышение которых обусловливает развитие токсического стоматита.
Увеличение количества серебра в слюне не вызывает токсических явлений, так как химическим антагонистом для серебра является поваренная соль, которая подавляет процессы диссоциации и растворения [Оксенгельдлер Г. И., 1982]. Соли серебра в отличие от солей меди оказывают не раздражающее, а только противовоспалительное действие, давая бактерицидный эффект [Комендантова М. В., 1968].
Установлено, что у больных, пользующихся зубными протезами из нержавеющей стали, увеличивается содержание свинца в компанктном веществе кости нижней челюсти и слюне по сравнению с нормой [Гожая Л. Д., Семенюк В. М., 1974].
Стоматиты при отравлении свинцом характеризуются кровоточивостью, изъязвлением десен, слюнотечением, увеличением и болезненностью лимфатических узлов при пальпации. Механизм действия объясняется тем, что свинец способствует спазму кровеносных сосудов, развитию анемии.
Кадмий входит в состав золотых припоев. При коррозии серебряно-палладиевых золотых сплавов в слюне увеличивается содержание кадмия (1•10 -5 %) по сравнению с нормой (0,5•10 -6 %). При этом может развиться токсический стоматит: сухость во рту, ощущение привкуса металла, бледность слизистых оболочек. Возможно повышение артериального давления [Гожая Л. Д., 1969].
Ртуть входит в состав амальгамовых пломб. При сочетании таких пломб и золотых протезов происходит амальгамирование золота. При этом может возникнуть ртутный стоматит: десны набухшие, синевато-красные, чувствительные и кровоточащие. На деснах, слизистой оболочке щек и языке появляются некротизированные участки, ограниченные гиперемированной каймой. Язык и слюнные железы увеличены, больные жалуются на металлический вкус во рту [Шугар Л. и др., 1980].
Микроэлементы, вымываемые из металлических протезов, являются механическими и химическими раздражителями рецепторного поля полости рта. Так, биотические количества солей хлора, меди, цинка, кобальта (1•10 -13 — 1•10 -14 %) способны повышать возбудимость и усиливать сокращение периферических нервов. При концентрации меди 1•10 -6 % возбудимость падает, мышечное сокращение ослабевает [Попов Г. В., 1962]. Под влиянием некоторых микроэлементов (цинк, марганец, медь и др.) изменяется ионная проницаемость клеточной мембраны нервного волокна и центральных нейронов в покое и при возбуждении. Микроэлементы изменяют обменные клеточные процессы.
В ответ на раздражения, вызываемые микроэлементами и микротоками, возникает болевая защитная реакция слизистой оболочки полости рта и, в частности, языка. Установлено, что с увеличением количества металлических включений в полости рта и интенсивности электрохимических процессов, о чем можно судить по спектрограмме слюны, понижается порог болевой чувствительности языка и, следовательно, она повышается (13,1± ±0,12 г/мм2).
У здоровых лиц самый высокий уровень болевой чувствительности регистрируется в области кончика языка и его передней трети (25,1 ±0,18 и 27,3±0,15 г/мм2), самый низкий — у корня языка (по средней линии 55,4 ±0,31 г/мм2, на боковых поверхностях 42,6 ± ±0,18 г/мм2) [Ефремова Л. А., 1975].
Микроэлементы, поступающие в слюну из металлических протезов, заглатываются, всасываются через слизистую оболочку желудка и с током крови поступают в печень (депо). При этом наблюдаются обострения заболеваний печени, гастритов, язвенной болезни.
Поражение органов желудочно-кишечного тракта проявляется диспепсией, болями в животе, локализующими в эпигастральной области, металлическим вкусом во рту, извращением вкусовой чувствительности. По данным В. И. Батырь (1972), у больных с металлическими протезами, страдающими заболеваниями желудочно-кишечного тракта, при проведении только бальнеологического лечения улучшения не наступило, так как не были удалены протезы из разнородных металлов, влияние которых на организм сохранилось. У 97 из 131 больного заболевания органов желудочно-кишечного тракта развились спустя 1—3 года после протезирования. Объективными тестами таких заболеваний вследствие влияния металлических зубных протезов послужили показатели содержания микроэлементов биологических сред (слюна, желудочный сок, кровь, моча) по сравнению с контрольной группой обследованных.
У больных, которым проводили лечение болезней желудочно-кишечного тракта, не устраняя разнородность металлов в полости рта, в желудочном соке, крови было достоверно увеличено содержание марганца, меди, свинца, никеля, в моче — железа, меди.
У лиц же, подвергшихся комбинированной терапии (лечение заболеваний желудочно-кишечного тракта и ортопедическое), отмечено значительное снижение содержания микроэлементов в желудочном соке, крови и моче.
В результате лечения при помощи протезов из серебряно-палладиевых сплавов улучшилась функция вкусовых рецепторов языка натощак, повысился уровень функциональной мобильности (в норме после еды происходит мобилизация половины вкусовых рецепторов языка), восстановился гастролингвальный рефлекс [Батырь В. И., 1972].
Клиническая картина токсического стоматита, вызванного пластмассовым протезом. Токсический стоматит может возникнуть в полости рта и при пользовании акриловыми протезами, когда содержание мономера в протезе высокое вследствие грубого нарушения режима полимеризации. Характерно быстрое и выраженное проявление интоксикации. Спустя 1—7 сут после наложения съемных протезов ощущается сильное жжение слизистых оболочек полости рта под протезом, жжение губ. Снятие протеза уменьшает эти ощущения, но они не исчезают полностью. При осмотре полости рта отмечаются гиперемия и отек слизистых оболочек под протезом (чаще на верхней челюсти), сухость слизистых оболочек полости рта (чаще только под съемными протезами). Язык гиперемирован, сухой. Сосочки сглажены, атрофированы. Токсический стоматит на акриловый протез может сопровождаться не только гипо-, но и гиперсаливацией.
Токсины нарушают функцию парасимпатических нервов, а также ткань слюнных желез, что приводит к изменению обмена гистамина и серотонина, калия, белка, следствием чего является гипосаливация. При гиперсаливации таких изменений обмена не отмечено [Михайлов В. В. и др., 1981; Стебаков В. А., 1980]. По-видимому, она является защитным фактором, направленным на отмывание токсина — мономера.
Анализ историй болезни 90 больных токсическим стоматитом показал, что у 82 (91%) отмечались жжение и сухость под пластмассовым протезом. У 13 больных (14,4%) протезы были некачественными. Цвет пластмассы изменился у 16 больных (17,7%). Важно, что 57 из 90 больных (71%), пользовавшихся съемными протезами на беззубую верхнюю челюсть и нижнюю челюсть при частичной потере зубов, ощущали жжение под верхним протезом.
Диагноз токсического стоматита, вызванного акриловым протезом, мы устанавливали на основании не только характерной клинической картины, но и анализов периферической крови после двухчасового ношения акрилового протеза. Приводим клинический анализ крови больноro с токсической реакцией на акриловый протез (табл. 9). Из табл. 9 видно, что токсический стоматит на акрилаты сопровождается лейкоцитозом, эритропенией, увеличением СОЭ.

К числу ранних биохимических показателей при воздействии акрилатов следует отнести повышение активности ферментов — целуроплазмина, ацетилхолинэстеразы сыворотки крови, увеличение содержания общего и восстановленного глютатиона, а также повышение активности ЩФ, ЛДГ и трансаминаз смешанной слюны [Разуддинов С., 1974]. Повышение активности ферментов свидетельствует о компенсаторном усилении окислительно-восстановительных процессов в организме [Маврина Е. А., 1977].
При хроническом токсическом действии акрилатов возможны изменения органов желудочно-кишечного тракта: нарушение моторики, дискинезия, обострения хронического гастрита, колита. В табл. 10 представлена основные диагностические критерии и информативные методы исследования при стоматите. Клинико-экспериментальные исследования указывают на возможность развития острых отравлений акрилатами.

Острые отравления возникают при воздействии высоких концентраций мономера, проникающего через верхние дыхательные пути или кожные покровы. Это может случиться при грубых нарушениях техники безопасности при работе зубных техников [Варес Э. Я., Павленко А. П., 1981; Катаева В. А., 1981].
Читайте также:


