Элективная питательная среда для культивирования стафилококков
Глава 14. Стафилококки
Впервые стафилококки были обнаружены Л. Пастером в 1897 г. Подробно они были изучены А. Огстоном (1882) и Ф. Розенбахом (1884).
Морфология. Стафилококки (от греч. staphyle - виноградная гроздь) имеют вид круглых шаров диаметром 0,5-1,5 мкм. Размножаясь, образуют скопления в виде грозди винограда. Такая форма является результатом деления микробов в различных плоскостях. Однако в гное встречаются единичные и парные кокки. Стафилококки неподвижны, не имеют спор, при специальных условиях культивирования образуют микрокапсулу, грамположительны.
Культивирование. Стафилококки - факультативные анаэробы, однако лучше растут в присутствии кислорода. Растут и размножаются на обычных питательных средах, хорошо растут на средах с кровью, оптимальные условия - температура 37° С, рН 7,2-7,4.
Элективными средами являются желточно-солевой агар и солевой агар. На МПА колонии стафилококка выпуклые, круглые, непрозрачные, блестящие, размером 2-4 мм с ровными краями. При росте стафилококки образуют пигмент: золотистый, лимонно-желтый или белый. Лучше всего пигмент образуется на молочной среде при комнатной температуре и рассеянном свете. Стафилококковый пигмент не растворяется в воде, растворяется в ацетоне, эфире, спирте и т. д. При росте некоторых штаммов стафилококка на агаре с кровью вокруг колонии образуется зона гемолиза. Рост на бульоне характеризуется равномерным помутнением и осадком на дне.
Ферментативные свойства. Стафилококки вырабатывают сахаролитические и протеолитические ферменты. Сахаролитические ферменты расщепляют ряд сахаров: лактозу, глюкозу, сахарозу, мальтозу, глицерин и другие с образованием кислоты.
Протеолитические свойства стафилококка выражаются в способности растворять казеин, разжижать желатин (медленно), расщеплять другие белковые субстраты.
Стафилококки продуцируют ферменты патогенности: 1) коагулазу (сворачивает плазму крови); 2) гиалуронидазу (фактор распространения); 3) лецитиназу (растворяет лецитин оболочки клеток); 4) фибринолизин (лизирует фибрин); 5) ДНКазу (деполимеризует ДНК); 6) фосфатазу и др.
Наличие плазмокоагулазы позволяет дифференцировать золотистый стафилококк от стафилококков других видов. Многие стафилококки вырабатывают пенициллиназу, разрушающую пенициллин.
Токсинообразование. Стафилококки вырабатывают экзотоксины. К их числу относятся гемолизины четырех типов, из которых наибольшее значение имеет α-токсин. Он обладает следующими свойствами: гемолитическим - вызывает гемолиз эритроцитов, дермонекротическим - при внутрикожном введении вызывает некроз, летальным - при внутривенном введении приводит к гибели чувствительных к нему животных.
Кроме гемолизинов стафилококки образуют лейкоцидин, убивающий лейкоциты, энтеротоксины шести типов, вызывающие пищевые отравления, эксфолиатины двух типов, приводящие к отслаиванию эпидермиса у новорожденных детей.
Антигенная структура. Стафилококки имеют протеиновый антиген А, общий для всех золотистых стафилококков, и полисахаридные антигены: А, Б, С.
Стафилококки выделяют бактериоцины (стафилоцины), которые обладают антагонистическим действием по отношению к микроорганизмам данного рода.
Среди золотистых (реже эпидермальных) стафилокков различают около 40 фаговаров. Определение чувствительности выделенных из различных объектов стафилококковых культур к типовым фагам имеет важное эпидемиологическое значение (при установлении источника и путей передачи возбудителя).
Классификация. В настоящее время стафилококки, выделенные от человека, делят на 3 вида (табл. 23): S. aureus, S. epidermidis, S. saprophyticus.

Таблица 23. Дифференциация видов стафилококков, выделенных от человека
Примечание. + наличие ферментации, устойчивости, - отсутствие ферментации, устойчивости.
Устойчивость к факторам окружающей среды. Стафилококки довольно устойчивы, поэтому они обнаруживаются в воздухе, почве, воде, на предметах обихода. При температуре 100° С они погибают моментально, при температуре 70° С - через 10-15 мин. Они хорошо переносят низкие температуры. При замораживании сохраняют жизнеспособность в течение нескольких лет. Хорошо переносят высушивание. Прямой солнечный свет убивает их только через несколько часов. Обычные растворы дезинфицирующих веществ (например, сулема в разведении 1:1000) убивают их через 15-20 мин. При обезвреживании выделений, содержащих гной, белок, мокроту, не следует применять фенол. Это дезинфицирующее вещество вызывает коагуляцию белков, что предохраняет микроорганизмы от гибели. Стафилококки чувствительны к бриллиантовому зеленому.
Восприимчивость животных. К стафилококку чувствительны крупный и мелкий рогатый скот, лошади, свиньи, куры. Из экспериментальных животных - кролики, белые мыши и котята.
Источники инфекции. Больной человек и бактерионоситель.
Пути передачи. Контактно-бытовой, воздушно-капельный, воздушно-пылевой, пищевой.
Заболевания у человека. Пиодермия, фурункулы, карбункулы, панариции, абсцессы; воспалительные процессы различных органов и тканей; ангины, циститы, остеомиелиты, холециститы, маститы; сепсис и септикопиемия; пищевые токсикоинфекции и многие другие. Описано около 120 нозологических форм стафилококковой этиологии.
Патогенез. Стафилококки проникают через кожу и слизистые оболочки.
Преимущественное значение при стафилококковых заболеваниях имеет золотистый стафилококк (S. aureus). Менее выражена роль в патологии человека S. epidermidis и S. saprophyticus. Патогенез обусловливается свойствами возбудителя - ферментами, экзотоксинами, веществами бактериальной клетки и состоянием иммунной системы макроорганизма.
Чаще поражается кожа и подкожная клетчатка - возникают пиодермиты, фурункулы, панариции. Нередко стафилококки обусловливают вторичные заболевания, например пневмонию при гриппе. Они также вызывают раневые инфекции. Особенно велика роль стафилококков в акушерской практике, так как новорожденные очень чувствительны к ним. В течении стафилококковых заболеваний имеет значение развитие аллергии, поэтому заболевание характеризуется рецидивами.
Особое место среди стафилококковых заболеваний занимают пищевые интоксикации. Клинически они протекают как токсикозы, сопровождаются рвотой, поносом, головной болью и другими явлениями.
Иммунитет. У человека имеется естественная резистентность, связанная с механическими факторами, фагоцитозом и наличием антител. Воспалительный процесс, возникающий в месте внедрения возбудителя, обусловливает задержку стафилококков и затрудняет их распространение по организму. В образовавшемся очаге стафилококки подвергаются фагоцитозу.
Образующийся в процессе заболевания антитоксин является важным фактором в общем комплексе иммунитета. Однако приобретенный иммунитет нестойкий, поэтому наблюдаются рецидивы.
Профилактика. Сводится к улучшению санитарно-гигиенических условий, активному выявлению больных и бактерионосителей, правильному режиму работы больничных учреждений.
Специфическая профилактика. Стафилококковый анатоксин и антистафилококковый иммуноглобулин.
Лечение. Антибактериальные препараты, поливалентный стафилококковый бактериофаг, антистафилококковая плазма и иммуноглобулин. В некоторых случаях при хроническом течении стафилококковых инфекций применяют аутовакцину.
1. По какому признаку кокки объединены в одну группу?
2. Какие ферменты и факторы патогенности продуцируют стафилококки?
3. Какие заболевания вызывают стафилококки?
4. Какие виды стафилококков Вы знаете?
Цель исследования: выделение и идентификация стафилококков.
1. Гной (фурункулы, карбункулы, абсцессы).
2. Слизь из зева (ангина).
3. Мокрота (пневмония).
4. Моча (пиелиты и циститы).
5. Дуоденальное содержимое (холецистит).
6. Кровь (подозрение на сепсис).
7. Рвотные массы, промывные воды желудка, пищевые продукты (пищевые отравления).
8. Слизь из носа (обследование на бактерионосительство).

Способы сбора материала

Первый день исследования
Все посевы ставят в термостат на сутки.
Обнаружение стафилококков при микроскопии гноя из закрытого абсцесса и осадка мочи, взятой катетером, позволяет дать предварительный положительный ответ: обнаружен стафилококк.
Посевы на плотных и жидких питательных средах вынимают из термостата и изучают. Подозрительные в отношении стафилококка колонии, выросшие на желточно-солевом агаре, отсевают на скошенный агар для получения и дальнейшего изучения чистой культуры. При этом учитывают наличие лецитиназы, которое проявляется в образовании радужного венчика вокруг колонии. Чашки с оставшимися колониями оставляют на 2-3 дня при комнатной температуре для выявления пигмента. Просматривают посевы на чашках с агаром, содержащим кровь. Колонии с четкой зоной гемолиза (просветление) вокруг них выделяют на скошенный агар. Посев крови в сахарном бульоне инкубируют 10 сут, производя через 2-3 дня высевы на агар с кровью и желточно-солевую среду.
При отсутствии роста на плотных питательных средах делают высев из бульона с глюкозой на агар с кровью. Посевы ставят в термостат на сутки.
Вынимают посевы из термостата. Из выделенных на скошенный агар культур делают мазки, окрашивают по Граму и микроскопируют. При наличии грамположительных стафилококков проводят дальнейшее изучение выделенной культуры:
а) ставят реакцию плазмокоагуляции;
б) изучают гемолитические свойства;
в) определяют продукцию ДНКазы;
г) определяют ферментацию маннита в анаэробных условиях;
д) определяют устойчивость к новобиоцину.
Реакция плазмокоагуляции. Цитратную плазму, полученную из крови кролика, разводят изотоническим раствором натрия хлорида в соотношении 1:4 и наливают в две преципитационные пробирки по 0,3-0,5 мл. В одну пробирку вносят петлю исследуемой культуры, другая пробирка служит контролем. Обе пробирки ставят в термостат при температуре 37° С. Учет реакции производят через 2-3 ч. При отсутствии свертывания плазмы посевы оставляют при комнатной температуре на 24 ч, после чего учитывают реакцию. При наличии фермента коагулазы плазма свертывается (не выливается из перевернутой пробирки). В контрольной пробирке консистенция плазмы не изменяется.
Ускоренный метод определения коагулазы. В стерильной капле воды на предметном стекле суспендируют выделенную культуру, к ней прибавляют одну каплю неразведенной плазмы. При положительной реакции из микробных клеток в течение 20-60 с образуются крупные хлопья. Этот метод используют при массовых обследованиях.
Определение гемолитических свойств. Производят посев на агар с 5% крови (штаммы, продуцирующие α-гемолизин, дают зоны просветления среды и на кроличьей и на бараньей крови, продуцирующие β-гемолизин лизируют только эритроциты барана).
Определение ДНКазы. Исследуемую культуру засевают на среду, содержащую ДНК. Посевы инкубируют. Через 18-20 ч на чашку с выросшими колониями стафилококка добавляют 5-7 мл раствора хлороводородной кислоты. ДНК реагирует с кислотой и среда становится мутной. Если выделенная культура продуцирует фермент ДНКазу, он деполимеризует ДНК и помутнение не образуется.
Расщепление маннита в анаэробных условиях. Исследуемую культуру засевают уколом на полужидкий агар с маннитом. Поверхность среды заливают вазелиновым маслом. Инкубируют 18-24 ч при 37° С. Положительная реакция характеризуется изменением цвета среды (в среде имеется индикатор).
Производят учет результатов (табл. 24).
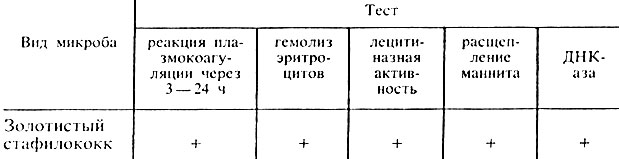
Таблица 24. Свойства золотистого стафилококка
Примечание. + положительная реакция.
Наличие перечисленных признаков позволяет отдифференцировать золотистые стафилококки от стафилококков других видов и дать окончательный ответ: выделен S. aureus (рис. 37).
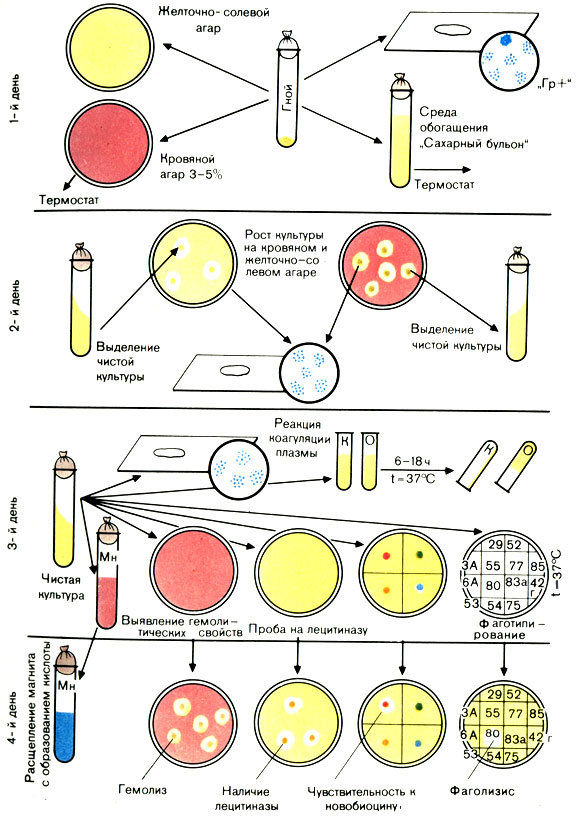
Рис. 37. Схема выделения и идентификации стафилококка
Для установления эпидемиологической цепочки выделенную культуру фаготипируют. Фаготипирование может подтвердить идентичность стафилококков, выделенных от разных больных и из объектов внешней среды.
Для фаготипирования используют критические тест-разведения фагов. Критическим тест-разведением называют то максимальное разведение фагов, при котором происходит полусливной лизис соответствующего штамма стафилококка.
Методика фаготипирования. В чашку Петри наливают 20 мл 1,5% МПА, дают ему застыть и подсушивают в термостате в течение 30-40 мин. На поверхность агара наносят 1 мл 4-6-часовой культуры выделенного стафилококка, распределяют по поверхности всей чашки, избыток жидкости отсасывают или дают ей испариться в термостате в открытой чашке. Предварительно дно чашки делят на секторы или квадраты. Число квадратов или секторов должно соответствовать количеству используемых фагов. Затем на каждый квадрат или сектор наносят один фаг.
Чашки ставят в термостат при температуре 37° С. Результаты определяют через 6-7 ч. Если чашки оставляют при комнатной температуре, то учет фаголизиса производят через 18-24 ч.
Биологические пробы. Проба на определение летальных свойств культуры. Для выявления летального действия токсина кролику вводят внутривенно (или внутрибрюшинно) фильтрат бульонной культуры стафилококка из расчета 0,1-0,2 мл фильтрата на 1 кг массы кролика. Гибель кролика через 3-4 дня свидетельствует о наличии летального действия токсина.
Дермонекротическая проба. Пробу ставят на кролике (наиболее чувствительному к этому токсину животному). Предварительно на боку или на спине животного выщипывают шерсть и вводят внутрикожно 0,2 мл двухмиллиардной взвеси стафилококковой культуры в изотоническом растворе натрия хлорида. При наличии в выделенной культуре некротических свойств в месте введения образуется инфильтрат, сопровождающийся некрозом.
Реакцию учитывают через 24-18 ч.
Полученную культуру стафилококка проверяют на чувствительность к антибиотикам методом бумажных дисков (см. главу 9).
1. Какой материал исследуют при заболеваниях, вызываемых стафилококками?
2. Каковы основные методы лабораторного исследования для выявления стафилококков?
3. Какова методика постановки реакции плазмокоагуляции?
4. На какой среде выявляют гемолитические свойства стафилококков?
5. С какой целью проводят фаготипирование?
Проверьте, к какому антибиотику чувствительна выделенная культура стафилококка.
Желточно-солевой агар Чистовича. Готовят желточную смесь (1 желток куриного яйца на 150 мл стерильного изотонического раствора натрия хлорида). К мясопептонному солевому агару (8-10% натрия хлорида), растопленному и остуженному до 45° С, добавляют 20% желточной взвеси (соблюдают стерильность) и разливают в чашки.
Агар с кровью. См. главу 7.
Солевой бульон, солевой агар. Готовят как обычные среды - МПБ и МПА, только натрия хлорид вносят в большем количестве (8-10%). Бульон разливают в колбы, пробирки, агар - в чашки.
Для выделения культур стафилококков обычно используют 5%-ный кровяной агар (кровь овцы, кролика, крупного рогатого скота). При исследовании образцов, содержащих постороннюю микрофлору, целесообразно использовать селективные среды.
Таблица 9. Дифференциальные признаки стафилококков, имеющих основное медицинское значение
| Признак | S. aureus | S. epidermidis | S. saprophyticus | |
| Anaerobius | Aureus | |||
| Наличие каротиноидного сегмента | – | ± | – | + |
| Способность к росту в анаэробных условиях (тиогликолевая среда) | + | + | + | ± |
| Рост на средах с 10% NaCI | + | + | ± (слабо) | + |
| Рост при: | ||||
| 15°С | ? | + | – (слабо) | + |
| 45°С | – | + | + | ± |
| Образование кислоты при ферментации углеводов в аэробных условиях: | ||||
| ксилоза | – | – | – | – |
| арабиноза | – | – | – | – |
| раффиноза | – | – | – | – |
| сахароза | + | + | + | + |
| маннит | – | + | – | ± |
| манноза | – | + | ± | – |
| трегалоза | – | + | – | + |
| лактоза | – | + | ± | ± |
| галактоза | – | + | ± | – |
| фруктоза | + | + | + | + |
| ксилит | – | – | – | ± |
| Восстановление нитратов | – | + | + (слабо) | – |
| Щелочная фосфатаза | + | + | + | – |
| Гиалуронидаза | + | + | + | ? |
| Уреаза | ? | ± | + | + |
| Коагулаза (на сыворотке кролика) | + | + | – | – |
| Фибринолизин | ? | ± | ± | ? |
| Гемолитическая активность | + | + | – (слабо) | – |
| ДНКаза | + | + | – (слабо) | – |
| Чувствительность к новобиоцину (МИК >1,6 мкг/мл) | + | + | + | – |
С целью дифференциации патогенных стафилококков от сапрофитных, а также от микрококков, используют среды, позволяющие одновременно определить один из признаков, характеризующих патогенные стафилококки. Приводим рецепты некоторых питательных сред.
Молочно-солевой агар
В 100 мл МПБ растворяют 6,5 г хлорида натрия, 20 г агар-агара. Устанавливают рН 7,4, стерилизуют при 121°С 20 минут. Перед использованием агар расплавляют, охлаждают до 45°С, добавляют 10% стерильного обезжиренного молока и разливают по чашкам Петри. На этой среде определяют пигментообразование и способность к росту при наличии 6,5% хлорида натрия.
Лактозо-солевой бульон с фенолротом
В 1000 мл дистиллированной воды растворяют 10 г триптона, 5 г мясного экстракта, 1 г дрожжевого экстракта, 5 г хлористого лития, 20 г агара. Устанавливают рН 6,8, разливают по пробиркам и стерилизуют при 121°С 15 минут. При росте коагулазоположигельных стафилококков среда желтеет (тест на коагулазу положительный).
Теллурит-полимиксин-желточный агар Крисли
В 1000 мл дистиллированной воды растворяют 10 г триптона, 5 г дрожжевого экстракта, 5 г маннита, 20 г хлорида натрия, 2 г хлористого лития, 18 г агара. Устанавливают рН 7,3, стерилизуют 15 минут при 121°С. Перед использованием в среду добавляют 100 мл 30%-ной желточной эмульсии (на физиологическом растворе), 0,4 мл стерилизованного фильтрацией 1%-ного водного раствора полимиксина М, 10 мл стерилизованного автоклавированием (121°С 15 мин) 1%-ного водного раствора теллурита натрия.
Среда Джиолиотта и Кантони
В 1000 мл дистиллированной воды растворяют 10 г триптона, 5 г мясного экстракта, 5 г дрожжевого экстракта, 5 г хлористого лития, 20 г маннита, 5 г хлористого натрия, 1,2 г глицина, 3 г пирувата натрия. Устанавливают рН 6,9, стерилизуют при 115°С 20 мин. Перед употреблением к среде добавляют 0,1 мл 1%-ного водного раствора теллурита натрия, стерилизованного фильтрацией, При росте коагулазоположительных стафилококков наблюдается почернение среды или черный осадок.
Среда Бэрда-Паркера
К 90 мл основной среды с температурой 45°С добавляют 6,3 мл глицинового раствора, 1 мл раствора теллурита натрия, 5 мл эмульсии желтка, перемешивают и разливают в чашки Петри. Среда пригодна к использованию в течение 28 дней (хранение при 4°С). Перед посевом на поверхность среды наносят 0,5 мл 20%-ного водного раствора пирувата натрия, стерилизованного фильтрацией; распределяют по поверхности, подсушивают. Колонии коагулазоположительных стафилококков черные, блестящие, с узкой серо-белой полосой и окружены прозрачной зоной.
Желточная эмульсия. Свежее куриное яйцо выдерживают в 0,001%-ном растворе HgCl2. Соблюдая требования асептики, отделяют желток и эмульгируют его в 200 мл физиологического раствора.
Глициновый раствор. Глицин — 20 г, дистиллированная вода — 100 мл. Стерилизуют при 120°С 15 минут.
Раствор теллурита натрия. Теллурит натрия — 1 г, дистиллированная вода — 100 мл. Стерилизуют фильтрацией.
Желточно-солевой агар Чистовича
В расплавленный МПА с 10% хлорида натрия (рН 7,2), охлажденный до температуры 60°С, добавляют желточную эмульсию. После тщательного перемешивания питательную среду разливают в чашки Петри.
Среда Чаплина-Бернса
К 100 мл МПА добавляют 3,3 мл 0,1%-ного водного раствора кристаллического фиолетового и 5 г лактозы. Устанавливают рН 6,8. Стерилизуют автоклавированием (110°С 30 минут). Колонии патогенных стафилококков растут быстрее, чем непатогенных, и приобретают фиолетовый или оранжевый цвет.
Среда Чемпена (для выделения патогенных стафилококков)
Вариант 1: пептон — 1%, D-маннит — 1%, натрия хлорид — 7,5%, дрожжевой экстракт — 0,25%, двузамещенный фосфорнокислый калий — 0,5%, агар-агар — 1,5%. Среду стерилизуют 90 минут при 110°С, устанавливают рН 7,0 и добавляют 10% стерильного обезжиренного молока (молоко способствует лучшему образованию пигмента).
Вариант 2: пептон — 1%, дрожжевой экстракт — 0, 25%, желатин — 3%, лактоза — 0,2%, D-маннит — 1%, натрия хлорид — 7,5%, двузамещенный фосфорнокислый калий — 0,5%, агар-агар — 1,5%. Стерилизуют 90 минут при 110°С, устанавливают рН 7,0.
Молочно-солевой агар: в 100 см 3 питательного агара растворяют при кипячении 6,5 г хлорида натрия, стерилизуют при 0,1 МПа в течение 20 мин. К расплавленному и остуженному до 45°С агару добавляют 10 см 3 на 100 см 3 обезжиренного стерилизованного молока, тщательно размешивают и разливают тонким слоем в чашки Петри. Учитывают колонии с зоной просветления.
Желточно-солевой агар: к 150 см 3 расплавленного и охлажденного до 45°С 6%-ного солевого агара стерильно добавляют 50 см 3 желточного раствора (1 желток куриного яйца растворяют в 150-200 см 3 физиологического раствора). Быстро перемешивают и разливают в чашки Петри.
Среды для культивирования дрожжей и микроскопических грибов
Среда Сабуро. Основой этой среды является дрожжевая вода. Для приготовления дрожжевой воды 70…100 г свежих прессованных дрожжей (7…10 г сухих дрожжей) кипятят в течение 20…30 мин в 1 л дистиллированной воды и отстаивают в высоком цилиндре на холоде 12 час. Отстоявшуюся жидкость декантируют, добавляют еще 1 л воды, кипятят 30 мин, фильтруют, доводят рН до требуемого значения. Приготовленную среду стерилизуют дробно по 20 мин 2…3 сут. К 100 мл стерильной дрожжевой воды добавляют 1% пептона, 2% агара, после растворения агара вносят 4% глюкозы или мальтозы, фильтруют, разливают в пробирки и стерилизуют при 0,05 МПа в течение 20 мин.
Среду можно готовить и на обычной 1%-ной пептонной воде.
Синтетическая среда Ридер для дрожжей. В состав среды входят (в г/л):сульфат аммония 3,сульфат магния 0,7, нитрат кальция 0,04, хлорид натрия 0,5. дегидрофосфат калия 1,0, гидрофосфат калия. Начальное значение рН среды 6,6.Для изучения размножения дрожжей добавляют 2% сахара, для исследования брожения 5…10%. Полная синтетическая среда содержит также витамины (в мкг/мл): инозит 5, биотин 0,0001, пантотеновую кислоту 0,25, тиамин 1,0, пиридоксин 0,25, никотиновую кислоту 0,5. Стерилизуют среду в автоклаве при давлении 0,1 МПа.
Картофельно-глюкозный агар. Очищенный и нарезанный ломтиками картофель массой 200 г заливают 1 л дистиллированной воды и кипятят в течение 1 часа. Отвар фильтруют, к фильтрату добавляют воду до первоначального объема, 2% глюкозы и 2…3% агар-агара. Среду разливают в пробирки или колбы и стерилизуют при 0,1 МПа в течение 10 мин. При употреблении устанавливают рН 3,5 при помощи 10%-ного стерильного раствора безводной лимонной кислоты.
Синтетическая среда Чапека для грибов. Состав среды (в г/л): сахароза или глюкоза 30, дигидрофосфат калия 1,0, нитрат натрия 2,0, сульфат магния 0,5, хлорид калия 0,05, сульфат железа 0,1, агар 20. Навеску агара выщелачивают и добавляют к указанным ингредиентам, предварительно растворенным в 1 л дистиллированной воды, прогревают текучим паром, устанавливают рН 4,0…5,5 10% раствором лимонной кислоты или гидроксида натрия. Фильтруют, разливают в пробирки и стерилизуют дробно текучим паром 3 сут по 30 мин.
Полная среда с лизином для выявления несовершенных дрожжей. В 1 л водопроводной воды вносят (в г/л): глюкозу - 50, сульфат магния - 1, дигидрофосфат калия - 2, лактат калия - 12 мл 50% раствора, L(+) моногидрат лизина – 1, витаминный раствор (на 100 мл стерильной дистиллированной воды добавляют (в г) инозитола 2, пантотената кальция 0,4, никотинамида 0,5, хлоргидраттиамина 0,1), агара - 20. рН среды составляет 5,0…5,2. Среду разливают в пробирки и стерилизуют 15 мин при 0,1 МПа.
Среда с ацетатом для обнаружения несовершенных дрожжей. На 1 л водопроводной воды берут 10 г ацетата натрия, 10 г хлорида аммония, 5 г глюкозы, 3 мл дрожжевого автолизата, разливают в пробирки и стерилизуют при давлении 0,05 МПа в течение 30 мин.
Среды для культивирования молочнокислых бактерий
Цельное молоко разливают в пробирки или колбы и стерилизуют при 0,1 МПа в течение 10 мин. Среду используют для изучения физиологических свойств молочнокислых бактерий.
Обезжиренное молоко отделяют от сливок путем сепарирования, разливают в пробирки или колбы и стерилизуют при тех же режимах, что и цельное молоко. Среду используют для изучения физиологических свойств микробов и для группового количественного учета молочнокислых бактерий.
Гидролизованное молоко. В стерильном обезжиренном молоке устанавливают рН 7,6…7,8. Молоко нагревают до 45 0 С и к 1 л молока добавляют 0,5 - 1 г панкреатина, предварительно растворенный в теплой воде, и 5 мл хлороформа. Емкость с молоком плотно закрывают корковой пробкой, смесь тщательно перемешивают и ставят в термостат при температуре 40 0 С на 18…24 часа. Затем полученную прозрачную жидкость декантируют и фильтруют через бумажный фильтр. Фильтрат разводят водой в 2 раза, устанавливают рН 7,0…7,2 и стерилизуют при 0,1 МПа в течение 15 мин.
Агар с гидролизованным молоком. В гидролизованное молоко вносят 1,5…2,0% агар-агара. Смесь нагревают до кипения и выдерживают до полного растворения агара. Горячую среду фильтруют через ватный фильтр, разливают в пробирки или колбы и стерилизуют при давлении 0,1 МПа в течение 10…15 мин.
Среда для количественного учета гнилостных бактерий
Молочный агар готовят путем внесения 20% горячего стерильного обезжиренного молока в стерильный расплавленный 2% водный раствор агар-агара. Используется эта среда для количественного учета протеолитических и пептонизирующих бактерий (микрококков, маммококков). Вокруг колоний гнилостных бактерий образуются зоны протеолиза и пептонизации.
Среда с говяжьим жиром. В состав среды входят: пептон – 1 г, дрожжевой автолизат – 0,3, двузамещенный фосфат натрия – 0,1 г, агар – 1,5 г, дистиллированная вода – до 100 мл, рН 7,0…7.4.
Отдельно готовят в пробирках стерильный говяжий жир. Среду стерилизуют при 121 0 С (0,1 МПа) в течение 15 мин.
Участники и результаты
44-ФЗ, Электронный аукцион
– Разъяснения 102 постановления Правительства РФ.
– Разъяснения 102 постановления Правительства РФ.
ИНН 1308079580 КПП 130801001
| Наименование | Кол-во | Цена за ед. | Стоимость, ₽ |
|---|---|---|---|


