Вакцина коклюшно дифтерийно столбнячная адсорбированная жидкая акдс вакцина
Действующее вещество:
Содержание
Фармакологическая группа
Нозологическая классификация (МКБ-10)
Состав и форма выпуска
1 доза вакцины содержит взвесь 10 млрд коклюшных микробных клеток, 15 флокулирующих (ЛФ) дифтерийного и 5 антитоксин-связывающих единиц (ЕС) столбнячного анатоксина. Это соответствует не менее 4 Международным защитным единицам коклюшной вакцины, не менее 30 Международным единицам (МИЕ) дифтерийного анатоксина, не менее 60 МИЕ столбнячного анатоксина. Сорбент — гидроксид алюминия (0,25–0,55 мг/мл), консервант — мертиолят (0,05 мг/мл). Суспензия для инъекций в ампулах по 1 мл (две прививочные дозы), в упаковке 10 шт.
Характеристика
Взвесь убитых коклюшных микробов и очищенных дифтерийного и столбнячного антитоксинов, адсорбированных на гидроксиде алюминия. Представляет собой суспензию белого или слегка желтоватого цвета, разделяющуюся при стоянии на прозрачную жидкую часть и рыхлый осадок, полностью разбивающийся при встряхивании.
Фармакологическое действие
Формирует иммунитет к вирусам коклюша, дифтерии и столбняка.
Показания препарата Вакцина коклюшно-дифтерийно-столбнячная адсорбированная (АКДС-вакцина)
Коклюш, дифтерия, столбняк (профилактика) у детей старше 3 мес.
Противопоказания
Гиперчувствительность, заболевания ЦНС с прогрессирующим течением; острые респираторные заболевания и обострение хронических заболеваний, злокачественные болезни крови, новообразования, анафилактический шок, сывороточная болезнь, беременность, лактация.
Побочные действия
Повышение температуры, недомогание, в месте введения болезненность, гиперемия, отечность.
Способ применения и дозы
В/м в верхний наружный квадрант ягодицы или в передненаружную область бедра, однократно 0,5 мл. Перед прививкой ампулу необходимо тщательно встряхнуть до получения гомогенной взвеси. Курс вакцинации состоит из трех прививок с интервалом 45 дней.
Меры предосторожности
После введения необходимо наблюдение за привитыми в течение 30 мин (возможность развития аллергических реакций). Следует подготовить средства противошоковой терапии. Не пригоден к применению препарат в ампулах с нарушенной целостностью и маркировкой, при изменении физических свойств (мутность, интенсивное окрашивание, наличие неразбивающихся хлопьев), при истекшем сроке годности, неправильном хранении.
Условия хранения препарата Вакцина коклюшно-дифтерийно-столбнячная адсорбированная (АКДС-вакцина)
Хранить в недоступном для детей месте.
Срок годности препарата Вакцина коклюшно-дифтерийно-столбнячная адсорбированная (АКДС-вакцина)
Не применять по истечении срока годности, указанного на упаковке.
Инструкция по медицинскому применению
Синонимы нозологических групп
| Рубрика МКБ-10 | Синонимы заболеваний по МКБ-10 |
|---|---|
| A35 Другие формы столбняка | Водобоязнь (гидрофобия) |
| Клостридиозы раневые | |
| Мышечные спазмы при столбняке | |
| Столбняк | |
| Столбняк местный | |
| Тетанус | |
| A37 Коклюш | Бактерионосительство возбудителей коклюша |
| Судорожный кашель |
Оставьте свой комментарий
Текущий индекс информационного спроса, ‰
Регистрационные удостоверения Вакцина коклюшно-дифтерийно-столбнячная адсорбированная (АКДС-вакцина)
Р N002666/01-2003 ![]()
ЛС-000659 ![]()
Еще много интересного
Все права защищены.
Не разрешается коммерческое использование материалов.
Информация предназначена для медицинских специалистов.
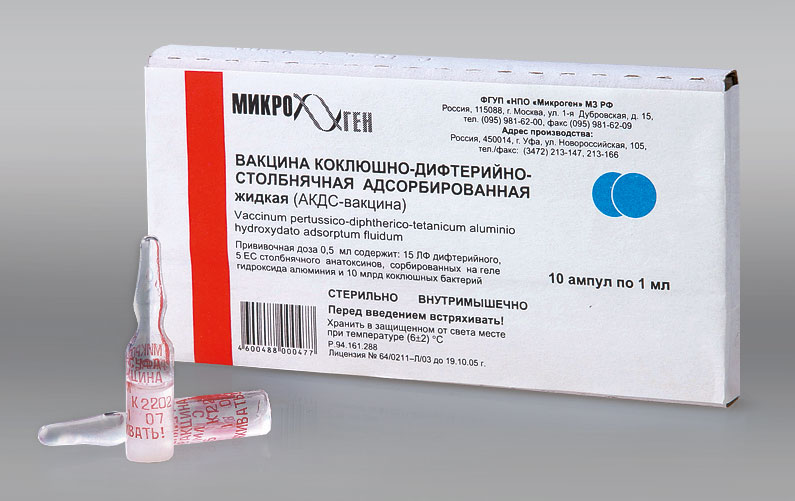
- Форма выпуска: 1 ампула / 2 дозы №10
- Схема вакцинации: профилактика дифтерии, коклюша, столбняка согласно Национального календаря прививок у детей трехкратно с интервалом 1,5 месяца (3 мес – 4,5 мес – 6 мес).
Инструкция по применению
НПО МИКРОГЕН, ФГУП (Россия)
Код ATX: J07CA (Комбинация вакцин для профилактики вирусных и бактериальных инфекций)
Активное вещество: вакцина дифтерийно-столбнячная, коклюшная (адсорбированная) (diphtheria, tetanus and pertussis vaccine (adsorbed))
Ph.Eur. Европейская Фармакопея
ВАКЦИНА КОКЛЮШНО-ДИФТЕРИЙНО-СТОЛБНЯЧНАЯ АДСОРБИРОВАННАЯ (АКДС-ВАКЦИНА)
сусп. д/в/м введения 0.5 мл/1 доза: амп. 10 шт.
Суспензия для в/м введения желтовато-белого цвета, гомогенная, без посторонних включений, разделяющаяся при стоянии на бесцветную прозрачную жидкость и рыхлый, полностью разбивающийся при встряхивании.
1 доза
вакцина для профилактики дифтерии, коклюша и столбняка
Вспомогательные вещества: алюминия гидроксид - не более 0.55 мг, формальдегид - не более 50 мкг, мертиолят 42.5-57.5 мкг (консервант).
0.5 мл - ампулы (5) - упаковки контурные ячейковые (2) - пачки картонные.
0.5 мл - ампулы (10) - пачки картонные.
Клинико-фармакологическая группа: Вакцина для профилактики дифтерии, столбняка, коклюша
Фармако-терапевтическая группа: МИБП-вакцина
Введение препарата в соответствии с утвержденной схемой вызывает формирование специфического иммунитета против коклюша, дифтерии и столбняка.
Профилактика коклюша, дифтерии и столбняка у детей.
Коды МКБ-10
Прививки АКДС-вакциной проводят в возрасте от 3 месяцев до достижения возраста 3 года 11 мес 29 дней (прививки детям, переболевшим коклюшем, проводят АДС-анатоксином).
Препарат вводят внутримышечно в передне-наружную область бедра в дозе 0.5 мл (разовая доза). Перед прививкой ампулу необходимо тщательно встряхнуть до получения гомогенной взвеси.
Курс вакцинации состоит из 3-х прививок с интервалом 1.5 месяца (3 мес, 4,5 мес и 6 мес).
Сокращение интервалов не допускается.
При необходимости увеличения интервалов очередную прививку следует проводить в возможно ближайший срок, определяемый состоянием здоровья ребенка.
Ревакцинацию проводят однократно в возрасте 18 мес (при нарушении сроков прививок - через 12-3 мес после последней вакцинации АКДС-вакциной.
Если ребенок до достижения 3 лет 11 мес 29 дней не получил ревакцинацию АКДС-вакциной, то ее проводят АДС-анатоксином (для возрастов 4 года - 5 лет 11 мес 29 дней) или АДС-М-анатоксином (6 лет и старше).
У части привитых в первые двое суток могут развиваться кратковременные общие (повышение температуры, недомогание) и местные (болезненность, гиперемия, отечность) реакции. В редких случаях могут развиться осложнения: судороги (обычно связанные с повышением температуры, эпизоды пронзительного крика, аллергические реакции, крапивница, полиморфная сыпь, отек Квинке).
Учитывая возможность развития аллергических реакций немедленного типа у особо чувствительных детей, за привитыми необходимо обеспечить медицинское наблюдение в течение 30 мин. Места проведения прививок должны быть обеспечены средствами противошоковой терапии.
- прогрессирующие заболевания нервной системы;
- афебрильные судороги в анамнезе,
- развитие на предшествующее введение АКДС-вакцины сильной общей реакции (повышение температуры в первые двое суток до 40°С и выше, появление в месте введения отека и гиперемии свыше 8 см в диаметре) или осложнения.
Дети с противопоказаниями к применению вакцины могут быть привиты АДС-анатоксином в соответствии с инструкцией по его применению
Если ребенок привит двукратно, курс вакцинации против дифтерии и столбняка считают законченным; если ребенок получил одну прививку, вакцинация может быть продолжена АДС-М-анатоксином, который вводят однократно, не ранее, чем через три месяца.
В обоих случаях первую ревакцинацию проводят АДС-М-анатоксином через 9-12 месяцев после последней прививки. Если осложнение развилось после третьей вакцинации АКДС-вакциной, первую ревакцинацию проводят АДС-М-анатоксином через 12-18 месяцев. Последующие ревакцинации проводят в 7, в 14 и каждые последующие 10 лет АДС-М анатоксином.
Не применяют при беременности и в период лактации.
Детей, перенесших острые заболевания, прививают не ранее, чем через 4 недели после выздоровления; при легких формах респираторных заболеваний (ринит, легкая гиперемия зева и т.д.) прививка допускается через 2 недели после выздоровления. Больных хроническими заболеваниями прививают по достижении стойкой ремиссии (не менее 4 недель).
При повышении температуры выше 38.5°С более, чем у 1% привитых или возникновении выраженных местных реакций (отек мягких тканей диаметром более 5 см; инфильтраты диаметром более 2 см) более, чем у 4% привитых, а также развитии тяжелых поствакцинальных осложнений, прививки препаратом данной серии прекращают.
Стабильные проявления аллергического заболевания (локализованные кожные проявления, скрытый бронхоспазм и т.п.) не являются противопоказанием к вакцинации, которая может быть проведена на фоне соответствующей терапии.
Детей, родившихся с весом менее 2 кг, прививают при нормальном физическом и психомоторном развитии; отставание в весе не является основанием к отсрочке вакцинации.
С целью выявления противопоказаний врач (фельдшер на ФАП) в день прививки проводит опрос родителей и осмотр ребенка с обязательной термометрией. Дети, временно освобожденные от прививки, должны быть взяты под наблюдение и учет и своевременно привиты.
Не пригоден к применению препарат в ампулах с нарушенной целостностью, отсутствием маркировки, при изменении физических свойств (изменение цвета, наличие неразвивающихся хлопьев), при истекшем сроке годности, неправильном хранении.
Вскрытие ампул и процедуру вакцинации осуществляют при строгом соблюдении правил асептики и антисептики. Препарат во вскрытой ампуле хранению не подлежит.
Введение препарата регистрируют в установленных учетных формах с указанием номера серии, срока годности, предприятия-изготовителя, даты введения, характера реакции на введение препарата.
Случаи передозировки не установлены.
АКДС-вакцину можно вводить одновременно (в один день) с полиомиелитной вакциной и другими препаратами национального календаря профилактических прививок (за исключением БЦЖ), а также с инактивированными вакцинами календаря профилактических прививок по эпидемическим показаниям.
Храненить при температуре от 2 до 8°С в соответствии с СП 3.3.2.1248-03. Хранить в недоступном для детей месте.
Транспортировать при температуре от 2 до 8°С в соответствии с СП 3.3.2.1248-03. Замораживание не допускается.
Срок годности - 18 месяцев. Препарат с истекшим сроком годности применению не подлежит.
Для лечебно-профилактических учреждений
Всё, что вам нужно знать о китайском коронавирусе
Интервью телеканала RT с Дмитрием Львовым — легендой советской вирусологии, экспертом ВОЗ по гриппу и респираторным инфекциям с 1987 года.
Ротавирусная инфекция: что важно знать?
Существует несколько типов вируса, но патогенными для человека являются серотипы А, В, С, а наиболее распространен тип А. Этот вирус поражает не только человека, но и разные виды млекопитающих и птиц. Ротавирус группы А считается одной из наиболее частых причин возникновения инфекционных диарей у детей.
Полиомиелит – симптомы, последствия, как не заразиться
Полиомиелит – это острое инфекционное заболевание человека, которое сопровождается поражением нервной системы, развитием парезов и параличей. Полиомиелит в основном поражает детей в возрасте до 5 лет. 1 из 200 инфекций приводит к необратимому параличу. Среди тех парализованных, от 5% до 10% умирают, когда их дыхательные мышцы становятся неподвижными.
Отличие ротавирусной инфекции от кишечной инфекции.
Многие родители паникуют, путая ротавирус, дизентерию и отравление. Врачи предупреждают, что одно из главных отличий – характер стула.
Коронавирус: Молот и Танец
Эта статья была результатом невероятных усилий группы обычных людей, работающих круглосуточно, чтобы найти все соответствующие исследования, чтобы структурировать их в единое целое, если это может помочь другим обработать всю имеющуюся информацию о коронавируса.
Содержимое (Table of Contents)
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФАРМАКОПЕЙНАЯ СТАТЬЯ
Вакцина коклюшно-дифтерийно- ФС.3.3.1.0010.15
cтолбнячная адсорбированная
(АКДС-вакцина) Взамен ФС 42-3362-97
Настоящая фармакопейная статья распространяется на иммунобиологический лекарственный препарат — вакцину коклюшно-дифтерийно-столбнячную адсорбированную (АКДС-вакцину), которая представляет собой смесь инактивированных коклюшных клеток и обезвреженных формальдегидом при нагревании дифтерийного и столбнячного токсинов, очищенных и адсорбированных на алюминия гидроксиде или другом разрешенном к применению минеральном сорбенте.
В состав лекарственного средства может входить антимикробный консервант.
АКДС-вакцина предназначена для специфической профилактики коклюша, дифтерии и столбняка.
ПРОИЗВОДСТВО
Все этапы производства АКДС-вакцины должны быть валидированы с целью подтверждения установленных требований и должны гарантировать безопасность ее применения.
При производстве столбнячного анатоксина используют штаммы/штамм Clostridium tetani, полученные и депонированные в Государственной коллекции. Микробные клетки культивируют на жидких питательных средах, обеспечивающих высокую продукцию столбнячного токсина. Методы культивирования должны гарантировать сохранение свойств штаммов и предотвращать их контаминацию. Токсинсодержащую культуральную жидкость, освобожденную от микробных клеток и продуктов их распада, проверяют на стерильность, рН и содержание токсина. Для производства столбнячного анатоксина используют культуральную среду с активностью токсина не менее 15 L+/100 в 1 мл. Детоксикация столбнячного токсина должна обеспечивать сохранение антигенной активности анатоксина и гарантировать его безопасность – отсутствие остаточной токсичности (специфическая безопасность) и реверсии токсических свойств. Столбнячный анатоксин должен быть очищен от примесей, вызывающих побочные реакции при введении человеку. Для характеристики очищенного столбнячного анатоксина определяют рН, специфическую (антигенную) активность, содержание общего и белкового азота, антигенную чистоту (удельную активность).
Определение специфической безопасности столбнячного анатоксина. Вводят подкожно 5 морским свинкам массой 250 — 350 г 1500 Lf столбнячного анатоксина (суммарно в бок и внутреннюю поверхность верхней трети бедра). В течение 21 сут наблюдения у животных не должны обнаруживаться признаки столбняка (ригидность лапки, искривление позвоночника или сочетание указанных признаков) и потери массы тела. Если фиксируют гибель более 1 животного по причине, не связанной со специфической интоксикацией, испытание повторяют. Если при повторном испытании наблюдают гибель более 1 животного, столбнячный анатоксин считают не прошедшим испытание.
Реверсия токсичности столбнячного анатоксина. Готовят раствор, содержащий столбнячный анатоксин, консервант (при его наличии) в 0,9 % растворе натрия хлорида в концентрации, принятой для готового продукта. Полученную смесь делят на 2 части и выдерживают в течение 42 сут: первую — при температуре (37 ± 1) ºС, вторую — при температуре от 2 до 8 ºС. Каждый образец вводят подкожно 5 морским свинкам массой 250 – 350 г в объеме 5 мл (по 2,5 мл в оба бока). Наличие признаков столбняка в течение 21 сут наблюдения за животными свидетельствует о присутствии в пробе столбнячного токсина.
Для производства АКДС-вакцины используют только стерильный и безопасный столбнячный анатоксин с удельной активностью не менее 1000 ЕС (или Lf) на мг белкового азота.
При производстве дифтерийного анатоксина используют токсигенный штамм Corynebacterium diphtheriae, полученный и депонированный в Государственной коллекции. Микробные клетки культивируют на жидких питательных средах, обеспечивающих высокую продукцию дифтерийного токсина. Методы культивирования должны гарантировать сохранение свойств штамма и предотвращать его контаминацию. Токсинсодержащую культуральную жидкость, освобожденную от микробных клеток и продуктов их распада, проверяют на стерильность, рН и содержание токсина. Для производства дифтерийного анатоксина используют культуральную среду с активностью токсина не менее 80 Lf в 1 мл. Детоксикация дифтерийного токсина должна обеспечивать сохранение антигенной активности анатоксина и гарантировать его безопасность: отсутствие остаточной токсичности (специфическая безопасность) и реверсии токсических свойств. Для характеристики очищенного дифтерийного анатоксина определяют его рН, специфическую (антигенную) активность, содержание общего и белкового азота, антигенную чистоту (удельную активность). Дифтерийный анатоксин должен быть очищен от примесей, вызывающих побочные реакции при введении человеку.
Определение специфической безопасности дифтерийного анатоксина. Морским свинкам (5 животным) массой 250 — 350 г вводят подкожно 1500 Lf (суммарно в оба бока) дифтерийного анатоксина. В течение 42 сут наблюдения у животных не должны обнаруживаться изъязвления, инфильтраты, абсцессы, некрозы на местах инъекции и потеря массы тела. Если наблюдается гибель хотя бы 1 животного от дифтерийной интоксикации (красные надпочечники при аутопсии погибших животных), дифтерийный анатоксин применению не подлежит. Если наблюдают гибель более 1 животного по причине, не связанной с дифтерийной интоксикацией, испытание повторяют. Если при повторном испытании устанавливают гибель более 1 животного, дифтерийный анатоксин считают не прошедшим испытание.
Реверсия токсичности дифтерийного анатоксина. Готовят раствор, содержащий дифтерийный анатоксин, консервант (при его наличии) в 0,9 % растворе натрия хлорида в концентрации, принятой для готового продукта. Полученную смесь делят на 2 части и выдерживают в течение 42 сут: первую — при температуре (37 ± 1) ºС, вторую — при температуре от 2 до 8 ºС. По 0,1 мл каждого образца вводят внутрикожно 2 морским свинкам массой 250 — 350 г или 1 кролику массой (2,5 ± 0,5) кг в объеме 0,2 мл. Наличие реакций на месте инъекции в течение 4 сут наблюдения свидетельствует о присутствии во введенном растворе дифтерийного токсина (реверсии токсичности).
Для производства АКДС-вакцины используют только стерильный и безопасный дифтерийный анатоксин, содержащий не менее 1500 Lf на мг белкового азота.
Инактивированная коклюшная суспензия (КС) представляет собой стерильную взвесь обезвреженных формальдегидом цельных микробных клеток Bordetella pertussis. Для производства КС используют штаммы, полученные и депонированные в Государственной коллекции. Производство ЕС должно быть основано на системе посевных серий. Культуры рабочих посевных серий должны обладать теми же характеристиками, что и культуры штамма, из которого была получена исходная посевная серия. Ежегодно перед использованием в производстве посевные серии должны быть проверены по морфологии, культуральным и антигенным свойствам, дермонекротической активности, вирулентности и токсичности, а также иммуногенной активности.
Определение серологических (антигенных) свойств КС. Взвесь коклюшных микробных клеток должна содержать агглютиногены 1, 2 и 3. Уровень агглютиногенов должен выявляться в реакции агглютинации соответствующими адсорбированными агглютинирующими сыворотками в титре не ниже 1:1280. При производстве КС используют штаммы Bordetella pertussis (серотип 1.2.3 – 1 штамм, серотип 1.2.0 – 1 штамм, серотип 1.0.3 — 1 штамм), взятые в равных соотношениях или в соотношении 4:3:3. Содержание формальдегида в инактивированной КС не более 300 мкг/мл, тиомерсала (при его наличии) – от 85 до 115 мкг/мл.
Уровень агглютиногенов 1, 2 и 3 следует определять на стадии получения сведенной КС и перед добавлением адъюванта или объединением с другими компонентами (антигенами) комбинированных вакцин. Для определения уровня содержания агглютиногенов используют адсорбированные коклюшные сыворотки к агглютиногенам 1, 2, 3. Титром считают величину, соответствующую последнему удвоенному разведению сыворотки, дающему агглютинацию, соответствующую +++.
Для постановки развернутой РА готовят двукратные разведения сывороток от 1:160 до 1:10240 в 0,9 % растворе натрия хлорида, рН (7,1 ± 0,2). Для этого в ряд агглютинационных пробирок, за исключением первой, наливают по 0,5 мл 0,9 % раствора натрия хлорида, рН (7,1 ± 0,2). Затем в первую и вторую пробирки вносят по 0,5 мл сыворотки в разведении 1:160. После тщательного перемешивания содержимого переносят 0,5 мл полученного разведения 1:320 из второй пробирки в третью, получая разведение 1:640, из третьей пробирки 0,5 мл переносят в четвертую и т.д. Из последней пробирки ряда, содержащей предельное разведение сыворотки (1:10240), 0,5 мл удаляют в емкость с дезинфицирующим раствором для получения равных объемов разведенной сыворотки (по 0,5 мл) во всех опытных пробирках.
Во все пробирки с приготовленными двукратными разведениями сывороток вносят по 0,5 мл испытуемой микробной взвеси с мутностью 10 МЕ (за 1 МЕ условно принят 1,1 млрд коклюшных бактерий в 1 мл). Одновременно проводят контроль сыворотки и антигена в тех же объемах на отсутствие спонтанной агглютинации, смешивая:
- – 0,5 мл сыворотки в разведении 1:160 с 0,5 мл 0,9 % раствора натрия хлорида, рН (7,1 ± 0,2);
- – 0,5 мл микробной взвеси КС с 0,5 мл 0,9 % раствора натрия хлорида, рН (7,1 ± 0,2).
Содержимое пробирок перемешивают путем встряхивания штатива, который затем помещают на 2 ч в термостат при температуре (36 ± 1) °С, после чего оставляют на 18-20 ч при температуре (5 ± 3) °С.
Результаты реакции агглютинации учитывают визуально до встряхивания пробирок, а затем для более точного учета – в агглютиноскопе при осторожном встряхивании осадка путем медленного наклона пробирки.
Определение специфической безопасности инактивированной КС. Полноту инактивации коклюшных микробов (специфическую безопасность) определяют в опытах на животных.
Испытуемую КС вводят внутрибрюшинно в объеме 0,5 мл, содержащем 10 млрд коклюшных бактерий (прививочная доза вакцины для человека) 10 беспородным белым мышам массой 14 — 16 г. Мышам контрольной группы (10 животных) внутрибрюшинно вводят по 0,5 мл 0,9 % раствора натрия хлорида, рН (7,0 ± 0,3), содержащего в той же концентрации консервант, который присутствует в вакцине. Для испытания используют здоровых животных одного пола из одной партии. Если используют животных обоего пола, их следует равномерно распределить по группам. Непосредственно перед введением вакцины определяют общую массу каждой группы мышей. Через 72 ч и спустя 7 сут после введения определяют общую массу каждой группы мышей. Вакцина считается безопасной, если:
а) через 72 ч общая масса тела опытных животных не ниже их исходной массы тела перед введением препаратов;
б) через 7 сут относительный прирост массы тела мышей, получивших испытуемую коклюшную суспензию, составляет не менее 60 % прироста массы тела контрольных животных.
В случае гибели за этот срок хотя бы 1 мыши или потери в массе тела, по сравнению с первоначальной, опыт повторяют на удвоенном количестве мышей с теми же требованиями. В случае гибели хотя бы 1 мыши при повторном контроле испытуемая вакцинная масса признается непригодной.
Определение дермонекротической активности. Испытание проводят на кроликах или мышах-сосунках. Коклюшная суспензия в концентрации 4 МЕ в объеме 0,2 мл при внутрикожном введении кролику не должна вызывать образования инфильтратов и развития некрозов; допускается гиперемия не более 10 мм в диаметре. В качестве контроля используют введение живой культуры в объеме 0,2 мл с минимальной концентрацией микробных клеток, вызывающей некроз размером не менее 5 мм в диаметре. Определение проводят на 2 белокожих кроликах массой 1,5-2 кг. Учет результатов проводят ежедневно в течение 4 сут.
КС, содержащая 1 МЕ в объеме 0,05 мл, при подкожном введении четырехдневным мышам-сосункам в область шеи со стороны спины не должна вызывать изменения цвета кожных покровов. В качестве положительного контроля вводят живую коклюшную культуру, взятую в том же объеме с минимальной концентрацией микробных клеток, вызывающей кожную реакцию; в качестве отрицательного контроля – 0,05 мл 0,9 % раствора натрия хлорида. Каждый препарат вводят 2 животным. Реакцию учитывают в течение 24 ч. Появление сине-пурпурного окрашивания инъецированной области свидетельствует о присутствии недостаточно обезвреженного дерматонекротического токсина.
Для обоих тестов в качестве положительного контроля используют живую 2-суточную культуру тест-штамма или производственного (не подвергнутого инактивации) штамма, выращенную на среде Борде-Жангу с 30 % крови человека или КУА с 10 % крови человека.
Для производства вакцины используют КС с концентрацией клеток от 60 до 80 МЕ в 1 мл, рН 6,8–7,4.
Показатели, которые влияют на качество, но не могут быть определены в конечном продукте, должны быть проверены на промежуточных стадиях производства, что должно быть отражено в нормативной документации.
Прививочная доза АКДС-вакцины (0,5 мл) содержит 15 Lf дифтерийного анатоксина, 5 ЕС (Lf) столбнячного анатоксина и 10 млрд клеток инактивированных коклюшных бактерий. В состав лекарственного средства может входить антимикробный консервант.
ИСПЫТАНИЯ
Опалесцирующая жидкость белого цвета, которая может иметь сероватый или желтоватый оттенок. При отстаивании разделяется на рыхлый осадок белого или белого с сероватым или желтоватым оттенком цвета, легко диспергируемый при встряхивании, и прозрачную надосадочную жидкость. Испытания проводят визуально в проходящем свете.
Должна быть безопасной (дифтерийный и столбнячный компоненты) при подкожном введении 5 морским свинкам массой 250-350 г 6 прививочных доз для человека (суммарно в бок и лапку). Через 30 дней все животные должны остаться живыми без симптомов столбняка, дифтерийной интоксикации и потери массы тела. В случае гибели 1 из животных или потери массы тела от неспецифических причин испытание повторяют. Если при повторном испытании гибнет более 1 животного, лекарственный препарат признают не соответствующим требованиям.
Специфическую безопасность коклюшного компонента оценивают аналогично методу, описанному для определения специфической безопасности коклюшной суспензии.
Специфическую активность дифтерийного и столбнячного компонентов возможно оценивать по титру соответствующих антител в сыворотке крови иммунизированных животных в тестах с параллельным использованием стандартных образцов, калиброванных в МЕ.
Раздел должен содержать следующую информацию: наименование штаммов; место их депонирования; допустимое количество пассажей (при необходимости) и методику их проведения с указанием условий культивирования; при необходимости — дополнительные к паспортным данным требования к характеристикам штаммов.
Транспортирование и хранение при температуре от 2 до 8 °С.
Инструкция
Суспензия для инъекций, 0.5 мл/доза
0.5 мл суспензии содержат
активные вещества: дифтерийного анатоксина не менее 30 международных единиц (МЕ), столбнячного анатоксина не менее 40 МЕ,
3 антигена Bordetella pertussis: коклюшного анатоксина 25 мкг, филаментозного гемагглютинина 25 мкг и 8 мкг пертактина (белок наружной мембраны 69 кДа),
вспомогательные вещества: алюминий (в виде алюминия гидроксида), натрия хлорид, вода для инъекций.
Мутная суспензия беловатого цвета, разделяющаяся при стоянии на бесцветную прозрачную жидкость и белый осадок, полностью разбивающийся при встряхивании.
Вакцины. Противобактериальные вакцины. Противококлюшные вакцины. Коклюшный очищенный антиген в комбинации с токсином.
Код АТХ J07AJ52
Иммунологические свойства
Вакцина коклюшно-дифтерийно-столбнячная бесклеточная адсорбиро-ванная.
Вакцина содержит дифтерийный анатоксин, столбнячный анатоксин и три очищенных коклюшных антигена коклюшный анатоксин (РТ), филаментозный гемагглютинин (FHA) и 69 кД наружного мембранного белка (пертактин), адсорбированные на солях алюминия.
Токсины дифтерии и столбняка, полученные из культур Corynebacterium diphtheriae и Clostridium tetani, очищаются и детоксифицируются. Бесклеточные коклюшные компоненты вакцины (PT, FHA и пертактин) получены в результате выращивания I фазы культуры Bordetella pertussis, из которой экстрагируются, очищаются и обрабатываются формальдегидом коклюшный анатоксин (PT), филаментозный гемагглютинин (FHA) и пертактин. Коклюшный анатоксин (PT) проходит процесс необратимой детоксификации.
Инфанрикс® соответствует требованиям ВОЗ по производству биологических субстанций и дифтерийных столбнячных вакцин.
При производстве вакцины не используются субстанции человеческого происхождения.
Иммунная реакция на первичную иммунизацию
Через 1 месяц после проведения курса первичной иммунизации тремя дозами в первые 6 месяцев жизни у более чем 99% младенцев, вакцинированных вакциной Инфанрикс®, титры антител составили более 0.1 МЕ/мл для дифтерии и столбняка.
Вакцина содержит антигены PT, FHA и пертактина, которые играют важную роль для защиты от коклюша. В клинических исследованиях иммунный ответ на эти антигены коклюша составил более 95%.
Иммунная реакция на введение бустерной дозы Инфанрикс®
После введения бустерной дозы Инфанрикс® на втором году жизни (13-24 месяцев), все первично вакцинированные Инфанриксом® младенцы имели титры антител к дифтерии и столбняку более 0.1 МЕ/мл. Бустерная реакция на антигены коклюша наблюдалась более чем у 96% этих детей.
Защитная эффективность Инфанрикс®
Защитная эффективность Инфанрикс® против типичного коклюша, определяемого ВОЗ (> 21 дня пароксизмального кашля, с лабораторным подтверждением), была продемонстрирована в рамках проспективного слепого исследования с участием детей, в семье которых другие дети болели коклюшем. На основании данных, собранных у контактных лиц на дому, где имелся больной с типичным коклюшем, защитная эффективность вакцины составила 88,7%.
первичная активная иммунизация детей в возрасте от 2 месяцев и старше против дифтерии, столбняка и коклюша
бустерная доза для детей, получивших первичную вакцинацию в количестве 3-х доз вакцины антигенами цельноклеточной или бесклеточной АКДС
Рекомендуемая доза для введения составляет 0,5 мл.
Курс первичной иммунизации состоит из 3 доз вакцины (2-й, 3-й, 4-й месяцы), введение бустерной дозы рекомендуется на втором и шестом годах жизни ребенка.
Схемы вакцинации отличаются в разных странах, соответственно, график вакцинации определяется каждой страной индивидуально в соответствии с местными рекомендациями.
Инфанрикс® следует вводить глубоко внутримышечно (в передне- латеральную область бедра) и чередовать места введения в течение курса вакцинации.
Ни при каких обстоятельствах Инфанрикс® нельзя вводить внутривенно!
Инфанрикс® должен вводиться с особыми предосторожностями лицам, страдающим тромбоцитопенией или нарушениями в свертывающей системе крови, т.к. после внутримышечного введения вакцины у таких пациентов может возникнуть кровотечение. В таких случаях необходимо прижать место инъекции ватным тампоном как минимум на две минуты (не растирая).
Инструкция к применению
Вакцина Инфанрикс® представляет собой мутную белую суспензию. При хранении вакцины может образоваться белый осадок и прозрачная надосадочная жидкость. Перед использованием вакцина должна быть комнатной температуры. Перед использованием вакцину необходимо тщательно встряхнуть до получения однородной, белой, мутной суспензии и проверить визуально на отсутствие инородных частиц и/или изменения внешнего вида. В случае обнаружения посторонних частиц или изменения внешнего вида вакцина не подлежит использованию. Вакцина Инфанрикс®
может смешиваться с вакциной Хиберикс® для одновременной вакцинации одной инъекцией. Хиберикс® представляет собой белую таблетку или лиофилизированный порошок во флаконе в комплекте с прозрачным, бесцветным, стерильным растворителем (физиологический раствор), который представлен либо в ампуле, либо в предварительно заполненном шприце.
Необходимо добавить содержимое всего шприца с вакциной Инфанрикс® во флакон с вакциной Хиберикс®. В этом случае растворитель, находящийся в упаковке с вакциной Хиберикс®, следует утилизировать, поскольку его заменяет вакцина Инфанрикс®. После добавления вакцины Инфанрикс® в вакцину Хиберикс® смесь необходимо хорошо встряхнуть. Комбинированная вакцина по внешнему виду немного более мутная, чем вакцина Инфанрикс®. При наличии изменений внешнего вида вакцина подлежит утилизации. После восстановления вакцины Хиберикс® вакциной Инфанрикс® вакцину необходимо быстро ввести путем внутримышечной инъекции в передне-латеральную область бедра.
Неиспользованные материалы следует уничтожить в соответствии с местными требованиями по утилизации биоопасных материалов.
Представленный ниже профиль безопасности основан на данных, полученных в 20 клинических исследованиях с участием 11 469 детей, получивших 18 420 доз вакцины. При применении АКДС и комбинированных вакцин, содержащих АКДС-компоненты, наблюдалось увеличение частоты встречаемости местных реакций и лихорадки после введения ревакцинирующей дозы вакцины Инфанрикс® по сравнению с курсом первичной вакцинации.
Частота встречаемости определяется следующим образом:
Очень часто: ≥ 1/10
- реакции в месте инъекции, в т.ч., индурация, утомляемость(1), лихорадка ≥ 39,1°С, диффузная припухлость конечности, в которую была произведена инъекция, иногда с вовлечением прилежащего сустава(3)
Данные пострегистрационного наблюдения
Нарушения со стороны крови и лимфатической системы
Нарушения со стороны иммунной системы
Аллергические реакции, в т.ч., анафилактические и анафилактоидные реакции, включая анафилактический шок
Нарушения со стороны нервной системы
Шок или шокоподобное состояние (гипотонически-гипореактивные эпизоды), судороги (фебрильные или афебрильные) в течение 2–3 дней после введения вакцины
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Апноэ у сильно недоношенных детей (рожденных на ≤ 28 неделе беременности)
Нарушения со стороны кожи и подкожных тканей
Общие расстройства и нарушения в месте введения
Припухлость всей конечности, в которую была произведена инъекция(3)
(1) Наблюдается исключительно при проведении ревакцинации
(2) Очень часто наблюдается при проведении ревакцинации
(3) У детей, получивших в качестве курса первичной вакцинации бесклеточные коклюшные вакцины, чаще развиваются реакции припухлости после введения ревакцинирующей дозы, чем у детей, у которых первичная вакцинация проводилась с использованием цельноклеточных вакцин. Местная припухлость в месте инъекции (> 50 мм) и диффузная припухлость встречаются чаще (соответственно, очень часто и часто), когда ревакцинирующую дозу вводят в возрасте от 4 до 6 лет. Такие реакции обычно проходят, в среднем, через 4 дня.
(4) Наблюдается при применении дифтерийного и столбнячного компонента.
- повышенная чувствительность к компонентам вакцины или признаки повышенной чувствительности после предыдущего введения Инфанрикс®, или дифтерийной и столбнячной вакцин, или цельноклеточной коклюшно-дифтерийно-столбнячной вакцины (КцДС)
- симптомы энцефалопатии неизвестной этиологии в анамнезе, которые наблюдались в течение 7 дней после предыдущего введения коклюшной вакцины. В таких случаях курс вакцинации должен быть продолжен только вакциной против дифтерии и столбняка
- острые заболевания, сопровождающиеся повышением температуры
- острые инфекционные заболевания
Вакцину Инфанрикс® не следует вводить пациентам в возрасте старше 7 лет, поскольку в этом возрасте необходима более низкая доза анатоксина.
Вакцину Инфанрикс® можно вводить одновременно с другими детскими вакцинами; однако вакцину (простую или комбинированную) для профилактики краснухи следует вводить либо одновременно с ней, либо с интервалом в один месяц.
Другие вакцины и Инфанрикс® следует вводить в разные участки тела.
Инфанрикс® можно смешивать в одном шприце с вакциной Хиберикс® Haemophilus influenzae типа b (Hib) или другими PRP-T Hib вакцинами. При этом растворитель, прилагаемый к вакцине Хиберикс®, следует заменить вакциной Инфанрикс®.
У пациентов, получавших иммуносупрессивные препараты, или у пациентов со снижением иммунитета возможно отсутствие адекватного иммунного ответа.
Назначение вакцины Инфанрикс® должно быть отложено у детей с острыми формами инфекционных заболеваний, сопровождающихся повышением температуры тела. Легкие формы инфекционного заболевания не являются противопоказаниями для вакцинации.
Перед вакцинацией необходимо изучить анамнез ребенка (особенно в отношении предыдущей вакцинации и возможного наличия нежелательных эффектов) и провести клинический осмотр.
Если какое-либо из нижеперечисленных явлений развилось при наличии временной связи с введением бесклеточной или цельноклеточной АКДС-вакцины, следует тщательно рассмотреть целесообразность введения вакцин с коклюшным компонентом в дальнейшем на основании соотношения факторов риска и ожидаемой пользы. В некоторых обстоятельствах с одной стороны, существует высокая вероятность заражения коклюшем, но, с другой стороны, риск считается слабым, поскольку явления, наблюдавшиеся при предшествовавшей вакцинации, не вызывали устойчивых последствий.
Перечисленные ниже явления, которые являются противопоказаниями для применения цельноклеточной АКДС-вакцины, можно рассматривать в качестве состояний, требующих осторожности при применении вакцины Инфанрикс®:
температура 40.5 С в течение 48 часов после вакцинации, которая не является следствием других известных причин;
Коллапс или шокоподобное состояние (эпизоды гипотонии и пониженной реактивности) в пределах 48 часов после вакцинации;
Длительный плач, продолжающийся 3 часов, появившийся в течение 48 часов после вакцинации;
Судороги с лихорадкой или без нее, появившиеся в течение 3 дней после вакцинации;
Как и при любой другой вакцинации следует тщательно рассмотреть соотношение польза-риск иммунизации вакциной Инфанрикс® или отсрочить введение данной вакцины при наличии у ребенка впервые выявленного или прогрессирующего тяжелого неврологического расстройства.
Фебрильные судороги в анамнезе, судороги в семейном анамнезе не являются противопоказаниями для использования вакцины Инфанрикс®.
Инфекция вируса иммунодефицита человека (ВИЧ) не является противопоказанием к вакцинации. Как и с другими вакцинами, можно ожидать, что у пациентов, проходящих курс иммуносупрессивной терапии или страдающих иммунодефицитом, адекватная иммунологическая реакция может не проявиться.
При введении любой инъекционной вакцины следует предусмотреть все необходимое для оказания медицинской помощи в случае развития редкой анафилактической реакции на введение вакцины.
В связи с этим, вакцинируемый должен оставаться под медицинским наблюдением в течение 30 минут после иммунизации.
Как и все вакцины против дифтерии, столбняка и коклюша, вакцину Инфанрикс® следует вводить глубоко внутримышечно и предпочтительно чередовать места введения в течение курса вакцинации.
Инфанрикс® должен вводиться с особыми предосторожностями лицам, страдающим тромбоцитопенией или нарушениями в свертывающей системе крови, т.к. после внутримышечного введения вакцины у таких пациентов может возникнуть кровотечение.
Ни при каких обстоятельствах Инфанрикс® нельзя вводить внутривенно!
Необходимо учитывать потенциальный риск апноэ и необходимость мониторинга функции дыхания в течение 48-72 ч при первичной вакцинации детей, родившихся преждевременно (≤ 28 недель гестации) и, особенно, детей с респираторным дистресс-синдромом в анамнезе. Ввиду большой пользы от вакцинации детей данной группы, вакцинацию не следует откладывать или отказывать в ее проведении.
Возможно развитие обморочного состояния как психогенной реакции на инъекционный путь введения препарата, в связи с чем, необходимо предупредить возможные ушибы и ранения при падении пациента.
Беременность и период лактации
Инфанрикс® не предназначен для вакцинации взрослых.
Во время постмаркетинговых исследований сообщалось о случаях передозировки вакциной. Побочные реакции не являются специфичными и схожи по профилю с побочными реакциями, возникающими при режиме обычной вакцинации.
По 0.5 мл (1 доза) помещают в предварительно наполненный шприц из нейтрального стекла типа I. Носик шприца укупорен пробкой из бутилкаучука. По 1 шприцу вместе с 1 или 2 иглами помещают в пластиковую контурную ячейковую упаковку. По 1 пластиковой контурной ячейковой упаковке вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в пачку картонную.
Хранить при температуре от 2 С до 8 С.
Транспортировка при температуре от 2 С до 8 С
Хранить в недоступном для детей месте!
Не использовать по истечении срока годности
По рецепту (для специализированных учреждений)
GlaxoSmithKline Biologicals s.a., Бельгия
89, rue de I’Institut 1330 Rixensart, Belgium
Упаковщик
GlaxoSmithKline Biologicals s.a., Бельгия
89, rue de I’Institut 1330 Rixensart, Belgium
GlaxoSmithKline Biologicals s.a., Бельгия
89, rue de I’Institut 1330 Rixensart – Belgium
Адрес организации, принимающей на территории Республики Казахстан
претензии от потребителей по качеству продукции (товара) и ответственной за пострегистрационное наблюдение за безопасностью лекарственного средства
Представительство компании ГлаксоСмитКляйн Экспорт Лтд в Казахстане
050059, г.Алматы, ул.Фурманова, 273
Номер телефона: +7 727 258 28 92, +7 727 259 09 96
Читайте также:



