Диагностика малярии толстая капля что это
15 марта 2017, 10:47 Эксперт статьи: Блинова Дарья Дмитриевна 0 7,941
Малярия — одно из опаснейших паразитарных заболеваний на планете, ежегодно поражающее сотни миллионов человек. Люди должны понимать, как проводятся исследования на малярию, как распознать симптомы и когда обратиться за лечением. Ежегодно из сотен миллионов заразившихся сотни тысяч умирают, несмотря на то, что существует лекарство, заболевание поддается лечению.
Что такое малярия?
Малярия — опасное и очень заразное паразитарное заболевание, легко передающееся через укусы комаров рода анофелис и через кровь, например, при переливании. Недуг сопровождается повторяющимися приступами лихорадки, наиболее широко распространен в странах с влажным и жарким климатом. После того как паразит попал в тело, он начинает размножаться, поражает клетки, разрушает их, лавинообразно наращивая свое присутствие. Посему решившие посетить жаркие тропические страны должны проявлять повышенную осторожность, и при наименьших подозрениях сдать анализ крови. Заражению особенно подвержены:
- люди с низким иммунитетом,
- дети до 5 лет,
- беременные женщины.
Виды плазмодий
Всего различают четыре различных вида малярии и четыре типа плазмодий, ее вызывающие:
- Plasmodium falciparum, что провоцирует тропическую лихорадку — одну из самих опасных и нуждающихся в срочном лечении разновидностей заболевания.
- Plasmodium vivax — провоцирует появление трехдневной малярии.
- Plasmodium malariae — является источником четырехдневной лихорадки.
- Plasmodium ovale — главная причина малярии овале (недуга вроде трехдневной).
Симптомы малярии
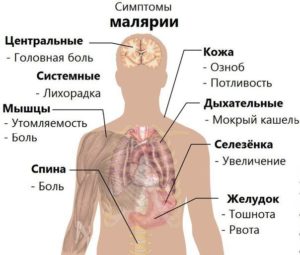
Главными (и самим очевидными) симптомами, проявляющимся при малярии, являются повторяющиеся с равными промежутками времени приступы лихорадки, повышение температуры и озноб. Длятся они несколько часов и сопровождаются такими признаками:
- повышение температуры до 41 °C;
- дрожь;
- проявления кашля;
- повышенная потливость (обычно сопровождает окончание приступа и снижение температуры).
Кроме того приступы могут сопровождаться такими явлениями как:
- расстройства пищеварительной системы,
- боль в разных частях тела, мышцах, голове,
- повышенная утомляемость,
- желтуха.
Хотя обычно симптомы при малярии проявляются спустя несколько недель после заражения, некоторые возбудители могут месяцами жить в организме незаметно. Во время острых приступов наблюдается тенденция к изменению состава крови, может возникать анемия, в особенности при тропической лихорадке. Возможно увеличение внутренних органов, например селезенки, но точную оценку может дать лишь врач.
Диагностические исследования малярии
При обнаружении вышеперечисленных симптомов необходимо срочно провести диагностику малярии. Единственным основным способом диагностирования заболевания до сих пор остается непосредственное обнаружение плазмодиев в крови, которая берется у больного во время приступов. Самые распространенные способы анализа включают взятие крови на малярию методом толстой капли и мазка. Обнаружив плазмодии, можно определить, серьезно ли болен человек, каким именно штаммом. Проводятся также общее исследование крови, обследование мочи, биохимические исследования на содержание билирубина или уровень альбумина.
Поскольку паразит влияет непосредственно на кровь, из-за лихорадки в ее составе наблюдаются различные изменения. Таким образом, показано проведение общего обследования крови для выявления малярии. Лейкоцитоз, анемия, тромбоцитопения — вот лишь немногие возможные последствия болезни.
В общий анализ входят:
- Сравнение уровня гемоглобина, а также эритроцитов — плазмодии влияют напрямую на кровяные тельца, разрушая их во время болезни.
- Оценка показания уменьшения тромбоцитов — наблюдается у подавляющего большинства больных, является одним их характерных признаков малярии.
- Проверка лимфоцитов — их уровень тоже может меняться во время болезни.
Можно также выделить ряд других анализов крови, что могут обнаружить малярию:
- Метод выявления антител к малярии — позволяет с помощью введения в организм плазмодия отслеживать реакцию иммунитета на него. Если итогом будет негативная реакция, это позволит исключить диагноз.
- Метод выявления белков плазмодия является одним из новейших возможных анализов, позволяющих определять составные молекулы возбудителя. При сравнительной быстроте способ обладает неплохой точностью, а также небольшими финансовыми затратами для пациента.
- Метод ПЦР, или полимеразная цепная реакция — непосредственно определяет генетический материал малярийного плазмодия. Проводя такой анализ крови можно определить точное число возбудителей, даже если оно небольшое. К сожалению, одним из недостатков является высокая стоимость процедуры.
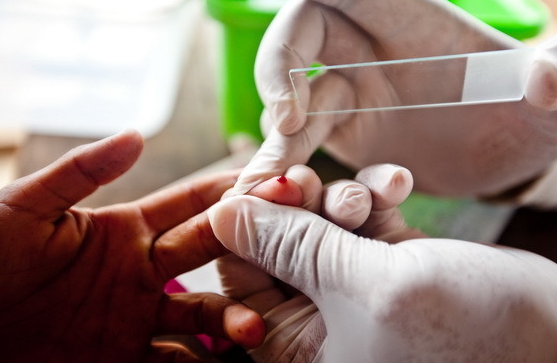
Анализ мазка и толстой капли крови являются наиболее дешевыми и простыми методами обнаружения малярии. В то же время они требуют внимательности и значительных трудозатрат, а также исполнения ряда рекомендаций. При необходимости обследовать более одного пациента необходимо подготовить инструментарий заранее. При тонком мазке кровь берут из безымянного либо среднего пальца на левой руке. При изготовлении мазка палец удерживается ранкой кверху. Мазок крови — небольшой, его располагают в центре стекла.
Толстая капля отличается от мазка возможностью исследовать больший объем материала. Если обычные мазки крови— тоненькие, то капля, наносимая на стекло этим методом, имеет размер с монету. В итоге, исследуется в десятки раз больший объем крови. В дальнейшем каплю подсушивают, и после окрашивания краской Романовского, промывания — исследуют. Лучше, если анализы будет проводить опытный исследователь, ведь неподготовленный может принять за паразитов различные загрязнения или образования: бляшки Биццоцеро, обломки лейкоцитов, различные микроорганизмы, включая грибок или простейших, случайно попавших на образец.
3.2. ПРОФИЛАКТИКА ПАРАЗИТАРНЫХ ЗАБОЛЕВАНИЙ
Паразитологическая диагностика малярии
Дата введения 2001-01-01
1. Методические указания подготовлены сотрудниками Института медицинской паразитологии и тропической медицины им. Е.И.Марциновского Московской медицинской Академии им. И.М.Сеченова Минздрава России (к.м.н. Рабинович С.А., к.б.н. Кукина И.В., Mа. ская* Е.В., к.м.н. Морозов Е.Н.) и Федерального центра государственного санитарно-эпидемиологического надзора Минздрава России (к.б.н. Цыбина Т.Н., Сыскова Т.Г.).
________________
* Брак оригинала. - Примечание изготовителя базы данных.
2. УТВЕРЖДЕНЫ Главным государственным санитарным врачом Российской Федерации, Первым заместителем Министра здравоохранения Российской Федерации Г.Г.Онищенко 19 октября 2000 г.
3. ВВЕДЕНЫ ВПЕРВЫЕ.
1. Область применения и нормативные ссылки
1. Область применения и нормативные ссылки
Паразитологическую лабораторную диагностику малярии проводят клинико-диагностические лаборатории лечебно-профилактических учреждений (ЛПУ) системы Минздрава, ведомственных учреждений, а также другие лаборатории, независимо от принадлежности и форм собственности (НИИ, вузов, Минобороны, УВД, частных клиник и т.д.), имеющие лицензию и аккредитованные в системе госстандарта и госсанэпиднадзора в установленном порядке.
Органы и учреждения государственной санитарно-эпидемиологической службы Российской Федерации организуют и проводят эпидемиологический надзор за малярией, частью которого является:
контроль за уровнем лабораторной диагностики малярии в клинико-диагностических лабораториях лечебно-профилактических учреждений и других ведомств (в т.ч. исследования: 1) контрольные - не менее 10% препаратов крови, от числа отрицательных; 2) обязательные - 100% сомнительных и положительных препаратов крови с целью подтверждения лабораторного диагноза малярии);
обследование населения в очагах малярии, обследование населения по эпидпоказаниям и с консультативной целью.
В настоящих методических указаниях использованы ссылки на следующие нормативно-методические и правовые документы.
Федеральный закон "О санитарно-эпидемиологическом благополучии населения" (30 марта 1999, N 52-ФЗ).
"Основы законодательства Российской Федерации об охране здоровья граждан" (22 июля 1993, N 5487-1).
Санитарные правила и нормы 3.2.569-96* "Профилактика паразитарных болезней на территории Российской Федерации".
_______________
* Действуют СанПиН 3.2.1333-03. - Примечание изготовителя базы данных.
Санитарные правила 3.1/3.2.558-96* "Общие требования по профилактике инфекционных и паразитарных заболеваний".
_______________
* Действуют СП 3.1/3.2.1379-03. - Примечание изготовителя базы данных.
Санитарные правила 1.2.731-99 "Безопасность работы с микроорганизмами 3-4 групп патогенности и гельминтами".
2. Общие положения
Возможность завоза малярии на территорию Российской Федерации, появление вторичных от завозных и местных случаев заболевания требуют своевременной лабораторной диагностики, необходимой для адекватного лечения и рационального проведения противоэпидемических мероприятий.
Малярию человека вызывают 4 вида паразитических простейших рода Plasmodium: Р. falciparum - возбудитель тропической малярии, Р. vivax - трехдневной малярии, Р. ovale - малярии типа трехдневной, Р. malariae - четырехдневной малярии. Неспецифические клинические проявления малярии, преимущественно в первые дни болезни, при наличии ряда объективных показателей эпидемиологического характера: географический анамнез (пребывание на территории стран с тропическим и субтропическим климатом) и клинического характера: лихорадочное состояние неясной этиологии, анемия, увеличение селезенки и ряд других - обязывают врачей лечебно-профилактических учреждений заподозрить малярию.
Безусловным подтверждением диагноза служит обнаружение малярийного паразита при микроскопическом исследовании крови. Особое значение имеет раннее выявление возбудителя тропической малярии, при несвоевременной диагностике которой возможен летальный исход. Определение вида паразита служит основанием для выбора рациональной терапии и правильной организации противоэпидемических мероприятий.
3. Характеристика развития малярийного паразита в эритроцитах
Проявления малярии обусловлены развитием паразита в эритроците - так называемой эритроцитарной шизогонией. В процессе эритроцитарной шизогонии образуются бесполые и половые формы паразита.
Бесполые формы за период времени, характерный для каждого вида паразита, проходят в эритроцитах ряд последовательных возрастных стадий своего развития, строение которых (морфология) и их окрашиваемость (тинкториальные свойства) хорошо различимы в "тонком мазке" крови. Трофозоиты - одноядерные растущие стадии: кольцевидные, развивающиеся (амебовидные, полувзрослые) и зрелые. Шизонты - делящиеся стадии: развивающиеся (незрелые), с последовательным делением ядер и общей цитоплазмой и зрелые, представляющие скопление дочерних клеток мерозоитов с обособленными ядрами и цитоплазмой. В динамике эритроцитарная шизогония в общем виде протекает следующим образом. Мерозоит, внедрившийся в эритроцит, быстро увеличивается в размере, в цитоплазме появляется пищеварительная вакуоль и образуется - кольцевидный трофозоит. На этой стадии цитоплазма имеет вид узкого ободка, огибающего пищеварительную вакуоль, ядро сравнительно мелкое, компактное с трудно различимой структурой хроматина, оттеснено к одному из полюсов клетки. По мере роста паразита увеличиваются его размеры, количество цитоплазмы нарастает: ядро становится более крупным, менее компактным. В цитоплазме могут появиться асимметричные утолщения, различающиеся по форме и числу, псевдоподии - образуется амебовидный трофозоит. В дальнейшем у развивающегося трофозоита постепенно исчезает вакуоль, продолжает увеличиваться ядро и количество цитоплазмы - образуется зрелый трофозоит. Зрелый трофозоит - округлая или несколько вытянутая клетка с относительно рыхлым ядром, правильной или несколько вытянутой формы, занимающая весь или часть пораженного эритроцита. Затем наступает стадия шизонта, начинается попарное деление ядер, образуется развивающийся (незрелый) шизонт. По окончании деления ядер одномоментно делится цитоплазма, обособляясь вокруг каждого из дочерних ядер - образуется зрелый шизонт, состоящий из мерозоитов; их число, размеры и расположение по отношению к скоплению пигмента характерны для каждого вида плазмодиев (см. таблицы). При отсутствии или неэффективном лечении мерозоиты внедряются в интактные эритроциты, и цикл вновь повторяется с присущей для каждого вида плазмодиев продолжительностью развития одной генерации. У Р. falciparum, P. vivax, P. ovale - 48 ч, Р. malariae - 72 ч.
В процессе роста паразита в его цитоплазме появляется малярийный пигмент - продукт метаболизма гемоглобина, представляющий собой включения от едва заметных мелких зерен и гранул до относительно более крупных, неправильной формы, от золотисто-коричневого до черного цвета. Количество пигмента, размеры его частиц и распределение в цитоплазме паразита меняются по мере его перехода в последовательные стадии развития.
У части трофозоитов деления ядер не происходит и они дифференцируются в половые формы, гаметоциты - женские (макрогаметоциты) и мужские (микрогаметоциты). Мужские и женские гаметоциты различаются между собой по морфологии, в первую очередь по структуре ядра, характеру и окраске цитоплазмы. В отличие от бесполых форм гаметоциты не имеют выраженной вакуоли, характеризуются значительно более обильным и грубым пигментом. Округлая форма присуща гаметоцитам Р. vivax, Р. ovale и Р. malariae, удлиненная серповидная (полулуния) - Р. falciparum. Гаметоцитов образуется меньше, чем бесполых форм. При этом женских гаметоцитов в 3-5 раз больше, чем мужских, что затрудняет выявление последних. Гаметоциты Р. vivax, Р. ovale, P. malariae значительно отличаются от гаметоцитов Р. falciparum по срокам созревания, появления в периферической крови и сохранения способности заражать переносчика (самок комара Р. anopheles).
Р. vivax, Р. ovale и Р. malariae развиваются в эритроцитах, циркулирующих в периферической крови. Развитие Р. falciparum происходит в синусах селезенки и мелких капиллярах внутренних органов в связи с адгезией пораженных эритроцитов к стенкам таких капилляров. В периферической крови обнаруживаются, преимущественно при неосложненном течении, только самые молодые стадии - кольцевидные трофозоиты. Их число очень быстро нарастает, поэтому при однократном исследовании периферической крови в начале болезни можно получить неправильное представление об истинном числе паразитов. При осложненном течении в периферической крови могут быть обнаружены более зрелые возрастные стадии паразита и гаметоциты в связи с нарушением сосудистого тонуса.
При оценке результатов исследования препаратов крови, наряду с типичной морфологией возбудителя, необходимо учитывать ряд особенностей, характеризующих паразитологическое развитие инфекции собственно и привходящих воздействий (предшествовавшее применение противомалярийных препаратов, неправильное приготовление и окраска препаратов крови).
4. Принцип метода паразитологической диагностики малярии
Паразитологическая диагностика малярии основана на обнаружении бесполых и половых форм возбудителя при микроскопическом исследовании крови, что возможно только в период его развития в эритроците. Для обнаружения плазмодиев и определения их вида используют препараты крови, приготовленные методом "тонкого мазка" и "толстой капли", окрашенные по Романовскому-Гимза. Оба метода, имеющие свои преимущества и недостатки, являются взаимодополняющими.
Основной метод - "толстая капля". Благодаря распределению относительно большего объема крови на меньшей площади, за один и тот же промежуток времени просматривается количество крови в 30-40 раз большее, чем в "тонком мазке", что значительно повышает шанс обнаружения паразитов, особенно при низкой паразитемии. Начинать надо всегда с просмотра "толстой капли".
Чувствительность метода "толстой капли" такова, что при просмотре 100-150 полей зрения можно обнаружить около 8 паразитов в 1 мкл крови. Концентрация исследуемой крови на ограниченной площади приводит к многослойному расположению эритроцитов. Для того чтобы паразиты были видимы, "толстую каплю" окрашивают нефиксированной; это приводит к гемолизу эритроцитов, и паразиты подвергаются деформации. Несмотря на определенную специфичность, такая деформация иногда может препятствовать идентификации вида паразита. Ограничиться просмотром "толстой капли" можно только, если вид паразита был первоначально установлен. "Толстая капля" относительно быстро позволяет выявить и других паразитов крови: трипаносом, микрофилярий, спирохет, бабезий и др. Отрицательный паразитологический результат изучения "толстой капли", но повышенное содержание остатков незрелых эритроцитов позволяет предположить перенесенную недавно малярию (при отсутствии соответствующих анамнестических данных), обнаружение повышенного содержания лейкоцитов, их видовой состав, а также повышенное содержание остатков незрелых эритроцитов, позволяют предположить иное заболевание, не связанное с малярией.
В "тонком мазке", фиксированном до окраски, сохраняются морфологические особенности как пораженного эритроцита, так и присущие данному виду паразита. Большое значение для дифференциального диагноза имеет характер изменения пораженных эритроцитов. "Тонкий мазок" крови делают в дополнение к "толстой капле". В тех случаях, когда вид возбудителя в очаге установлен, для эпиднадзора за очагом можно ограничиться методом "толстой капли".
5. Необходимые реактивы и оборудование
1. Этиловый спирт 96°.
2. Азур-эозин по Романовскому-Гимза (промышленный маточный раствор или сухая краска).
3. Метиленовый синий.
4. Этиловый эфир.
6. Тетраборат натрия (бура).
7. Калий фосфат однозамещенный безводный - KH PO .
Приготовление мазка и толстой капли крови при малярии.Основной метод лабораторной диагностики малярии - обнаружение эритроцитарных паразитов в толстой капле или мазке крови. В практической работе исследуют преимущественно толстые капли, так как за один и тот же промежуток времени в толстой капле можно просмотреть в 30 - 50 раз больший объем крови, чем в мазке, следовательно, и количество плазмодиев в ней больше. К мазку обращаются лишь в тех случаях, когда видовую принадлежность найденных паразитов по толстой капле установить не удается. Для выявления возбудителей малярии кровь берут при первом же подозрении на эту инфекцию независимо от температуры тела, поскольку паразиты циркулируют в крови и в интервале между приступами.
Предметные стекла, на которых готовят препараты, должны быть хорошо вымыты и обезжирены. Кровь берется с соблюдением правил асептики. Кожу пальца протирают спиртом и прокалывают простерилизованной иглой-копьем или толстой инъекционной иглой. Если кровь из мякоти пальца вытекает плохо, то больного просят сделать несколько энергичных движений рукой, кистью и слегка массируют палец. Первую выступившую каплю крови вытирают сухой ватой, затем палец поворачивают проколом вниз и ко второй капле прикасаются предметным стеклом.
Тонкие мазки крови приготавливают по методике, общепринятой для гематологических исследований. Мазок не должен доходить ни до конца, ни до краев предметного стекла. Поэтому капля крови должна быть диаметром не более 2 - 3 мм. Предметное шлифованное стекло, которым делается мазок, должно быть уже стекла, на которое наносят мазок. Для этого углы шлифованного стекла обламывают пинцетом. В целях приготовления мазка шлифованное стекло ставят перед каплей крови под углом 45° и продвигают вперед до соприкосновения с ней. Когда кровь равномерно распределится между обоими стеклами, быстрым движением делают мазок.
Для приготовления толстой капли крови на предметное стекло наносят каплю крови диаметром около 5 мм. Эту каплю размазывают иглой или углом предметного стекла в диск диаметром 10 - 15 мм. Толщина капли должна быть такой, чтобы сквозь нее можно было читать газетный шрифт Мазки не должны быть толстыми, поскольку после высыхания они растрескиваются и отстают от стекла. Обычно на стекло наносят 2 - 3 капли на некотором расстоянии одна от другой. Взятые капли должны быть отмечены. На обратной стороне стекла восковым карандашом указывается фамилия больного или соответствующий регистрационный номер.
Очень удобно наносить толстую каплю на влажный толстый мазок крови. В этом случае капля самостоятельно растекается в правильный диск. Простым карандашом на мазке делается маркировка препарата Такой препарат удобен еще и тем, что в мазке довольно хорошо сохраняется часть пораженных эритроцитов, а это важно для уточнения вида паразита. Преимущество данного метода в том, что капля, нанесенная на мазок, удерживается более прочно, чем нанесенная непосредственно на стекло.
Приготовленные толстые капли высушивают при комнатной температуре не менее 2 - 3 ч без какого-либо дополнительного подогревания во избежание фиксации крови. После высыхания капли на нее наливают краску Романовского - Гимзы, разведенную как обычно (2 капли краски на 1 мл дистиллированной воды). Продолжительность окраски в среднем составляет 30 - 45 мин. Окрашенную каплю осторожно ополаскивают водопроводной водой (сильная струя может смыть каплю) и просушивают в вертикальном положении. Фильтровальной бумагой ее высушивать нельзя. При окраске капли в водных растворах красок происходит выщелачивание гемоглобина из эритроцитов, вследствие чего в окрашенной капле эритроциты уже не видны. Из форменных элементов сохраняются лейкоциты и тромбоциты.
Мазки фиксируют, помещая их на 3 мин в метиловый или на 10 мин в 96% этиловый спирт. Зафиксированные препараты высушивают на воздухе, защищая от пыли и мух. Потом препараты помещают в специальный контейнер и окрашивают азур-эозиновым красителем по Романовскому - Гимзе на протяжении 20 - 30 мин.
По истечении этого срока контейнер подставляют под слабую струю воды и промывают. После того как из контейнера польется неокрашенная вода, остатки ее сливают и промывают еще раз. Не рекомендуется сначала сливать краску, а затем промывать мазок водой, поскольку пленка, образовавшаяся на поверхности красителя, может попасть на препараты и оказаться причиной диагностической ошибки. Капля на мазке окрашивается так же, как толстая капля.
Промытые препараты высушивают и исследуют под микроскопом. В зараженных эритроцитах видны плазмодии малярии с голубой цитоплазмой и ярко-красным ядром. Нахождение плазмодиев малярии в крови больного является неоспоримым доказательством болезни.
Определение интенсивности паразитемии при малярии. Достаточно точный метод сводится к подсчету среднего числа паразитов на одно поле зрения толстой капли. Если паразитов много, то подсчет ведут в 10 полях зрения, если мало в 100. Численность указывают отдельно для обнаруженных стадий паразита, например, р. falciparum кольца +++, гаметоциты +. Применительно к численности колец ВОЗ рекомендованы следующие символы:
1 – 10 в 100 п. зр = +.
более 10 в п. зр. = + + ++
более 100 в п.зр.=+ + + + +
Лаборанты с высоким уровнем подготовки применяют более точный метод, а именно, подсчитывают численность паразитов по отношению к числу лейкоцитов. Например, в толстой кишке на 100 лейкоцитов найдено 20 паразитов.
Допуская, что у больного 4.000 лейкоцитов в 1 мкл крови, легко установить:
в исследованных полях зрения – 100 лейкоцитов и 20 паразитов в 1 мкл имеется 4000 лейкоцитов и Х паразитов. Следовательно, в 1 мкл: 4000х20/100 = 800 паразитов. Подсчет будет еще более точным, если в формулу ввести конкретное, а не предположительное число лейкоцитов у данного пациента. При очень высокой паразитемии ее интенсивность может быть охарактеризована числом паразитов на 100 эритроцитов, подсчитанных в тонком мазке.
Не нашли то, что искали? Воспользуйтесь поиском:
Клиническая диагностика
Во многих уголках мира, особенно в гиперэндемичных и голоэндемичных регионах, врачи зачастую ставят предполагаемый диагноз малярии, основываясь исключительно на клинических симптомах. Были предложены различные клинические алгоритмы, и наилучший из них определяет лишь 50% истинных случаев малярии. Он не позволяет дифференцировать малярию, вызваннуе falciparum и vivax плазмодиями. Более того, многие симптомы предполагаемой малярии совпадают с другими заболеваниями, такими как пневмония, отит, тонзиллит и др.
Исследование мазков крови
В настоящее время, несмотря на появление других методов, микроскопическое исследование мазков крови остается "золотым стандартом" для диагностики малярии. Исследования мазка крови позволяет выяснить следующее: 1. инфицирован ли больной 2. вид и стадию жизненного цикла плазмодия 3. уровень паразитемии (количество паразита в 1 мкл крови).
При правильном осуществлении этот метод имеет значительную чувствительность. Порог определения возбудителя при "тонкой капле" составляет 100 паразитов/мкл. Для "толстой капли" этот порог ниже - около 5-20 паразитов/мкл. В обоих случаях точность зависит в основном от опыта микроскописта.
В целом, исследование мазков крови простой и недорогой метод, но все же требует значительную рабочую силу и достаточно времени для просмотра 100 микроскопических полей на каждый мазок. Также необходимы соответствующее оборудование, реактивы и тренированный персонал.
Подробные руководства по сбору крови и подготовке мазка предоставляются со стороны ВОЗ и Центра по контролю и предупреждению заболеваний и могут быть получены с нашей интернет- странички. Имеется также информация о микроскопической картине различных стадий и видов плазмодия ([Интерпретация мазков крови). Каждая клиника в мире имеет свою специфику приготовления кровяных мазков для диагностики малярии, тем не менее существуют общие принципы, которые должны соблюдаться.
Как правило, мазок должен быть приготовлен как можно раньше после взятия венозной крови. Это позволяет предотвратить возможные изменения в морфологии возбудителя и обеспечить хорошее окрашивание. Особое внимание следует обратить на стадию фиксации при приготовление препарата. Необходимо избегать случайной фиксации "толстой капли" метанолом, особенно, если и "толстая капля", и "тонкий мазок" находятся на одном предметном стекле. Исследователь должен дождаться испарения спирта на пальцах исследуемого перед приготовлением "толстой капли". Необходимо избегать фиксации "толстой капли" при одновременном высушивании предметного стекла при помощи искусственного тепла.
Таким образом, до окрашивания "тонкий мазок" фиксируется метанолом; "толстая капля" окрашивается без фиксации. Многие больницы используют краску Райт-Гимзы (Wright-Giemsa), которая вполне приемлема; тем не менее, только краска Райт недостаточно хорошо окрашивает плазмодии. Для лучшего результата мазок должен окрашиваться при помощи 3% раствора Гимзы (pH 7.2) на 30-45 минут.
Правильная толщина " толстой капли" может быть оценена при помощи четкости печатного текста, видимого сквозь предметное стекло. Печатный текст должен быть лишь слегка разборчивый. При ограниченности ресурсов, "толстая капля" и "тонкий мазок" могут готовиться на одном предметном стекле. Всегда необходимо исследовать и "толстую каплю", и "тонкий мазок". Оба дают важную информацию для диагностики малярии (Таблица1).
Таблица 1. Характеристика толстой капли и тонкого мазка| Толстая капля | Тонкий мазок |
| Гемолизированные эритроциты | Фиксированные эритроциты |
| Много слоевs | Один слой |
| Больший объем | Меньший объем |
| Хороший скрининг-тест | Хорошая дифференциация видов |
| Определяет инфекцию даже при низкой паразитемии | Инфекция с низкой паразитемией может быть пропущена |
| Затруднена дифференциальная диагностика видов | Требует больше времени для интерпретации |
Нижеприведенные таблицы могут быть использованы для дифференциации видов плазмодия как на "толстой капле", так и в "тонком мазке" (Таблицы 2-3).
Таблица 2. Дифференциация видов плазмодия в "тонком мазке".| Признак | P. falciparum | P. vivax | P. ovale | P. malariae |
| Пораженный эритроцит увеличен | + | + | ||
| Форма пораженного эритроцита | округлая | округлая, деформированная | овальная, ворсинчатая | округлая |
| Зернистость эритроцита | пятна Маурэра | пятна Шуффнера | пятна Шуффнера | нет |
| Форма трофозоита | маленькие кольца, поверхностные формы | большие кольца, амебовидные | большие кольца, компактные | маленькие кольца, компактные |
| Зерна хроматина | двойные | единичные | крупные | единичные |
| Зрелый шизонт | редко, 12-30 мерозоитов | 12-24 мерозоитов | 4-12 мерозоитов | 6-12 мерозоитов |
| Гаметоцит | серповидной формы | большой, округлый | большой, округлый | компактный, округлый |
| Признак | P. falciparum | P. vivax | P. ovale | P. malariae |
| Однородные трофозоиты | + | |||
| Фрагментированные трофозоиты | ++ | + | ||
| Компактные трофозоиты | + | + | ||
| Пигментированные трофозоиты | + | |||
| Неоднородная цитоплазма | + | + | ||
| Зернистость | + | + | ||
| Шизонты обнаруживаются | крайне редко | часто | часто | часто |
| Гаметоциты обнаруживаются | случайно | обычно | обычно | обычно |
Определение количества циркулирующих возбудителей чрезвычайно важно в клинических целях, для наблюдения за развитием заболевания и эффективностью лечения. Были предложены различные методы:
-
Число паразитов в 1 мкл крови ("толстая капля"): Этот метод требует исследования по возможности большого количества микроскопических полей (иммерсионный окуляр100x), необходимых для подсчета 200 лейкоцитов. Количество бесполых возбудителей и лейкоцитов должно подсчитываться в каждом поле, пока количество лейкоцитов не достигнет 200.
| + | 1-10 бесполых форм паразита в 100 полях "толстой капли" |
| ++ | 11-100 бесполых форм паразита в 100 полях "толстой капли" |
| +++ | 1-10 бесполых форм паразита в одном поле "толстой капли" |
| ++++ | > 10 бесполых форм паразита в одном поле "толстой капли" |
Необходимо знать, что концентрация возбудителя в крови взаимосвязана с тяжестью клинических проявлений (Таблица 4.).
Таблица4. Соотношение паразитемии и клинического проявления малярии| Паразитемемия | PПаразиты / мкл | Замечания |
| 0.0001-0.0004% | 5-20 | Чувствительность толстой капли капли |
| 0.002% | 100 | В регионах с сезонной малярией, симптомы могут проявляться при паразитемии ниже этого уровня |
| 0.2% | 10,000 | Выше этого уровня клиника проявляется у лиц с иммунитетом |
| 2% | 100,000 | Максимальная паразитемия при P.vivax и P.ovale |
| 2-5% | 100,000-250,000 | Гиперпаразитемия/тяжелая малярия*, повышенная смертность |
| 10% | 500,000 | Рекомендуется переливание крови/высокая смертность |
| *Согласно ВОЗ критерии тяжелой малярии: паразитемия > 10,000 /мкл и выраженная анемия (гемоглобин 20% паразитов и/если > 5% нейтрофилов содержат видимый пигмент. Hдnscheid T. (1999) Diagnosis of malaria: a review of alternatives to conventional microscopy. Clin Lab. Haem. 21, 235-245. | ||
Флюоресцентная микроскопия
Этот метод диагностики малярии основан на способности флюоресцентных красок определять РНК и ДНК возбудителя. В качестве напоминания, в норме зрелые эритроциты не имеют ядерного вещества. Поэтому, любое вещество, определяемое флюоресцентным красителем предположительно свидетельствует о наличии плазмодия. Различные методы окраски были созданы для улучшения исследования мазков крови. Метод Кавамото предполагает окрашивание "тонкого мазка" при помощи акридина оранжевого (AO). Этот метод относительно дешевый и имеет высокую чувствительность (до 90%). Тем не менее, он требует сложного оборудования (флюоресцентного микроскопа).
Количественная лейкоцитарная пленка (Quantitative Buffy Coat Assay (QBC®) является другой модификацией флюоресцентной микроскопии. До микроскопии, кровь центрифугируется в пробирках, покрытых АО. Окрашиваются как возбудитель, так и гранулоциты. Тем не менее, под флюоресцентным микроскопом, возбудитель расположен под слоем гранулоцитов в пробирке QBC® метод быстрый и целесообразный при скрининге большого количества образцов. Тем не менее, он требует наличия центрифуги и специальных красителей , а также флюоресцентного микроскопа. Все они стоят дорого. Более того, определение и подсчет видов затруднен.
Серологическая диагностика
Серологические методы основаны на определении антител по отношению к возбудителям малярии. Положительный тест не может различить прошлую и нынешнюю инфекцию и поэтому имеет ограниченную ценность для решений относительно лечения. С другой стороны, отрицательный тест позволяет исключить возможность малярии, поскольку было установлено, что антитела к бесполым возбудителям появляются уже через несколько дней после поражения эритроцитов. Основное применение серологических тестов следующее:
- Ретроспективное подтверждение эмпирически леченых неиммунизированных лиц
- Выслеживание асимптоматических инфекций у доноров крови
- Исследование на наличие врожденной малярии, особенно, если мазки крови матери отрицательные
- Эпидемиологические исследования для определения регионов передачи малярии и наблюдение за эффективностью профилактических мер.
Определение малярийного антигена
Этот метод диагностики малярии основан на ряде иммунологических проб для определения специфических антигенов. Широко применяются пробы, основанные на определении гистидин-насыщенного белка-2 (ГНБ-2) и паразитарной лактатдегидрогеназы (пЛДГ). В обоих случаях используется иммунохроматографический скорый диагностический тест (СДТ) с кровью.
Эти легко осуществимые тесты были разработаны для быстрой диагностики малярии, вызванной Р. falciparum-ом. Нижеприведенная таблица обобщает признаки 2-х основных серологических методов, используемых в настоящее время (Таблица 5.).
Таблица5. Скорые тесты определения малярии
| Признак | PfГНБ-2 тесты | пЛДГ тесты |
| Принцип, лежащий в основе теста |
|
|
| Преимущества |
|
|
Полимеразная цепная реакция (PCR)
Этот метод основан на молекулярном биологическом методе для определения генетического материала возбудителя. Он имеет крайне высокую чувствительность. Принцип теста: выявление ничтожно малого количества паразитарной ДНК и увеличние в миллионы раз для более легкого определения. Порог чувствительности составляет 0.05-0.1 паразитов/мкл. Сегодня данный метод позволяет дифференцировать виды плазмодия. Более того, он может быть использован для определения мутацийобуславливающих лекарственную устойчивость возбудителя. Тем не менее,на сегодня этот многообещающий метод используется лишь в больших исследовательских лабораториях. Метод связан с высокой стоимостью и вовлечением обученного персонала. Вероятность загрязнения (ложно-положительный тест) крови остается другим недостатком полимеразной цепной реакции.
Читайте также:


