Выходом инфекции за его пределы к
Первичное микробное загрязнение раны реализуется в момент ранения. От нео нужно отличать вторичное микробное загрязнение, которое происходит при неаккуратном обращнеии с раной, отсутствии повязки или наличии нестерильной повязки.
Что же происходит с микробами, попавшими в рану. Большая часть их погибает за счет фагоцитоза, а часть их приспосабливается. Через 1-2 недели в ране преобладает кокковая флора, так называемая микрофлора раны - эта та ассоциация микробов, которая осталась в ране спустя некоторое время после ранения вследствие естественного отбора.
Микробное загрязнением раны это еще не есть раневаия инфекция. Нагноение раны - это физиологическая мера организма, направленная на заживление раны; при нагноении раны микробы питаются мертвыми ткаями, утилизируют их, вызывают развитие грануляций. Грануляции имеют мало форменных элементов, но ипмеют много сосудов, по которым прибывают фибробласты, которые затем становятся фиброцитами, составляющими основу рубцовой ткани.
От нагноения раны нужно отличать инфекци раны - результат взаимодействия микро - и макроорганизма, вызывающее воспаление и признаки общей реакции организма в виде болей, лихорадки, слабости, тошноты и соответствующей реакции крови. До сих пор эти термины часто смешиваются, а их необходимо различать.
Что же сопровождается инфекцию раны? Прежде всего, это гнйоно-резорбтивная лихорадка, характеризующаяся вечерними подъемами температуры тела и другми общими явлениями. Еще более грозное осложнение раневой инфекции это сепсис. Развивается в результате подавления ретикулоэндотелиальной системы. Лихорадка приобретает ремитирующий характер, в общем анализе крови наблюдается анемия, появление юных форм лейкоцито. Рзавивается раневое истощение так назыаемая потерия гноя - это потерия больших количеств белка ( 120 г гноя = 10 белка), могут появляться гнойные метастазы. Реактивность падает насктоль, что хирург вскривает одни очаг, а в это время где-то в другом месте зреет другой очаг. Поэтому сейчас сепсис делят на две формы:
1. Сепсис без метастазов.
2. Сепсис с гнойными метастазами.
Местные формы инфекции.
· Инфекция раны. Развивается в стенках раневого канала, отделена от живых тканей демаркационной линией. Процесс сугубо местный так как разваивается в тканях с пониженной сопротивляемостью. На этой стадии микробы являются “помощниками”, очищающими рану от мертвых тканей;
· Раневая флегмона - развивается при выходе инфекции за пределы раны, когда процесс переходит на живые и здоровые ткани, прилежащие к очагу повреждения;
· Образование гнойных затеков - пассивное распространение гноя за пределы раны когда отток гноя недостаточно организован хирургами, или рана после первичной хирургической обработки была зашита наглухо.
Важной является профилактика раневой инфекции, которая должная совершаться на поле боя ( обработка краев раны, наложение асептической повязки, остановка кровотечения, даже с помощью жгута, транспортная иммобилизация). Но главная профилактика это проведение рациональной первичной хирургической обработки раны.
Существует военно-полевая хирургическая доктрина, которая гласит:
1. Все открытие огнестрельные повреждения микробно загрязненные и потенциально инфицированы.
2. Профилактикой является возможно ранняя первичная хирургическая обработка раны.
Первичная хирургическая обработка раны - это хирургическое вмешательство, направленное на предупреждение развития раневой инфекции и на восстановление разрушенных тканей.
Помощь на этапах медицинской эвакуации.
МПБ - иммобилизация (шины Дитерихса, шины Крамера).
МПП - введение антибиотиков, у слабых раненых - переливание О(1) группы крови. В случае полного разможжения конечности проводится транспортная ампутация. Заполняется первичная медицинская карточка.
ОМедБ - операция первичной хирургической обработки раны по показаниям. Помещение раненых с анаэробной инфекцией в анаэробную палатку. При развитии гнойной инфекции раны выолпняется вторичная хирургическая обработка раны - операция , направленная на ликвидацию развившейся раневой инфекции ( часто стафилококковая).
Однако после ранения нередко развивается анаэробная инфекция. Микроорганизмы вызыывающие ее размножаются без доступа кислорода и сами образуют газы (газовая инфекция). Ранее называлась “бронзовая кожа”, самопроизвольная эмфизема, газовый нарыв и т.д.). микроорганизмы вызыающие анаэробное поражение открыты в 1894 году ( Вейнберг). В 1916 году (Себин) открыта Clostridium histoliticum.
· Clostridium histoliticus ( при гнойно-гнилостных поражениях).
Вообще же гноя при анаэробных инфекция не наблюдается, а выделяется водянистая жидкость. Замечено , что возбудители анаэробной инфекции могут обнаруживаться в 90% свежих случайных ран, инфекция развивается всего лишь у 1-2% лиц. То есть понятие анаэробной инфекции чисто клиническое.
Эти микробы выделяют экзотоксины, вызывающие сильную интоксикацию, эйфорию, бессоницу и пр. Развитию анаэробной инфекции способствует значительное разрушение тканей, особенно мягких; оказалось , что при огнестрельных переломах анаэробная инфекция развивается в 5 раз чаще. Также способствует наложение жгутов, массовео поступление раненных , осенне-зимний период, кровопотеря переутомление, наличие шока, загрязнение раны почвой. Летальность при анаэробной инфекции 15-50%.
Классификация.
1. По скорости распространения: быстрораспространяющаяся, медленнораспространяющаяся.
2. По клиническим пряовлениям: эмфизематозные формы, гнилостно-гнойные формы, отечные формы.
3. По глубине распространения: эпифасциальные, субфасциальные.
Инкубационный период короче, чем при гнойной инфекции, может встречаться молниеносные формы. Начальные симптомы: боли в ране, нарастание отека ( симптом лигатуры Мельникова) конечности, конечность приобретает синюшную окраску, температура кожи понижается, частота пульса намного опережает температуру тела, изменения психики - эйфория, бессоница.
Кардиальные симптомы - появление подкожной эмфиземы ( покожная крепитация), желтушность кожи, мышцы в ране приобретают коричнево-красный цвет и не кровоточат.
Бактериологическое исследование не имеет решающего значения, главное - клиника.
Профилактика - своевременная и радикальная первичная хирургическая обработка раны.
Лечение.
1. Хирургическое. Главное - рассечение раны, нанесение лампасных разрезов, а при субфасциальной форме с фасциотомией; цель - освободить мышцы от сдавления. Тампонада раны, может проводится любыми антисептиками. Гипсовая повязка не накладывается.
2. 150 тыс антитоксических единиц сыворотки противоклостридиальной. Вводится капельно, на физиологическом растворе, в соотношении 1 к 5.
Не нашли то, что искали? Воспользуйтесь поиском:
Острый холецистит - воспаление желчного пузыря, развивающееся очень быстро - в течение нескольких часов или дней. Ему подвержены люди всех возрастов, но чаще всего страдают в пожилом и старческом возрасте (40-50 % от общего числа заболевших). По количеству операций острый холецистит уступает только аппендициту.
Острый холецистит может возникнуть абсолютно внезапно, обычно ночью, хотя днем человек прекрасно себя чувствовал, а может несколько дней готовить к своему появлению горечью и металлическим вкусом во рту, тяжестью в правом подреберье или в подложечной области, подташниванием.
Часто болевой приступ возникает либо после употребления жирной, жареной еды, гораздо реже он случается после неадекватной физической нагрузки. Боль обычно приступообразная, схваткообразная, резкая, отдает в правую половину - под лопатку, в ключицу, шею справа. Боль может возникнуть не только в правом подреберье, но и в левом. Если же воспалительный процесс распространился на поджелудочную железу, боль - опоясывающая.
По силе и характеру боли приступ напоминает желчную колику, но может длиться больше 6 часов, и боль при этом гораздо острее. На ее пике нередко возникают тошнота и рвота, которая не приносит никакого облегчения. Приступ может длиться от нескольких часов и дней до полутора-двух недель. Уже в первые часы приступа повышается температура. Может появиться желтуха.
Частота пульса колеблется от 80 до 120 ударов в минуту и выше. Частый пульс – это очень серьезный признак, который свидетельствует о глубокой интоксикации и тяжелых морфологических изменениях в брюшной полости.
Живот при пальпации очень болезнен в правом подреберье и часто в эпигастральной области.
Самая распространенная причина острого холецистита - желчекаменная болезнь. Она развивается в желчном пузыре, потерявшем сократительную способность, в результате чего желчь кристаллизуется, а со временем образуются камни. То есть камень появляется в нездоровом желчном пузыре, как жемчужина, которая, как известно, растет только в больном моллюске.
На нарушение моторики желчного пузыря влияют много факторов:
- желчекаменная болезнь. Острый холецистит, возникающий на ее почве, составляет 85-90%. Также имеет значение хроническое изменение желчного пузыря в виде склероза и атрофии элементов стенок желчного пузыря
- проникновение инфекции. При попадании инфекции воспаление в желчном пузыре возникает, если нарушена его дренажная функция и возникает задержка желчи
- нарушение оттока желчи из пузыря: камни, перегибы удлиненного или извитого пузырного протока, его сужение
- микробы (стафилококки, стрептококки и др.)
- затекание панкреатического сока в желчный пузырь и повреждающее действие панкреатических ферментов на ткань пузыря. Как правило, эта патология желчного пузыря сочетается с явлениями острого панкреатита
- сосудистые изменения в стенке желчного пузыря. У пожилых людей сосудистые нарушения, связанные с возрастными изменениями, могут вызывать развитие деструктивных форм острого холецистита (первичная гангрена желчного пузыря).
При диагностике острого холецистита в 12–17 % случаев возникают ошибки, которые приводят к неправильному выбору метода лечения и запоздалому оперативному вмешательству.
Но в типичных случаях диагностика не представляет проблем при выявлении неспецифических симптомов воспалительного процесса: гипертермия, лейкоцитоз, увеличение СОЭ. Повышение в крови сахара, амилазы или других панкреатических ферментов свидетельствуют о тяжести интоксикации. Основным методом диагностики является контрастная холецистохолангиография.
Наиболее четкое изображение желчного пузыря и желчевыводящих протоков может быть получено при инфузионной холеграфии.
Сегодня очень эффективным считается ультразвуковой способ исследования. При механической желтухе, обусловленной холедохолитиазом, стенозом большого дуоденального сосочка показано выполнение ретроградной панкреатохолангиографии (РПХГ). При невозможности выполнения РПХГ может быть использована чрезкожная чрезпеченочная холангиография.
Если заболевание протекает без осложнений, то за время от 2-3 недель до 2-3 месяцев состояние может нормализоваться. Но может привести к воспалению поджелудочной железы (панкреатиту), воспалению желчевыводящих путей (холангиту), эмпиеме желчного пузыря, его прободению с развитием желчного перитонита. Это очень серьезные осложнения, требующие неотложной хирургической помощи, поэтому заниматься самолечением острого холецистита опасно для жизни! При возникновении признаков, схожих с симптомами острого холецистита, тем более, если вы перенесли в прошлом желчную колику, следует немедленно вызвать скорую. Самолечение острого холецистита не допустимо! Ни в коем случае не применяйте грелки, не промывайте желудок и не принимайте слабительные средства.
Лечение, начатое в ранние сроки заболевания и проведенное в полном объеме, останавливает воспалительный процесс в желчном пузыре, а, значит, позволяет избежать операции.
Лечение, как правило, проводится, чтобы улучшить отток желчи в кишечник, нормализовать нарушенные процессы обмена веществ и восстановить нормальную деятельность других систем организма.
Комплекс лечебных мероприятий выглядит так:
- голод в течение 2-3 дней;
- холод на область правого подреберья;
- промывание желудка, если наблюдается тошнота и рвота;
- назначение в инъекциях спазмолитиков 3 раза в день.
Назначение обезболивающих препаратов при остром холецистите запрещено, поскольку снятие болей нередко сглаживает картину заболевания и приводит к тому, что момент прободения желчного пузыря врачи могут не заметить.
При остром холецистите делается правосторонняя паранефральная блокада 0,25 % раствором новокаина в количестве 80-100 мл., которая снимает болевые ощущения и улучшает отток инфицированной желчи из желчного пузыря и желчных протоков благодаря усилению сократительной способности пузыря и снятию спазма сфинктера Одди (сфинктер печеночно-поджелудочной ампулы). При необходимости назначают гликозиды, кокарбоксилазу, панангин, эуфиллин и гипотензивные средства.
Основной метод лечения острого холецистита – антибиотики, но только те, которые в достаточной концентрации накапливаются в пузырной желчи и к которым чувствительна вызвавшая острый холецистит микробная флора.
При лечении заболевания рекомендуются утренняя гимнастика и лечебная физкультура, способствующие нормализации оттока желчи.
Вопрос о хирургическом лечении и его объеме решается по общему состоянию больного, тяжести основного заболевания и наличии сопутствующих изменений во внепеченочных желчных протоках. Чаще всего проводится холецистэктомия - удаление желчного пузыря. Это основная операция при остром холецистите, которая обычно ведет к полному выздоровлению больного.
Без лечения болезнь может закончиться гангреной желчного пузыря и перфорацией, что приводит к сепсису, шоку и перитониту. Такое развитие острого холецистита сопряжено с высокой смертностью (до 65%).
Частью лечения является строгая диета: в первые двое суток – голод, в последующие сутки – пюре из овощей и фруктов, нежирные сорта мяса, каши, молочнокислые продукты низкой жирности, минеральная негазированная вода, компот.
Если вы уже однажды перенесли приступ острого холецистита и решили забыть об этом, нарушив диету, то не сомневайтесь - приступ повторится, и возникнет вероятность развития хронического холецистита.
Очень важно, чтобы диета соблюдалась постоянно, а не курсами, потому что стоит съесть что-нибудь вкусное, но вредное, как часто случается в праздничные дни, это приведет к началу нового приступа, который потребует госпитализации больного и даже оперативного вмешательства.
Избежать желчнокаменной болезни трудно, если у человека есть к ней предрасположенность. Но все же можно, если соблюдать простое правило – питаться сбалансировано и регулярно, не наедаться на ночь, следить за своим весом. Самое важное для профилактики осложнений острого холецистита - своевременное оперативное лечение желчнокаменной болезни. Кроме того, важно предупреждать нарушения обмена веществ (в том числе ожирения), лечить запоры, а также устранять очаги инфекции в организме (лечение кариозных зубов, тонзиллита).
- Развитие острого холецистита во время беременности связано с тем, что во время беременности весь пищеварительный тракт сдавливается беременной маткой. На уровне желчного пузыря это способствует застою желчи и образованию камней, что является основными причинами развития острого холецистита.
Опасность острого холецистита во время беременности связана с двумя проблемами. Во-первых, во время беременности ограничены возможности использования антибиотиков, во-вторых, при беременности крайне нежелательно и затруднительно проведение операции по удалению воспаленного желчного пузыря. Кроме того, боли при остром холецистите могут быть спутаны с болями при начинающихся схватках.
Поэтому при возникновении симптомов, описанных выше, следует немедленно обратиться к врачу и придерживаться его рекомендаций.
- Это осложнения, непосредственно связанные с воспалением желчного пузыря и с выходом инфекции за его пределы. К этим осложнениям относятся околопузырный инфильтрат и абсцесс, прободение желчного пузыря, перитонит различной распространенности, желчные свищи, острый панкреатит, и наиболее частые осложнения – механическая желтуха и холангит. Осложненные формы встречаются в 15–20 % случаев. Осложнения острого холецистита, как правило, развиваются у больных не получавших лечение или начавших лечение слишком поздно.
Признаки осложненного течения острого холецистита это усиление боли в животе, повышение температуры, резкое ухудшение состояния больного.
Курсовая Внутрибольничные инфекции
Введение
Внутрибольничные инфекции (синоним нозокомиальные инфекции) - инфекционные болезни, связанные с пребыванием, лечением, обследованием и обращением за медицинской помощью в лечебно-профилактическое учреждение. Присоединяясь к основному заболеванию, ВБИ ухудшает течение и прогноз болезни.
Проблемы ВБИ приобрели большую актуальность в связи с появлением так называемых госпитальных (как правило, полирезистентных к антибиотикам и химиопрепаратам) штаммов стафилококков, сальмонелл, синегнойной палочки и других возбудителей. Они легко распространяются среди детей и ослабленных, особенно пожилых, больных со сниженной иммунологической реактивностью, которые представляют собой так называемую группу риска.
Внутрибольничная инфекция – одна из острейших проблем современной медицины. Минимальный экономический ущерб, наносимый ВБИ ежегодно, составляет 10–15 млрд. рублей. Присоединение ВБИ к основному заболеванию увеличивает в среднем на 6–8 дней продолжительность пребывания пациента в стационаре. Летальность в группе лиц с внутрибольничными инфекциями значительно превышает таковую среди аналогичных групп больных без ВБИ.
Госпитальные инфекции оцениваются как одна из причин смерти. Летальность при различных нозологических формах колеблется от 3.5% до 60%, а при генерализованных формах достигает такого же уровня, как в доантибиотическую эру. В настоящее время во всём мире развернулась научная дискуссия о возникновения внутрибольничных инфекций в лечебно-профилактических учреждениях. По данным официальной регистрации внутрибольничные инфекции в Российской Федерации развиваются у 0.15% госпитализированных больных.
Однако выборочные исследования показали, что госпитальные инфекции возникают у 6.3% больных с колебаниями от 2.8-7.9%. В период с 1997-1999 года в России зарегистрировано 50-60 тыс. случаев внутрибольничных инфекций. Большую опасность для пациентов и медицинского персонала представляют также вспышки гепатитов В и С, которые регистрируется в различных типах стационаров России.
Для успешной борьбы с внутрибольничными инфекциями необходимо оптимизировать эпидемиологический надзор и на его основе проводить профилактические и противоэпидемиологические мероприятия, способствующие управлению эпидемическим процессом при этих инфекциях.
Таким образом, актуальность проблемы госпитальных инфекций для теоретической медицины и практического здравоохранения не вызывает сомнения. Она обусловлена с одной стороны высоким уровнем заболеваемости, летальности, социально-экономическим и моральным ущербом, наносимым здоровью пациентов, а с другой стороны внутрибольничные инфекции наносят существенный вред здоровью медицинского персонала.
В последние десятилетия внутрибольничные инфекции становятся всё более значимой проблемой здравоохранения, в экономически развитых странах они возникают у 5-10% пациентов, что значительно отягощает течение основного заболевания, создавая угрозу для жизни больного, а также увеличивает стоимость лечения. Во многом это связано с демографическими сдвигами (увеличение числа лиц преклонного возраста) и накопления в популяции лиц повышенного риска (люди с хроническими заболеваниями, интоксикациями или принимающие иммунодепрессанты).
Заключение
В основе профилактики внутрибольничных инфекций лежит пунктуальное выполнение комплекса диагностических, санитарно-профилактических и противоэпидемических мероприятий, регламентированных для лечебно-профилактических учреждений. В частности, предусматриваются наличие фильтра и отдельный прием лихорадящих детей в детских поликлиниках (и взрослых во время эпидемии гриппа); обследование персонала на носительство возбудителей и, в случае выявления такового, отстранения от работы до выздоровления; санирование больных стертыми формами инфекций и бессимптомных носителей возбудителей: проведение текущей и заключительной дезинфекции (в т.ч. в кабинете инфекционных заболеваний, операционном блоке, перевязочных, центральном стерилизационном отделении, физиотерапевтическом отделении и др.) с использованием дезинфицирующих средств, бактерицидных ламп и др.; соблюдение методов асептики и антисептики, максимальное использование одноразовых инструментов и систем; тщательная обработка рук персонала, правильная организация операций и перевязок. Больной с неясной инфекционной болезнью или возможным сочетанием инфекций должен находиться в боксе или в отдельной палате при приемном отделении до уточнения диагноза. За лицами, общавшимися с больными, страдающими В. и., устанавливают клиническое наблюдение, проводят лабораторные исследования, необходимые при предполагаемом виде инфекции. Госпитализация больных в отделение, где выявлена В. и., полностью прекращается на срок максимального инкубационного периода. Прием новых больных разрешается после заключительной дезинфекции. [2]
Борьба с ВБИ, требующая значительных финансовых затрат, может быть успешной при условии комплексного подхода к решению проблемы с использованием организационных и фармацевтических методов.
В соответствии с Приказом Минздрава РФ № 220 от 17 сентября 1993 г. в лечебно-профилактических учреждениях страны в штатные расписания вводится должность эпидемиолога или его помощников, что дает реальную возможность оптимизации системных мер профилактики ВБИ. [10]
Создано Общество контроля больничных инфекций, которое взаимодействует со всеми ступенями здравоохранения - районными, городскими, областными, республиканскими больницами, специализированными медицинскими центрами. Одна из его основных задач - привнесение международных норм и правил в отечественную медицину. Общество имеет тесные контакты с аналогичными международными организациями, и прежде всего с APIC (Ассоциация практиков инфекционного контроля), США. [10]
Какие меры необходимо предпринять для ограничения распространения ВБИ? Это прежде всего понимание серьезности проблемы руководящими органами здравоохранения и продолжение финансовой поддержки системы мер. В рамках госпитальных мероприятий - своевременное информирование специалистов о мировых и отечественных достижениях в этой области, определение наиболее опасных участков внутри больниц, организация обучения медицинского персонала и просвещение населения и больных, организация системы утилизации медицинских отходов, совершенствование нормативных документов и стандартов с учетом мировой документации, применение современных средств антибиотикотерапии и антисептики. [3]
Одним из методов снижения внутрибольничного инфицирования является использование пластикового контейнера для внутривенных растворов, который обладает рядом существенных преимуществ перед стеклянными емкостями для растворов. Наиболее значимыми из них является то, что пластиковый контейнер нельзя разбить, меньшими являются затраты на транспортировку и утилизацию. Другим преимуществом, менее заметным, но не менее важным, является невозможность попадания воздуха в гибкий спадающийся при вытекании жидкости контейнер, как это происходит при использовании стеклянных или пластиковых флаконов. Исключение возможности попадания воздуха внутрь системы делает невозможным инфицирование пациента при внутривенной инфузии.
Закрытые стерильные спадающиеся системы для внутривенных растворов, которые включают также мини-контейнеры (50 и 100 мл) для дополнительного проведения лекарственной терапии, быстро стали производственным стандартом в Северной Америке и других частях мира. США полностью перешли на использование таких закрытых систем еще с середины семидесятых годов. [3]
Основным в комплексе мер, направленных на снижение внутрибольничного инфицирования, является широкомасштабное использование достижений химико-фармацевтической промышленности, производимых в стране дезинфекционных, антисептических и бактериальных средств, обеспечивающих эффект вне зависимости от вида возбудителя. Хорошо зарекомендовали себя дезинфекционные растворы лизетол, пресепт, сайдекс. Колоссальное значение имеет грамотное, целенаправленное использование антибиотиков с учетом устойчивости к ним микроорганизмов, которые являются основными возбудителями внутрибольничных инфекций. [9]
Самыми эффективными лечебными препаратами при внутрибольничных гнойно-воспалительных заболеваниях являются цефалоспорины. Возможно сочетание их с аминогликозидами. Если возбудитель В. и. не выделен, но имеется подозрение на наличие грамотрицательной флоры, эмпирически можно применить аминогликозиды (гентамицин, тобрамицин, амикацин). При вирусных инфекциях показан интерферон. [3]
Список использованной литературы
1. Беляков В.Д. Госпитальная инфекция - Л.: Медицина, 1976
2. Богданов И.Л. Внутрибольничные инфекции и их профилактика – Киев: Киев, 1963.
3. Внутрибольничная инфекция. Учебно-методическое пособие./ под ред. Бурцева М.Ю. - Иркутск, 1999.
4. Гандельсман Б.И Дезинфекционное дело / под ред. И. И. Карон. – М.: Медицина, 1971.
5. Громашевский Л.В. Общая эпидемиология - М.: Медицина, 1965.
6. Качемасова З.Н., Ефремова С.А., Рыбакова А.М. Санитарная микробиология и вирусология – М.: Медицина, 1987.
7. Лоншонци Г. Внутрибольничные инфекции: перевод с венг. – М.: Медицина, 1988.
8. Медицинская микробиология / под ред. акад. РАМН В.И. Покровского. – М.: ГЭОТАР-МЕД, 2001.
9. Медицинская микробиология. / Гл. ред. В.И. Покровсктй, О. К. Поздеев – М.: ГЭОТАР-МЕД, 1998.
10. Рейзис А.Р. Госпитальные инфекции в современной медицине – СПб: РУДИ-БАРС, 1993.
11. Семина Н.А. Актуальные вопросы эпидемиологии и инфекционных болезней. – М.: Медицина, 1999.
12. Шерертц Д., Хэмптон Э., Ристуцина Л. Внутрибольничная инфекция /под ред. Р.П. Венцела. – М.: Медицина 1990.
13. Эпидемиологические особенности внутрибольничных инфекции в районах Сибири и Крайнего севера. / Ратушняк С.С. – автореферат, Иркутск, 1999.
14. Яфаев Р.Х., Зуева Л.П. Эпидемиология внутрибольничной инфекций – Ленинград: Медицина, 1989.
* Примечание. Уникальность работы указана на дату публикации, текущее значение может отличаться от указанного.

Общие сведения
Частота регистрации ИСМП в разных странах варьирует в широких пределах. Так, в РФ этот показатель составляет 1-1,5% (40-60 тыс. случаев/год), США — 3-5 % (2,5 млн. случаев/год), Великобритании — 5-6 %, Германии —3,5 %, Китае — 7-8 %. Однако, эти показатели, особенно в странах СНГ и, в частности, России не отражают реальную эпидемиологическую ситуацию. Результаты научных исследований ведущих специалистов-эпидемиологов РФ свидетельствуют, что реальное количество ИСМП составляет в среднем около 10% и находится на уровне 2-2,5 миллионов случаев/год. Присоединение ИСМП к основному заболеванию увеличивает продолжительности лечения (пребывания в стационаре) пациента на 7-10 дней, а прямые затраты лечебных учреждений на 65-85 млрд рублей в год. Летальность при различных нозологических формах ИСМП варьирует в пределах 3,5-35%.
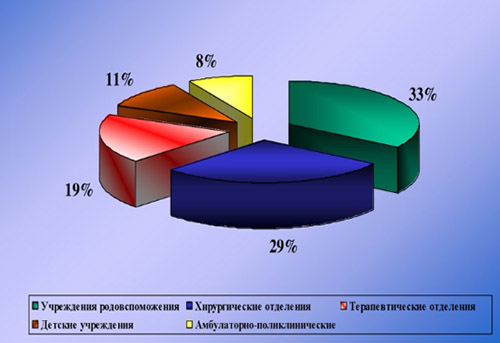
Наибольший удельный вес ИСМП приходится на хирургические и акушерские стационары (отделения травматологии, урологии, реанимации, абдоминальной хирургии, гинекологии, ожоговой травмы, стоматологии, отоларингологии, онкологии). Наиболее драматичны проявления ИСМП в отделениях интенсивной терапии и реанимации, где они в различных нозологических формах регистрируются в 25-30% случаев.
Патогенез
Патогенез внутрибольничных инфекций существенно различается и определяется видом заболевания, этиологическим фактором (видом возбудителя, факторами его вирулентности), механизмом и путями передачи инфекции.
Классификация
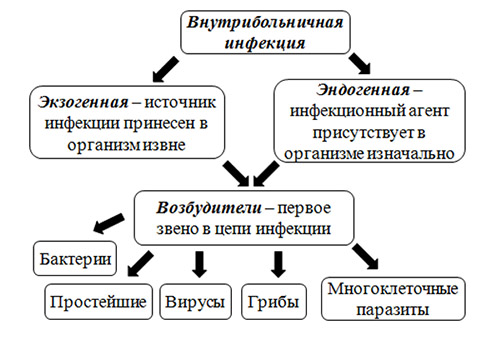
Прежде всего, различают две больших группы ИСМП (рис. ниже):
- Экзогенная инфекция — обусловлена заражением пациента инфекционным агентом в условиях посещения/нахождения в ЛПУ.
- Эндогенная инфекция — инфекции, вызванных условно-патогенными микроорганизмами, вегетирующими в пищеварительном тракте, на кожных и слизистых покровах, которые при неблагоприятных условиях становятся патогенными. В структуре ВБИ роль эндогенной инфекции незначительна.
Группы и этиологический фактор ИСМП
В основу классификации ВБИ положены различные факторы. В зависимости от путей/факторов передачи различают воздушно-капельные, контактно-бытовые, контактно-инструментальные, постоперационные, постинфекционные, постэндоскопические, послеродовые, посттрансфузионные, постдиализные, посттравматические, постгемосорбционные и другие инфекции.
В зависимости от степени распространения инфекции различают:
- Генерализованные: бактериемия, септицемия, септикопиемия, токсико-септическая инфекция.
- Локализованные инфекции, включающие:
- Респираторные инфекции (ОРЗ, бронхит, плеврит, пневмония, легочный абсцесс и др.).
- Инфекции подкожной клетчатки/кожи (послеожоговые, послеоперационные, послетравматические), дерматомикозы, постинъекционные — абсцессы/флегмоны подкожной.
- Стоматологические инфекции (абсцесс, стоматит).
- ЛОР-инфекции (ринит, отиты, синуситы, ангина, ларингит, фарингит).
- Урологические инфекции.
- Инфекции пищеварительного тракта (энтерит, колит, гастроэнтероколит, холецистит, гепатиты др.).
- Постоперационные инфекции (перитонит, абсцессы брюшины).
- Инфекции глаза (конъюнктивит).
- Инфекции урологической и половой системы (пиелонефрит, уретрит, цистит, бактериурия, эндометрит, сальпингоофорит).
- Инфекции костно-cуставного аппарата (остеомиелит, бурсит, артрит).
- Инфекции сердечно-сосудистой системы (миокардит, эндокардит, перикардит, инфекции артерий и вен).
- Инфекции ЦНС (менингит).
- По характеру течения: острые, подострые, хронические. По тяжести течения: легкие, тяжёлые и среднетяжелые.
Причины
Этиологическим фактором ИСМП может быть чрезвычайно широкий спектр микроорганизмов (около 250 видов), принадлежащих к разным таксономическим группам: бактерии, вирусы, простейшие, грибы. При этом, инфекционным агентом могут быть патогенные, условно-патогенные микроорганизмы, а в ряде случаев и сапрофитная микрофлора. Наибольшей удельный вес в этиологической структуре ИСМП принадлежит возбудителям гнойно-септических инфекций (80-85%), кишечных инфекций (8-10%), вирусам гепатитов В, С, D (6-7%), инфекции дыхательных путей (2-3%). В целом, структура ВБИ изменчива и зависит преимущественно от профиля отделения/вида стационара и микробного пейзажа конкретного лечебного отделения (рисунок ниже).
К возбудителям ВБИ, имеющими наибольшее значение относятся:
- грамположительная флора: стафилококки (золотистый, эпидермальный), стрептококки (пневмококк, энтерококк, пиогенный стрептококк);
- грамотрицательная флора: энтеробактерии (эшерихия, сальмонелла, шигелла, синегнойная палочка, клебсиелла, протей, иерсиния).
- вирусы (аденовирусной инфекции, простого герпеса, кори, ветряной оспы, гриппа, парагриппа, респираторно-синцитиальной инфекции, эпидпаротита, ротавирусы, риновирусы, энтеровирусы, возбудители вирусных гепатитов);
- грибы (рода Candida, аспергиллы).
Значимость различных видов ИСМП во многом определяется профилем ЛУ. Так, в гинекологических и родильных отделениях ведущую роль играет стафилококковая инфекция (золотистый стафилококк), кишечная палочка, энтерококки, диплоидный грибок (молочница); в ожоговых стационарах — синегнойная инфекция; в урологических отделениях — грамотрицательная микрофлора: кишечная, синегнойная палочка; в детских отделениях — вирусы краснухи, кори, эпидемического паротита, ветряной оспы.
Формирование госпитального штамма (с приобретенной устойчивостью) обеспечивается за счет их преимущества (доминирования) перед другими представителями микробной популяции. Основными отличиями госпитального штамма микроорганизма от стандартного являются: повышенная вирулентность (патогенность), формирующаяся за счет многократного пассажа через организм больных ЛПУ, высокая устойчивость к воздействию неблагоприятных факторов (дезинфектантам, антисептикам, химиопрепаратам, применяемым в конкретном мед. учреждении) и способность к длительному выживанию, постоянная циркуляция в среде больничного стационара среди больных и персонала.
Основную массу всех форм ВБИ (около 80%) составляют:
- инфекции мочевыделительной системы;
- ОРЗ и вентилятор-ассоциированные пневмонии;
- послеоперационные раневые гнойно-септические инфекции;
- кожные инфекции;
- интраабдоминальные инфекции;
- ангиогенные катетер-ассоциированные инфекции.
Любая нозологическая форма ВБИ развивается только при наличии всех звеньев эпидемического процесса: источника инфекции, механизма (факторов) передачи и восприимчивого организма человека.
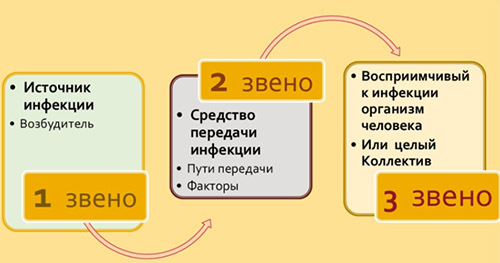
Основные источники внутрибольничной инфекции:
- больные и носители, находящиеся в стационаре;
- персонал лечебных учреждений;
- лица, ухаживающие за больными и посетители стационаров (студенты, лица, навещающие пациентов).
Аэрогенный — процесс заражения осуществляется через воздушную среду. Выделяют:
- воздушно-капельный путь (этим путем возбудитель передается при большинстве ОРЗ, пневмониях) при разговоре, кашле;
- воздушно-пылевой путь (передаются заболевания, возбудитель которых устойчив во внешней среде — кишечные инфекции, туберкулез, зоонозы).
- Контактно-бытовой путь – инфекционный агент передается через грязные рук, предметы личной гигиены, игрушки, посуду.
- Пищевой (реализуется через зараженные продукты питания при нарушениях технологии приготовления или хранения готовых блюд и пищевых продуктов).
- Водный (через воду).
- Прямой — передача возбудителя непосредственно через физический контакт между резервуаром инфекции (инфицированный индивидуум/контаминированный предмет) с кожей, слизистой или раневой поверхностью восприимчивого организма человека.
- Непрямой — посредством механического переноса инфекционного агента через руки медицинского персонала, предметы обихода, инструменты и оборудование лечебного учреждения. Непрямой контакт является наиболее часто задействованным путем распространения. Этот путь передачи часто называют артифициальным (искусственным) или парентеральным путем передачи возбудителя, который реализуется путем проведения различных инвазивных манипуляций (инъекции, забор крови, инструментальные манипуляции, вакцинацию, местные/общие операции) или использовании специальной аппаратуры при проведении гемодиализа, ИВЛ.
- Гемоконтактный — передается через кровь при обширных хирургические вмешательствах, инфузионной терапии, программном гемодиализе.
Заболеваемость ИСМП носит преимущественно эндемический характер и обусловлена индивидуальными факторами риска и клиническими процедурами. Значительно реже ИСМП протекают в виде локальных эпидемий. Развитию эпидемических вспышек способствует несвоевременная диагностика стертых форм заболевания и выявление носителей инфекционных агентов, как среди поступающих пациентов, так и среди медицинского персонала, контаминация предметов общего пользования, систематическое нарушение методов асептики при выполнении инструментальных процедур.
Специфичны для каждого вида инфекционного возбудителя. Однако, в целом для большинства нозологических форм ИСМП определяющими факторами являются параметры, характеризующие организм хозяина:
- возраст (пожилой/старческий, дети — новорожденные и раннего возраста, особенно недоношенные, со сниженной сопротивляемостью организма и перенесшие родовую травму);
- пациенты, страдающие тяжелыми хроническими заболеваниями, с алиментарной дистрофией;
- длительно находящиеся в стационаре и особенно на постельном режиме;
- беременные/роженицы;
- пациенты, получающие лучевую/иммуносупрессивную терапию;
- имунноскомпрометированные лица;
- больные после обширных хирургических операций, получающие кровезаместительную/инфузионную терапию, с программным гемодиализом, находящиеся на ИВЛ.
Факторы риска ИСМП, связанные с предметами окружающей среды (загрязнение поверхностей, воздуха, воды в распространении инфекции) имеют меньшую значимость.
Возникновению и распространению ИСМП способствуют:
Симптомы
Симптоматика внутрибольничных инфекций определяется конкретной нозологической формой и симптомами основного заболевания, формой и тяжестью их течения, вирулентностью инфекционного агента и состоянием организма больного.
Анализы и диагностика
К ВБИ относятся случаи, отвечающие следующим критериям:
- Повторное поступление пациента в стационар с установленной инфекцией (с клиническими признаками, данными инструментальных и лабораторных методов исследовани — микробиологических, серологических и методов экспресс-диагностики), являющееся следствием предыдущей госпитализации.
- Период развития клинической симптоматики заболевания ВБИ после поступления в лечебный стационар должен составлять не менее 48 часов и более.
- Выявляется четкая взаимосвязь между симптоматикой заболевания и проведенными вмешательства инвазивного типа (после ингаляции, инъекций, перевязки и т.д.) или в ряде случаев — с выявленным источником инфекционного агента (поступивший больной со стертой формой заболевания/носитель) и фактором ее распространения.
Для точной диагностики заболевания и определения конкретного штамма возбудителя инфекции, требуется проведение лабораторных—бактериологических/серологических исследований различных биоматериалов (мазок из зева, мокрота, кровь, моча, кал, раневое отделяемое).
Лечение
Проблема лечения госпитальных инфекций представляет значительную трудность, что обусловлено неэффективностью большинства широко применяемых антибиотиков, в частности цефалоспоринов. Для лечения таких инфекций применяются карбапенемы (Меропенем, Дорипенем), имеющие широкий спектр антимикробной активности, в частности к микроорганизмам, устойчивым к пенициллинам/цефалоспоринам или в ряде случаев комбинированные лекарственные препараты пенициллинов с ингибиторами бета-лактамаз (Пиперациллин + Тазобактам, Тикарциллин, Амоксициллин-Клавуланат и др.).
Карбапенемы используются для лечения тяжелых нозокомиальных пневмоний и других инфекций верхних дыхательных путей; инфекций органов малого таза, гинекологических, абдоминальных, мочеполовых инфекций; кожи и мягких тканей; сепсиса. Однако, препараты этой группы могут вызывать побочные реакции в виде крапивницы, сыпи, диспепсических расстройств, поражения печени и почек, дисбактериоза.
При выявлении метициллинрезистентных штаммов золотистого стафилококка, являющегося частым возбудителем внутрибольничных резистентных стафилококковых инфекций для лечения, используются гликопептидные антибиотики (Ванкадицин, Тейкопланин-Тева, Ликованум, Таргоцид и др.), которые высокоактивны по отношению к грамположительным аэробным/анаэробным инфекционным агентам — стафилококкам, стрептококкам, пневмококкам, энтерококкам, клостридиям, листериям, коринебактериям и другим. Показаниями к назначению являются тяжелые инфекции, вызванные энтерококками, инфекционный эндокардит, ассоциированный с зеленящими стрептококками, менингит и пневмонии, вызванные пневмококком, катетер-ассоциированный сепсис, перитонит, антибиотик-ассоциированная диарея и других инфекций, угрожающих жизни. В ряде случае гликопептидные антибиотики сочетаются с цефалоспоринами 3 поколения (Цефтибутен, Цефиксим, Цефотаксим, Цефоперазон, Цефтазидим и др.) или фторхинолонами (Офлоксацин, Ципрофлоксацин, Пефлоксацин, Норфлоксацин, Левофлоксацин и другие).
Необходимо отметить, что спектр возбудителей внутригоспитальных осложнений, а также их антибиотикорезистентность существенно различаются в отделениях различного профиля, поэтому при выборе антибиотика следует ориентироваться на чувствительность выделенной микрофлоры к ним, в также учитывать эпидемиологическую ситуацию в каждом конкретном лечебном учреждении.
Кроме антибиотикотерапии назначается специфическое лечение при той или иной конкретной нозологической форме ВБИ с учетом клинических проявлений, тяжести течения, риска развития осложнений. В индивидуальном порядке проводится симптоматическое лечение. В качестве дополнительной терапии назначают иммуностимуляторы: интерферон; бактериофаги, витаминно- минеральные комплексы.
В настоящее время для борьбы с тяжелыми проявлениями ВБИ разработана стратегия деэскалационной терапии, базирующаяся на нескольких принципах:
- Безотлагательное начало проведения антибактериальной терапии.
- Выбор антимикробных препаратов (АМП) с учетом чувствительности микроорганизмов и способности проникать в ткани, при отсутствии таких данных — использование антибиотиков широкого спектра действия.
- Назначение высоких доз антибиотиков, подбираемых индивидуально.
Эта стратегия предполагает безотлагательное назначение стартового антибиотика широкого спектра действия (комбинации антибиотиков) с целью максимально полного охвата спектра вероятных возбудителей с последующим переходом на антибиотик, к которому отсутствует устойчивость согласно данным микробиологического исследования. Именно своевременная и адекватная антимикробная терапия является ключевым условием и благоприятным прогностическим фактором, увеличивающей вероятность благоприятного исхода заболевания.
Читайте также:
- Слизь в шейке матки не пропускает инфекции
- Борьба с инфекцией крови
- Инфекция герпес все 8 типы
- Диагностика инфекционных заболеваний пособие
- Условия аэрозольного механизма передачи при менингококковой инфекции
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.

