Вакцина против аденовирусной инфекции крс


Здоровье животных -
залог Вашей прибыли
- Вирусная диарея
- Инфекционный ринотрахеит /
инфекционный пустулезный вульвовагинит - Парагрипп-3
- Респираторно-синцитиальная инфекция
- Ротавирусная инфекция
- Аденовирусная инфекция
- Коронавирусная инфекция
- Пастереллёз
- Эшерихиоз
Вирусная диарея крупного рогатого скота (болезнь слизистых оболочек, мукозальная болезнь, инфекционная диарея крупного рогатого скота, инфекционный энтерит крупного рогатого скота, диарея новорожденных телят) — контагиозная болезнь преимущественно молодых животных, характеризующаяся эрозивно-язвенным воспалением слизистых оболочек пищеварительного тракта.

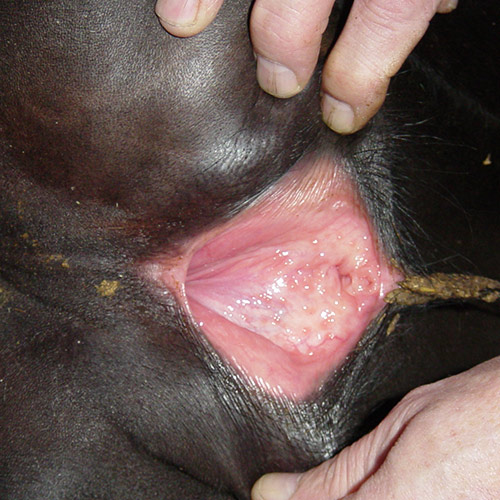
Острое контагиозное вирусное заболевание, характеризующаяся лихорадкой, катарально-некротическим воспалением слизистых оболочек верхних дыхательных путей, поражением глаз, половых органов (с признаками пустулёзного вульвовагинита), ЦНС, абортами.

Парагрипп-3 (лат. — Paragrippus bovum; англ. — Parainfluenza-3-virus; транспортная лихорадка крупного рогатого скота, параинфлюэнца-3) — остро протекающая контагиозная болезнь, главным образом телят, характеризующаяся лихорадкой, катаральным воспалением верхних дыхательных путей, а в тяжелых случаях поражением легких.
Контагиозная, остро протекающая болезнь, характеризующаяся лихорадкой, преимущественным поражением органов дыхания, потерей аппетита.
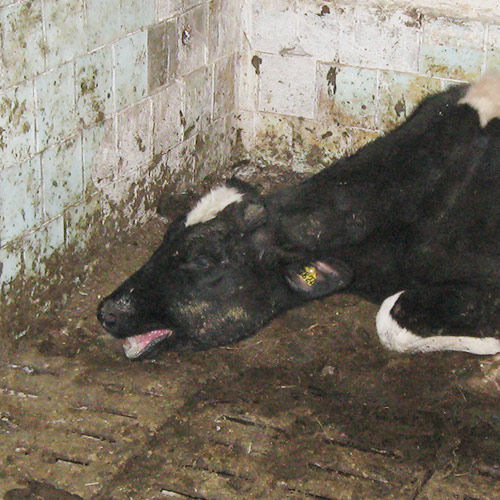
Остро протекающая, высококонтагиозная болезнь новорожденных телят, характеризующаяся профузным поносом, дегидратацией организма, развитием катарального или катарально-геморрагического гастроэнтерита и высокой летальностью.
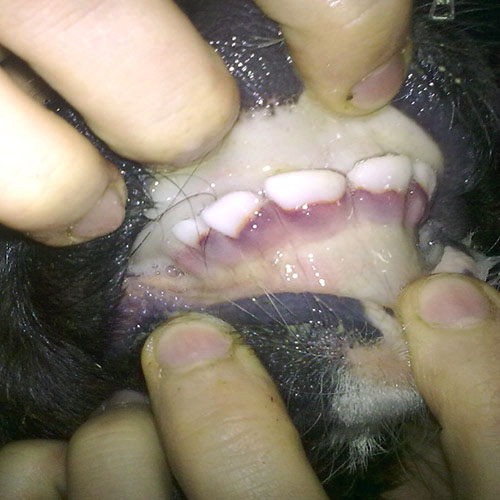
Остро протекающее заболевание молодняка сельскохозяйственных животных, характеризующееся поражением органов дыхания, пищеварения, лимфоидной ткани, конъюнктивитами. Крупный рогатый скот часто является носителем латентных аденовирусов, вызывающих бессимптомные инфекции.
Остропротекающая болезнь новорожденных телят, характеризующаяся профузным поносом, иногда со слизью и кровью в каловых массах, дегидратацией организма, депрессией и истощением.
Болезнь регистрируется у телят 7-18-дневного возраста, но чаще всего коронавирусный энтерит возникает у животных 8-14-дневного возраста. К заболеванию более предрасположены телочки (37,9%), чем бычки (23,8%). Порода скота и способ ведения животноводства не оказывают значительного влияния на частоту случаев болезни.
контагиозная инфекционная болезнь животных многих видов, характеризующаяся при остром течении септическими явлениями, крупозным воспалением легких, плевритом, отеками в различных областях тела, а при подостром и хроническом течениях гнойно-некротизирующей пневмонией, поражением глаз, суставов, молочной железы и геморрагическим энтеритом.
Острое инфекционное заболевание с фекально-оральным механизмом передачи; характерно преимущественное поражение ЖКТ с развитием энтерита или энтероколита, в редких случаях - генерализованных форм с внекишечными проявлениями.
| Вирус | Таксономия | Тип НК | ГА св-ва | Основные пути передачи | Восприимчивые животные (резервуар) | Основные клинические формы и признаки | Внутриутробная инфекция |
|---|---|---|---|---|---|---|---|
| ИРТ/ИПВ | Сем. Herpesviridae, подсем. Alphaherpesvirinae, род Varicellovirus | ДНК | - Воздушно-капельно - Перорально - Со спермой - Трансплацентарно | КРС, козы, овцы, буйволы, верблюды, ламы, свиньи | - Ринит, бронхопневмония - Пустулезный вульвовагинит/ баланопостит, эндометрит - Конъюнктивит - Латентная/персистентная инфекция (вследствие инфицирования вирулентным штаммом или вакцинации живым вирусом) | Аборт плода в любой период стельности, чаще в последний триместр. Телята, инфицированные в поздние сроки стельности, рождаются мертвыми или погибают в первые дни жизни с признаками септицемии. | |
| ВД | Сем. Flaviviridae, род Pestivirus | РНК | - Воздушно-капельно - Перорально - Со спермой - Трансплацентарно - Контактно через предметы ухода) | КРС, буйволы, олени, косули | - Диарея - Ринит, бронхопневмония - Болезнь слизистых (вследствие суперинфицирования персистентно инфицированных животных): изъязвление и некроз слизистых, диарея, гибель - Персистентная инфекция | На 1-80 сут. стельности: аборты, мумификация, рассасывание плода На 80-125 сут. стельности: при инфицировании нецитопатогенным штаммом - рождение персистентно-инфицированных животных, цитопатогенным – патология развития или гибель плода После 125 сут. стельности: рождение клинически здоровых телят, наличие антител в сыворотке крови. | |
| ПГ-3 | Сем. Paramyxoviridae, подсем. Paramyxovirinae, род Respirovirus | РНК | - Воздушно-капельно - Перорально - Со спермой - Трансплацентарно | КРС, буйволы, лошади, овцы, козы, верблюды, собаки, крысы | - Ринит, бронхопневмония - Конъюнктивит | Аборты Рождение нежизнеспособных телят | |
| РС | Сем. Paramyxoviridae, подсем. Pneumovirinae, род Pneumovirus | РНК | - Воздушно-капельно - Со спермой - Трансплацентарно | КРС, овцы, козы | - Ринит, бронхопневмония | Аборты | |
| РВ | Сем. Reoviridae, род Rotavirus | РНК | - Перорально - Контактно | КРС, свиньи, овцы, лошади, кошки, собаки, дикие жвачные | - Диарея разной степени тяжести | ||
| КВ | Сем. Coronaviridae, род Betacoronavirus | РНК | - Перорально - Воздушно-капельно - Контактно | КРС, буйволы | - Острая диарея | ||
| АВ | Сем. Adenoviridae род Mastadenovirus | ДНК | - Перорально - Воздушно-капельно - Через конъюнктиву | КРС, чаще телята от 2 мес. до 4 мес. | - Пневмония, энтерит, конъюктивит |

КОМБОВАК-A
Вакцина инактивированная комбинированная против инфекционного ринотрахеита, парагриппа-3, вирусной диареи, респираторно-синцитиальной, рота-, коронавирусной болезней и аденовирусной инфекции крупного рогатого скота

КОМБОВАК
Вакцина инактивированная комбинированная против инфекционного ринотрахеита, парагриппа-3, вирусной диареи, респираторно- синцитиальной, рота- и коронавирусной болезней телят

КОМБОВАК-Р
Вакцина инактивированная комбинированная против инфекционного ринотрахеита, парагриппа-3, респираторно- синцитиальной болезни, вирусной диареи и пастереллеза телят

КОМБОВАК-К
Вакцина инактивированная комбинированная против вирусной диареи, рота-, коронавирусной болезней и эшерихиоза телят
| Антиген | Комбовак | Комбовак-Р | Комбовак-К | Комбовак-А |
|---|
| ИРТ / ИПВ |
| ВД |
| ПГ-3 |
| РС |
| РВ |
| КВ |
| АВ |
| Pasteurella multocida (серовары A, B, D) |
| Mannheimia haemolytica |
| E. coli (протективные антигены эшерихий, термостабильные и термолабильные энтеротоксины) |
- Высоко эффективны
- Полностью безопасны
- Можно применять племенным животным
- Безопасны для стельных
животных - Стабильны при хранении
- Колостральные антитела у телят
не снижают эффективность вакцинации - Изготовлены с использованием
современных адьювантов - Исключена реактивация латентных
вирусов и отсутствует иммуносупрессия
Вакцины КОМБОВАК и КОМБОВАК-А применяют по эпизоотическим показаниям для иммунизации взрослых животных и телят в хозяйствах, неблагополучных по респираторным и желудочно-кишечным,
а вакцину КОМБОВАК-Р преимущественно по респираторным болезням крупного рогатого скота.
Вакцинируют клинически здоровых животных.
В зависимости от принятой в хозяйстве технологии можно использовать наиболее удобную для предприятия схему вакцинации взрослого поголовья.
Коров и телок случного возраста прививают дважды: за 4 и 1 неделю до осеменения, а затем ревакцинируют перед отелом дважды:
- первый раз – за 50-60 суток до отела,
- второй раз – через 14-21 суток (не позднее 30 суток до отела.
Все поголовье животных старше года прививают каждые 6 месяцев двукратно с интервалом 14-21 суток.
Не рекомендуется вакцинировать животных за 3 недели до и после отела.
Независимо от применяемой схемы вакцинации взрослого поголовья телят вакцинируют в возрасте 7-10 суток и старше дважды с интервалом 20-25 суток.
Ревакцинацию проводят однократно в той же дозе в возрасте 6 месяцев.
Вакцину вводят в область шеи.
Вакцину КОМБОВАК-К применяют для иммунизации стельных коров и нетелей в хозяйствах, неблагополучных по желудочно-кишечным болезням новорожденных телят, с целью создания колострального иммунитета. Вакцинируют клинически здоровых животных.
Вакцину вводят в область шеи внутримышечно в дозе 3 см 3 .
Животных вакцинируют дважды: первый раз - за 40-50 суток до отела,
второй раз - через три недели после первой иммунизации.
- Применение вакцин
- Схема №1
- Схема №2
- Вакцинация телят
- Применение КОМБОВАК-К
Производственные испытания по оценке эффективности применения вакцины КОМБОВАК-А проводили в условиях хозяйства неблагополучного по основным вирусным заболеваниям телят, где было вакцинировано 376 стельных коров и 370 телят, полученных от вакцинированных животных, в качестве контроля использовали невакцинированных стельных коров (n=243) и телят (n=238), которых содержали в другом помещении.
Таким образом, применение вакцины КОМБОВАК-А в условиях неблагополучного хозяйства позволило снизить заболеваемость телят в 3 раза, а сохранность поголовья повысить в 3,1 раза, по сравнению с контрольной группой невакцинированных животных.

Вакцина против клостридиозов сельскохозяйственных животных инактивированная
Лекарственная форма: суспензия для инъекций

Бовилис Бовипаст RSP (Bovilis Bovipast RSP) – инактивированная вакцина против парагриппа-3, респираторно-синцитиальной инфекции и пастереллеза крупного рогатого скота. Лекарственная форма: суспензия для инъекций.

Вакцина для спецефической профилактики от инфекционного ринотрахеита (ИРТ)
БОВИЛИС IBR МАРКИРОВАННАЯ ЖИВАЯ С РАСТВОРИТЕЛЕМ УНИСОЛВ

Вакцина против инфекционного ринотрахеита, парагриппа-3, вирусной диареи, респираторно-синцитиальной, рота- и коронавирусной болезни телят




Вакцина ЛТФ-130 для профилактики и терапии трихофитоза крупного рогатого скота



Вакцина против инфекционного ринотрахеита и парагриппа-3 телят

Вакцина против парагриппа-3, инфекционного ринотрахеита и вирусной диареи КРС эмульсионная инактивированная (ИРТ+ПГ+ВД)

Вакцина против колибактериоза телят

Вакцина против лептоспироза животных
Прозрачная бесцветная жидкость с серо-белым осадком, легко разбивающимся в гомогенную взвесь при встряхивании, образуя медленно оседающую взвесь. В состав препарата входят штаммы Leptospira серогрупп Помона, Тарассови, Гриппотифоза, Сейро.

ВАКЦИНА ЭМУЛЬГИРОВАННАЯ ПРОТИВ ПАСТЕРЕЛЛЕЗА КРУПНОГО РОГАТОГО СКОТА, БУЙВОЛОВ И ОВЕЦ

Вакцина против сальмонеллеза телят

Вакцина против ротавирусной, коронавирусной инфекций и эшерихиоза крупного рогатого скота инактивированная эмульгированная

Вакцина инактивированная против мастита коров/.
Эмульсия для инъекций желтовато-белого цвета, однородная.

Вакцина против ринотрахеита, парагриппа-3, вирусной диареи, респираторно-синтициальной инфекции крпного рогатого скота

Вакцина против клостридиозов крупного рогатого скота и овец поливалентная инактивированная

Вакцина против листериоза сельскохозяйственных животных из штамма "АУФ" живая сухая
Лекарственная форма: лиофилизат для приготовления суспензии для инъекций

Вакцина предназначена для специфической профилактики пастереллеза крупного рогатого скота в неблагополучных и угрожаемых по респираторной патологии скотоводческих хозяйствах.
По внешнему виду вакцина представляет собой однородную эмульсию от белого до кремового цвета слегка вязкой консистенции.

Вакцина против пастереллеза жвачных животных инактивированная эмульгированная.
Лекарственная форма: эмульсия для инъекций

Сыворотка против пастереллеза крупного рогатого скота, овец и свиней

Профилактика и лечения эшерихоза молодняка

Шемелькова Г.О., Верховская А.Е., Соболева Г.Л.
ООО "Ветбиохим", г. Москва
Шемельков Е.В., Иванов Е.В., Непоклонова И.В.
АНО "Научно-исследовательский институт диагностики и
профилактики болезней человека и животных", г. Москва
Алипер Т.И. "НПО НАРВАК",
"ФГБУ НИИ вирусологии им. Д.И. Ивановского" МЗ РФ, г. Москва
Аденовирус крупного рогатого скота широко распространен среди поголовья и часто, в сочетании с другими вирусными агентами (вирусы инфекционного ринотрахеита, парагрип-па-3, вирусной диареи, респираторно-синцитиальным, рота- и коро-навирусами), является первопричиной возникновения и развития основных респираторных и кишечных инфекционных заболеваний телят, которые, в дальнейшем, осложняются вторичными инфекциями бактериальной этиологии [2, 5, 7, 10].
Установлено, что аденовирусы являются иммунодепрес-сантами и способствуют развитию других инфекционных патологий. Из-за сходства с другими инфекционными заболеваниями вирусной этиологии клинико-эпизоотологическая диагностика аденовирусной инфекции крупного рогатого скота затруднена [4].
Ввиду частой полиэтиологичности первичных вирусных инфекций и невозможности разграничения ведущей роли того или иного агента в развитии патологии, наиболее эффективным методом специфической профилактики таких заболеваний является применение комбинированных вакцин, содержащих антигены сразу всех или нескольких из указанных возбудителей [3, 7]. Вакцинации подвергают стельных коров для создания у новорожденного потомства пассивного колострального иммунитета, а также телят с 2-3-х недельного возраста для создания активного поствакцинального иммунитета [9].
В настоящее время имеется ряд поливалентных вакцин против двух, трех и более указанных респираторных и/или кишечных вирусных заболеваний телят, но отсутствуют зарегистрированные биопрепараты, предназначенные для специфической профилактики аденовирусной инфекции крупного рогатого скота. Однако, наряду с другими вирусными агентами, аденовирусы играют значительную роль в этиологии указанных заболеваний [1, 2, 8, 11].
В ранее проведенных исследованиях нам удалось выделить и идентифицировать методом секвенирования фрагмента генома аденовирус крупного рогатого скота I-го типа. Выделенный штамм аденовируса был адаптирован к перевиваемой культуре клеток и депонирован в государственной коллекции вирусов ФГБУ НИИ вирусологии им. Д.И. Ивановского МЗ РФ. В ходе проведенных исследований установили, что выделенный аденовирус обладает выраженными антигенными свойствами и пригоден для использования в составе инактивированных вакцин [6].
Целью настоящей работы была разработка комбинированной вакцины против аденовирусной инфекции, инфекционного ринотрахеита, парагриппа-3, вирусной диареи, респираторно-синци-тиальной, рота- и коронавирусной болезнях крупного рогатого скота, а также оценка эффективности ее применения в производственных условиях.
Материалы и методы. Для проведения серомониторинга использовали пробы сыворотки крови крупного рогатого скота, полученные из разных субъектов РФ, которые исследовали на наличие ви-руснейтрализующих антител к аденовирусу, вирусам инфекционного ринотрахеита, парагриппа-3, вирусной диареи, респираторно-синци-тиальному, рота- и коронавирусам крупного рогатого скота. Наличие специфических антител к возбудителям инфекционного ринотрахеита и респираторно-синцитиальной инфекции, так же определяли методом ИФА, с использованием соответствующих диагностических ИФА-наборов: "ИРТ-СЕРОТЕСТ" и "РСИ-СЕРОТЕСТ", производства ООО "Ветбиохим".
В качестве прототипа использовали инактивированную комбинированную вакцину "КОМБОВАК", производства ООО "Ветбиохим".
Экспериментальные образцы вакцины готовили из одной партии инактивированного аденовируса крупного рогатого скота I-го типа, штамм "Альфа" (выделен от 17-и суточного теленка) [6], а также инактивированных антигенов производственных штаммов вирусов инфекционного ринотрахеита, парагриппа-3, вирусной диареи, рес-пираторно-синцитиального, рота- и коронавирусов крупного рогатого скота.
При выборе адъюванта для вакцины провели исследования шести различных коммерческих и экспериментальных препаратов: ISA 50, ISA 71, ISA 206, ISA 773 (SEPPIC, Франция), адъювантный комплекс Акрум-С (комплекс высокомолекулярного синтетического полиэлектролита со смесью поверхностно-активных гликозидов), гель гидроокиси алюминия (ГОА). Соотношения антигенной части и адъюванта брали в пропорциях, рекомендованных производителем адъюванта или подбирали опытным путем.
В качестве лабораторной модели, для оценки безвредности использовали группы морских свинок и белых мышей (n = 5 и n = 10, соответственно, на каждый образец). Морским свинкам вакцину вводили внутримышечно в дозе 2,0 мл, белым мышам - подкожно в дозе 0,5 мл. За животными вели наблюдение в течение 15 суток.
Антигенную активность образцов на лабораторной модели, оценивали путем проведения однократной внутримышечной вакцинации группы морских свинок (n = 10, на каждый образец), сформированной по принципу аналогов в дозе 1,0 мл, с последующим исследованием сыворотки крови, полученной до и через 21 сутки после вакцинации, на наличие специфических антител в реакции нейтрализации (РН).
Безвредность и антигенную активность изготовленных образцов в опыте на естественно восприимчивых животных оценивали путем проведения двукратной внутримышечной иммунизации коров за 1-2 месяца до осеменения (n=30 на каждый образец вакцины), сформированных в соответствующие группы по принципу аналогов, в дозе 3,0 мл. Кровь брали выборочно по 10 голов из каждой группы перед вакцинацией (Д0) и через 21 сутки после первой (Д21) и второй иммунизаций (Д42), с последующим исследованием сыворотки крови по уровню специфических антител в РН.
Для определения оптимальной иммунизирующей дозы вакцины использовали три группы коров за 1-2 месяца до осеменения (n = 15 в каждой группе), которых иммунизировали внутримышечно двукратно с интервалом 21 сутки в дозах 2,0 мл (первую группу), 3,0 мл (вторую группу) и 4,0 мл (третью группу). А также две группы телят в возрасте 2,5-3 месяца (n = 15 в каждой группе), которых иммунизировали двукратно внутримышечно в дозах 1,0 мл (первую группу) и 2,0 мл (вторую группу). Кровь у животных брали перед вакцинацией (Д0) и через 21 сутки после второй иммунизаций (Д42), с последующим исследованием сыворотки крови по уровню специфических антител в РН. В качестве контроля использовали группы невакцинированных животных (по 10 голов коров и телят).
Постановку и учет результатов РН осуществляли по стандартным методикам с использованием соответствующих контрольных штаммов вирусов.
Оценку эффективности применения вакцины в производственных условиях проводили в животноводческом хозяйстве, неблагополучном по респираторным и кишечным инфекционным заболеваниям телят. В хозяйстве вакцинировали стельных коров - дважды: первый раз - за 50-60 суток до отела, второй - через 14-21 сутки в дозе 3,0 мл. Полученных телят первый раз вакцинировали в возрасте 25-30 суток, повторно через 20-25 суток в дозе 2,0 мл. В качестве контроля использовали группы невакцинированных стельных коров и телят, которые содержались в другом помещении. Эффективность применения вакцины определяли по эпизоотологическим показателям: заболеваемость телят респираторными и кишечными инфекциями, смертность телят, а также их вынужденная выбраковка в опытной и контрольной группах.
Статистическую обработку данных выполняли общепринятыми методами (компьютерные программы Microsoft Excel 2010, Stat Plus 2005).
Результаты исследований. На первом этапе работы (20102012 г.) мы провели исследование 869 проб сыворотки крови коров и телят, полученных от невакцинированных животных, из 12 неблагополучных по основным респираторным и кишечным инфекционным заболеваниям хозяйств Вологодской, Воронежской, Калужской, Московской, Тамбовской областей, Алтайского и Краснодарского краев, Республики Башкирия. В ходе проведенного серомониторинга было выявлено наличие специфических антител к возбудителям: аденовирусной инфекции (АВ) в 24% исследуемых проб, инфекционного ринотрахеита (ИРТ) - в 47%, парагриппа-3 (ПГ-3) - в 85%, вирусной диареи (ВД) - в 86%, респираторно-синцитиальной болезни (РС) - в 62%, ротавирусной болезни (РВ) - в 89%, коронавирусной болезни (КВ) - в 87% исследуемых проб (рисунок 1).
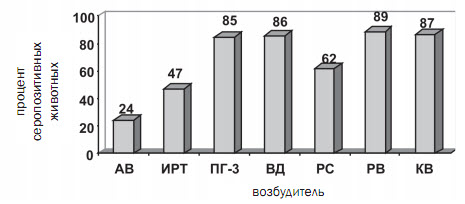
Рис. 1. Количество положительных проб сыворотки крови крупного рогатого скота
к соответствующему вирусу (в процентах от общего числа исследованных)
Результаты проведенных исследований свидетельствуют о широком распространении аденовирусной инфекции крупного рогатого скота в животноводческих хозяйствах, при этом, в подавляющем большинстве случаев, она встречается в сочетании с другими вирусными заболеваниями. Таким образом, аденовирус крупного рогатого скота играет существенную роль в этиологии основных вирусных заболеваний телят. Полученные результаты согласуются с данными других ученых, показывающими широкое распространение вирусных инфекций, в том числе и аденовирусной, среди поголовья крупного рогатого скота [1, 2, 5].
Кроме того, при проведении серологических исследований, установлена корреляция результатов по выявлению антител к вирусам ИРТ и РС, полученных в РН и ИФА.
На основании проведенных исследований, с учетом имеющихся литературных данных, мы пришли к заключению о целесообразности создания комбинированной вакцины против основных респираторных и кишечных вирусных заболеваний телят, включающей в себя аденовирус крупного рогатого скота.
Поскольку, по сравнению с прототипной вакциной "КОМБОВАК", в новой вакцине увеличивается количество вирусных антигенов и, следовательно, снижается объемная доля каждого отдельного антигена, то для нее требуется более иммунологически эффективный адъювант, способный обеспечить выраженный иммунный ответ на каждый антиген.
В ходе данной работы исследовали шесть адъювантов, с которыми изготовили экспериментальные образцы вакцины. Оценку изготовленных образцов проводили по показателям безвредности и антигенной активности в опытах на лабораторных и естественно восприимчивых животных.
Изучение безвредности показало, что экспериментальные образцы вакцины не вызывали заболевания или гибели подопытных животных, при этом у отдельных особей наблюдали образование плотных ограниченных припухлостей на месте введения образцов с масляными адъювантами.
В опытах на лабораторных и естественно восприимчивых животных установлено, что введение экспериментальных образцов вакцины вызывало развитие выраженного иммунного ответа (Р Таблица 1. Сравнительная оценка антигенной активности вакцины с разными адъювантами в опыте на лабораторных животных
Похожие темы научных работ по ветеринарным наукам , автор научной работы — Белоусова Р. В., Вазир Ясер, Третьякова И. В., Калмыкова М. С., Ярыгина Е. И.
Современная биологическая химия достигла больших успехов в изучении химического состава живых организмов и молекулярных механизмов процессов жизнедеятельности, служит научной базой в решении многих важных проблем в биолога и, медицине, ветеринарии, дает специалистам новые возможности активного воздействия на биологические процессы. Интеграция учебного процесса, фундаментальных и прикладных научных исследований, творческого методического обеспечения образовательных программ - современное перспективное направление в подготовке высококвалифицированных кадров: бакалавров, специалистов, магистров.
1. Афонский С.И. Современное состояние проблемы комплексных соединений в биохимии II В кн.: Биокомплексы и их значение. — М.: Колос, 1965.
2. Василевич Ф.И.. Коробов А.В., Рогожина Л.В., Зайцев С.Ю., Фролова Л.А. Профессор А.Г. Малахов и его творческий путь в науке и высшем образовании// Вопросы физико-химической биологии в ветеринарии: Сб. науч. тр. - М.: ФГОУ ВПО МГАВМиБ им. К.И. Скрябина, 2004—2005.
3. Джафаров М.Х., Зайцев С.Ю., Максимов В.И. Стероиды. Строение, получение, свойства, биологическое значение, применение в медицине и ветеринарии. — СПб.: Лань, 2009.
4. Достижения супрамопекулярной химии и биохимии в ветеринарии и зоотехнии. Труды международной научно-практической конференции (22—25 сентября 2008 г., Москва). Выпуск 1,2, — М.: ФГОУ ВПО МГАВМиБ им. К.И. Скрябина, 2008.
5. Зайцев С.Ю., Царькова М.С., Варламова Е.А., Бондаренко В.В., Тимо-нин А.Н., Лобова Н.А., Ведерников А.И., Громов С.П., Алфимов М.В. Хемо-сенсорные оптоматериалы для определения диаминов на основе хромоген-ного краун-эфира, иммобилизованного в полимерные пленки // Известия вузов. Химия и химическая технология, 2009: 52 (3): 65—69.
6. Зайцев С.Ю. Супрамолекулярные системы на границе раздела фаз как модели биомембран и наноматериалы (научная монография). — Москва; Донецк: Норд Компьютер. 2006.
7. Зайцев С.Ю., Тульская Е.В., Каштиго Т.В., Царькова М.С., Коршикова А.В. Способ получения иммобилизованной липазы // Патент РФ № 2301831 от 27.06.2007 г.
8. Кармолиев Р.Х. Свободнорадикальная патология в этиопатогенезе болезней животных // Ветеринария, 2005; 4: 42—47.
9. Кондрахин И.П., Архипов А.В., Левченко В.И., Таланов Г.А., Фролова Л.А., Новиков В.Э. Методы ветеринарной клинической лабораторной диагностики. — М.: КолосС, 2004.
10. Малахов А.Г. С.И. Афонский и его учение о биохимических комплексных соединениях и их значении в обмене веществ / Вопросы физико-химической биологии в ветеринарии: Сб. науч. тр. — МГАВМиБ им. К.И. Скрябина, 1997.
11. Sungurov Yu.V., EremeevN.L., Lebedev А.Т., Maloshitskaya O.A., Rudens-kayaG.N., Semenova S.A., ShmoylovA.M. Mass spectrometry approach for determination of collagenase specificity, Chapter XVIII. In: Research Progress in Biotechnology, G.E.Zaikov (Ed.), Nova Science Publishers Inc., New-York, 200.
F. I. Vasilevitch, S. Yu. Zaitsev, L. A. Frolova, R. Kh. Karmoliyev, M. Kh. Dzhafarov, M. S. Tsarkova, N. L. Yeremeyev. Importance of the scientific-educational complex for training specialists at the department of organic and biological chemistry named after professors S. I. Afonskii and A. G. Malakhov. In the article there is some information about history of the department, its education and research activities today.
удк 619:615.371 Антигенные свойства ассоциированной
инактивированной вакцины против аденовирусной инфекции и вирусной диареи крупного рогатого скота
Р.В. Белоусова \ В. Ясер 2, И.В. Третьякова3, М.С. Калмыкова \ Е.И. Ярыгина5
1 Доктор ветеринарных наук, профессор. 4 Кандидат ветеринарных наук.
2 Кандидат ветеринарных наук. 5 Доктор биологических наук, Кандидат биологических наук, доцент. старший научный сотрудник.
Сокращения: АВ — аденовирус, ВД—вирус диареи, ГМФ-№ — гексаметафосфат натрия, ЖКТ — желудочно-кишечный тракт, КРС — крупный рогатый скот, КСТ — перевиваемая культура коронарных сосудов теленка, ПЭГ-6000— полиэтиленгликоль с молекулярной массой 6000 дальтон, РДП — реакция диффузионной преципитации, РН — реакция нейтрализации, РИГА — реакция непрямой гемагтлютинации, Т-1 — перевиваемая культура клеток почки теленка, ЦТД — цитотоксическая доза
Аденовирусная инфекция и вирусная диарея КРС широко распространены в нашей стране и за рубежом [10]. Их возбудители занимают ведущее место в патологии респираторного тракта и ЖКТ новорожденных телят. По данным отчетности ветеринарных лабораторий РФ за 7 лет, при диарее от телят в большинстве случаев выделяют АВ и ВД.
Экономический ущерб при этих заболеваниях складывается из падежа молодняка, снижения мясной и молочной продуктивности, выбраковки животных, ущерба, приносимого абортами, бесплодием
и т.д. Терапия малоэффективна. В комплексе противоэпизоотичес-ких мероприятий ведущее место занимает специфическая профилактика [1]. Чаще всего скот прививают моновакцинами [2], хотя особенности циркуляции этих вирусов дают основания предполагать большую эффективность ассоциированных вакцин [5]. Однако конструирование вакцин из нескольких антигенов — сложная задача. Каждый компонент в ней должен сохранять свои нативные антигенные свойства и обеспечивать стойкий протективный эффект [3, 8].
В последние годы в связи с экологическим неблагополучием и возрастающей нагрузкой на организм животных актуальным стало применение иммуномодуляторов [6, 7, 9]. Высказывалось предположение, что введение иммуномодуляторов с ассоциированной вакциной повысит эффективность последней [4, 5].
Цель наших исследований состояла в разработке ассоциированной инактивированной концентрированной вакцины против аденовирусной инфекции и вирусной диареи КРС, а также оценке ее эффективности, в т.ч. при комбинированном применении с иммуномодуляторами.
Материалы и методы
В работе использовали АВ, штамм Во\ т-10 и ВД, штамм Опдоп с инфекционными титрами 106-25 ЦТД^/мл и 107,75 ЦТД^/мл соответственно. Культуры клеток Т-1 и КСТ заражали этими вирусами в дозах 0,1 и 0,03 ЦТД50/клетку соответственно и титровали по общепринятым методикам.
Для концентрирования вирусов использовали ПЭГ-6000 и ГМФ-№. Вирусные антигены инактивировали 40%-м раствором формалина. В качестве адъюванта использовали гадро-окись алюминия. Полноту инактивации вирусов оценивали посредством трех слепых пассажей в культуре клеток. Экспериментальные образцы биопрепаратов проверяли на стерильность п безвредность по общепринятым методикам.
Антигенную активность вакцин тестировали на белых крысах и телятах. Титр антител определяли в РН, РНГА, РДП.
В работе использовали иммуномодуляторы фоспренил (0,4%-й раствор) и гликопин (0,2%-й раствор).
Чрез 72 ч после заражения культуры клеток Т-1 в дозе 0,1 ЦТДл/клетку инфекционный титр АВ достигал 10625 ЦТД
/мл. Титр ВД в культуре клеток КСТ при заражающей дозе
0.03 ТЦД50/клетку в течение 48 ч повышался до 107 75 ЦТД^/мл.
При концентрировании вирусных антигенов осаждением и изофокусированием установили, что оптимальная конечная концентрация ПЭГ-6000 для АВ составила 10% и для ВД — 8 %. При этих концентрациях потеря инфекционной активности была минимальной и достигала 10,09% и 10,87 % соответственно. Очистка от балластных белков была максимальной — 73,26 % и 85,49 % соответственно. При концентрировании вирусов изофокусированием с помощью ГМФ-Ыа установили, что оптимальными значениями рН для АВ п ВД были 4,5 и 4,0 соответственно (при таких уровнях рН потеря инфекционности составляла 20,57 и 20,57 %, а степень очистки — 69.76 и 82,85 % соответственно).
Исследование остаточной инфекционной активности вирусов показало, что формалин в концентрации 0,2 % и 0,3 % полностью инактивирует вирусы: в культурах клеток, в которые инокулировали обработанный им вируссодержащий материал, на протяжении трех пассажей не наблюдали цитопа-тических изменений.
При сравнении антигенной активности экспериментальных серий моновалентных (как культуральных, так и концентрированных) вакцин отметили, что разница в титре антител при концентрации формалина 0,2 и 0,3 % не была дос-
1. Титр антител в сыворотке крови крыс к АВ и ВД
товерной. Это позволило предположить, что концентрация формалина в вакцине практически не влияла на уровень антител к обоим вирусам. Поэтому в дальнейшем для приготовления вакцинных препаратов использовали наименьшую из тестированных концентраций формалина (0,2 %).
Исходя из данных о том, что эффективным адъювантом для одноименных моновакцин является гидроокись алюминия, его использовали в оптимальной концентрации 1,3%. На первом этапе изготовили 6 серий моновакцин. Из них 2 были вакцины с нативными культуральными вирусами, а 4 -препараты с соответствующими антигенами, сконцентрированными разными способами в 5 раз.
Антигенную активность экспериментальных серий вакцин проверили на 75 крысах (по 5 животных в каждой группе). Им вводили культуральные вакцины в дозе 1.0 мл, а концентрированные — в дозах 0,1, 0,2 н 0,5 мл. Полученные результаты приведены в таблице 1.
Как видно из данных таблицы, культуральные вакцины, введенные в дозе 1.0 мл, и концентрированные моновакцины против обеих вирусных инфекций в дозах 0,1; 0,2 н 0,5 мл обладали высокой антигенной активностью.
При использовании концентрированной ПЭГ или ГМФ-Na вакцин в дозе 0,1 мл титр антител в РН был достаточно высоким (АВ - 9,07 и 9,17 log2; ВД - 8,07 и 7,92 log,) и при этом незначительно отличался от титра антител при иммунизации крыс в дозах 0.2 и 0,5 мл (р > 0.05). С учетом экономической эффективности оптимальной сочли наименьшую из испытанных доз — 0,1 мл. Антигенная активность этого типа вакцин не зависела от способа концентрирования вирусных антигенов. Однако, учитывая что ПЭГ-6000 применяют на биофабриках для очистки и концентрирования вирусов при производстве различных вакцин, а ГМФ-Na — для диагностических препаратов, для изготовления ассоциированной вакцины в дальнейшей работе использовали только ПЭГ-6000. Концентрированные им моновакцины из АВ и ВД смешивали в соотношении 1:1. Антигенную активность ассоциированных вакцин (культуральных и концентрированных) исследовали на 20 крысах (табл. 2).
Как видно из таблицы 2, при исследовании антигенной активности и определении оптимальной дозы ассоциированной вакцины разница в титре нейтрализующих антител к АВ и ВД в опытных группах была недостоверной по сравнению с контролем (группа 1) и не зависела от дозы.
При изучении влияния вакцин на клеточный иммунитет отметили, что количество Т- и В-лимфоцитов у крыс, приви-
Вакцина Доза, мл Титр антител, log,
Против аденовирусном инфекции КРС Культуральная 1,0 10,00 ±0,91 11,00 ±0,82 6,00 ± 0,00
Концентрированная ПЭГ-6000 0,1 0,2 0,5 9,07 ± 0,84 8,38 ± 1,03 8,26 ± 0,34 10,5 ± 1,0 9,75 ± 0,96 9,75 ± 0,5 3,75 ± 0,50 4,25 ± 0,50 4,25 ± 0,50
Концентрированная ГМФ-Ыа 0,1 0,2 0,5 9,17 ±0,58 9,01 ± 0,75 9,75 ± 0,24 10,67 ±0,58 10,33 ±0,58 11,00 ± 0,0 4,67 ± 0,58 4,33 ± 1,16 5,33 ± 0,58
Против вирусной диареи КРС Культуральная 1,0 8,82 ± 0,77 10,00 ±0,82 6,25 ± 0,50
Концентрированная ПЭГ-6000 0,1 0,2 0,5 8,07 ± 0,43 7,88 ± 0,71 8,14 ±0,77 9,25 ± 0,50 9,00 ± 0,82 9,25 ± 0,5 4,00 ± 0,82 4,50 ±1,00 5,25 ±1,26
Концентрированная ГМФ-Ыа 0,1 0,2 0,5 7,92 ± 0,51 7,33 ±1,04 8,41 ± 0,68 9,33 ± 0,58 8,67 ± 1,16 9,5 ± 0,58 4,33 ± 0,58 4,67 ± 0,58 5,75 ± 0,96
Плацебо 1,0 Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
РН РНГА РДП РН РНГА РДП
1-я ассоциированная культуральная вакцина по 2,0 мл 9,82 ± 10,25 ± 4,50 ± 0,69 0,50 0,58 9,13 ± 9,75 ± 5,50 ± 0,85 0,96 1,29
2-я ассоциированная концентрированная вакцина по 0,2 мл 8,68 ± 10,00 ± 3,75 ± 0,24 0,00 0,50 8,51 ± 9,75 ± 4,25 ± 1,34 0,98 0,5
3-я ассоциированная концентрированная вакцина по 0,4 мл 9,03 ± 10,25 ± 4,25 ± 0,17 0,50 0,50 8,22 ± 9,5 ± 4,75 ± 0,74 0,58 0,98
4-я плацебо по 1,0 мл 9,0 log., и удерживался на достаточно высоком уровне более 8 мес (срок наблюдения). Титр антител в РН коррелировал с результатами в РНГА и РДП.
Исследуемая ассоциированная вакцина сохраняла свою антигенную активность в течение двух лет (срок наблюдения) при температуре 4 "С.
При изучении влияния иммуномодуляторов фоспренн-ла и гликопина на гуморальные н клеточные факторы поствакцинального иммунитета установили, что при однократном введении с ассоциированной вакциной фоспрени-ла и гликопина (в дозах 0,2 мкг/кг и 0,12 мкг/кг соответ-
ственно) относительное количество Т- и В-лимфоцитов увеличивалось на 7,0 и 3,0 %, а титр нейтрализующих антител повышался на 2,0
В результате исследований разработана ассоциированная инактивированная концентрированная вакцина против инфекций АВ и ВД. В опытах на лабораторных животных и телятах препарат оказался безвредным и обладал выраженной антигенной активностью, которая сохранялась 14 мес (срок наблюдения). Сочетанное применение ассоциированной инактивированной вакцины с иммуномодуляторами обеспечивало повышение ее антигенной активности.
1. Бепоусова Р.В. Профилактика аденовирусной инфекции крупного рогатого скота. Информ. листок. Моск. обл. террит. центр науч.-тех. информации и пропаганды, 1988; №413—88.
2. Белоусова Р.В. Инактивированная вакцина против аденовирусной инфекции крупного рогатого скота // Вестник с.-х. науки, 1989; 8: 91—95.
3. Вазир Я., Третьякова И.В., Ярыгина Е.И. и др. Антигенные свойства экспериментальной ассоциированной вакцины против аденовирусной инфекции и вирусной диареи крупного рогатого скота // Ветеринария, 2008; 4: 23—26.
4. Вазир Я., Третьякова И.В., Устинова Г.И. и др. Влияние иммуномодуляторов на антигенную активность моновалентных вакцин против аденовирусной инфекции и вирусной диареи KPC // Материалы 3-й конференции по учебно-методической, воспитательной и научно-практической работе ФГОУ ВПО МГАВМиБ. 2006.
5. Вазир Я., Белоусова Р.В., Устинова Г.И. и др. Испытание бивалентной вакцины против аденовирусной инфекции и вирусной диареи крупного рогатого скота на кроликах с использованием иммуномодуляторов // Ветеринарная патология, 2007; 3 (22): 199—202.
6. ДееваА.В., РаковаТ.Н., Лобова Т.П.. Белоусова Р.В. Эффективность применения фоспренила для повышения неспецифической резистентности организма и лечения острых вирусных инфекций у молодняка KPC // Ветеринарная патология, 2005; 1: 96—98.
7. Деева А.В.. Белоусова Р.В. Применение фоспренила. Механизм повышения продуктивности, профилактического и терапевтического действия // Ветеринария, 2004; 2: 9—13.
8. Куликова И.Л., Дьяконов Л.П., Жидков С.А. Культура клеток сосудов сердца теленка и чувствительность этой культуры к вирусу диареи крупного рогатого скота // Цитология. 1992; 34(9): 75.
9. Ожерелков C.B. Роль естественных иммуномодулирующих факторов в патогенезе экспериментальных вирусных инфекций: дис. докт. биол. наук. —М., 2003.
10. Петрова О.Т., Татарчук А.Т., Сапожникова Н.Л. Острые респираторные вирусные инфекции KPC в Свердловской области (ИЭВ Сибири и Дальнего Востока) // Ветеринария, 2002; 2.
R.V. Belousova, V. Yaser, I.V. Tretyakova, M.S. Kalmykova, E.I. Yaryguina. Antigenic properties of associated inactivated vaccine against adenovirus infection and bovine viral diarrhea. Investigate a series of new experimental inactivated associated vaccine adenoviral infections and viral diarrhea in rats and calves. The results of serological studies have shown its high antigenic activity, which rises when its combined with immunomodulators.
удк 619 6153 Особенности накопления и
выведения йода при его поступлении в организм животных в виде неорганической
соли и в связанной с белком форме
Н.П. Лысенко JI.B. Рогожина 2
1 Заведующий кафедрой радиобиологии, доктор биологических наук, профессор.
2 Декан ветеринарно-биологического факультета, кандидат биологических наук, доцент.
Сокращения: Бк — беккерель, ЖКТ — желудочно-кишечный тракт
Йод — химический элемент, без которого организм не может нормально функционировать. Дефицит йода служит причиной многих заболеваний. Это обусловлено тем, что он входит в состав
тиреоидных гормонов, которые синтезируются в щитовидной железе. Гормональные нарушения, возникающие из-за дефицита йода, подчас не имеют ярко выраженных клинических признаков, и поэтому их трудно диагностировать [4].
Большой ущерб, который приносит йодная недостаточность, можно предотвратить, если в рацион животных включать подкормки, содержащие этот элемент. Назначение таких подкормок в молочном скотоводстве повышает надои на 10. 20 %, а содержа-
Читайте также:


