Свертывание крови защита от инфекций
Кровь не только снабжает ткани тела питательными веществами и обеспечивает удаление продуктов распада. Она также содержит компоненты иммунной системы организма.
Кровь представляет собой биологическую жидкость, которая выполняет защитную функцию. Она постоянно присутствует в сердечно-сосудистой системе и в любой момент готова реагировать на внедрение инфекции.
Костный мозг
Все клетки крови образуются в костном мозге - желеобразной субстанции, располагающейся внутри костей. Все типы кровяных клеток исходят от универсальной стволовой клетки, которая в дальнейшем дифференцируется на эритроциты, тромбоциты или белые кровяные клетки иммунной системы.
Клетки могут мигрировать в другие области, например в селезенку или тимус, где они трансформируются в иные типы клеток.
Лимфатическая система
Работе иммунной системы оказывает содействие лимфатическая система. Она обеспечивает циркуляцию в организме жидкой смеси, называемой лимфой. Важно то, что лимфатическая система обеспечивает транспорт белых кровяных клеток (лимфоцитов).
В капиллярах (самых мелких кровяных сосудах) под действием давления происходит выход жидкости и мелких молекул в межклеточное пространство. Это так называемая интерстициальная жидкость, которая омывает и питает ткани. Впоследствии она дренируется в лимфатическую систему, где циркулирует и в конечном итоге всасывается обратно в кровеносное русло. Дренирование этой жидкости отчасти происходит в результате сдавления сосудов окружающими мышцами.
Вирусы
В связи с чрезвычайно малыми размерами (около 0,00001 мм в диаметре) вирусы легко проникают в организм через дыхательный и желудочно-кишечный тракт. Кровь способна осуществлять борьбу с вирусами, доставляя антитела к пораженной области.
Одноклеточные паразиты
Бактерии и простейшие распознаются, поглощаются путем фагоцитоза и уничтожаются фагоцитами, образующимися из лейкоцитов.
Вторжение микробов приводит к выработке факторов, которые притягивают фагоциты к инфицированной области; затем микробы покрываются антителами и поглощаются.
Многоклеточные паразиты
Гельминты, или паразитирующие черви, более распространены в странах с теплым климатом. Кровь атакует их с помощью специальных клеток эозинофилов. Они названы так потому, что окрашиваются в красный цвет лабораторным красителем эозином.
Грибок
Грибки хорошо развиваются во влажной теплой среде, например между пальцев ног. Организм пытается бороться с ними с помощью иммунной реакции, доставляя антитела к месту поражения через кровь.
Компоненты иммунной защиты крови
Хотя некоторые инфекции могут победить защиту организма человека, различные составляющие крови успешно борются против большинства микробов.
Элементы крови, противодействующие инфекциям:
Фагоциты
Когда микробный агент попадает в организм, он сталкивается со специальными клетками крови - полиморфноядерными нейтрофилами и моноцитами. Их задачей является поглощение (фагоцитоз) микробных частиц и разрушение их в процессе внутриклеточного переваривания.
Фагоциты находятся не только в крови. Они выходят из кровяных сосудов в ткани, где готовятся к противодействию вторгшимся микробам. Из двух типов фагоцитов нейтрофилы имеют относительно короткий жизненный цикл, в то время как моноциты живут дольше и трансформируются в другие клетки - макрофаги. Макрофаги создают защитную зону воспаления вокруг микробов, ограничивая их распространение. Там где это возможно, макрофагоциты поглощают микробные тела.
Лимфоциты. Различают 3 типа лимфоцитов.
Т-лимфоциты. Эффективно борются с вирусами. Вирусологи классифицируют их на различные подгруппы (Т-хелперы, Т-супрес-соры и др). Они совместно действуют против микроорганизмов. В-лимфоциты. Участвуют в производстве антител, обладающих антимикробным действием.
Т-киллеры и NK-киллеры (натуральные киллеры). Часто способны распознавать человеческие клетки, в которые внедрился вирус, и уничтожать их.
Интерфероны.
Это химические вещества, продуцируемые инфицированными клетками и Т-лим-фоцитами. Интерфероны проходят через кровоток, активируя Ж-киллеры и обеспечивая противовирусную защиту.
Компоненты комплемента.
Включают около 20 белков.
На ранних стадиях иммунного ответа они работают совместно в борьбе с инфекцией, участвуя в развитии воспаления вокруг инфицированной области.
Белки острой фазы.
Это белки крови, обладающие способностью прикрепляться к определенной бактерии и нарушать ее жизнедеятельность на ранних стадиях заражения.
Эозинофилы.
Это специализированные белые кровяные клетки, играющие роль в борьбе с гельминтами. Они способны инактивировать некоторых паразитов, присоединяясь к ним и высвобождая токсические вещества.
Антитела
Антитела являются важными компонентами крови. Это сложные молекулы, называемые иммуноглобулинами, которые продуцируются в ответ на внедрение инфекции. Существуют различные типы иммуноглобулинов. ■ Иммуноглобулины класса G составляют примерно 3/4 иммуноглобулинов крови в норме.
Каждое млекопитающее обладает сложной системой защитных приспособлений, позволяющих ему отражать атаки болезнетворных агентов, удалять из организма чужеродные материалы. К защитным функциям крови можно отнести: свертывание крови, фагоцитоз и иммунные ответ на инфекцию.
При повреждении ткани из нее вытекает кровь, которая вскоре свертывается, образуя кровяной сгусток. Последний препятствует дальнейшей потере крови и проникновению в организм болезнетворных микроорганизмов. Очевидно, что этот процесс имеет большое значение для выживания животного. Не менее важно и то, что в неповрежденных сосудах кровь не свертывается. Чрезвычайная сложность многостадийного процесса свертывания крови служит одновременно для того, чтобы этот процесс не происходил тогда, когда в нем нет необходимости. Для его осуществления нужны по меньшей мере 12 различных факторов, действующих согласованным образом.
Кровь, вытекающая на поверхность раны, соприкасается с воздухом и смешивается с веществами, выделяющимися из поврежденных клеток и разрушенных тромбоцитов. Высвобождающийся из поврежденных тканей липопротеин тромбопластин вместе с факторами свертывания (ферменты плазмы) и ионами кальция катализирует превращение неактивного белка плазмы протомбина в тромбин. Тромбин - протеолитический фермент, он расщепляет крупную молекулу глобулярного белка плазмы фибриногена на более мелкие единицы - мономеры, которые затем полимеризуются и образуют сеть, состоящую из длинных перепутанных нитей фибрина - нерастворимого фибриллярного белка. После удаления фибриногена из плазмы остается жидкость, которая называется сывороткой. В сети, образованной волокнами фибрина, задерживаются форменные элементы крови и в результате образуется кровяной сгусток. Позднее он сжимается, подсыхает и образует струп, который препятствует дальнейшей потере крови и создает механический барьер для проникновения патогенных бактерий.
При такой сложности всего процесса отсутствие или низкая концентрация любого из незаменимых факторов свертывания крови могли бы вызвать чрезмерно сильное кровотечение. Такое состояние известно под названием гемофилия. В неповрежденных кровеносных сосудах кровь не свертывается, поскольку выстилка сосудов обладает очень гладкой поверхностью и не вызывает разрешения тромбоцитов или клеток крови. К тому же в крови имеются активные вещества, препятствующие свертыванию. Одно из таких веществ гепарин, присутствующий в небольшом количестве в плазме и выделяемый тучными клетками, находящимися в соединительной ткани и печени. Гепарин препятствует превращению фибриногена в фибрин и поэтому широко используется в клинике как антикоагулянт.
Если сгусток образуется внутри кровеносного сосуда , он называется тромбом, и его образование ведет к острому нарушению кровообращения - тромбозу. Тромбоз может произойти в результате повреждения эндотелия кровеносного сосуда, так как шероховатость поврежденного участка способствует разрушению тромбоцитов и таким образом запускает процесс свертывания крови. Особенно опасен и может привести к внезапной смерти коронарный тромбоз (тромбоз венечной артерии сердца).
Фагоцитоз осуществляют главным образом нейтрофилы. Это амебоидные клетки, мигрирующие в места повреждения клеток и тканей. Стимулами для их миграции служат какие-то вещества, освобождаемые разрушенными клетками крови и тканями. Нейтрофилы обладают способностью распознавать любые бактерии, проникшие в организм. Эту способность усиливают плазменные белки -опсонины, которые прикрепляются к поверхности бактерий и каким-то образом делают их легче узнаваемыми. Обнаружив бактерию, нейтрофил захватывает ее путем фагоцитоза, и в нем формируется фагосома. С фагосомой сливаются мелкие лизосомы, образуя фаголизосому. В фаголизосому из лизосом изливаются другие гидролитические ферменты, под действием которых бактерия переваривается. В конце концов растворимые продукты переваривания бактерий поглощаются окружающей цитоплазмой нейтрофила.
Нейтрофилы способны проходить через стенки кровеносных капилляров и передвигаться в межклеточных пространствах. В таких органах, как печень, селезенка и лимфатические узлы, имеются крупные неподвижные фагоциты -макрофаги. Роль макрофагов состоит в поглощении токсичных чужеродных частиц и микроорганизмов и длительном, а часто и постоянном их удерживании внутри себя. Таким путем нередко приостанавливается распространение инфекции. Вместе с нейтрофилами макрофаги образуют ритикулоэндотелиальную систему организма.
При ранении какого-либо участка тела возникает местная реакция окружающих тканей, которая проявляется в опухании и болезненности. Это состояние называется воспалением и связано с выделением из поврежденных тканей определенных веществ: гистамина и серотонина. Эти вещества вызывают местное расширение капилляров, в результате чего усиливается приток крови к поврежденному участку и повышается его температура. Возрастает также проницаемость капилляров, и в результате плазма выходит в окружающие ткани и вызывает их набухание отек. Плазма содержит бактерицидные факторы, антитела и нейтрофилы, которые все вместе противодействуют распространению инфекции. Кроме того, в плазме присутствует фибриноген, способствующий в случае необходимости свертыванию крови, а избыток тканевой жидкости снижает концентрацию и токсичность любых потенциально опасных раздражающих агентов.
К концу воспалительного процесса появляются клетки -фибробласты, которые секретируют коллаген. Это фибриллярный белок, который, соединяясь с полисахаридами, образует сеть из беспорядочно переплетающихся волокон рубцовой ткани. Для образования колллагена необходим витамин С, так как без него молекулы коллагена не достраиваются. Примерно через две недели после ранения беспорядочная масса волокон реорганизуется и собирается в пучки, расположенные вдоль линий натяжения в области раны. Здесь начинают также прорастать многочисленные мелкие кровеносные сосуды, которые снабжают кислородом и питательными веществами клетки, участвующие в заживлении раны. Одновременно к процессу заживления подключается и окружающий эпидермис. Отдельные клетки эпидермиса мигрируют в рану и поглощают остатки тканей и фибрин образовавшегося кровяного сгустка. Встречаясь друг с другом, эпидермальные клетки соединяются, образуя сплошной слой под струпом. Когда формирование этого слоя заканчивается, струп отпадает и открывается эпидермис.
Стадии процесса заживления
1. В поврежденном участке возникает кровотечение
2. Происходит свертывание крови
3. Начинается воспалительный процесс
4. В рану мигрируют лейкоциты, которые поглощают чужеродный материал, бактерий и остатки клеток.
5. В ране собираются фибробласты, синтезирующие коллаген, из которого формируется рубцовая ткань
6. Эпидермальные клетки поглощают последние остатки разрушенных клеток и начинают разрушать рубец.
7. Эпидермис образует в области раны новую кожу.
8. Струп слущивается.
Если рана небольшая, то для борьбы с инфекцией бывает достаточно одного лишь фагоцитоза, но при значительных размерах повреждения в действие вступает иммунная система организма.
ИММУННАЯ СИСТЕМА
Антитело - молекула, синтезируемая организмом животного в ответ на присутствие чужеродного вещества, к которому эта молекула обладает высоким сродством. Все антитела - белки, называемые иммуноглобулинами. В молекуле иммуноглобулина есть константные и вариабельные участки, последние действуют подобно ключу, который подходит к определенному замку. Каждый организм способен производить тысячи видов антител различной специфичности, которые могут распознавать всевозможные виды чужеродных веществ.
Чужеродное вещество, вызывающее образование антител, называют антигеном или иммуногеном. Обычно антиген представляет собой белковую или полисахаридную молекулу, находящуюся на поверхности микроорганизма или в свободном виде. У млекопитающих сформировались две системы иммунитета - клеточный и гуморальный.
Клеточный иммунитет.При воздействии с антигеном Т-лимфоциты, несущие на мембране рецепторы, способны распознавать этот антиген, затем начинают размножаться и образуют клон таких же Т-лимфоцитов. Клетки этого клона вступают в борьбу с несущими антиген микроорганизмами или вызывают отторжение чужеродной ткани.
Гуморальный иммунитет. В-лимфоциты распознают антиген таким же образом, как и Т-клетки, но реагируют по-другому. Размножаясь при стимуляции, они образуют клон плазматических клеток, которые синтезируют антитела и выделяют их в кровь или тканевую жидкость. Здесь антитела связываются с антигенами на поверхности бактерий и ускоряют их захват фагоцитами или присоединяются к бактериальным токсинам и нейтрализуют их.
Не нашли то, что искали? Воспользуйтесь поиском:
В организме обычного человека около 5-ти литров крови. В крови содержаться клетки, которые защищают нас от инфекций и доставляют к органам жизненно необходимые в-ва. Кровь- это поистине живая жидкость, без которой наша жизнь не представляется возможной.
Кровь содержит 4 основных компонентов:
· эритроциты – красные кровяные клетки, которые отвечают за доставку кислорода от наших легких к органам
· лейкоциты – белые кровяные клетки, защищают от инфекций
· тромбоциты –клетки, которые отвечают за свертываемость крови и тем самым защищают наш организм от большой кровопотери при травмах.
· плазма – является транспортной средой для кровяных клеток, помогая им передвигаться по нашему телу
У этих клеток самая важная функция. В одной капли крови содержится Красные кровяные клетки выполняют одну из самых важных функций крови. В капле крови содержатся миллионы эритроцитов, которые постоянно циркулируют по телу, доставляя к органам кислород и удаляя продукты распада.
Эритроциты называют красными кровяными клетками, потому что они содержат протеин – гемоглобин, имеющий ярко-красный цвет. Гемоглобин содержит в своём составе железо, что делает его идеальным средством для транспортировки кислорода и двуокиси азота. Когда кровь проходит через легкие, молекулы кислорода присоединяются к гемоглобину; по мере движения по телу кислород попадает в клетки. После отдачи кислорода, гемоглобин связывает двуокись азота с продуктами распада и удаляет их из нашего тела. Но жизнь эритроцита очень мала и составляет около 120 суток, но костный мозг регулярно производит новые клетки крови и восполняет потерю.
Масса эритроцитов, взятая у донора, применяется для переливания крови и изготовления препаратов крови.
Если в наш организм опадает инфекция, за дело берутся белые кровяные клетки, которые постоянно наготове и имеют в своем арсенале множество способов борьбы с паразитами. Лимфоциты производят антитела для защиты нашего организма, которые нейтрализуют и уничтожают микроорганизмы инфекций. Фагоциты, при обнаружении чужеродного микроорганизма, сразу захватывают его, поглощают и уничтожают.
Лейкоциты живут от нескольких дней до нескольких недель. В одной капле крови человека находится около 4-8 тыс белых кровяных клеток. Но когда в наш организм попадает инфекция, число этих клеток резко увеличивается. Слишком малое или, наоборот, слишком большое содержание в крови лейкоцитов, говорит об наличии в организме серьезных заболеванийПри инфекционном сепсисе применяются переливания гранулоцитов – это разновидность лейкоцитов.
Тромбоциты 
Нам очень тяжело самим перенести большую кровопотерю. Тромбоциты играют важную роль, помогая нашему организму защититься от потери крови.
Кальций и вит.К должны быть всегда в норме и в достаточном кол-ве, что обеспечивает хорошую свертываемость. Поэтому дефицит этих компонентов в нашем организме может привести к проблемам при кровопотери.
Плазма – это прозрачная, окрашенная в светло-желтый цвет жидкость, которая на 90% состоит из воды и является очень важным компонентом крови
Может показаться, что плазма не играет такой большой роли, как клетки, которые она транспортирует. Но думать так, всё равно что считать, что рыбы важнее реки, в которой они живут – ведь без одного не может быть и другого.
Кроме воды плазма содержит в своём составе растворённые соли кальция( около 1%), калия, фосфорной кислоты, натрия. Около 7% объёма составляют белки ( например, фибриноген, который принимает активное участие при свертываемости крови). В плазме есть углекислый газ, глюкоза и другие питательные в-ва и продукты распада. Плазма предназначена для переливаний и для изготовления криопреципитата – высокотехнологичного препарата, необходимого для лечения гематологических больных, в частности, гемофиликов.
- 25260
- 20,3
- 5
- 8
Формирование тромба в кровотоке. Кровеносный сосуд заполнен клетками крови значительно плотнее, чем показано на этом рисунке, так что ситуация там напоминает давку при входе на эскалатор в метро. Маленькие и относительно немногочисленные белые клетки — тромбоциты: справа можно видеть, как они активируются, меняют форму и прикрепляются к стенке сосуда, формируя агрегат — тромб.
Свертывание крови — крайне сложный и во многом еще загадочный биохимический процесс, который запускается при повреждении кровеносной системы и ведет к превращению плазмы крови в студенистый сгусток, затыкающий рану и останавливающий кровотечение. Нарушения этой системы крайне опасны и могут привести к кровотечению, тромбозу или другим патологиям, которые совместно отвечают за львиную долю смертности и инвалидности в современном мире. Здесь мы рассмотрим устройство этой системы и расскажем о самых современных достижениях в ее изучении.
Каждый, кто хоть раз в жизни получал царапину или рану, приобретал тем самым замечательную возможность наблюдать превращение крови из жидкости в вязкую нетекучую массу, приводящее к остановке кровотечения. Этот процесс называется свертыванием крови и управляется сложной системой биохимических реакций.
Иметь какую-нибудь систему остановки кровотечения — абсолютно необходимо для любого многоклеточного организма, имеющего жидкую внутреннюю среду. Свертывание крови является жизненно необходимым и для нас: мутации в генах основных белков свертывания, как правило, летальны. Увы, среди множества систем нашего организма, нарушения в работе которых представляют опасность для здоровья, свертывание крови также занимает абсолютное первое место как главная непосредственная причина смерти: люди болеют разными болезнями, но умирают почти всегда от нарушений свертывания крови. Рак, сепсис, травма, атеросклероз, инфаркт, инсульт — для широчайшего круга заболеваний непосредственной причиной смерти является неспособность системы свертывания поддерживать баланс между жидким и твердым состояниями крови в организме.
Вплоть до самого последнего времени свертывание крови успешно сопротивлялось попыткам исследователей понять его работу, и лишь в последние годы тут произошел качественный скачок. В данной статье мы расскажем об этой замечательной системе: как она устроена, почему ее так сложно изучать, и — самое главное — поведаем о последних открытиях в понимании того, как она работает.
Как устроено свертывание крови
Остановка кровотечения основана на той же идее, что используют домохозяйки для приготовления холодца — превращении жидкости в гель (коллоидную систему, где формируется сеть молекул, способная удержать в своих ячейках тысячекратно превосходящую ее по весу жидкость за счет водородных связей с молекулами воды). Кстати, та же идея используется в одноразовых детских подгузниках, в которые помещается разбухающий при смачивании материал. С физической точки зрения, там нужно решать ту же самую задачу, что и в свертывании — борьбу с протечками при минимальном приложении усилий.
Свертывание крови является центральным звеном гемостаза (остановки кровотечения). Вторым звеном гемостаза являются особые клетки — тромбоциты, — способные прикрепляться друг к другу и к месту повреждения, чтобы создать останавливающую кровь пробку.
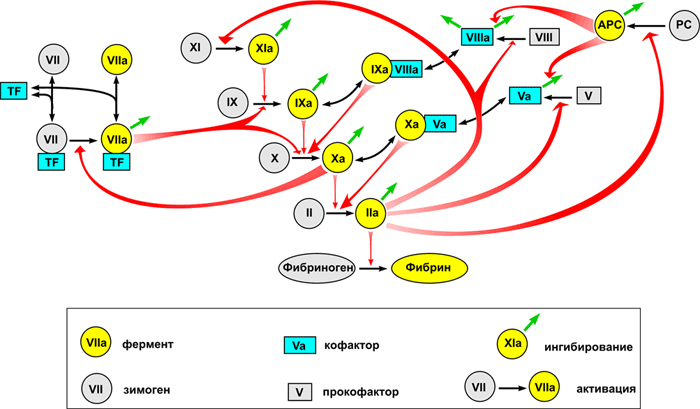
Общее представление о биохимии свертывания можно получить из рисунка 1, внизу которого показана реакция превращения растворимого белка фибриногена в фибрин, который затем полимеризуется в сетку. Эта реакция представляет собой единственную часть каскада, имеющую непосредственный физический смысл и решающую четкую физическую задачу. Роль остальных реакций — исключительно регуляторная: обеспечить превращение фибриногена в фибрин только в нужном месте и в нужное время.
Фибриноген напоминает стержень длиной 50 нм и толщиной 5 нм (рис. 2а). Активация позволяет его молекулам склеиваться в фибриновую нить (рис 2б), а затем в волокно, способное ветвиться и образовывать трехмерную сеть (рис. 2в).
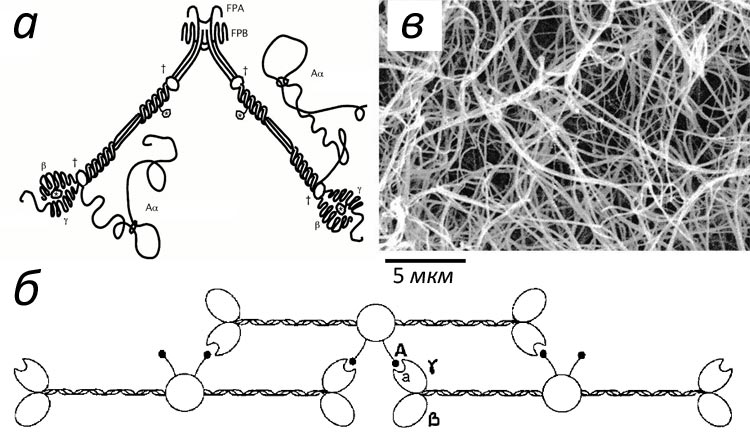
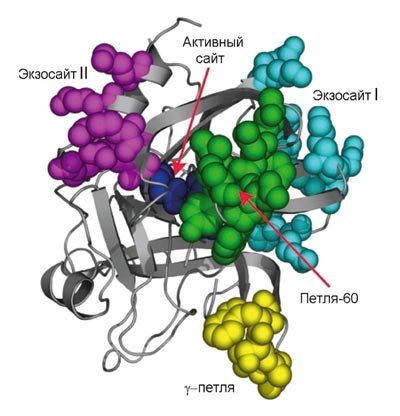
Активатор фибриногена тромбин (рис. 3) принадлежит к семейству сериновых протеиназ — ферментов, способных осуществлять расщепление пептидных связей в белках. Он является родственником пищеварительных ферментов трипсина и химотрипсина. Протеиназы синтезируются в неактивной форме, называемой зимогеном. Чтобы их активировать, необходимо расщепить пептидную связь, удерживающую часть белка, которая закрывает активный сайт. Так, тромбин синтезируется в виде протромбина, который может быть активирован. Как видно из рис. 1 (где протромбин обозначен как фактор II), это катализируется фактором Xa.
Активатором свертывания служит белок, называемый тканевым фактором, присутствующий в мембранах клеток всех тканей, за исключением эндотелия и крови. Таким образом, кровь остается жидкой только благодаря тому, что в норме она защищена тонкой защитной оболочкой эндотелия. При любом нарушении целостности сосуда тканевой фактор связывает из плазмы фактор VIIa, а их комплекс — называемый внешней теназой (tenase, или Xase, от слова ten — десять, т.е. номер активируемого фактора) — активирует фактор X.
Такое устройство системы называется положительной обратной связью: тромбин активирует белки, которые ускоряют его собственное производство. И здесь возникает интересный вопрос, а зачем они нужны? Почему нельзя сразу сделать реакцию быстрой, почему природа делает ее исходно медленной, а потом придумывает способ ее дополнительного ускорения? Зачем в системе свертывания дублирование? Например, фактор X может активироваться как комплексом VIIa—TF (внешняя теназа), так и комплексом IXa—VIIIa (внутренняя теназа); это выглядит совершенно бессмысленным.
В крови также присутствуют ингибиторы протеиназ свертывания. Основными являются антитромбин III и ингибитор пути тканевого фактора. Кроме этого, тромбин способен активировать сериновую протеиназу протеин С, которая расщепляет факторы свертывания Va и VIIIa, заставляя их полностью терять свою активность.
Протеин С — предшественник сериновой протеиназы, очень похожей на факторы IX, X, VII и протромбин. Он активируется тромбином, как и фактор XI. Однако при активации получившаяся сериновая протеиназа использует свою ферментативную активность не для того, чтобы активировать другие белки, а для того, чтобы их инактивировать. Активированный протеин С производит несколько протеолитических расщеплений в факторах свертывания Va и VIIIa, заставляя их полностью терять свою кофакторную активность. Таким образом, тромбин — продукт каскада свертывания — ингибирует свое собственное производство: это называется отрицательной обратной связью. И опять у нас регуляторный вопрос: зачем тромбин одновременно ускоряет и замедляет собственную активацию?
Формирование защитных систем крови началось у многоклеточных свыше миллиарда лет назад — собственно, как раз в связи с появлением крови. Сама система свертывания является результатом преодоления другой исторической вехи — возникновения позвоночных около пятисот миллионов лет назад. Скорее всего, эта система возникла из иммунитета. Появление очередной системы иммунных реакций, которая боролась с бактериями путем обволакивания их фибриновым гелем, привело к случайному побочному результату: кровотечение стало прекращаться быстрее. Это позволило увеличивать давление и силу потоков в кровеносной системе, а улучшение сосудистой системы, то есть улучшение транспорта всех веществ, открыло новые горизонты развития. Кто знает, не было ли появление свертывания тем преимуществом, которое позволило позвоночным занять свое нынешнее место в биосфере Земли?
У ряда членистогих (таких, как рак-мечехвост) свертывание также существует, но оно возникло независимо и осталось на иммунологических ролях. Насекомые, как и прочие беспозвоночные, обычно обходятся более слабой разновидностью системы остановки кровотечения, основанной на агрегации тромбоцитов (точнее, амебоцитов — дальних родственников тромбоцитов). Этот механизм вполне функционален, но накладывает принципиальные ограничения на эффективность сосудистой системы, — так же, как трахейная форма дыхания ограничивает максимально возможный размер насекомого.
К сожалению, существа с промежуточными формами системы свертывания почти все вымерли. Единственным исключением являются бесчелюстные рыбы: геномный анализ системы свертывания у миноги показал, что она содержит гораздо меньше компонентов (то есть, устроена заметно проще) [6]. Начиная же с челюстных рыб и до млекопитающих системы свертывания очень похожи. Системы клеточного гемостаза также работают по схожим принципам, несмотря на то, что мелкие, безъядерные тромбоциты характерны только для млекопитающих. У остальных позвоночных тромбоциты — крупные клетки, имеющие ядро.
Подводя итог, система свертывания изучена очень хорошо. В ней уже пятнадцать лет не открывали новых белков или реакций, что для современной биохимии составляет вечность. Конечно, нельзя совсем исключить вероятность такого открытия, но пока что не существует ни одного явления, которое мы не могли бы объяснить при помощи имеющихся сведений. Скорее наоборот, система выглядит гораздо сложнее, чем нужно: мы напомним, что из всего этого (довольно громоздкого!) каскада собственно желированием занимается только одна реакция, а все остальные нужны для какой-то непонятной регуляции.
Как исследовать свертывание?
Для изучения свертывания создаются различные модели — экспериментальные и математические. Что именно они позволяют получить?
С одной стороны, кажется, что самым лучшим приближением для изучения объекта является сам объект. В данном случае — человек или животное. Это позволяет учитывать все факторы, включая ток крови по сосудам, взаимодействия со стенками сосудов и многое другое. Однако в этом случае сложность задачи превосходит разумные границы. Модели свертывания позволяют упростить объект исследования, не упуская его существенных особенностей.
Попытаемся составить представление о том, каким требованиям должны отвечать эти модели, чтобы корректно отражать процесс свертывания in vivo.
В экспериментальной модели должны присутствовать те же биохимические реакции, что и в организме. Должны присутствовать не только белки системы свертывания, но и прочие участники процесса свертывания — клетки крови, эндотелия и субэндотелия. Система должна учитывать пространственную неоднородность свертывания in vivo: активацию от поврежденного участка эндотелия, распространение активных факторов, присутствие тока крови.
Рассмотрение моделей свертывания естественно начать с методов исследования свертывания in vivo. Основа практически всех используемых подходов такого рода заключается в нанесении подопытному животному контролируемого повреждения с тем, чтобы вызвать гемостатическую или тромботическую реакцию. Данная реакция исследуется различными методами:
- наблюдение за временем кровотечения;
- анализ плазмы, взятой у животного;
- вскрытие умерщвленного животного и гистологическое исследование;
- наблюдение за тромбом в реальном времени с использованием микроскопии или ядерного магнитного резонанса (рис. 4).

Классическая постановка эксперимента по свертыванию in vitro заключается в том, что плазма крови (или цельная кровь) смешивается в некоторой емкости с активатором, после чего производится наблюдение за процессом свертывания. По методу наблюдения экспериментальные методики можно разделить на следующие типы:
- наблюдение за самим процессом свертывания;
- наблюдение за изменением концентраций факторов свертывания от времени.
Второй подход дает несравненно больше информации. Теоретически, зная концентрации всех факторов в произвольный момент времени, можно получить полную информацию о системе. На практике исследование даже двух белков одновременно дорого и связано с большими техническими трудностями.
Наконец, свертывание в организме протекает неоднородно. Формирование сгустка запускается на поврежденной стенке, распространяется с участием активированных тромбоцитов в объеме плазмы, останавливается с помощью эндотелия сосудов. Адекватно изучить эти процессы с помощью классических методов невозможно. Вторым важным фактором является наличие потока крови в сосудах.
Осознание этих проблем привело к появлению, начиная с 1970-х годов, разнообразных проточных экспериментальных систем in vitro. Несколько больше времени потребовалось на осознание пространственных аспектов проблемы. Только в 1990-е годы стали появляться методы, учитывающие пространственную неоднородность и диффузию факторов свертывания, и только в последнее десятилетие они стали активно использоваться в научных лабораториях (рис. 5).

Рисунок 5. Пространственный рост фибринового сгустка в норме и патологии. Свертывание в тонком слое плазмы крови активировалось иммобилизованным на стенке тканевым фактором. На фотографиях активатор расположен слева. Серая расширяющаяся полоса — растущий фибриновый сгусток.
Наряду с экспериментальными подходами для исследований гемостаза и тромбоза также используются математические модели (этот метод исследований часто называется in silico [8]). Математическое моделирование в биологии позволяет устанавливать глубокие и сложные взаимосвязи между биологической теорией и опытом. Проведение эксперимента имеет определенные границы и сопряжено с рядом трудностей. Кроме того, некоторые теоретически возможные эксперименты неосуществимы или запредельно дороги вследствие ограничений экспериментальной техники. Моделирование упрощает проведение экспериментов, так как можно заранее подобрать необходимые условия для экспериментов in vitro и in vivo, при которых интересующий эффект будет наблюдаем.
Регуляция системы свертывания
Рисунок 6. Вклад внешней и внутренней теназы в формирование фибринового сгустка в пространстве. Мы использовали математическую модель, чтобы исследовать, как далеко может простираться влияние активатора свертывания (тканевого фактора) в пространстве. Для этого мы посчитали распределение фактора Xa (который определяет распределение тромбина, который определяет распределение фибрина). На анимации показаны распределения фактора Xa, произведенного внешней теназой (комплексом VIIa–TF) или внутренней теназой (комплексом IXa–VIIIa), а также общее количество фактора Xa (заштрихованная область). (Вставка показывает то же самое на более крупной шкале концентраций.) Можно видеть, что произведенный на активаторе фактор Xa не может проникнуть далеко от активатора из-за высокой скорости ингибирования в плазме. Напротив, комплекс IXa–VIIIa работает вдали от активатора (т.к. фактор IXa медленнее ингибируется и потому имеет большее расстояние эффективной диффузии от активатора), и обеспечивает распространение фактора Xa в пространстве.
Сделаем следующий логический шаг и попробуем ответить на вопрос — а как описанная выше система работает?
Как упоминалось в первой части статьи, многие реакции свертывания медленны. Так, факторы IXa и Xa сами по себе являются очень плохими ферментами и для эффективного функционирования нуждаются в кофакторах (факторах VIIIa и Va, соответственно). Эти кофакторы активируются тромбином: такое устройство, когда фермент активирует собственное производство, называется петлей положительной обратной связи.
Одной из интригующих загадок, преследовавших биохимиков на протяжении многих лет после открытия основных белков свертывания, была роль фактора XII в гемостазе. Его дефицит обнаруживался в простейших тестах свертывания, увеличивая время, необходимое для образования сгустка, однако, в отличие от дефицита фактора XI, не сопровождался нарушениями свертывания.
Один из наиболее правдоподобных вариантов разгадки роли внутреннего пути был предложен нами с помощью пространственно неоднородных экспериментальных систем. Было обнаружено, что положительные обратные связи имеют большое значение именно для распространения свертывания. Эффективная активация фактора X внешней теназой на активаторе не поможет сформировать сгусток вдали от активатора, так как фактор Xa быстро ингибируется в плазме и не может далеко отойти от активатора. Зато фактор IXa, который ингибируется на порядок медленнее, вполне на это способен (и ему помогает фактор VIIIa, который активируется тромбином). А там, куда сложно дойти и ему, начинает работать фактор XI, также активируемый тромбином. Таким образом, наличие петель положительных обратных связей помогает создать трехмерную структуру сгустка.
Активация протеина С тромбином сама по себе медленна, но резко ускоряется при связывании тромбина с трансмембранным белком тромбомодулином, синтезируемым клетками эндотелия. Активированный протеин С способен разрушать факторы Va и VIIIa, на порядки замедляя работу системы свертывания. Ключом к пониманию роли данной реакции стали пространственно-неоднородные экспериментальные подходы. Наши эксперименты позволили предположить, что она останавливает пространственный рост тромба, ограничивая его размер.
Подведение итогов
В последние годы сложность системы свертывания постепенно становится менее загадочной. Открытие всех существенных компонентов системы, разработка математических моделей и использование новых экспериментальных подходов позволили приоткрыть завесу тайны. Структура каскада свертывания расшифровывается, и сейчас, как мы видели выше, практически для каждой существенной части системы выявлена или предложена роль, которую она играет в регуляции всего процесса.
На рисунке 7 представлена наиболее современная попытка пересмотреть структуру системы свертывания. Это та же схема, что и на рис. 1, где разноцветным затенением выделены части системы, отвечающие за разные задачи, как обсуждалось выше. Не все в этой схеме является надежно установленным. Например, наше теоретическое предсказание, что активация фактора VII фактором Xa позволяет свертыванию пороговым образом отвечать на скорость потока, остается пока еще непроверенным в эксперименте.

Рисунок 7. Модульная структура системы свертывания: роль отдельных реакций свертывания в функционировании системы.
Вполне возможно, что эта картина еще не вполне полна. Тем не менее, прогресс в этой области в последние годы вселяет надежду, что в обозримом будущем оставшиеся неразгаданные участки на схеме свертывания обретут осмысленную физиологическую функцию. И тогда можно будет говорить о рождении новой концепции свертывания крови, пришедшей на смену старинной каскадной модели, которая верно служила медицине на протяжении многих десятилетий.
Читайте также:


