Системной красной волчанке и других коллагенозах
В настоящей статье излагаются результаты изучения посредством реакции Штеффена неполных сывороточных антител у больных системной красной волчанкой, склеродермией, дерматомиозитом и так называемыми недифференцированными коллагенозами.
Исследована 81 сыворотка от 34 больных системной красной волчанкой, которая диагностировалась на основании сочетания типичных кожных изменений с висцеральной патологией и изменениями крови. При отсутствии поражений кожи (у двоих) характерная висцеральная патология сочеталась с наличием клеток LE в крови и костном мозгу.
Большую часть обследованных больных составляли женщины (28 человек), в основном моложе 45 лет. 24 больных обследованы в период обострения заболевания, остальные наблюдались в период относительной ремиссии. За время наблюдения умерло 6 больных. Все больные получали гормональную терапию, половина из них лечилась кортикостероидами длительное время.
Частота отдельных симптомов заболевания располагается следующим образом: поражения кожи найдены у 32 больных, в том числе у 11 они были диссеминированными по коже. Лихорадка, чаще неправильного типа, обнаружена у 30 больных, полиаденит - также у 30 больных, клинические признаки поражения суставов имелись у 28 больных, в том числе у 21 была только полиартралгия, иногда очень тяжелая. Патология почек найдена у 27 больных, у 7 из них она была ведущей. Сердечная патология определялась у 28 человек, у 10 больных поражение сердца было тяжелым. Клетки LE в крови обнаружены у 13 больных из 24 обследованных. Изменения в легких обнаружены у 14 больных. С такой же частотой отмечалось увеличение печени и у трех человек селезенки. Изменения крови найдены у 27 больных.
Помимо системной красной волчанки, обследовано пять больных системной склеродермией, двое - дерматомиозитом и семь больных с чертами недифференцированного коллагеноза. У трех больных последней группы кожные элементы красной волчанки сочетались со склеродермией, тяжелым деформирующим полиартритом и язвенным колитом. Кроме того, у одного больного панникулит Христиан - Вебера сочетался с транзиторной панцитопенией. У трех больных ведущей патологией было поражение легких типа синдрома Рича в сочетании с полиартритом, синдромом Рейно, склеродермией, болезнью Микулича и резчайшим агранулоцитозом.
Все больные (женщины старше 40 лет) получали кортикостероиды и наблюдались до трех и более лет. За время наблюдения умерло трое.
В этих группах больных исследованы противотканевые антитела в 43 сыворотках. Для сопоставления результатов обследованы 52 практически здоровых лица и донора крови
Оказалось, что в контрольной группе антитела обнаруживаются редко и в низком титре (в 4,4% проб из 280 реакций). Не отмечалось какой-либо избирательности в реакциях с отдельными антигенами. В то же время у больных системной красной волчанкой и другими "большими коллагенозами" антитела обнаруживаются значительно чаще. У больных волчанкой они найдены в 70,7% (249 положительных проб из 352), при прочих коллагенозах- в 59,5% (118 положительных реакций из 198). Чаще остальных определялись антитела к паренхиматозным органам, особенно к сердцу и почке, где процент положительных реакций достигал 90, почти вдвое реже обнаружены антитела к тканям, богатым коллагеном. В то же время наиболее частыми клиническими признаками были поражения кожи и суставов. Возможно, что полученные данные объясняются сравнительно низкой антигенной активностью коллагена.
С целью клинико-иммунологического сопоставления мы распределили результаты исследования в зависимости от выраженности органной патологии у больных системной красной волчанкой. В группе "О" отсутствовали клинические признаки органной патологии. В группу "А" мы включили случаи сомнительной патологии органа (артралгия, непостоянные следы белка в моче, боли в сердце и т. д.). В группы "Б" и "В" включены случаи несомненной органной патологии, соответственно умеренные или резко выраженные с нарушением функции органа. Последними для кожи мы считали диссеминацию люпоидных поражений кожи, выраженные экссудативно-инфильтративные реакции.
Не придавая большого значения средним титрам противотканевых антител, выведенным по результатам полуколичественных реакций, мы, тем не менее, сочли их до известной степени демонстративными для отдельных групп и антигенов. Во всех сыворотках групп "Б" и "В" содержались антитела к сердцу и почке. Обращает на себя внимание наличие в группе "О" сывороток с высоким содержанием антител. Уровень антител в ряде этих случаев был стационарным длительное время. Одна больная наблюдалась в течение трех лет. Все это время титр антикардиальных антител был в пределах трех ступеней поглощения антиглобулина. Клинических признаков поражения сердца у этой больной в течение всего срока наблюдения не выявлено. У другой больной этой группы даже четырехкратная абсорбция сывороточных антител к почке удвоенной дозой антигена не истощила полностью сыворотки. Статистически достоверное различие в обнаружении антител в краевых группах "О" и "В" найдено лишь для почки.
Для всех антигенов имелось известное соответствие между средним титром антител и выраженностью органной патологии. В трети сывороток титр антител к почке и сердцу был очень высоким (от 4 ступеней и более). Наряду с этим ни в одной из сывороток титр антител к суставной капсуле не достигал 4 ступеней и к коже был максимальным лишь в 6 сыворотках. В 10 сыворотках больных с тяжелым поражением кожи соответствующие антитела не найдены. У таких больных висцеральная патология была умеренной, а титр антител к паренхиматозным органам - невысокий.
При исследовании антитканевых антител нами найдено несколько вариантов кривых: стационарный (высокий и низкий), волнообразный, затухающий и нарастающий. Последний вариант кривой совпадал с ухудшением соответствующей органной патологии. В одном случае системной красной волчанки с преимущественным поражением почек и кожи титр антител к почке внезапно повысился с 4 ступеней до 7. Несколько дней спустя было обнаружено повышение протеинурии с 2,31 до 24% (!). Больная погибла через год при явлениях нарастающей почечной недостаточности. В то же время высокий стационарный тип кривой антител может годами наблюдаться у больных без клинических признаков соответствующей патологии.
Мы не ставили специальной задачи изучения специфичности антитканевых антител. Как правило, сывороточные антитела при коллагенозах реагировали со многими тканями. Однако в двух случаях своеобразной клинической картины антитела к коже и суставной капсуле отсутствовали при многократном исследовании на фоне высокого титра антител к паренхиматозным органам. У этих больных отсутствовали признаки поражения кожи. В одном случае полиартралгия сочеталась с прогрессирующим истощением и лихорадкой у 32-летней больной. В крови и костном мозгу обнаружено очень большое количество волчаночных клеток (92 клетки на 108 нормальных лейкоцитов). В другом случае полиартрит сочетался с адгезивным полисерозитом, кардитом, нефритом. Выявлялись также клетки LE в крови.
Во многих сыворотках титр антител к паренхиматозным органам и к тканям, богатым коллагеном, разнился на 2 и более ступени.
Таким образом, при системной красной волчанке обнаруживаются противотканевые антитела с различной направленностью. Имеется некоторое соответствие между тяжестью органной патологии и частотой обнаружения соответствующих антител. Антитела к тканям, богатым коллагеном, обнаруживаются реже и в достоверно более низких титрах. Выделены некоторые типы кривых содержания противотканевых антител.
Для склеродермии и при остальных "больших коллагенозах" клинико-иммунологическое сопоставление привело принципиально к тем же выводам. Для склеродермии, может быть, более характерный тип кривой антител - стационарный (у четырех больных из пяти). Антитела к коже у этих больных обнаружены в 13 сыворотках из 16, но и здесь средний титр антител к коже и суставной капсуле сравнительно невысок. При прочих коллагенозах мы видели только волнообразные и затухающие типы кривых антител, что соответствовало клинической картине улучшения состояния больных.
Полученные нами данные указывают на определенную клиническую ценность определения антитканевых антител методикой Штеффена, обнаружение которых, возможно, является более тонким тестом изучения патологических процессов в организме. Наличие высокого титра антител в течение длительного времени без клинических признаков соответствующей органной патологии позволяет нам сомневаться в безусловности понятия "аутоагрессивности" этих антител.
На основании проведенных исследований можно сделать следующие выводы:
1. В сыворотках больных системной красной волчанкой часто обнаруживаются неполные антитела к антигенам различных органов. При других коллагенозах аутоантитела обнаруживались несколько реже.
2. Неполные противотканевые антитела выявлялись у больных системной красной волчанкой нередко и в тех случаях, когда клинические признаки соответствующей висцеральной патологии отсутствовали.
3. Антитела к паренхиматозным органам отмечались чаще и в более высоких титрах по сравнению с антителами к тканям, богатым коллагеном.
В развитии концепции К. б. можно выделить несколько периодов. Первый из них, морфологический, связан с объединением Клемперером перечисленных выше болезней на основе общего для них патогистол, признака — фибриноидного изменения коллагеновых волокон соединительной ткани. Второй период характеризуется привлечением внимания к изучению клин, картины болезней, отличающейся полисистемностыо и частым поражением суставов, серозных оболочек, кожи, внутренних органов, нервной системы и др. Третий период совпал с развитием теории Ф. Бернета о запрещенных клеточных клонах, с появлением учения об аутоиммунитете как ведущем механизме развития почти всех К. б. Это направление оказалось плодотворным в отношении разработки принципов лечения, иммунодепрессивного по своей сути.
Важным стимулом для развития учения о патологии соединительной ткани явились выводы М. Биша о морфол, самостоятельности соединительной ткани, учение И. И. Мечникова о фагоцитарной способности клеток соединительной ткани.
Однако основы учения о болезнях соединительной ткани были заложены еще в конце прошлого века Нейманном (Е. Neumann, 1880), который впервые описал тинкториальные свойства пораженной соединительной ткани, характерные для фибриноидного ее изменения. Позже в работах В. Т. Талалаева (1929) и Клинге (F. Klinge, 1933) было показано, что фибриноидные изменения соединительной ткани связаны с состоянием сенсибилизации и аллергическим генезом. А. А. Богомольцем была создана стройная концепция физиол. системы соединительной ткани и ее важной роли в защите человеческого организма. В клин, отношении учение о так наз. коллагеновых болезнях претерпело существенные изменения. Возникнув как учение о морфол, близости двух болезней, оно значительно расширилось в связи с включением вторичных синдромов, напр, геморрагического васкулита при туберкулезе, септическом эндокардите и др. В совр. клин, практике большинство клиницистов в группу заболеваний соединительной ткани с иммунными нарушениями включают системную красную волчанку (см.) и системную склеродермию (см.), дерматомиозит (см.), узелковый периартериит (см. Периартериит узелковый), ревматоидный артрит (см.) и ревматизм (см.), анкилозирующий спондилоартрит (см. Бехтерева болезнь), синдром Шегрена (см. Шегрена синдром) и др. Как в свое время неправильно было формулировать диагноз коллагеновая болезнь, коллагенопатия, недифференцированный коллагеноз, так в 70-х гг. недопустим диагноз системное заболевание соединительной ткани, т. е. необходимо распознавание определенной нозол, формы.
Содержание
Этиология
Этиология изучена недостаточно, однако провоцирующими, выявляющими факторами могут быть: лекарственная непереносимость (антибиотиков, сульфаниламидов), напр. при узелковом периартериите, системной красной волчанке (волчаночноподобный синдром — lupus-like syndrome); влияние физ. факторов — охлаждение, особенно длительное воздействие влажного холода, чрезмерная инсоляция, вибрация, физ. травма; психическая травма, эндокринные влияния при абортах, родах, беременности; вегатативно-нейротрофические и эндокринные факторы — нарушение функции гипоталамо-гипофизарно-надпочечниковой системы.
Успехи исследований второй половины 20 в. позволяют обсуждать роль вируса в этиологии этих болезней: значение поверхностного антигена гепатита В и антител к нему при узелковом периартериите, РНК-вирусов, коревых или кореподобных вирусов при системной красной волчанке. Не исключена возможность вирусного генеза и других К. б., поскольку во всех пораженных тканях при электронной микроскопии обнаружены тубулоретикулярные включения, имеющие отношение к продуктам жизнедеятельности вирусов. При всех К. б. обнаруживают антитела к широкому кругу РНК-содержащих вирусов: кори, парагриппа, гриппа и др. Неэффективность общепринятых методов выделения вируса из организма больного позволяет говорить о К. б. как болезнях интегративных, при которых отмечается интеграция РНК-вируса и клетки хозяина.
Избирательное поражение отдельных людей (напр., лишь 0,1—3% перенесших стрептококковую ангину заболевают ревматизмом) свидетельствует о значении семейно-генетического предрасположения как этиол, фактора К. б. Все больше накапливается данных в пользу полигенного наследования К. б.: более высокая, чем в общей популяции, распространенность в семьях больных, особенно среди родственников I степени родства; большая частота среди монозиготных, чем дизиготных, близнецов; больший эмпирический риск заболевания для сибсов (братьев и сестер) в семьях больных по сравнению с семьями здоровых. В семьях больных К. б. различные болезни этой группы встречаются чаще, чем в популяции, что позволяет предполагать участие общих генов в наследовании этих болезней. Несомненный интерес представляют данные о большей частоте некоторых антигенов гистосовместимости при некоторых К. б., напр. HLA В-27 при болезни Бехтерева и др. Сцепленность того или иного гена HL—A-системы с повышенной чувствительностью к инф. агентам заслуживает внимания, поскольку доказано, что носители отдельных HL—A-антигенов характеризуются особой иммунологической чувствительностью к тому или иному инф. агенту. Предполагается структурное сходство антигенов микроорганизма и HLA, обусловливающее развитие перекрестных реакций и др. Хотя для большинства К. б. конкретные механизмы наследования предрасположенности еще не известны, сам факт агрегации (накопления) К. б. в определенных семьях заслуживает внимания с точки зрения возможности проведения профилактических мер в этих семьях.
Патогенез
Эти болезни считают классическим примером органонеспецифических аутоиммунных болезней, характерными чертами которых являются: 1) гипергаммаглобулинемия; 2) наличие аутоантител; 3) обнаружение в очаге поражения комплексов антиген—антитело; 4) скопление в пораженных тканях плазматических и лимфоидных клеток, имеющих отношение к продукции циркулирующих антител и клеточных реакций; 5) эффективность кортикостероидов и (или) других иммунодепрессантов; 6) сочетание с такими аутоиммунными заболеваниями (синдромами), как тиреоидит Хасимото, гемолитическая анемия, тромбоцитопеническая пурпура и др. Начальным звеном любого иммунопатол. процесса является стимуляция иммунокомпетентной системы каким-либо антигеном, вероятно, различным для каждой К. б., но Всегда с участием аутоантигена (см.), усиленной выработкой аутоантител (см.) и однозначным для всех К. б. результатом — иммунными нарушениями, имеющими свои характерные особенности при каждой из них. Большую роль в возникновении аутоантигенов при К. б. играют лизосомы (см.), носители кислых гидролаз. Высвобождение кислых гидролаз в очагах дезорганизации соединительной ткани усиливает гидролитическое расщепление тканей и клеток, способствует появлению аутоантигенов и формированию аутоиммунных реакций. Электронно-микроскопическое исследование показывает увеличение числа лизосом в миокарде при ревматизме, в клетках синовиальной оболочки при ревматоидном артрите. Высокая активность лизосомальных ферментов обнаружена в клетках ревматической гранулемы, в синовиальной жидкости при ревматоидном артрите. Вейссманн (G. Weissmann, 1964) наблюдал провоцирующее действие лабилизаторов лизосом (УФ-лучей, витамина А) в случаях возникновения и обострения системной красной волчанки — заболевания с наиболее ярко выраженными аутоиммунными нарушениями.
Т. о., аутоиммунные механизмы патогенеза характеризуются тем, что либо циркулирующие антитела, либо тканевые иммунокомпетентные клетки направлены против антигенов собственных тканей (см. Аутоаллергические болезни). При системной красной волчанке аутоантитела активны против нативной ДНК ядер клеток любой локализации, при ревматоидном артрите — против измененного (агрегированного) человеческого гамма-глобулина и др. Это свидетельствует о потере способности распознавания своего и чужого. Для всех К. б. характерно значительное нарушение гуморального звена иммунитета, связанного с В-лимфоцитами и проявляющегося безудержной продукцией различных аутоантител. При системной красной волчанке, напр., обнаруживают аутоантитела не только к нативной ДНК, но и к ДНК с измененной вторичной структурой (односпиральной, с деспирализованными участками), нуклеопротеиду (комплексу ДНК + гистон), цельным ядрам клеток (антинуклеарные факторы, выявляемые методом иммунофлюоресценции), а также к цитоплазматическим компонентам клетки и др. При К. б. могут развиваться также аутоиммунные синдромы, связанные с циркулирующими антителами, напр, аутоиммунная гемолитическая анемия или аутоиммунная тромбоцитопения.
Иммунокомплексная патология лежит в основе иммунопатол. синдромов, развивающихся при К. б. Классическим примером иммунокомплексной патологии является гломерулонефрит при системной красной волчанке (люпус-нефрит), обусловленный циркуляцией в крови больных комплексов нативная ДНК — антитела к ДНК — комплемент. Фиксация комплемента (цельного или его компонентов — третьего, четвертого, пятого и др.) приводит к активации системы комплемента (см.), высвобождению факторов хемотаксиса с привлечением в очаг воспаления полинуклеарных лейкоцитов и других клеток воспаления. При разрушении этих клеток происходит высвобождение лизосомальных энзимов во внеклеточное пространство и развитие воспалительной реакции. Поскольку система комплемента играет важную роль в формировании иммунных комплексов, происходит потребление комплемента и развивается гипокомплементемия при люпус-нефрите или снижение комплемента в синовиальной жидкости при ревматоидном синовите. Столь значительное нарушение гуморального иммунитета обусловлено нарушением клеточного иммунитета и его контролирующих функций в отношении гуморального иммунитета. Предполагается, что имеет место врожденный дефицит Т-лимфоцитов; кроме того, они могут разрушаться под влиянием обнаруживаемых у больных К. б. лимфоцитотоксических аутоантител и воздействием вирусов и др. Клеточный иммунитет играет важную роль при многих К. б.
Из других механизмов развития К. б. привлекает к себе внимание нарушение метаболизма коллагена, свойственное всем болезням этой группы. Наиболее ярко эта патология проявляется при системной склеродермии и ревматоидном артрите, при которых отмечается повышенная скорость биосинтеза коллагена, формирование менее устойчивых коллагеновых структур с повышенным распадом и тенденция развития избыточного фиброза.
Патологическая анатомия
Патологоанатомическую основу К. б. составляют иммунопатоморфол. изменения, имеющие аллергический генез (см. Аллергия); поражение микроциркуляторного русла (микроангиопатия), сосудов мелкого и среднего калибра; системная прогрессирующая дезорганизация соединительной ткани. Сочетание этих процессов дает характерную картину воспаления на иммунной основе (см. Воспаление). Изменения соединительной ткани при разных К. б. характеризуются различной преимущественной локализацией патол, процесса: при ревматизме поражается соединительная ткань сердца, при ревматоидном артрите — суставы, при системной склеродермии — кожа, узелковом периартериите — стенки сосудов мелкого и среднего калибра, при системной красной волчанке происходит генерализованное поражение соединительной ткани. Дерматомиозит (см.) не все морфологи относят к группе К. б., т. к. его морфол, основой являются дистрофические изменения скелетной мускулатуры с вторичными воспалительными процессами в межмышечной соединительной ткани, хотя по нек-рым иммунол. показателям он приближается к К. б.
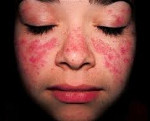
Коллагенозы – группа заболеваний, объединенных однотипными функционально-морфологическими изменениями со стороны соединительной ткани (главным образом, коллагенсодержащих волокон). Характерным проявлением коллагенозов является прогрессирующее течение, вовлечение в патологический процесс различных внутренних органов, сосудов, кожи, опорно-двигательной систем. Диагностика коллагенозов основана на полиорганности поражения, выявлении положительных лабораторных маркеров, данных биопсии соединительной ткани (кожи или синовиальных оболочек суставов). Чаще всего для лечения коллагенозов применяются кортикостероиды, иммунодепрессанты, НПВС, аминохинолиновые производные и др.
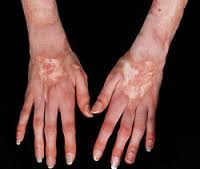
Общие сведения
Коллагенозы (коллагеновые болезни) – иммунопатологические процессы, характеризующиеся системной дезорганизацией соединительной ткани, полисистемным поражением, прогрессирующим течением и полиморфными клиническими проявлениями. В ревматологии к числу коллагенозов принято относить ревматоидный артрит, ревматизм, системную красную волчанку, системную склеродермию, узелковый периартериит, дерматомиозит, гранулематоз Вегенера и др. Эти заболевания объединены в единую группу на основании общего патоморфологического признака (фибриноидного изменения коллагена) и патогенетического механизма (нарушения иммунного гомеостаза).
Различают врожденные (наследственные) и приобретенные коллагенозы. Врожденные соединительнотканные дисплазии представлены, в частности, мукополисахаридозами, синдромом Марфана, несовершенным остеогенезом, синдромом Элерса-Данлоса, эластической псевдоксантомой, синдромом Стиклера и др.
Приобретенные коллагенозы, в свою очередь, включают СКВ, склеродермию, узелковый периартериит, дерматомиозит, ревматоидный полиартрит, синдром Шегрена, ревматизм, системный васкулит, диффузный эозинофильный фасциит и др. Из них первые четыре нозологические единицы причисляют к большим коллагенозам, отличающимся истинно системным характером поражения и тяжестью прогноза; остальные – к малым коллагеновым болезням. Также принято выделять переходные и смешанные формы диффузных заболеваний соединительной ткани (синдром Шарпа).

Причины коллагенозов
Врожденные коллагенозы обусловлены наследственным (генетическим) нарушением структуры коллагена или обмена веществ. Менее изучена и понятна этиология приобретенных системной заболеваний соединительной ткани. Она рассматривается с точки зрения мультифакторной иммунопатологии, обусловленной взаимодействием генетических, инфекционных, эндокринных факторов и влияний внешней среды. Многочисленные исследования подтверждают связь между конкретными системными заболеваниями соединительной ткани и носительством определенных HLA-антигенов, главным образом, антигенов гистосовместимости II класса (HLA-D). Так, системная красная волчанка ассоциирована с носительством DR3-антигена, склеродермия - А1, В8, DR3 и DR5-антигенами, синдром Шегрена - с HLA-B8 и DR3. В семьях больных коллагенозами, чаще, чем в популяции в целом, системные заболевания регистрируются среди родственников первой степени родства.
В отношении инфекционных агентов, причастных к развитию коллагенозов, до сих пор ведутся научные исследования. Не исключается инфекционно-аллергический генез диффузных заболеваний соединительной ткани; рассматривается возможная роль внутриутробных инфекций, стафилококков, стрептококков, вирусов парагриппа, кори, краснухи, паротита, простого герпеса, цитомегаловируса, Эпштейна-Барр, Коксаки А и др.
Следует отметить связь коллагенозов с изменениями эндокринно-гормональной регуляции: с началом менструального цикла, абортами, беременностью или родами, климаксом. Внешнесредовые факторы, как правило, провоцируют обострение скрыто протекающей патологии либо выступают триггерами возникновения коллагенозов при наличии соответствующей генетической предрасположенности. Такими пусковыми механизмами могут являться стресс, травма, переохлаждение, инсоляция, вакцинация, прием лекарств и пр.
Патогенез и патоморфология коллагенозов
Патогенез коллагенозов можно представить в виде следующей общей схемы. На фоне бактериально-вирусной сенсибилизации организма формируются патогенные иммунные комплексы, которые оседают на базальной мембране сосудов, синовиальных и серозных оболочках и провоцируют развитие неспецифического аллергического воспаления. Эти процессы вызывают аутоаллергию и аутосенсибилизацию к собственным тканям, нарушение клеточного и гуморального факторов иммуногенеза, гиперпродукцию аутоантител к ядрам клеток, коллагену, эндотелию сосудов, мышцам.
Извращенные иммунные, сосудистые и воспалительные реакции при коллагенозах сопровождаются патологической дезорганизацией соединительной ткани. Патоморфологические изменения проходят 4 стадии: мукоидного набухания, фибриноидного некроза, клеточной пролиферации и склероза.
Коллагенозы сопровождаются различными патологоанатомическими изменениями, однако все заболевания объединяет диффузное вовлечение в патологический процесс соединительной ткани организма, которое может встречаться в различных сочетаниях. Так при узелковом периартериите преимущественно поражаются сосуды мышечного типа, что приводит к рубцеванию и запустеванию последних, поэтому в клиническом течении нередко отмечаются аневризмы сосудов, кровоизлияния, кровотечения, инфаркты. Для склеродермии типично развитие распространенного склероза (поражения кожи и подкожной клетчатки, пневмосклероза, кардиосклероза, нефросклероза). При дерматомиозите преобладает поражения кожи и мышц, а также расположенных в них артериол. Системная красная волчанка характеризуется полисиндромным течением с развитием дерматоза, полиартрита, синдрома Рейно, плеврита, нефрита, эндокардита, менингоэнцефалита, пневмонита, невритов, плекситов и пр.
Симптомы коллагенозов
Несмотря на многообразие клинико-морфологических форм коллагенозов, в их развитии прослеживаются общие черты. Все заболевания имеют длительное волнообразное течение с чередованием обострений и ремиссий, неуклонным прогрессированием патологических изменений. Характерна стойкая лихорадка неправильного типа с ознобами и профузными потами, признаки аллергии, необъяснимая нарастающая слабость. Общими для всех коллагенозов являются системный васкулит, мышечно-суставной синдром, включающий миалгии, артралгии, полиартриты, миозиты, синовиты. Часто отмечается поражение кожи и слизистых оболочек - эритематозная сыпь, петехии, подкожные узелки, афтозный стоматит и др.
Поражение сердца при коллагенозах может сопровождаться развитием миокардита, перикардита, миокардиодистрофии, кардиосклероза, артериальной гипертензии, ишемии, стенокардии. Со стороны органов дыхания отмечаются пневмониты, плевриты, инфаркт легкого, пневмосклероз. Почечный синдром включает в себя гематурию, протеинурию, амилоидоз почек, хроническую почечную недостаточность. Нарушения деятельности ЖКТ могут быть представлены диспепсией, желудочно-кишечными кровотечениями, приступами абдоминальных болей, симулирующими холецистит, аппендицит и др.
Полиморфизм клинической картины объясняется органоспецифичностью поражения при различных формах коллагенозов. Обострения диффузных заболеваний соединительной ткани обычно связаны с инфекциями, переохлаждением, гиперинсоляцией, травмами.
Диагностика коллагенозов
Основанием для предположения той или иной формы коллагеноза служит наличие классических клинико-лабораторных признаков. Типично появление в крови неспецифических маркеров воспаления: С-реактивного белка, повышение α2-глобулинов, фибриногена, серомукоида, СОЭ и др. Большое диагностическое значение имеет определение иммунологических маркеров, характерных для каждого заболевания: ЦИК, антинуклеарного и ревматоидного факторов, антител к одно- и двухспиральной ДНК, антистрептолизина-0, антител к ядерным антигенам, уровня комплемента и др. Нередко для постановки патоморфологического диагноза приходится прибегать к биопсии кожи, мышц, синовиальной оболочки суставов, почки.
Определенную помощь в диагностике коллагенозов может оказать рентгенологическое исследование костей и суставов, при котором выявляются общие (остеопороз, сужение суставных щелей), а также частные рентгенологические признаки (узурация суставных поверхностей при ревматоидном артрите, асептические некрозы суставных поверхностей при СКВ, остеолизы дистальных фаланг при склеродермии и т. п.). Для выявления характера и степени поражения внутренних органов используются ультразвуковые методы диагностики (ЭхоКГ, УЗИ плевральной полости, УЗИ почек, УЗИ органов брюшной полости), МРТ, КТ. Дифференциальная диагностика различных форм коллагенозов проводится ревматологом; при необходимости пациента консультируют другие специалисты: кардиолог, пульмонолог, иммунолог, дерматолог и др.
Лечение и прогноз коллагенозов
Течение большинства коллагеновых болезней прогрессирующее и рецидивирующее, что требует поэтапного, длительного, нередко пожизненного лечения. Чаще всего для терапии различных форм коллагенозов используются следующие группы препаратов: стероидные (глюкокортикоиды) и нестероидные противовоспалительные средства, цитостатики, аминохинолиновые производные, препараты золота. Дозировка и длительность курсов определяется строго индивидуально с учетом типа заболевания, остроты и тяжести течения, возраста и индивидуальных особенностей больного.
Для всех видов коллагенозов характерно хроническое прогрессирующее течение с многосистемным поражением. Назначение кортикостероидной или иммуносупрессивной терапии помогает уменьшить остроту клинических симптомов, привести к более или менее длительной ремиссии. Наиболее скоротечное развитие и тяжелое течение имеют так называемые большие коллагенозы. Гибель больных может наступить в результате почечной, сердечно-сосудистой, дыхательной недостаточности, присоединения интеркуррентной инфекции. Для профилактики обострений коллагенозов важно устранить очаги хронической инфекции, проходить диспансерное обследование, избегать избыточной инсоляции, переохлаждения и других провоцирующих факторов.
Читайте также:


