Особенности инфекционного эндокардита у больных пожилого возраста
В последние десятилетия прослеживается явное "постарение" заболевания. Мужчины поражаются в 2–3 раза чаще женщин, а в возрастной популяции старше 60 лет это соотношение может достигать 8:1. Рост числа пожилых больных с ИЭ связывают в первую очередь с увеличением продолжительности жизни, обусловленной улучшением социальных условий, доступностью высококвалифицированной медицинской помощи и т.д. В то же время у лиц старших возрастных категорий значительно чаще имеют место факторы, предрасполагающие к развитию ИЭ. В частности, изменения клапанного аппарата сердца, обусловленные кальцинозом, на фоне сниженных реологических свойств крови нередко приводят к формированию тромботических отложений на клапанах и пристеночном эндокарде (асептический тромбоэндокардит), что является потенциальным "ложем" для ИЭ. Хорошо известно, что больные старше 60 лет в силу наличия сопутствующих заболеваний значительно чаще подвергаются оперативным вмешательствам, диагностическим и лечебным инвазивным. К тому же у пациентов этой группы нередко имеются очаги хронической инфекции различной локализации, являющиеся потенциальным источником бактериемии. Играют роль инволютивные процессы в иммунной системе, что благоприятствует реализации транзиторной бактериемии в ИЭ.
Ведущим этиологическим агентом ИЭ собственных клапанов у пожилых больных являются стрептококки (до 80% случаев). Среди них превалируют стрептококки группы D (Streptococcus bovis) и энтерококки, на долю которых приходится до 40% случаев ИЭ стрептококковой этиологии. Данное обстоятельство, по всей видимости, связано с большей встречаемостью воспалительных и онкологических заболеваний толстой кишки, а также достаточно частыми инструментальными урологическими манипуляциями у этой категории пациентов (в частности, при аденоме предстательной железы у пожилых мужчин). На втором месте в этиологической структуре находятся стафилококки (24–30%), которые большей частью являются причиной нозокомиального ИЭ.
Клиническая картина ИЭ у лиц пожилого и старческого возраста характеризуется малосимптомностью, стертостью ведущих клинических проявлений, признаками ряда сопутствующих заболеваний, что нередко затрудняет своевременную диагностику, назначение адекватной терапии и обусловливает высокую летальность (>40%). Наиболее ранним и частым симптомом ИЭ является лихорадка (в большинстве случаев неправильного типа), сопровождающаяся ознобом различной выраженности с последующим значительным потоотделением. Однако у пожилых пациентов, особенно на фоне застойной недостаточности кровообращения, печеночной и/или почечной недостаточности температура тела может быть субфебрильной и даже нормальной. Нередко ИЭ у пожилых дебютирует с быстрой утомляемости, прогрессирующей слабости, общего недомогания, анорексии и потери массы тела, что ошибочно связывают с возрастными изменениями или наличием других заболеваний. В отдельных случаях косвенными симптомами развивающегося ИЭ у пожилых может быть немотивированная прогрессирующая недостаточность кровообращения или нарастающая дисциркуляторная энцефалопатия. Меньшую выраженность иммунологических проявлений заболевания и преобладание общетоксических симптомов в группе больных старше 60 лет объясняют с позиций старения иммунной системы и меньшего напряжения иммунных процессов.
Частота вовлечения сердечных клапанов при ИЭ в пожилом возрасте не отличается от таковой у молодых больных. Митральный клапан поражается в 35–40% случаев, аортальный – с аналогичной частотой (32–40%), оба клапана – в 10%. Правильное истолкование аускультативных феноменов нередко бывает весьма затруднительным, так как в большинстве случаев появление нового сердечного шума и изменение старого часто связывают не с ИЭ, а с прогрессированием атеросклеротического процесса.
Застойная недостаточность кровообращения осложняет течения заболевания в пожилом возрасте значительно чаще. Полагают, что данный феномен обусловлен быстрым разрушением клапанного аппарата, уже ранее пораженного дегенеративным процессом, миокардиальной слабостью вследствие септического миокардита, протекающего на фоне атеросклеротического (иногда постинфарктного) кардиосклероза.
Поражение центральной нервной системы у пожилых больных ИЭ встречается значительно чаще (примерно в 1/3 случаев), чем у пациентов молодого и среднего возраста. Такие симптомы, как спутанность сознания, депрессия или психоз, нередко ошибочно расцениваются как проявление органических возрастных изменений головного мозга. Гемиплегия, афазия, парезы черепно-мозговых нервов, являющиеся следствием септических церебральных эмболий, в ряде случаев могут быть первыми клиническими проявлениями ИЭ у пожилых.
[youtube.player]











Инфекционный эндокардит у пожилых пациентов
Инфекционный эндокардит (ИЭ) — тяжелое системное инфекционное заболевание, протекающее с разрушением клапанов сердца. Течение ИЭ часто осложняется эмболиями и поражением внутренних органов и характеризуется высокой летальностью.
Высокая смертность сохраняется
Инфекционный эндокардит (ИЭ) — тяжелое системное инфекционное заболевание, протекающее с разрушением клапанов сердца. Течение ИЭ часто осложняется эмболиями и поражением внутренних органов и характеризуется высокой летальностью. В большинстве случаев (приблизительно в 90%) заболевание вызывают бактерии. Источником бактериемии может быть локальный септический очаг. Микроорганизмы также могут появиться в кровотоке во время или после определенных медицинских процедур или при использовании нестерильных шприцев наркоманами. ИЭ — заболевание, проявления которого изменяются в зависимости от первичной клинической картины, участия микроорганизмов, наличия или отсутствия осложнений и от коморбидного состояния самого пациента.
В настоящее время, несмотря на современные методы диагностики, широкий спектр антибиотиков, доступные операции, частота встречаемости ИЭ не снизилась и по-прежнему сохраняются высокая заболеваемость и смертность. За последние годы произошли изменения в представлении о течении заболеваний, предрасполагающих факторах, осложнениях и возбудителях. Например, ревматическая болезнь сердца уступила лидирующие позиции дегенеративным заболеваниям, которые все чаще встречаются у пожилых больных (мужчин старше 60 лет и женщин старше 65 лет). У этой категории больных течение ИЭ имеет свои особенности, что может затруднить диагностику и отсрочить назначение правильного лечения.
Ранее заболевание встречалось у лиц молодого возраста с известным поражением, в большинстве случаев ревматическим, клапана сердца. Сегодня ИЭ все чаще поражает пожилых, у которых он развивается либо у больных с ранее неизвестной патологией клапана, либо у пациентов с протезированными клапанами, или вследствие других медицинских процедур. Пожилые пациенты предрасположены к инфекционным заболеваниям по ряду причин: из-за снижения иммунитета, физической активности, наличия коморбидных состояний, а также увеличения у этой категории больных числа кардиохирургических вмешательств, таких как протезирование клапанов, установка искусственных водителей ритма.
Известно, что у больных пожилого возраста ИЭ чаще встречается среди мужчин. Соотношение мужчин и женщин составляет от 1,2:1 до 3:1, хотя в возрасте старше 60 лет — 8:1. В исследовании Euro Heart Survey частота ИЭ у пожилых составила 26%. В другом исследовании — French survey — 33% больных были старше 67 лет.
Заболеваемость ИЭ от одной страны к другой колеблется в пределах 3—10 случаев/100 тыс. человек в год. Заболеваемость ИЭ в молодом возрасте достаточно низкая, но резко увеличивается с возрастом — пик заболеваемости составляет 14,5 эпизода/100 тыс. человек в год среди пациентов от 70 до 80 лет.
Недавно были опубликованы данные по 44 пациентам пожилого возраста с диагностированным ИЭ. Поражение МК было выявлено у 20 пациентов (45%), у14 больных (32%) был поражен аортальный клапан, и только у 2 больных (5%) были повреждены оба клапана. Эти данные перекликаются с крупным исследованием, включившим 15 демографических исследований, состоявших из 2371 случая ИЭ в семи развитых странах (Дания, Франция, Италия, Нидерланды, Швеция, Великобритания и США), где показано увеличение распространенности ИЭ, связанного с протезированием клапанов и пролапсом митрального клапана, и снижение частоты ИЭ, связанного с ревматической болезнью сердца.
Стрептококки группы D (S. bovis) становятся все более частой причиной ИЭ, особенно в пожилом возрасте при заболеваниях толстой кишки. При этом часто в процесс вовлечены несколько клапанов, а также наблюдается высокий риск эмболии. Также было показано, что у лиц старшего возраста часто встречается энтерококковый ИЭ.
Нормальный эндотелий клапана устойчив к колонизации и инфекции циркулирующих бактерий. Однако старческая дегенерация, механическое разрушение эндотелия воздействуют на базовые белки внеклеточного матрикса, выработку тканевого фактора, отложение фибрина и тромбоцитов. Такие небактериальные тромботические эндокардиты (НБТЭ) способствуют присоединению и бактериальных инфекций. Повреждение эндотелия может возникнуть также в результате механического повреждения, вызванного турбулентным потоком крови, электродами или катетерами, воспалением, таким как ревмокардит, или дегенеративными изменениями у пожилых пациентов, которые связаны с воспалением, микроязвами и микротромбами. При эхокардиографии дегенеративные поражения клапанов обнаруживаются у 50% бессимптомных больных старше 60 лет и такого же количества пожилых пациентов с ИЭ.
Основные признаки заболевания
ИЭ у пожилого пациента должен подозреваться в следующих ситуациях.
1. Появление нового сердечного шума регургитации.
2. Эмболические события неизвестного происхождения.
3. Сепсис неизвестного происхождения.
4. При перенесенном ИЭ в анамнезе.
5. Имеющаяся клапанная болезнь сердца или врожденные пороки сердца и лихорадка.
6. Другие предрасполагающие к ИЭ состояния (например, иммунодефицитные, в/в введение лекарств).
7. Недавно перенесенные вмешательства, связанные с бактериемией.
8. Необъяснимая застойная сердечная недостаточность.
9. Новые нарушения проводимости.
ИЭ следует подозревать, если у больного с внутрисердечным протезным материалом появляется лихорадка.
Перечислим теперь основные признаки, подтверждающие диагноз ИЭ. Это, во-первых, определение положительных культур крови с типичными каузативными возбудителями ИЭ или позитивные серологические результаты хронической Ку-лихорадки (микробиологические данные могут предшествовать сердечным проявлениям). Во-вторых, это сосудистые или иммунологические проявления: эмболические события, пятна Рота, точечные кровоизлияния, элементы Дженуэя, узелки Ослера. В-третьих, речь идет о фокальных или неспецифических неврологических симптомах и признаках, признаках легочной эмболии/инфильтрации (правосторонний ИЭ), периферических абсцессах неизвестной этиологии.
Лихорадка может отсутствовать у пожилых пациентов, особенно после предварительного лечения антибиотиками, у иммунодефицитных пациентов, а также при ИЭ, вызванном менее вирулентными или атипичными микроорганизмами. В связи с этим в группах повышенного риска для исключения ИЭ необходимо постоянно помнить о его возможности и включать его в алгоритм дифференциального диагноза неясных случаев.
Хирургический метод лечения у пожилых пациентов применяется реже, что, вероятнее всего, связано с более высоким оперативным риском из-за большого количества сопутствующих заболеваний, хотя возраст в современной кардиохирургии не является противопоказанием к проведению кардиохирургического вмешательства. В ряде исследований хирургическое лечение зарекомендовало себя как разумный вариант помощи в пожилом возрасте с теми же показаниями, что и у более молодых пациентов. 
Что касается ИЭ нативного клапана (ИЭНК), то, согласно рекомендациям Европейского сообщества кардиологов, кардиохирургического лечения, как правило, следует избегать только при правостороннем ИЭНК, но и его возможно рассматривать как допустимое при следующих особых ситуациях: правосторонняя сердечная недостаточность (СН), вторичная по отношению к тяжелой недостаточности трехстворчатого клапана с плохим ответом на диуретическую терапию; ИЭ, вызванный трудно излечиваемыми микроорганизмами; бактериемия в течение как минимум 7 дней, несмотря на адекватную антибактериальную терапию; вегетации трехстворчатого клапана > 20 мм, которые сохраняются после повторных легочных эмболий с или без сопутствующей правосторонней СН.
Таким образом, ИЭ является важным, атипично текущим заболеванием у пожилых больных. Частота его встречаемости растет из-за увеличения числа дегенеративных заболеваний и протезирования клапанов сердца. Кроме того, течение ИЭ может зависеть от характера сопутствующих заболеваний пациента. Следует также учитывать, что у пожилых пациентов больше вероятность реинфекции бактериями кишечника и мочевыводящих путей, что также снижает их выживаемость.
А.И. МУРСАЛИМОВА, ассистент кафедры,
Г.Е. ГЕНДЛИН, профессор, доктор медицинских наук,
Кафедра госпитальной терапии №2 РНИМУ им. Н.И. Пирогова
[youtube.player]Заболеваемость ИЭ составляет от 1,7 до 6,5 случаев на 100 ООО населения в год. Мужчины молодого и среднего возраста болеют в 1,5-3 раза чаще, чем женщины, а в возрастной популяции старше 60 лет — в 8 раз чаще. В последнее время отмечается четкая тенденция к нарастанию частоты заболеваемости ИЭ у лиц пожилого и старческого возраста. Ряд авторов отмечают особенности течения ИЭ в этой воз растной группе, более высокую летальность, трудности диагностики и дифференциального диагноза с различными заболеваниями, свойственными этой возрастной группе. В 80-е годы прошлого столетия у подавляющего большинства больных всех возрастных групп развитию ИЭ предшествовало ревматическое поражение сердца. У пожилых лиц в последние годы ревматические пороки предшествуют этому заболеванию уже не столь часто. Одной из причин, вызывающих поражение клапанов сердца у пожилых лиц, является атеросклероз, что в значительной степени увеличивает вероятность развития ИЭ.
В настоящее время атероматозные отложения на аортальных клапанах найдены на аутопсии у 25% больных, умерших от ИЭ.
Предрасполагающие факторы к возникновению ИЭ суммированы в табл. 20.5.
Значительно чаще у пожилых пациентов развивается внутрибольничный ИЭ как результат частых внутривенных вливаний, проводимых в стационарах.
Летальность от ИЭ у молодых и лиц среднего возраста составляет около 30%, у пожилых увеличивается почти вдвое, колеблясь от 50 до 60%.
Факторы, предрасполагающие к развитию ИЭ у пожилых лиц
Факторы, способствующие бактериемии
Приобретенные пороки сердца Атеросклеротическое поражение створок и атероматоз аорты Перенесенные ИЭ Клапанные протезы Гипертрофическая кардиомиопатия Пролапс митрального клапана с ре- гургитацией
Врожденные пороки сердца (открытый артериальный проток и дефект межжелудочковой перегородки)
Медицинские манипуляции: повторные капельные вливания через постоянный венозный катетер, уретроскопия и цистоскопия, имплантация искусственного водителя ритма,
аортокоронарное шунтирование и ангиопластика коронарных артерий, катетеризация легочной артерии, стоматологические манипуляции
Сахарный диабет Онкопатология, чаще опухоли толстой кишки Лечение иммунодепрессантами
Особенности этиологии ИЭ в пожилом и старческом возрасте:
- стрептококки, прежде всего S. viridans, так же как и у более молодых пациентов, занимают первое место среди возбудителей ИЭ.5. bovis в последние годы приобретает большее значение в развитии ИЭ, чаще у пожилых лиц, особенно на фоне онкологических и воспалительных заболеваний толстого кишечника (около 10% всех ИЭ);
- энтерококки являются возбудителями ИЭ не более чем в 10% случаев у молодых лиц, у пожилых частота выделения этих возбудителей увеличивается до 18-20% в связи с более частой катетеризацией уретры, операциями на предстательной железе, проведением других манипуляций на мочеполовом тракте и пищеварительной системе;
- ИЭ стафилококковой этиологии может возникать вследствие внутривенного введения лекарственных препаратов, в результате инфицирования постоянных внутривенных катетеров, развития тромбофлебита, инфекций дыхательных и мочеполовых путей. В некоторых случаях ИЭ может быть осложнением манипуляций на сердце и крупных сосудах. Описаны случаи развития стафилококкового ИЭ после операции аортокоронарного шунтирования, ангиографии и имплантации постоянного кардиостимулятора;
- бесконтрольный прием антибиотиков, наличие целого ряда сопутствующих болезней, не всегда обоснованно леченных антибиотиками, приводят к возрастанию у пожилых пациентов роли грибов родов Candida и Aspergillus;
у больных пожилого возраста, страдающих онкологическими и тяжелыми хроническими заболеваниями (циррозы печени, сахарный диабет, хроническая почечная недостаточность), а также получающих иммунодепрессанты и кортикостероиды, отмечают увеличение роли грамотрицательной микрофлоры в развитии ИЭ. Последняя доминирует при инфекциях мочеполовой системы. Чаще в качестве причин ИЭ фигурируют кишечная палочка , клебсиелла, протей, синегнойная палочка.
[youtube.player]Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубеж
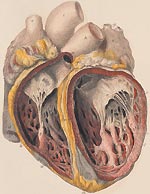
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубежом. По данным различных авторов, сегодня выросла заболеваемость в пожилом и старческом возрасте, а также среди лиц в возрасте до 30 лет, использующих внутривенное введение наркотиков [1, 2].
Известно, что ИЭ представляет собой заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде, протекающее с проявлениями системной инфекции, сосудистыми осложнениями и иммунной реакцией [3, 4, 5].
В данной работе обобщен опыт диагностики и ведения больных ИЭ на базе общетерапевтического отделения Александровской больницы Санкт-Петербурга за период 1998–2003 гг. Диагностика заболевания осуществлялась в соответствии с критериями Duke [8]. Диагноз ИЭ оценивался как достоверный при наличии двух главных критериев, а именно:
- при выделении типичного для ИЭ возбудителя при посевах крови больного;
- при определении эхокардиографических признаков поражения эндокарда - подвижные вегетации на клапанах сердца, абсцессов в области протеза клапана; образования внутрисердечных фистул и др., в сочетании с тремя или/и пятью вспомогательными критериями, к которым относились сосудистые осложнения (эмболии крупных артерий, септические инфаркты легких, внутричерепные кровоизлияния и др.), иммунологические феномены (гломерулонефрит, узелки Ослера, геморрагический васкулит и др.), а также фебрильная лихорадка, гепато-спленомегалия и другие проявления системной инфекции.
Нами было проведено обследование 105 больных ИЭ, из них у 80 человек в возрасте от 18 до 30 лет (первая группа) основным фактором риска заболевания являлась инъекционная наркомания.
Во второй группе больных (25 чел.) основными предрасполагающими факторами развития ИЭ были врожденные и приобретенные пороки сердца, а также протезированные клапаны.
У лиц старшей возрастной группы дополнительным фактором риска являлись дегенеративно-дистрофические изменения клапанов сердца.
Взаимосвязь характера поражения клапанов сердца и факторов риска ИЭ представлена в таблице 1.
По данным эхокардиографического исследования, у 100% больных первой группы были выявлены подвижные вегетации на створках трикуспидального клапана (ТК), что сопровождалось формированием его недостаточности I—III степени.
Во второй группе больных ИЭ отмечалось поражение левых камер сердца с образованием вегетаций на створках аортального и митрального клапанов. Изолированное поражение митрального клапана наблюдалось у двух человек с ревматическим пороком сердца (митральный стеноз), у одной больной с врожденным дефектом межжелудочковой перегородки и в единственном случае обструктивной формы гипертрофической кардиомиопатии.
Среди лиц пожилого и старческого возраста у девяти человек (36%) определялось изолированное поражение аортального клапана в отсутствии признаков аортального стеноза. Наряду с этим, у пяти больных (20%) в возрасте от 72 до 87 лет ИЭ развился на фоне аортального порока атеросклеротического генеза, причем у всех пятерых было выявлено сочетанное поражение аортального и митрального клапанов. Дегенеративно-дистрофические изменения других клапанов сердца определялись у 100% больных старшей возрастной группы.
Образование вегетаций на створках аортального клапана наблюдалось у двух больных с третичной формой сифилиса на фоне имеющегося аортального порока, связанного со специфическим процессом в аорте.
В двух случаях мы наблюдали развитие эндокардита протезированных клапанов.
При сопоставлении результатов посевов крови в двух группах больных определялись существенные различия как в частоте выделения микробной флоры, так и в видовом составе возбудителей эндокардита. По нашим данным, возбудителем ИЭ у больных-наркоманов в 71,3% наблюдений (57 чел.) являлся золотистый стафилококк, тогда как во второй группе, наряду с кокковой флорой, чаще обнаруживались грамотрицательные микроорганизмы (28%). Отрицательные результаты посевов крови значительно реже наблюдались в первой, чем во второй, группе больных ИЭ: 18,7% и 56% — соответственно. Данные относительно этиологической структуры ИЭ в обследуемых группах больных представлены в таблице 2.
Клиническое течение и характер осложнений инфекционного эндокардита во многом зависят от локализации клапанных вегетаций — в правых или левых камерах сердца, а также степени вирулентности возбудителя заболевания.
Течение ИЭ у больных-наркоманов отличалось особой тяжестью и полисиндромностью. Причиной госпитализации у большинства больных были острые осложнения основного заболевания. Значительная часть больных поступала в реанимационное отделение стационара с клиническими симптомами одно- или двухсторонней многофокусной пневмонии, причиной которой являлась септическая тромбоэмболия ветвей легочной артерии (72% больных). Течение пневмонии сопровождалось тяжелой дыхательной недостаточностью, нередко с развитием респираторного дистресс-синдрома (РДСВ) и очагами деструкции в легких (12%). Проявления вторичной нефропатии, которые обнаруживались у 100% больных в первой группе, иногда ошибочно трактовались как обострение хронического гломеруло- или пиелонефрита, мочекаменной болезни, что служило поводом для госпитализации этих больных в урологическое и нефрологическое отделения.
Во второй группе больных основной причиной госпитализации была длительная фебрильная лихорадка в сочетании с анемией и гепатолиенальным синдромом. Наряду с этим, у пяти человек (20%) поводом для госпитализации послужила прогрессирующая сердечная недостаточность.
Основные клинические синдромы, наблюдаемые у больных ИЭ первой и второй групп, представлены в таблице 3.
По нашим наблюдениям, характерной особенностью клинического течения ИЭ у больных-наркоманов являлась высокая частота септической ТЭЛА с формированием множественных очагов инфильтрации в легких. У многих больных легочные тромбоэмболии носили рецидивирующий характер (31,3% больных) и нередко осложнялись развитием деструктивных очагов в легких.
Образование вегетаций у 100% больных первой группы сопровождалось недостаточностью трехстворчатого клапана I—III степени с формированием потоков регургитации. Вместе с тем, у большинства пациентов не определялось тяжелых нарушений центральной гемодинамики, связанных с дисфункцией ТК. В данной группе больных характерной клинической особенностью был обратимый характер нарушений гемодинамики на фоне проводимой терапии. Острая сердечная недостаточность с дилятацией полостей сердца и снижением фракции выброса до 40% и ниже наблюдалась у 28 больных (35,3%) в связи с присоединением острого миокардита или на фоне сочетанного поражения клапанов сердца.
Вторичная нефропатия являлась одним из самых распространенных синдромов в первой группе больных ИЭ. Острая почечная недостаточность наблюдалась у 16 больных, причем у 10 из них она носила обратимый характер и была связана с острым ДВС-синдромом, а также с острой сердечной недостаточностью с отеками. Инфекционно-токсическая нефропатия регистрировалась в 73,8% наблюдений и сопровождалась мочевым синдромом — гематурией, протеинурией, лейкоцитурией — при достаточном уровне клубочковой фильтрации.
Характерной особенностью ИЭ во второй группе было подострое течение заболевания с длительным периодом лихорадки на догоспитальном этапе, причем в пожилом и старческом возрасте лихорадка носила субфебрильный характер с редкими подъемами температуры до фебрильных цифр.
Большинство больных подострым инфекционным эндокардитом (ПИЭ) поступали в стационар в стадии развернутой клинической картины заболевания с клиническими признаками тромбоэмболии сосудов большого круга кровообращения. В данной группе больных наиболее распространенными следует признать такие осложнения, как церебральные эмболии с развитием ишемических и геморрагических инсультов, эмболии почечных сосудов с болевым синдромом и гематурией, а также формирование острых очаговых изменений в миокарде, связанных с эмболией коронарных сосудов или прикрытием устьев коронарных артерий вегетациями [9].
Септические тромбоэмболии церебральных сосудов нередко сопровождались развитием гнойного менингоэнцефалита с летальным исходом. Вместе с тем, при посевах крови у 56% больных второй группы не получено роста микробной флоры. Обращает на себя внимание тот факт, что септицемия у больных с положительными результатами посевов крови в 28% наблюдений была обусловлена грамотрицательной микрофлорой. В этой категории больных источником бактериемии являлись очаги хронической инфекции в мочеполовой системе, а у двух больных (по данным аутопсии) был выявлен двухсторонний апостематозный нефрит.
У значительного числа больных ПИЭ (62%) определялись признаки острой недостаточности кровообращения с застойными хрипами в легких, легочной гипертензией, увеличением полостей сердца и периферическими отеками.
В этой группе больных чаще, чем в первой, наблюдалась преренальная азотемия и ОПН, связанные с развитием острой недостаточности кровообращения.
Острый диффузный миокардит, типичными проявлениями которого были различные нарушения ритма, диагностирован у 27% больных второй группы.
Анемия со снижением уровня гемоглобина до 80 г/л и менее выявлена у 100% больных второй группы. Значительное увеличение СОЭ (более 45 мм/ч) наблюдалось у 85,8% больных подострым ИЭ.
Кожные изменения в виде геморрагических высыпаний, пурпуры Шенлейн-Геноха, а также другие проявления иммунного воспаления в обеих группах больных встречались нечасто — 6,3 и 4% в первой и второй группах, соответственно.
Консервативная терапия больных ИЭ проводилось с использованием антибиотиков широкого спектра действия в сочетании со средствами дезинтоксикационной, антикоагулянтной и метаболической терапии. В составе антибактериальной терапии больные получали цефалоспорины III-IV поколений в комбинации с аминогликозидами и метронидазолом. Из группы цефалоспоринов назначались: цефтриаксон (лонгацеф) 2 г в сутки внутривенно (в/в), или цефотаксим (тальцеф) 2 г в сутки в/в, или цефепим (максипим) 2 г в сутки в/в в сочетании с аминогликозидами (амикацин в суточной дозе 1,5 г в/в) и метронидазолом по 1,5-2 г в сутки в/в. В случае, если такая терапия оказывалась неэффективной или существовали противопоказания к вышеперечисленным препаратам, применялись антибиотики группы линкозаминов: клиндамицин 1,2 г в сутки в/в или линкомицин 3 г в сутки в/в в сочетании со фторхинолонами (ципрофлоксацин 400 мг в сутки в/в). В условиях отделения реанимации в течение пяти–семи дней проводилась терапия имипинемом (тиенамом) в дозе 2—4 г в сутки в/в или рифампицином в суточной дозе 0,45—0,6 г в/в. Средняя продолжительность курса антибиотикотерапии в обследуемой группе больных составила 28 + 3,5 дней.
Дезинтоксикационная терапия включала в себя внутривенные инфузии реополиглюкина, гемодеза, поляризующих смесей в сочетании с петлевыми диуретиками. Объем вводимой жидкости составлял в среднем 2-2,5 л в сутки. В течение всего периода инфузионной терапии осуществлялся контроль за функциональным состоянием почек, электролитным составом крови, суточным диурезом. В условиях отделения реанимации у всех больных осуществлялся мониторинг ЦВД. Инфузионная терапия проводилась в течение всего острого периода заболевания до купирования проявлений интоксикационного синдрома. Средняя продолжительность курса составила 22 + 4,5 дня.
Развитие легочной эмболии, особенно в сочетании с признаками острого ДВС-синдрома в стадии гиперкоагуляции, служило основанием для назначения антикоагулянтной терапии. Начальная доза гепарина составляла 10 тыс. ЕД внутривенно, струйно, за-тем — по 1000 ЕД в час внутривенно, капельно с переходом на подкожное введение до 30 тыс. ЕД в сутки. Введение гепарина осуществлялось под контролем показателей коагулограммы и времени свертывания крови. Одновременно проводились внутривенные трансфузии свежезамороженной плазмы по 300 мл в сутки с добавлением 2500–5000 ЕД гепарина. Анемия тяжелой степени (Нb менее 80 г/л, Ht ≤25) корригировалась переливаниями эритроцитарной массы (пять–семь доз). При наличии гипопротеинемии использовалось введение растворов аминокислот, альбумина или нативной плазмы. Выявление клинических и рентгенологических признаков отека легких на фоне рецидивирующего течения септической ТЭЛА служило показанием для назначения кортикостероидов (преднизолон от 120 до 200 мг в сутки внутривенно капельно). Терапия антикоагулянтами прямого действия в сочетании с трансфузиями криоплазмы проводилась до стойкого улучшения показателей гемостаза. Критериями нормокоагуляции являлись уровень фибриногена в плазме 3-4 г/л, отсутствие тромбоцитопении, нормализация ВСК, АЧТВ, тромбинового времени, а также отрицательные паракоагуляционные тесты. По нашим данным, купирование проявлений острого ДВС-синдрома на стадии гиперкоагуляции у 75% больных отмечалось на седьмой–десятый день от начала комплексной терапии.
У части больных формировалась резистентность к проводимой антибактериальной терапии, которая характеризовалась нарастанием интоксикации, фебрильной лихорадкой, прогрессирующей анемией, а также высевами из крови возбудителя ИЭ – золотистого стафилококка — в 65% наблюдений. При рентгенологическом обследовании данной категории больных с большой частотой определялись очаги деструкции легочной ткани, а у трех больных гнойный выпот в плевральной полости.
Длительное применение антибиотиков широкого спектра действия у 70,3% больных (38 чел.) сопровождалось развитием побочных эффектов антибактериальной терапии. Кандидоз полости рта глотки, пищевода, а также кишечный дисбактериоз III-IV стадии был выявлен у 36 больных (66,7%). Применение антибиотиков с гепатотоксическими свойствами (цефалоспорины, линкозамины, метронидазол) у двух больных (3,7%) с хроническим гепатитом С и В приводило к прогрессированию печеночной недостаточности, которая сопровождалась высокой ферментемией (АЛТ 1500 ЕД, АСТ 1000 ЕД) и желтухой.
Развитие застойной сердечной недостаточности с появлением акроцианоза, влажных хрипов в базальных отделах легких, периферических отеков в сочетании с кардиомегалией и падением фракции выброса до 50—45% наблюдалось у пяти больных (9,3%) на фоне массивной инфузионной терапии.
Длительная антикоагулянтная терапия в 20,4% (11 чел.) наблюдений сопровождалась повышением толерантности плазмы к гепарину, что клинически выражалось в развитии периферических флеботромбозов, в то время как гепарининдуцированной тромбоцитопении в обследуемой группе больных мы не наблюдали.
Положительные результаты консервативной терапии были получены у 70,2% больных (56 чел.) с поражением ТК и лишь у 32% пациентов (6 чел.) из второй группы. Исходом ИЭ в обеих группах больных являлось формирование недостаточности клапанов сердца.
Госпитальная летальность при ИЭ у наркозависимых лиц составила 29,4% (24 чел.), тогда как у больных с поражением левых камер сердца (вторая группа) уровень смертности составил 68% (19 чел.).
По данным аутопсии, основными причинами смерти больных ИЭ были:
- септикопиемия с формированием гнойных очагов в печени, почках селезенке, головном мозге с развитием полиорганной недостаточности (46,2%);
- сердечная недостаточность на фоне полипозно-язвенного эндокардита с разрушением клапанов сердца, а также острый миокардит с дилятацией полостей сердца (39,4%);
- вторичная нефропатия с развитием почечной недостаточности, отеком легких, отеком головного мозга (14,4%).
Таким образом, характерные особенности ИЭ у лиц с наркотической зависимостью — это острое течение заболевания с поражением правых камер сердца и рецидивами септической ТЭЛА. Возбудителем ИЭ у инъекционных наркоманов в 71,3% является высоковирулентный золотистый стафилококк. Формирование недостаточности трехстворчатого клапана I—III степени стало самым распределенным осложнением ИЭ у наркоманов. При этом у большинства больных не наблюдается тяжелых нарушений центральной гемодинамики, приводящих к развитию острой недостаточности кровообращения.
Подострый ИЭ у больных с предрасполагающими заболеваниями сердца, а также у лиц пожилого и старческого возраста протекает с преимущественным поражением левых камер сердца, причем в старшей возрастной группе преобладает моноклапанное поражение. Наличие сопутствующей патологии у лиц старше 60 лет маскирует течение основного заболевания, чем и обусловлены поздняя диагностика и высокая смертность больных. Для затяжного течения ИЭ характерна низкая высеваемость возбудителя, по сравнению с острыми формами заболевания. Развитие тромбоэмболий сосудов большого круга кровообращения является характерной клинической особенностью подострого ИЭ.
Положительный эффект от проводимой консервативной терапии наблюдается у большинства больных ИЭ с поражением ТК, тогда как при подостром эндокардите левых камер сердца консервативная терапия является малоэффективной у большинства больных.
Госпитальная летальность в обеих группах больных обусловлена диссеминацией возбудителя с формированием гнойных очагов и полиорганной недостаточностью, а также развитием острой недостаточности кровообращения и вторичной нефропатии.
- Буткевич О. М., Виноградова Т. Л. Инфекционный эндокардит. - М., 1997.
- Симоненко В. Б., Колесников С. А. Инфекционный эндокардит: современное течение, диагностика, принципы лечения и профилактики. - Клин. мед., 1999. - 3. - С. 44-49.
- Тазина С. Я., Гуревич М. А. Современный инфекционный эндокардит. - Клин. мед.,1999. - 12. - С. 19-23.
- Bansal R. C. Infective endocarditis. Med Clin North America 1995; 79 (5): 1205-1239.
- Bayer A. S., Bolger A. F., Taubert K. A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-2948.
- McKinsey D. S., Ratts T. E., Bisno A. I. Underlying cardiac lesions in adults with infective endocarditis. The changing spectrum. Amer J Med 1987; 82: 681-688.
- Lamas C. C. Eykyn S. J. Suggested modifications to the Duke criteria for the clinical diagnosis of native valve and prosthetic valve endocarditis: analysis of 118 pathologically proven cases. Clin Infect Dis 1997; 25: 713-719.
- Durack D. T., Lukes A. S., Bright D. K. et al. New criteria for diagnosis of Infective Endocarditis Utilization of Specific Echocardiographic Finding. Amer J Med 1994; 96: 200-209.
- Тюрин В. П., Дубинина С. В. Инфекционный эндокардит у лиц пожилого и старческого возраста. - Клин. мед., 2000. - 4. - С. 53-56.
В. И. Уланова
В. И. Мазуров, доктор медицинских наук, профессор
Медицинская академия последипломного образования, Санкт-Петербург
Читайте также:


