Мнс и предрасположенность к инфекциям аутоиммунной патологии
Читайте также:
|
| Патоген | Человеческие белки | Длина совпадающих первичных последовательностей |
| Человеческий цитомегаловирус | Молекулы HLA-DR | 5 аминокислот |
| Вирус полиомиелита | рецептор к ацетилхолину | 6 аминокислот |
| Вирус папилломы Е2 | рецептор к инсулину | 6 аминокислот |
| Гликопротеин вируса бешенства | рецептор к инсулину | 6 аминокислот |
| Klebsiella pneumonia nitrogenase | молекула HLA – В27 | 6 аминокислот |
| Аденовирус 12 Е1В | a–глиадин | 7 аминокислот |
| ВИЧ, р24 | постоянный домен IgG | 8 аминокислот |
| Вирус кори, Р3 | кортикотропин | 7 аминокислот |
| Вирус кори, Р3 | основной белок миелина | 7 аминокислот |
Считается, что молекулярная мимикрия участвует в индукции ревматизма: Streptococcus pyogenes группы А (β-гемолитический стрептококк группы А) вызывает синтез антител, которые реагируют с белком М стрептококка и с сердечной мышцей. Еще одним ярким примером является возникновение аутоиммунного поствакцинального энцефалита у некоторых людей после проведения им вакцинации против бешенства. Так как один из пептидов основного белка миелина имеет участок, высоко гомологичный пептиду Р3 вируса кори, то одним из редких осложнений вакцинации против кори является аутоиммунное поражение миелиновой оболочки, которое может послужить пусковым механизмом возникновения рассеянного склероза.
Компьютерный анализ показал наличие гомологичных последовательностей между основным белком миелина и большим числом пептидов, полученных из вирусов человека и животных, включая вирусы гриппа, полиомы, аденовирусы, вирусы полиомиелита, Эпштейна-Барра и гапатита В. Особенно высокая степень гомологии обнаружена между белком одним из ферментов вируса гепатита В и основным белком миелина. Кроликов иммунизировали эти пептидом из вируса гепатита В, и в результате у них был обнаружен синтез антител и пролиферация Т-лимфоцитов, которые перекрестно реагировали с основным белком миелина.
Эти данные показывают, что инфицирование определенными вирусами, экспрессирующими эпитопы, обладающие молекулярной мимикрией к собственным секвестрированным антигенам, таким как основной белок миелина, может индуцировать аутоиммунный ответ к этим компонентам. Чувствительность к такому типу аутоиммунных реакций может также зависеть от МНС-гаплотипа индивидуума, так как определенные молекулы МНС I и II класса могут более эффективно представлять гомологичные пептиды патогенов, вызывая активацию аутореактивных Т-лимфоцитов.
Другим механизмом, способствующим индукции аутоиммунных процессов при инфекции, в первую очередь вирусной, является неадекватная экспрессия молекул МНС I класса на инфицированных клетках, что может привести к активации аутореактивных клонов Т-лимфоцитов. Показано, что у здоровых людей на β-клетках поджелудочной железы белки МНС I класса почти не экспрессируются, в то время как у больных инсулинозависимым диабетом обнаружен высокий уровень экспрессии этих белков. Установлено также, что вирусная инфекция может вызвать локальный воспалительный ответ в пораженном органе, приводящий к повышению продукции IFN-γ, который в свою очередь стимулирует экспрессию молекул МНС на β-клетках поджелудочной железы.
У некоторых людей иммунный ответ против инфекции заканчивается после элиминации патогена, вслед за этим заканчивается и возникший в результате эпитопного распространения ответ против собственных антигенов инфицированной ткани (аутоиммунный компонент инфекционного заболевания). У других же людей (генетически предрасположенных, например) даже после окончания иммунного ответа против элиминированного патогена аутоиммунный ответ против собственных тканей продолжается и прогрессирует. У них аутоиммунный компонент инфекционного заболевания перерастает в истинное аутоиммунное заболевание, продолжающееся и после удаления триггерного фактора.
Эпитопное распространение, по-видимому, лежит в основе патогенеза гемолитической анемии, возникшей при инфицировании некоторых людей бактерией Mycoplasma pulmonis. Антитела против этого патогена, относящееся к IgM, могут присоединяться как к собственным полисахаридам бактерий, так и к структурно похожим олигосахаридам антигена I эритроцитов, вызывая их комплементзависимый лизис. Таким образом происходит эпитопное распространение антительного ответа с бактериального компонента на структурно похожий компонент собственных клеток организма.
Механизм эпитопного распространения, скорее всего, участвует в патогенезе экспериментального аллергического энцефаломиелита (ЭАЭ) у мышей, вызванного вирусом мышиного энцефаломиелита Тейлера (Theiler), который является природным патогеном для мышей. Повреждения, вызванные вирусом у этих мышей, приводят в результате эпитопного распространения к активации клонов, аутореактивных к протеолипидам миелиновой оболочки. Именно эти клоны активируются при индукции ЭАЭ в результате иммунизации мышей миелиновыми белками или пептидами в результате эпитопного распространения без участия вируса.
Ещё одним механизмом, способствующим возникновению аутоиммунных заболеваний при инфекциях, является поликлональная активация лимфоцитов.
Причиной такой активации могут служить суперантигены – белки, продуцируемые бактериями или вирусами, которые, присоединяясь к цепям антигенраспознающего рецептора (неспецифически) и одновременно к молекулам МНС, представляющим пептиды суперантигена на поверхности антигенпредставляющих клеток, вызывают сильную поликлональную активацию Т-лимфоцитов, в том числе и аутореактивных, тем самым индуцируя аутоиммунный ответ. Примером таких суперантигенов может служить суперантиген Mycoplasma arthritidis, вызывающий артрит.
Поликлональную активацию В-лимфоцитов могут вызвать самые различные вирусы и бактерии: многие граммотрицательные бактерии, вирус Эпштейна-Барра и цитомегаловирусы, которые являются известными поликлональными активаторами, индуцирующими пролиферацию многочисленных клонов В-лимфоцитов, которые синтезируют IgM в отсутствие Т-хелперов. Если при этом активируются и аутореактивные клоны В-клеток, то начинается синтез аутоантител. Например, при инфекционном мононуклеозе, который вызывается вирусом Эпштейна-Барра, синтезируется множество аутоантител против различных собственных антигенов, включая антитела против Т- и В-лимфоцитов, антиядерные антитела и ревматоидный фактор. Подобным же образом лимфоциты больных СКВ продуцируют большие количества IgM против различных собственных антигенов. У многих больных СПИДом также обнаруживается высокий уровень аутоантител к эритроцитам и тромбоцитам. Эти больные часто бывают одновременно инфицированы и другими вирусами, в том числе вирусом Эпштейна-Барра и ЦМВ, которые также вызывают поликлональную В-клеточную активацию.
В последнее время интенсивно изучается ещё один механизм индукции аутоиммунной патологии, связанный с костимулирующей функцией антигенпредставляющих клеток (АПК), которая активируется инфекционными патогенами. Некоторые инфекционные агенты, паразитируя внутриклеточно в АПК, могут обеспечивать костимулирующие сигналыдля аутореактивных лимфоцитов, что может привести к их пролиферации, активации и нарушению периферических механизмов иммунологической толерантности к собственным антигенам. В роли таких АПК чаще всего выступают дендритные клетки (ДК).
Однако у некоторых людей абортивная активация может быть несовершенной, и активированные аутореактивные Т-лимфоциты атакуют собственные ткани организма. Такому срыву периферической толерантности может способствовать целый ряд факторов: генетическая предрасположенность, наличие вторичных иммунодефицитов и особенно – наличие очагов хронической инфекции.
Из изложенного видно, что среди неблагоприятных факторов внешней среды инфекции принадлежит ведущая роль в возникновении аутоиммунных заболеваний. Инфекционные агенты провоцируют нарушения механизмов периферической толерантности путем воздействия на различные звенья врожденного и адаптивного иммунитета, начиная с процессинга антигенов в АПК и заканчивая пролиферацией и дифференцировкой аутореактивных клонов эффекторных лимфоцитов. Исследования в этой области призваны углубить понимания механизмов патогенеза этой широко распространенной группы заболеваний человека, что позволит совершенствовать диагностику, лечение и разработать меры их профилактики.
Дата добавления: 2015-01-19 ; просмотров: 74 ; Нарушение авторских прав
[youtube.player]
Как и для большинства других заболеваний, некоторые особенности ДНК могут влиять на предрасположенность к развитию аутоиммунных болезней.
В последнее время для поиска связи между отдельными изменениями в генах и фенотипическим их проявлением (например, болезнью) часто применяют методику полногеномного поиска ассоциаций — GWAS, в которой сравниваются геномы больных и здоровых людей. Эта техника позволила ученым выявить больше генов, чья вариативность может привести к атаке иммунной системы на свой организм, и уточнить механизмы патологий. Таким способом можно обнаружить даже минимальное отличие: например, в один нуклеотид.
Есть и практическое применение новых данных: выявляется больше мишеней для потенциальных терапевтических разработок. Кроме того, это поможет стратифицировать пациентов с одной болезнью — разнести их по разным группам по серьезности и клиническим проявлениям, ведь у разных людей течение заболевания отличается. Например, при ревматоидном артрите важны возраст человека на момент начала болезни, число пораженных суставов, и внесуставные осложнения появляются не у всех.
Генетические изменения МНС класса I, например, связывают с такими аутоиммунными заболеваниями суставов, как псориатический артрит, анкилозирующий спондилит. МНС класса II — с ревматоидным артритом, ювенильным идиопатическим артритом.
Блокада провоспалительного фактора некроза опухолей (ФНО, или TNF) на фоне его гиперэкспрессии показала хорошие результаты при ревматоидном артрите и болезни Крона. Кроме того, анти-ФНО терапия эффективна и у многих пациентов с ювенильным ревматоидным артритом, язвенным колитом, псориазом, псориатическим артритом и анкилозирующим спондилитом.
Были обнаружены и другие полиморфизмы предрасположенности к аутоиммуным заболеваниям, например, IRF5, STAT4, bank1, PTPN22, IL23R и ICAM3.
Накапливается все больше данных, что изменение кишечной микробиоты тоже связано с аутоиммунными болезнями. Например, экспансия Prevotella copri из кишечника коррелирует с недавно обнаруженным ревматоидным артритом. Похожие данные получают и в моделях на животных: генетические факторы влияют на кишечную флору, а та, в свою очередь, изменяет риски развития аутоиммунных заболеваний.
Еще одна группа генов, которые могут повысить риски развития болезни, не человеческие. Не секрет, что у большинства европейцев 1-4% генома — от неандертальцев. Как говорят исследования, такие гены могут быть связаны с развитием диабета, системной красной волчанки, билиарного цирроза печени и болезни Крона. Предполагается, что в организме неандертальцев эти части ДНК играли другую роль. Однако результат попадания в геном современного человека, при том что образ жизни изменился за тысячи лет, оказался неблагоприятным. Одним из последствий может быть слишком бурная реакция иммунной системы на те угрозы, которые больше не актуальны, — например, на паразитических червей.
Несколько лет назад ученые открыли систему защиты бактерий, распознающую и разрушающую ДНК нападающих вирусов. Созданная на ее основе технология редактирования ДНК CRISPR успешно исследуется в лабораториях, но введение в клиническую практику зависит от того, удастся ли применить ее в организме человека. В случае успеха это откроет путь к лечению генетических причин болезней.
Помимо этого, более трети различий в экспрессии генов между людьми не объясняются генетикой. Вполне возможно, что эти нахождения вызваны внешними факторами, например, питанием или уровнем стресса. Эти данные объясняют ситуацию, когда только у одного близнеца из пары развивается аутоиммунное заболевание.
Влияние образа жизни на эпигенетику подтверждают не только исследование из Стэнфордского университета. В 2014 году ученые систематически проанализировали 329 исследований разных стран по отношениям между между ожирением, адипокинами (гормонами жировой ткани) и болезнями, связанными с иммунитетом. Оказалось, что адипокины участвуют в патогенезе таких заболеваний, как ревматоидный артрит, рассеянный склероз, сахарный диабет первого типа, псориаз, воспалительное заболевание кишечника, псориатический артрит и тиреоидит Хашимото. "У нас был длинный список причин аутоиммунных расстройств: инфекции, курение, пестициды, недостаток витаминов и прочее. Но за последние пять лет появился новый фактор, который невозможно игнорировать, — ожирение«,— комментирует руководитель исследования Иехуда Шонфельд (Yehuda Shoenfeld). Помимо этого, результатом ожирения оказался дефицит витамина D.
Аутоиммунное заболевание может спровоцировать и слишком большое потребление соли. В нескольких работах было показано, что некоторые формы этих болезней ассоциированы с повышенным количеством иммунных клеток Т-хэлперов 17 (Th17), секретирующих интерлейкин 17 и другие цитокины, участвующие в иммунном ответе. Ученые из Массачусетского технологического института (Massachusetts Institute of Technology), использовав технологию манипулирования генами исследователей из Гарвардского университета (Harvard University) в Кембридже, показали, что при культивировании мышиных клеток в среде с повышенной соленостью увеличиваются экспрессия SGK1 (serum glucocorticoid kinase 1), которая регулируют концентрацию хлористого натрия, и количество Th17.
Было показано и в мышиной модели рассеянного склероза, что на диете с высоким потреблением соли ускоряется прогрессирование болезни. Ученые пока остерегаются давать жесткие заключения насчет человека, но, как разумно отмечает Дэвид Хафлер (David Hafler) из Йельского университета, руководитель одной из работ, питание с низким содержанием соли в любом случае полезнее.
Доктор Стэйси Банерджи (Stacy Banerjee) из Salusity, компании дистанционного мониторинга хронических заболеваний, говорит, что стресс может привести к обострению болезни Крона, ревматоидного артрита и псориаза.
Исследователи из Корнельского университета (Cornell University) использовали животную модель для изучения рассеянного склероза. Оказалось, что мыши, получавшие дозу кофеина, эквивалентную шести — восьми чашкам кофе в день для человека, были защищены от развития вызванного аутоиммунного энцефаломиелита, животного аналога рассеянного склероза. Ученые объясняют это тем, что кофеин — известный блокатор рецептора аденозина, связанного с инфильтрацией центральной нервной системы иммунными клетками.
[youtube.player]Аутоиммунные процессы и аутоиммунные заболевания
Связь аутоиммунитета с патологией
Иммунная система способна реагировать на огромное число разнообразных агентов, и поскольку репертуар специфичностей В - и Т-клеток формируется случайным образом, он неизбежно включает множество молекул, специфичных по отношению к компонентам собственного организма. Для предупреждения аутореактивности действуют необходимые механизмы аутотолерантности, позволяющие различать "свои" и "не-свои" антигенные детерминанты. Однако, как в любой системе, при работе механизмов аутотолерантности существует риск нарушений. Известен целый ряд заболеваний, при которых имеют место аутоиммунные проявления, обусловленные избыточным образованием аутоантител и аутореактивных Т-клеток.
В качестве одного из примеров поражения, связанного с продукцией аутоантител, можно назвать тиреоидит Хасимото. Он исследован особенно подробно, и многие рассматриваемые в данной работе аспекты аутоиммунных заболеваний трактуются на основе сведений, полученных при изучении именно этого состояния. Тиреоидит Хасимото представляет собой болезнь щитовидной железы и чаще всего поражает женщин среднего возраста, приводя к формированию зоба и гипотиреозу. Железа при этом инфильтрирована воспалительными лимфоидными клетками, среди которых преобладают моноядерные фагоциты, лимфоциты и плазматические клетки; кроме того, в ней, как правило, образуются вторичные лимфоидные фолликулы. Часто при болезни Хасимото происходит регенерация тиреоидных фолликулов, что отличает это заболевание от другого подобного состояния - первичной микседемы, которая связана с аналогичными иммунологическими нарушениями, но сопровождается почти полным разрушением и резким уменьшением размеров щитовидной железы.
Сыворотка больных тиреоидитом Хасимото, как правило, содержит антитела к тиреоглобулину. При высоком титре их можно обнаружить с помощью реакций гемагглютинации и преципитации. У многих больных имеются и антитела к цитоплазматическому антигену, который локализован на апикальной поверхности фолликулярных эпителиальных клеток и представляет собой тиреоидную пероксидазу - фермент, йодирующий тиреоглобулин.
Спектр аутоиммунных заболеваний
Антитела, характерные для тиреоидита Хасимото и первичной микседемы, реагируют только с компонентами ткани щитовидной железы, и поэтому развивающийся патологический процесс носит сугубо локальный характер. Напротив, при таких заболеваниях, как, например, системная красная волчанка, сыворотка реагирует с компонентами многих, если не всех, тканей организма. Один из основных видов антител, характерных для СКВ, взаимодействует с клеточным ядром. Эти два заболевания образуют противоположные края спектра аутоиммунных болезней.
Органами-мишенями при органоспецифических заболеваниях часто оказываются щитовидная железа, надпочечники, желудок и поджелудочная железа. При органонеспецифических болезнях, в том числе ревматологических, обычно возникают поражения кожи, почек, суставов и мышц.
У одного человека может быть сразу несколько аутоиммунных заболеваний
Характерно, что аутоиммунные заболевания, находящиеся на одном краю спектра, часто встречаются вместе. У больных пернициозной анемией нередко обнаруживаются антитела к щитовидной железе, и среди таких больных аутоиммунные заболевания щитовидной железы встречаются чаще, чем в общей популяции. Точно так же, при аутоиммунных заболеваниях щитовидной железы у больных часто присутствуют аутоантитела к тканям желудка и клинические проявления пернициозной анемии.
Занимающие другой край спектра, ревматологические заболевания также сочетаются друг с другом. Например, признаки ревматоидного артрита часто сопутствуют клиническим проявлениям СКВ. При этих заболеваниях имеет место системное отложение иммунных комплексов, наиболее значительное в почках, суставах и коже. Оно приводит к нарушениям в работе многих органов. В то же время болезни, относящиеся к разным краям спектра, сочетаются друг с другом относительно редко.
Механизмы повреждений. тканей при аутоиммунных заболеваниях различны и зависят от места расположения данного заболевания в спектре. В тех случаях, когда антиген локализован в каком-либо одном органе, наибольшее значение имеют гиперчувствительность II типа и клеточные реакции. При органонеспецифических аутоиммунных заболеваниях основную роль играет отложение иммунных комплексов, ведущее так или иначе, в том числе путем активации комплемента и фагоцитоза, к воспалению.
Генетические факторы
Аутоиммунные заболевания могут быть семейными.
Существование семейных случаев аутоиммунных заболеваний - это четко установленный факт. Результаты исследований на одно - и разнояйцевых близнецах, а также данные об ассоциации тиреоидных аутоантител с Х-хромосомными аберрациями убеждают в том, что в основе семейных случаев лежат именно генетические факторы, а не влияние окружающей среды.
Семейные аутоиммунные заболевания чаще всего относятся к органоспецифическим. При этом генетические факторы определяют не только общую предрасположенность к появлению органоспецифических антител, но и тот орган, против компонентов ткани которого они преимущественно направлены. Характерно, что у родственников больных тиреоидитом Хасимото или пернициозной анемией частота обнаружения и титры тиреоидных аутоантител выше, чем в норме, а у родственников больных пернициозной анемией гораздо чаше присутствуют аутоантитела к компонентам ткани желудка. Таким образом, существуют генетические факторы, определяющие избирательность поражения желудка при этой группе органоспецифических аутоиммунных заболеваний.
Предрасположенность к аутоиммунным заболеваниям связана с определенными гаплотипами HLA.
Дальнейшим доказательством роли генетических факторов при аутоиммунных заболеваниях служит ассоциация подобных расстройств с определенными гаплотипами HLA. Так, ревматоидный артрит не ассоциирован с гаплотипами локусов HLA-A и HLA-B, но чаше развивается при наличии общей для DR1 и главных подтипов DR4 нуклеотидной последовательности. Эта последовательность присутствует также в белках теплового шока dnaJ различных бактерий и белке gp 110 вируса Эпштейна-Барр, что создает клинически значимую возможность индукции аутоиммунных заболеваний перекрестнореагирующими микробными эпитопами. Более того, молекулы HLA-DR, несущие эту последовательность, могут связывать другой бактериальный белок теплового шока, dnaK, а также его аналог у человека, белок теплового шока hsp73, который направляет отдельные белки в лизосомы, где осуществляется процессинг антигенов. При органоспецифических заболеваниях особенно часто встречается гаплотип B8,DR3, хотя тиреоидит Хасимото чаще ассоциирован с DR5. Следует отметить, что у гетерозигот DQ2/8 резко повышен риск развития инсулин-зависимого сахарного диабета. Это подтверждает представление об участии нескольких генетических факторов в развитии аутоиммунных заболеваний: во-первых, генов, определяющих общую предрасположенность к аутоиммунной патологии, органоспецифической или органонеспецифической, а во-вторых, других генов, которые определяют конкретную мишень антиген или антигены, против которых направлена и аутоиммунная реакция.
Патогенез
Аутоиммунные процессы часто приводят к развитию болезни. Обнаружение аутоантител при том или ином заболевании указывает на три возможности:
• аутоантитела служат причиной патологического процесса;
• аутоантитела образуются вследствие повреждения тканей, вызванного тем или иным патологическим процессом;
• существует некий третий фактор, который лежит в основе и повреждения ткани, и появления аутоантител.
Иногда аутоантитела действительно появляются вследствие повреждения ткани. Например, у лиц, перенесших инфаркт миокарда, в сыворотке могут присутствовать аутоантитела к антигенам сердечной мышцы. Однако простая травма, приводящая к высвобождению аутоантигенов, редко индуцирует образование аутоантител. В большинстве случаев при заболеваниях, сопровождающихся продукцией аутоантител. реализуется первая возможность, т.е. аутоиммунный процесс является причиной тканевых повреждений.
В патогенетической роли аутоиммунных процессов можно убедиться путем экспериментального моделирования.
Примеры индуцированных аутоиммунных процессов
Самый простой способ проверки того, служит ли причиной заболевания аутоиммунный процесс, - это попытки воспроизведения данного заболевания у экспериментальных животных путем намеренной индукции у них аутоиммунных процессов. Для этого животным вводят аутоантигены в полном адъюванте Фрейнда, и это действительно вызывает органоспецифическое поражение некоторых органов. Введение тиреоглобулина, например, может вызвать воспалительное поражение щитовидной железы, а введение основного белка миелиновой оболочки - развитие энцефаломиелита. После введения тиреоглобулина у животных не только появляются антитиреоидные аутоантитела, но и происходит инфильтрация щитовидной железы мононуклеарными клетками с нарушением структуры органа. Хотя такие изменения никоим образом нельзя считать тождественными тиреоидиту Хасимото, все же они в целом сходны с теми, какие наблюдаются при этом заболевании у человека.
Возможность экспериментальной индукции аутоиммунного заболевания зависит от линии животных. Например, подверженность крыс и мышей энцефаломиелиту в результате введения основного белка миелиновой оболочки связана с небольшим числом определенных генных локусов, главным образом в области генов МНС класса II. Аутоаллергический энцефаломиелит у животных восприимчивых линий можно вызвать также введением Т-клеток, специфичных к основному белку миелиновой оболочки. Такие Т-хелперные клетки принадлежат к субпопуляции CD4/Txl, причем введение реципиентам антител к CD4 непосредственно перед ожидаемым началом болезни предотвращает ее возникновение, блокируя взаимодействие CD4 на Тх-клетках с молекулами МНС класса II на антигенпрезентирующих клетках. Результаты опытов указывают на значение рестриктированных по молекулам МНС класса II аутореактивных Тх-клеток в развитии таких заболеваний и подчеркивают важнейшую роль МНС.
[youtube.player]Механизмы аутоиммунных заболеваний - краткий обзор:
- Аутоиммунные заболевания — относительно частые расстройства, и могут классифицироваться на органоспецифичные и системные на основании аутоантигенов, на которые направлены иммунные клетки.
- Несмотря на то что этиология этих заболеваний до сих пор не выяснена окончательно, их рассматривают в контексте нарушения иммунной толерантности к собственным антигенам.
- Механизмы исчезновения иммунной толерантности к аутоантигенам, как генетические, так и обусловленные факторами внешней среды, по-видимому, разнообразны, что приводит к нерегулируемой иммунной активации против аутоантигенов и последующему разрушению тканей.
- При аутоиммунных заболеваниях Т- и В-лимфоциты распознают аутоантигены и преобладают в фенотипе, однако на различных стадиях от инициации аутоиммунного ответа до разрушения тканей задействованы другие иммунные компоненты, в том числе антиген-презентирующие клетки и комплемент.
Аутоиммунные заболевания, в том числе ревматоидный артрит (РА) и системная красная волчанка (СКВ) — относительно частые расстройства. Этиология этих заболеваний до настоящего времени неясна, однако они развиваются на фоне нарушения иммунной толерантности к собственным антигенам. Механизмы исчезновения иммунной толерантности к собственным антигенам, по-видимому, многофакторные, в том числе генетические и средовые, которые действуют совместно и вызывают отличительные признаки заболевания: нерегулируемую иммунную активацию против аутоантигенов и последующее разрушение тканей.
Иммунная активация против аутоантигенов клинически проявляется присутствием антител и аутореактивных Т-клеток. В зависимости от аутоантигенов-мишеней аутоиммунные заболевания можно классифицировать на органспецифичные и системные аутоиммунные процессы.
Например, болезнь Грейвса с аутоантителами к рецептору тиреотропного гормона — типичный пример орган-специфичного аутоиммунного заболевания, как и сахарный диабет (СД) 1 типа с аутоантителами и аутореактивными Т-клетками против компонентов β-клеток поджелудочной железы, тогда как СКВ с характерными аутоантителами к повсеместно распространенным ядерным антигенам — хороший пример системного аутоиммунного заболевания. Несмотря на то что при аутоиммунных процессах в фенотипе преобладают адаптивные иммунные клетки, а именно В-и Т-лимфоциты, распознающие аутоантигены, на различных стадиях от инициации аутоиммунного ответа до разрушения тканей участвуют другие иммунные компоненты, в том числе антиген-презентирующие клетки (АПК) и комплемент.
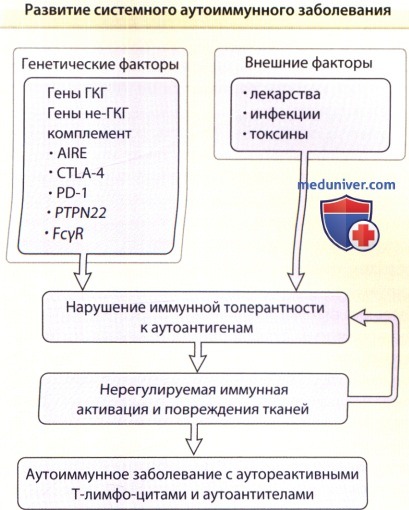
Механизмы развития системного аутоиммунного заболевания.
На рисунке показаны потенциальные механизмы инициации системных аутоиммунных заболеваний, в данном случае системной красной волчанки,
в том числе генетические и внешние факторы, которые действуют согласованно, нарушая иммунную толерантность к аутоантигенам.
В последующем наблюдаются нерегулируемая иммунная активация и повреждение тканей, что ведет к развитию аутоиммунного заболевания с аутореактивными Т-лимфоцитами и аутоантителами.
AIRE — autoimmune regulator (аутоиммунный регулятор); CTLA-4 — cytotoxic T-lymphocyte antigen-4 (цитотоксический Т-лимфоцитарный антиген-4; FcgR — рецептор к Fc-фрагменту иммуноглобулина G; ГКГ—главный комплекс гистосовместимости; PD-1 — programmed cell death 1 (ген программируемой смерти клетки-1); РТ-PN22 — proteintyrosinephosphatase 22 (протеинтирозин-фосфатаза 22).
а) Аутоиммунные заболевания полигенны. Аутоиммунные заболевания полигенны и задействуют как гены главного комплекса гистосовместимости (ГКГ), так и не относящиеся к нему гены. Тем не менее конкордантность аутоиммунных заболеваний у монозиготных близнецов составляет не 100%, а от 10 до 50%, в том числе для РА и СКВ, что свидетельствует о значимой роли негенетических факторов.
При этом генетическое влияние выражено. Вклад аллелей ГКГ в развитие аутоиммунного процесса известен уже 30 лет. У некоторых пациентов с РА наблюдается повышенная частота встречаемости лейкоцитарного антигена человека HLA-DR4. При помощи более сложных молекулярных методов была типирована последовательность локусов аллелей, кодирующих HLA, и было показано, что ген HLA-DRB1 высоко полиморфен, и этот полиморфизм может влиять на связывание пептидов с молекулами HLA и контакты между Т-клеточным рецептором (TCR) и молекулой HLA.
Таким образом, связь между аутоиммунными заболеваниями и определенными молекулами HLA можно объяснить при помощи модели, в которой подверженность заболеванию определяется различием в способности аллелей HLA презентировать аутоантигенные пептиды аутореактивным Т-лимфоцитам. Тем не менее, генетический вклад ГКГ в предрасположенность к развитию аутоиммунных заболеваний более значителен. Это утверждение иллюстрирует последнее исследование генотипирования панелей 1472 одиночных нуклеотидных полиморфизмов (SNPs) на протяжении 3,44 мегабаз (Mb) хорошо известного участка ГКГ в 10576 образцах ДНК пациентов с аутоиммунными заболеваниями, а именно СКВ, РА, рассеянным склерозом, и в группе контроля.
Результаты исследования показали наличие множественных аллелей риска в участках ГКГ I, II и III классов при вышеперечисленных аутоиммунных заболеваниях.
б) Связь с аутоиммунными заболеваниями генов, не относящихся к главному комплексу гистосовместимости. В настоящее время с помощью полногеномного сканирования (GWA), мощного инструмента определения новых генов, участвующих в аутоиммунитете, точно установлена связь между генами, не относящимися к ГКГ, и аутоиммунными заболеваниями. Это гены, участвующие в устранении аутоантигенов, апоптозе, клеточных сигналах, продукции цитокинов и экспрессии ко-стимулирующих молекул. Например, для нормального устранения иммунных комплексов требуются компоненты комплемента, и при СКВ с отложениями иммунных комплексов в пораженных органах, например почках, повышена частота гомозиготного дефекта С4.
В действительности, при мутациях гена AIRE развивается синдром, называемый аутоиммунная полиэндокринопатия-кандидоз-синдром эктодермальной дистрофии, или аутоиммунный полигландулярный синдром I (APS-1), который характеризуется хроническим кандидозом, гипопаратиреозом и болезнью Аддисона. Помимо этого, при данном состоянии часто наблюдаются другие орган-специфические аутоиммунные заболевания, в том числе сахарный диабет первого типа (СД 1), аутоиммунные заболевания щитовидной железы, недостаточность гонад, витилиго, гнездная алопеция, дистрофия ногтей и эмали зубов, а также пернициозная анемия.
г) Цитотоксический Т-лимфоцитарный антиген-4. У носителей определенного варианта генов, влияющих на активацию Т-лимфоцитов, выявляется повышенная частота аутоиммунных заболеваний. Эти гены — цитотоксический Т-лимфоцитарный антиген-4 (CTLA-4) и ген белковой тирозинфосфатазы 22 (PTPN22). CTLA-4 — основная иммунорегуляторная молекула, подавляющая активацию Т-лимфоцитов. Она экспрессируется на Т-лимфоцитах при стимуляции TCR антигеном на антиген-презентирующих клетках (АПК) и конкурирует с CD28 — молекулой положительной ко-стимуляции также на Т-лимфоцитах за связывание с CD80 и CD86, которые экспрессируются на АПК. В отличие от связывания CD80 и CD86 с CD28, взаимодействие этих молекул с CTLA-4 ингибирует активацию Т-лимфоцитов.
Была показана связь СКВ и РА с полиморфизмом одного нуклеотида (SNP) в промоторе и кодирующем участке CTLA-4. Эти сайты полиморфизма — позиция -1722 промотора CTLA-4 и позиция +49 экзона-1, однако функциональные последствия этих генных полиморфизмов в настоящее время неизвестны.
Полиморфизмы CTLA-4 также связаны с аутоиммунными эндокринопатиями: например, при SNP в CTLA-4CT60 G/G наблюдается снижение содержания продукта альтернативного сплайсинга CTLA-4 — растворимой формы CTLA-4, что связано с повышенной склонностью к болезни Грейвса, аутоиммунному гипотиреозу и СД1. Этот факт свидетельствует о возможной функциональной роли полиморфизмов CTLA-4 при аутоиммунных заболеваниях.
д) Ген программируемой смерти клетки 1. Так же как CTLA-4, белок программируемой смерти клетки 1 (PD-1) экспрессируется на Т-лимфоцитах и при активации обеспечивает ингибирующий сигнал. Эта молекула также экспрессируется на других иммунных клетках, в том числе В-лимфоцитах и миелоидных клетках. PD-1 кодируется геном PDCD1 и SNP в четвертом интроне связан с аутоиммунными заболеваниями, в том числе СКВ и РА. Интересно, что этот связанный с заболеваниями SNP нарушает связывание гематопоэтического фактора транскрипции 1 (RUNX1), что предположительно ведет к нарушению экспрессии гена PDCD1 и впоследствии к неконтролируемой активации Т-лимфоцитов. Связь генетических полиморфизмов CTLA-4 и PD-1 — молекул, регулирующих активацию Т-лимфоцитов, с аутоиммунными заболеваниями подтверждает мнение о том, что критическая точка для развития аутоиммунитета — регуляция активации Т-лимфоцитов этими ко-стимулирующими молекулами.
е) Белковая тирозинфосфатаза 22. Ген, кодирующий белковую тирозинфосфатазу 22 (PTPN22) — еще один недавно обнаруженный ген, связанный с аутоиммунными заболеваниями. Было обнаружено, что вариант гена PTPN22 с триптофаном в кодоне 620 (620W) вместо аргинина (дикий тип) связан с повышенным риском РА, СКВ, СД 1 и болезнью Грейвса. По-видимому, данная мутация имеет функциональные последствия, поскольку ген PTPN22 кодирует лимфоидную тирозинфосфатазу, которая модулирует активацию Lck и других киназ, участвующих в TCR сигнальном пути.
В действительности, аллель 620WPTPN22, по-видимому, может усиливать ингибирование активации TCR, уменьшая активацию Lck. Таким образом, еще необходимо выяснить, как данный аллель способствует развитию аутоиммунитета.
ж) Сигнальный путь рецептор фактора некроза опухоли. В последнее время установлено, что множество генов, кодирующих молекулы, участвующие в сигнальном пути рецепторов фактора некроза опухоли (ФНО) имеют отношение к аутоиммунитету. Среди них лучше всего изучен TNFAIP3, кодирующий индуцируемый белок ФНО А20, который является отрицательным регулятором индуцируемых ФНО NF-kB сигнальных путей. Ген, кодирующий белок 1, взаимодействующий с TNFAIP3 (TNIP1), ассоциирован с псориазом и СКВ. Также сообщалось о связи гена TRAF1 (фактор 1, ассоциированный с рецептором ФНО) с РА.
з) Рецепторы цитокинов. Полиморфизм некоторых рецепторов цитокинов связан с аутоиммунитетом. Рецепторный комплекс ИЛ-23 состоит из ИЛ-23R и ИЛ-12Rβ1, последний, в свою очередь, состоит из ИЛ-12Rβ1 и ИЛ-12Rβ2 субъединиц. Ген рецептора ИЛ-23R ассоциирован с воспалительными заболеваниями кишечника и псориазом. Этот факт представляет интерес, учитывая, что ИЛ-23 вовлечен в регуляцию созревания Т-хелперов 17 (Тh17), которые продуцируют активные провоспалительные цитокины ИЛ 17. Более того, ИЛ-17 обнаруживается в очагах псориаза на коже. Таким же образом обнаружено, что ген ИЛ 12В, кодирующий ИЛ-12 (р40 субъединица ИЛ-12), связан с псориазом.
и) Рецепторы к Fc-фрагменту иммуноглобулина G. Помимо генов, экспрессируемых Т-лимфоцитами, с аутоиммунитетом, по-видимому, связаны гены, задействованные в гуморальном иммунном ответе. Рецепторы к Fc-фрагменту иммуноглобулина G (IgG) (FcgyR: FC-GRIA, FCGRIB, FCGRIC, FCGRIIA, FCGRIIB, FCGRIIC, FC-GRIIIA, и FCGRIIIB. Связывание всех рецепторов Fcg R, за исключением FcRIIb, c IgG вызывает широкий спектр активирующих клеточных ответов, в том числе фагоцитоз, цитолиз, продукцию цитокинов и дегрануляцию, что ведет к воспалению. Напротив, Fcg Rllb в норме служит ингибирующим рецептором, который подавляет эффекторную функцию клеток. Сообщают о повышенной частоте некоторых вариантов генов FCGR у людей с аутоиммунными заболеваниями, в том числе СКВ и РА. Fcg Rlla с аргинином является фактором предрасположенности к СКВ в некоторых этнических группах.
Сходным образом, вариант Fcg RIIa с фенилаланином в положении 158 может быть фактором предрасположенности к СКВ и РА. Помимо этого, при СКВ обнаружены генетические полиморфизмы ингибирующего Fcg RIIb. Наиболее известный из подобных полиморфизмов — замена изолейцина в положении 232 (187 от N-конца зрелого белка) на треонин. Указанный генотип чаще всего обнаруживается у пациентов с СКВ. Биологическое влияние этого изменения на развитие СКВ неясно, однако при волчанке у мышей ингибирующее действие рецепторов Fcg R необходимо для подавления аутоиммунитета.
В целом генетические исследования генов как относящихся, так и не относящихся к ГКГ подтверждает, что у некоторых пациентов с аутоиммунными заболеваниями повышен генетический риск развития аутоиммунных расстройств в результате генетических изменений, нарушающих функции иммунных клеток. Тем не менее эти изменения не всегда наблюдаются у пациентов с аутоиммунными заболеваниями, и в генетической предрасположенности часто встречаются этнические различия. Эти факты указывают на то, что аутоиммунные заболевания полигенны, и в их развитии участвуют факторы окружающей среды.
Редактор: Искандер Милевски. Дата публикации: 7.2.2019
[youtube.player]Читайте также:
- Менингококковая инфекция у ребенка симптомы фото
- Профилактика вертикального пути передачи инфекционных заболеваний
- Серотерапия инфекционных болезней и ее возможные осложнения
- Инфекционный бронхит кур можно ли есть яйца
- Какие принимать пробиотики при ротавирусной инфекции
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.

