Микробные биопленки и внутрибольничные инфекции
Биоплёнки как форма существования микроорганизмов и их сообществ

Как бактерии образуют биоплёнку
Сегодня под термином биоплёнка понимают особую форму существования микроорганизмов и их сообществ, образующуюся на границе раздела фаз (обычно твёрдой и жидкой) и характеризующуюся набором свойств, отличных от совокупности автономных клеток микроорганизмов в чистой культуре. К образованию биоплёнок способно подавляющее большинство микроорганизмов.
Биоплёнка - множество (конгломерат) микроорганизмов, расположенных на какой-либо поверхности, клетки которых прикреплены друг к другу. Обычно клетки погружены в выделяемое ими внеклеточное полимерное вещество - слизь. Биоплёнка - обладающее пространственной и метаболической структурой сообщество (колония) микроорганизмов, расположенных на поверхности раздела сред и погружённых во внеклеточный полимерный матрикс (слизь). Обычно биоплёнки образуются в контакте с жидкостями при наличии необходимых для роста веществ. Поверхность, к которой прикреплена биоплёнка, может быть как неживой (камни), так и поверхностью живого организма (стенки кишечника). Считается, что 95-99% всех микроорганизмов в естественной среде существует в виде биоплёнки.

Перед тем, как рассмотреть вопрос формирования и состава микробной биопленки, отметим ее важность для иммунной защиты человеческого организма. Как было отмечено выше, 95-99% всех микроорганизмов в естественной среде существует в виде биоплёнки. Это касается и нашего кишечника, в котором, в свою очередь, сосредоточено около 70% всех иммунных клеток организма человека. Так как основной функцией иммунной системы кишечника является защита от проникновения бактерий в кровь, а также устранение патогенов, то состояния биопленки, которая является микробиологической составляющая эпителиального барьера кишечника, во многом зависит эффективность иммунитета.
Эпителиальный барьер в целом - это микроколонии бактерий и их метаболиты, пищевые волокна, слизь, гликокаликс, эпителиоциты, клетки стромы слизистой оболочки (фибробласты, лейкоциты, лимфоциты и др.).
Именно правильный состав и метаболическая активность собственной микрофлоры, активные эпителиальные клетки слизистой с рабочими сайтами адгезии, качественное питание (содержащее пищевые волокна, витамины и минералы), а также моторно-эвакуаторное функционирование ЖКТ – все это является основой защиты кишечника от его заселения патогенными и условно-патогенными микроорганизмами.
Как бактерии образуют биопленку:
Представленная анимация и покадровые иллюстрации показывают, как бактерии образуют биопленку. Биопленка, более известная как "слизь", представляет собой поверхностно-прикрепленное сообщество микроорганизмов. Формирование биопленки включает в себя ряд бактериальных процессов, включая бактериальную сигнализацию и зондирование кворума, производство пили и секрецию внеклеточной полимерной матрицы. Эта анимация была произведена для центра микробных инноваций, в университете Окленда, Новая Зеландия.












О биопленке более подробно:
Биоплёнки представляют собой сложные многокомпонентные трёхмерные структуры. В большинстве случаев в составе любой биоплёнки можно выделить как минимум два исходных компонента – клеточная биомасса и матрикс. В составе биоплёнок клетки микроорганизмов, прикреплённые к поверхности субстрата, равномерно покрываются матриксом – сложным комплексом биополимеров (рис.1).

По своему клеточному составу можно выделить два основных типа биопллёнок:
Моновидовые биоплёнки содержат в своём составе только один вид микроорганизмов. В природных условиях такие биоплёнки встречаются достаточно редко. В основном они формируются некоторыми патогенными микроорганизмами в тех органах и тканях макроорганизма, которые в норме являются стерильными. Примером таких биоплёнок и вызываемых ими поражений может служить образование биоплёнки P.aeruginosa в лёгких людей больных муковисцидозом.
Поливидовые биопленки. Большинство биоплёнок, образующихся в окружающей среде, относится к поливидовым биоплёнкам. Такие биоплёнки представляют сложные сообщества, состоящие из многих видов микроорганизмов. В пределах такого сообщества можно обнаружить клетки бактерий, дрожжевых и плесневых грибов, простейших, а так же частицы вирусов, в основном бактериофагов.

Важнейшим компонентом биоплёнки является матрикс (внеклеточная полимерная субстанция). Он представляет собой комплекс биополимеров, синтезируемый клетками микроорганизмов, входящих в состав биоплёнки. В состав матрикса входят полисахариды, структурные белки, экзоферменты, нуклеиновые кислоты (рис.2.-слева).
Матрикс играет огромную роль в организации и функционировании биоплёнок. Прежде всего, он способствует пространственной организации этих структур, отграничивая биоплёнки от негативного влияния внешней среды. Значительная степень вязкости матрикса, за счёт полисахаридов позволяет с одной стороны сконцентрировать синтезируемые экзоферменты рядом с клетками, тем самым, повышая их концентрацию в определённой точки пространства, а, с другой стороны, препятствует равномерному распределению по всей биоплёнке неблагоприятных для неё веществ, таких как, например, антибиотики и дезинфектанты. Компоненты матрикса биоплёнки так же могут служить резервными источниками основных биогенных элементов в случае прекращения поступления питательных веществ, что позволяет клеткам, входящим в состав биоплёнки некоторое время существовать в условиях сокращающегося притока питательных веществ.
Среди основных функций матрикса можно выделить следующие:
Полисахариды матрикса биоплёнки
Среди всех компонентов входящих состав матрикса биоплёнки основную роль в его построении играют экзополисахариды (ЭПС). В количественном соотношении это наиболее распространённые в матриксе биополимеры. В среднем, в зависимости от конкретной биоплёнки их количество варьирует от 50 до 90 % от общей сухой массы веществ матрикса.
Большинство экзополисахаридов биоплёнки представляют собой достаточно длинные полимеры с молекулярной массой от 0,5 х 10 6 до 2 х 10 6 дальтон. На сегоднешний день полисахариды найдены в матриксах биоплёнок практически всех микроорганизмов. Применение различных биохимических методов, а так же методов электронной и флуорисцентной микроскопии (с использованием меченных флуорисцентными красителями лектинов и моноклональных антител) позволило детально охарактеризовать многие из этих биополимеров. Основная роль полисахаридов в составе матрикса биоплёнки – придание жесткости конструкции за счёт взаимодействия между отдельными полимерами. Это обусловлено тем, что между цепями ЭПС осуществляются слабые физико-химические взаимодействия, стабилизирующие структуру (рис.3).
Рис.3. Слабые физико-химические взаимодействия между цепями ЭПС матрикса биоплёнки
Среди таких взаимодействий можно выделить следующие:
- Формирование водородных связей – образуются между ОН – группами обращёнными во вне от основного полимерного скелета.
- Электростатические взаимодействия – возникают между гидрофильными и гдрофобными группами полисахаридных цепей (например, между ОН – и СН3 – группами)
- Ионные взаимодействия – обусловлены связыванием отрицательно заряженных групп полисахаридных цепей посредством катионов двухвалентных металлов ( например, СОО - -Са 2+ - - ООС)
- Силы отталкивания – возникают между одинаково заряженными группами предотвращая коллапс структуры.
- ван дер Ваальсовы взаимодействия – ориентированные взаимодействия в тех участках полисахаридных цепей где внешние группировки полисахаридов формируют диполи.
По своему составу полисахариды матрикса биоплёнки можно разделить на два основных типа – гомополисахариды и гетерополисахариды. Гомополисахариды в составе матрикса биоплёнки встречаются лишь у относительно небольшого числа микроорганизмов. Они обычно представляют собой производные сахарозы, например, глюканы и фруктаны синтезируемые бактериями рода Streptococcus в биплёнках на поверхности зубов, и целлюлоза, синтезируемая Gluconobacter xylinus, Agrobacterium tumifaciens, Rhizobium spp. а так же некоторыми представителями семейства Enterobacteriaceae.
Экзополисахариды матрикса биоплёнки большинства бактерий относятся к гетерополисахаридам, которые представляют собой смесь из нейтральных и заряженных остатков сахаров. Так же они содержат значительное количество различных органических и неорганических заместителей, которые в значительной степени влияют на их физические и биологические свойства. Так, в связи с наличием в составе уроновых кислот (а так же иногда пирувата и сульфатов) некоторые такие полисахариды, включая альгинат, ксантан и колановую кислоту являются полианионными. Так же существуют и поликатионные адгезины.
Белки матрикса биоплёнки.
Вторым по содержанию компонентом матрикса биоплёнки являются экзобелки. В некоторых природных биоплёнках их количество может приблежаться к количеству экзополисахаридов, а иногда и превосходить их. Белки матрикса биоплёнки делятся по своему назначению на две большие группы: Структурные белки и Экзоферменты .
В биоплёнках обнаруживается значительное количество различных экзоферментов, многие из которых вовлекаются в деградацию биополимеров. Субстратом для этих ферментов являются водорасстворимые компоненты (такие как полисахариды, нуклеиновые кислоты и белки), а так же некоторые водонерасстворимые полимеры (целлюлоза, хитин, липиды) и различные органические частицы захваченные биоплёнками. Основные ферменты матрикса биоплёнки приведены в таблице 1.
Таблица 1. Основные ферменты матрикса биоплёнки
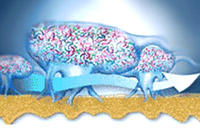
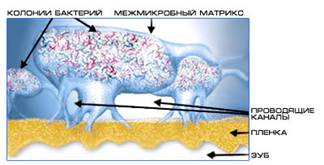
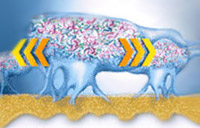
Особую форму колониальной организации микроорганизмов представляют собой биопленки. Они представляют собой микроколонии, сформированные в слизистом матриксе и разделённые открытыми (часто заполняемыми водой) каналами - своего рода аналог примитивной "циркуляторной системы", доставляющей питательные субстраты и убирающей продукты метаболизма.
В колониях бактерии Alcaligenes sp. обнаружены поры и каналы, а также более специализированные структуры ("газовые баллоны"), окруженные своеобразной "мембраной" и содержащие внеклеточные гемопротеины. Предположительно, такие структуры способствуют транспорту О2 к клеткам в колониях (агрегатах), т. е. речь идёт об аналоге дыхательной системы органов.
Продуцируемый микробами матрикс препятствует проникновению лекарственных средств, что повышает устойчивость бактерий к антибиотикам в десятки, а то и в сотни раз. В составе биопленки бактерии длительно сохраняются в организме хозяина и становятся устойчивыми к действию как гуморального, так и клеточного иммунитета. Поэтому наличие хронических инфекционных заболеваний определяется именно тем, что бактерии способны образовывать биопленки и, длительно персистируя, сохраняться в организме хозяина. Когда биопленки достигают определенного размера, от них начинают отрываться части, которые с помощью кровотока или по желудочно-кишечному тракту разносятся по организму. Происходит образование новых очагов роста биопленки (аналогия метастазирования злокачественных клеток).
Бактерии способны формировать биопленки не только на биологических поверхностях, но и на дереве, пластмассе, металле, например, при транспортировке нефти, на хирургическом инструментарии, эндоскопах, медицинском имплантируемом оборудовании (линзы, катетеры, искусственные клапаны сердца). С биопленками, образующимися на поверхностях стен, полов, кроватей, тесно связана и проблема внутрибольничных инфекций, поскольку ни УФО, ни дезсредства не помогают.
Иногда биопленки могут быть полезными, например, их применяют для обеззараживания отработанных и сточных вод. Нормальная микрофлора желудочно-кишечного тракта образует биопленки, которые хорошо и надежно защищают наши слизистые от повреждающих агентов.
В природе биопленки распространены повсеместно. Установлено, что свыше 95% существующих в природе бактерий находятся в биопленках. Они формируются в условиях текучести и только после достижения бактериями определенной плотности – от 1 до 10 млн в 1 мл. В этом случае бактерии выделяют высокоспецифичные сигнальные молекулы (автоиндукторы). Автоиндукторы посредством регуляторных белков экспрессируют гены, которые запускают синтез полисахаридов, образующих капсулы на поверхности этой бактериальной массы. В итоге образуется микробное сообщество, где ряд функций все типы клеток выполняют вместе, и в то же время происходит распределение обязанностей. В этом и состоит социальное поведение бактерий.
Могут формироваться и сложные сообщества, которые состоят из бактерий разных видов. В одну биопленку объединяются не только грамотрицательные и грамположительные микроорганизмы, но даже простейшие. В этих случаях работают те же принципы, только автоиндукторы имеют более широкую специфичность.
Пока препаратов, которые можно было рекомендовать к практическому использованию, не существует. Но есть понимание, как их создавать. Исходя из того, что ученые хорошо изучили механизмы формирования биопленок, сейчас активно идут поиски методов их разрушения. Это наиболее серьезный радикальный подход к лечению хронических инфекционных заболеваний. Других методов на сегодняшний день не существует: антибиотики бессильны, а остальные средства лишь симптоматические. Одно из возможных решений этой проблемы – поиск антипатогенных препаратов, которые, в отличие от антимикробных (вызывающих гибель или подавление роста бактерий), обладали бы способностью снижать или блокировать их вирулентность, в результате чего с инфекцией смогла бы справиться иммунная система организма. Мишенями таких антипатогенных лекарственных средств могут стать системы регуляции бактерий, контролирующие экспрессию факторов вирулентности. Открытие систем коммуникации бактерий (системы QS), контролирующих важные стадии инфекционных процессов, включая образование факторов вирулентности и биопленок, позволил вплотную подойти к этой цели. Используются разные стратегии, связанные с прерыванием цепи событий в процессе работы системы QS, включая подавление образования автоиндукторов, распространения и восприятия их сигналов. Появились сообщения о веществах, способных ингибировать синтез автоиндукторов. Например, для P.aeruginosa в качестве таких ингибиторов названы различные аналоги S-аденозилметионина, определенные макролидные антибиотики, применяемые в субминимальных концентрациях, эритромицин. Из окружающей среды выделены бактерии, способные вызывать деградацию молекул автоиндукторов или метаболизировать их.
Основные свойства биопленки:
Ø взаимодействующая общность разных типов микроорганизмов;
Ø микроорганизмы собраны в микроколонии;
Ø микроколонии окружены защитным матриксом;
Ø внутри микроколоний — различная среда;
Ø микроорганизмы имеют примитивную систему связи;
Ø микроорганизмы в биопленке устойчивы к антибиотикам, антимикробным средствам и реакции организма хозяина;
Ø бактерия в биопленке вырабатывает такие вещества, которые она не продуцирует, будучи в культуре;м
Ø икроорганизмы в биопленке ведут себя не так, как бактерии в культурной среде.
Схематическое изображение основных форм социального поведения микроорганизмов
Не нашли то, что искали? Воспользуйтесь поиском:
Мусаелян А.Г.,Студент 3 курса,лечебного факультета,СГМУ им В.И.Разумовского
Донецкая Э.Г.-А,научный руководитель,доцент кафедры Микробиологии,вирусологии и имунологии, им В.И.Разумовского
Резюме
Проблема биопленочных инфекций в настоящее время приобретает все большую актуальность в связи с ростом и развитием числа инфекций и осложнений ,вызываемых внедрением в медицинскую практику инвазивных методов диагностики и лечения. Особенно серьезно этот вопрос рассматривается при возникновении инфекций ,имеющих хроническое течение ,проблемы устойчивости к антибиотикам ,бактерий находящихся в составе биопленки. В настоящей работе обобщены, систематизированы и проанализированы теоритические аспекты инфекций, возникающих при оказании медицинской помощи. Рассматриваются вопросы образования биопленки, ее строение, и роль в распространении инфекции, приводящих к формированию хронических очагов в органах и тканях организма .
Особое внимание уделяются вопросам направленным на предотвращении, возникновении и развитии биопленочных инфекций ,и борьбы с антибиотикоустойчивостью микроорганизмов ,находящихся в составе биопленки.
Ключевые слова
Статья
Более 99% бактериальных популяций существуют в природных экосистемах не в виде свободно плавающих планктонных клеток, а в виде специфически организованных, прикрепленных к субстратам биопленок, образование которых представляет сложный, строго регулируемый биологический процесс. Способность формировать биопленки является составной частью жизненного цикла большинства микроорганизмов и успешной стратегией защиты бактерий от неблагоприятных факторов среды. Биопленки - это физические структуры, образуемые микробными сообществами на поверхности раздела фаз: развивающиеся на границе жидкой и твердой сред.
Биопленки имеют сложную архитектуру - они заключены в экзополимерный матрикс, содержат каналы, наполненные жидкостью, через которые происходит приток питательных веществ и кислорода и выведение продуктов метаболизма бактерий. Основным компонентом матрикса являются экзополисахариды (ЭПС); матрикс содержит также белки, нуклеиновые кислоты и другие вещества; состав матрикса различен у бактерий разных таксономических групп.Каналы в матриксе создают своеобразную проводящую систему, по которой перемещаются вещества по градиентам концентрации, по ним также могут мигрировать бактерии. Важнейшей функцией матрикса, помимо каркасной, обеспечивающей стабильность биопленки, является защитная. Показано, что матрикс защищает бактерии в биопленке от антибактериальных препаратов, а также от неблагоприятных возднействий внешней среды
Стадии формирования биопленок Выделяют несколько последовательных этапов образования биопленок . Первая стадия - начало развития биопленок – это переход бактерий от планктонного способа существования к другому, связанному с прикреплением клеток к биотической или абиотической поверхности. Прикрепление возможно только у подвижных бактериальных клеток.Первичный контакт планктонно плавающей (неприкрепленной) бактерии и поверхности среды происходит либо случайно (например, при пассивной миграции клеток с током жидкости), либо вследствие направленного движения, обусловленного хемотаксисом. Стадия первичной адгезии занимает несколько секунд, является обратимой и зависит от неспецифических физико-химических механизмов взаимодействия между поверхностными структурами микроорганизма и самого субстрата.
Вторая стадия адгезии характеризуется необратимым связыванием бактериальных клеток с поверхностью при помощи специфических молекул – адгезинов. Важную роль на этом этапе играют такие клеточные структуры, как фимбрии (пили), жгутики, поверхностные белки, липополисахариды.На второй стадии образования биопленок формируются микроколонии. Происходит агрегация клеток, прикрепившихся ранее к твердой поверхности, бактерии теряют подвижность, некоторые из них слипаются друг с другом, начинают выделять полимеры, формируя внеклеточный полимерный матрикс, и образуют многоклеточный слой. При достижении определенной толщины слоя клеток наступает следущая стадия – стадия созревания биопленки. На стадии созревания биопленок в результате деления клеток возникают компактные микроколонии, объединенные внеклеточным полимерным матриксом. Микроколонии постепенно увеличиваются в размерах и объединяются с образованием макроколоний. Одновременно с увеличением толщины биопленки формируются ее специфические структуры - полости, выросты, поры и каналы Возможность роста любой биопленки ограничена доступностью питательных веществ и кислорода, проникновением их в различные слои биопленки, эффективностью удаления метаболических отходов, рН среды, осмолярностью и т.д.
Последней стадией является стадия дисперсии биопленки: в определенный момент времени биопленка достигает критической массы, возникает динамическое равновесие, при этом от наружных слоев биопленки начинают открепляться клетки, способные покидать биопленку и колонизировать другие поверхности, чтобы повторить цикл. Этот процесс имеет большое значение, так как приводит к распространению, расширению инфекции, захвату патогенными бактериями новых мест обитания. В разрушении биопленки принимают участие собственные поверхностно-активные вещества бактерий, ферменты альгинатлиаза и другие полисахаридлиазы. Открепление бактерий от биопленки может быть обусловлено как внешними (движение жидкости), так и внутренними (энзиматическая деградация) причинами. По данным ряда исследований, планктонные клетки, потерявшие связь с биопленкой, представляют большую опасность в связи с приобретением новых свойств, включая устойчивость к антибиотикам.
Катетер-ассоциированные инфекции
Повседневная практика интенсивной терапии предполагает многочисленные инвазивные вмешательства, связанные с нарушением целостности кожных и слизистых покровов, что создает условия для проникновения условно-патогенных микроорганизмов во внутреннюю среду организма человека. К наиболее распространенным вмешательствам относится установка различного рода внутрисосудистых устройств, прежде всего, центральных венозных катетеров. Так, по данным статистики, в США в год устанавливается более 5 млн центральных венозных катетеров. В силу ряда объективных причин центральные венозные катетеры могут становиться вполне реальным источником инфекции.
Патогенез и этиология
Ключевым моментом в патогенезе катетер-ассоциированных инфекций является формирование на внутренней и/или наружной поверхности катетера микробной биопленки.
Известны следующие пути проникновения микроорганизмов внутрь сосудистого русла.
- Микроорганизмы из состава нормальной микрофлоры кожи пациента могут проникать в сосудистое русло через разрез в месте введения катетера и прикрепляться к его наружной поверхности-ЭКСТРАЛЮМИНАЛЬНЫЙ ПУТЬ. Вероятность такого пути колонизации поверхности катетера наибольшая в течение первых 10 сут после его постановки.
- В более поздний период возрастает вероятность колонизации внутренней поверхности катетера-ИНТРАЛЮМИНАЛЬНО- через канюлю при нарушении техники асептики и при уходе за катетером. Необходимо, однако, отметить, что описанные закономерности носят чисто статистический характер, у индивидуальных пациентов колонизация и внутренней, и наружной поверхностей может происходить в любые сроки. Более того, не являются редкостью и случаи, когда одновременно колонизуется и внутренняя, и наружная поверхности, причем участие в этих процессах могут принимать различные микроорганизмы.
- Колонизация катетеров возможна также при использовании контаминированных инфузионных растворов. К крайне редким случаям относится гематогенный путь колонизации катетеров.
Большинство микроорганизмов в той или иной степени способны прикрепляться к поверхности катетеров за счет неспецифических механизмов адгезии. Однако адгезия происходит гораздо эффективнее при отложении на поверхности катетера белков плазмы крови (фибрина, фибронектина, ламинина).











В данном интервью вы узнаете не только об известной роли биопленок в развитии катетер-ассоциированной инфекции, но также сможете понять причину поддержания ими хронического бактериального воспаления и их вклад в развитие инфекционных камней. В ходе беседы мы также выясним причину низкой эффективности длительной антибиотикотерапии чувствительных к препарату штаммов бактерий. И, конечно, узнаем мнение эксперта относительно проблемы подбора противомикробного лечения и разрабатываемых в мире подходов к решению проблемы биопленочных инфекций.

– Ирина Николаевна, расскажите, пожалуйста, почему научно-медицинское сообщество и вы, в частности, сейчас уделяете столь активное внимание проблеме биопленок?
– На протяжении своей медицинской деятельности врачи любой специальности сталкиваются с проблемой лечения хронических воспалительных заболеваний, трудно поддающихся терапии антибиотиками. Мне как специалисту, в течение 30 лет занимающемуся вопросами клинической микробиологии и клинической фармакологии, приходится сталкиваться с этой проблемой очень часто.
Проводимые в течение последних двух-трех десятилетий исследования показали, что одной из основных причин хронизации инфекций любой локализации является образование микробных биопленок. Есть данные, что две трети всех внутрибольничных инфекций сопровождаются образованием биопленок, затрудняя излечение пациентов. При этом в США на лечение подобных инфекций ежегодно тратится 1 млрд долл.
– А разве существуют какие-либо особенности у этих биопленочных инфекций?
Затяжному течению инфекции и хронизации процесса способствуют такие особенности биопленочной инфекции, как способность микробов в биопленке ускользать от иммунной защиты и повышенная устойчивость к антибиотикам. Биопленка способствует выживанию бактерий в неблагоприятных условиях окружающей среды.
– Как врач может определить, что хроническая инфекция у больного связана с формированием биопленок?
– Насколько проблема биопленок затрагивает урологических больных?
– Правильно ли я понимаю, что абактериальный простатит в этой ситуации в действительности оказывается, напротив-таки, очень даже бактериальным?
– К сожалению, диагноз абактериального простатита устанавливается именно в случаях отсутствия роста микроорганизмов в посевах мочи, секрете предстательной железы и эякуляте, которые, как я уже сказала выше, могут быть ложноотрицательными. Происходит персистенция микроорганизмов внутри биопленок, расположенных в ацинусах предстательной железы. Удерживаясь в их микробном матриксе, свободные (т.н. плактонные) бактериальные клетки не высвобождаются в достаточном количестве в секрет, что может имитировать картину стерильного посева.
– Отражается ли наличие биопленочной инфекции предстательной железы на клиническом течении простатита?
– Способность к образованию биопленок при хроническом простатите, вызванном кишечной палочкой, превышает таковую при обусловленных E.coli хронических циститах и пиелонефритах (63% против 40%). Считается, что чем больше матрикса биопленки образует бактерия, тем хуже купируются симптомы простатита и тем труднее лечение инфекции. Поэтому при остром простатите, когда отсутствует сформированный матрикс биопленки, антибиотики более эффективны, чем при хроническом. Как я уже говорила, наличие биопленок – прямой путь к хронизации инфекции и высокой вероятности постоянного присутствия симптомов заболевания даже после проведения эрадицирующего курса антибиотикотерапии, сопровождающегося исчезновением планктонных микроорганизмов. В связи с этим хронические заболевания, в том числе и хронический простатит, требуют длительного лечения противомикробными препаратами.
– Из вашего ответа следует, что кишечная палочка, вызывающая простатит и, скажем, цистит или пиелонефрит, совершенно разные бактерии.
– Не совсем так. Бактерии могут быть практически идентичны, но обладают в разной степени способностью к биопленкообразованию, отличны своей патогенностью, устойчивостью к антибиотикам и т.п. Было обнаружено, что штаммы бактерий, вызывающих простатит, на 85% представлены возбудителями, активно или умеренно образующими биопленки. Показано, что подобные свойства возбудителей инфекции достоверно ухудшают результаты лечения фторхинолонами – препаратами, которые, к сожалению, наиболее часто используются для лечения инфекций мочеполового тракта.
– Вы сказали, что и процесс образования инфекционных камней также связан с формированием микробных биопленок. Какую роль здесь играют бактерии?
– Вам как клиническому фармакологу хорошо знакома проблема антибиотикорезистентности бактерий. Можно ли считать биопленку также механизмом защиты от антибактериальных препаратов?
– Биопленка является мощным механизмом защиты микроорганизмов. Она ограничивает диффузию антибиотиков в матрикс, инактивирует антибиотик посредством изменения концентраций ионов металлов и значений pH и др. В случае проникновения антибиотика внутрь биопленки происходит гибель части микробных клеток, а пережившие действие антибиотика клетки формируют субпопуляцию клеток-персистеров. Они сохраняют свою жизнеспособность и способствуют восстановлению популяции микроорганизмов, вот только вновь восстановленная популяция несет в себе высокий уровень резистентности. Благодаря этому микробы в биопленке в 100–1000 раз более устойчивы к антибиотикам, чем планктонные микроорганизмы. Для того чтобы на них воздействовать, необходимо применение столь высоких концентраций антибиотиков, которые не могут быть достигнуты в организме человека при применении стандартных терапевтических доз.
– Тогда помогите нам разобраться. Какие антибиотики лучше проникают в структуру биопленки?
– А известны ли уже хоть какие-то способы борьбы с микробными биопленками?
– Методы воздействия на биопленки находятся в процессе их активного изучения. Известен опыт создания антител к факторам вирулентности бактерий, вакцин, использование бактериофагов, липосом с антибиотиками. Интересными видятся попытки воздействия исследователей из разных стран на чувство кворума бактерий (пептиды) и метаболизм железа и др. На данный момент наиболее результативными, а поэтому и более разработанными способами воздействия на биопленки являются средства их разрушения с помощью ДНК-аз и других ферментов, воздействующих на ключевые молекулы их матрикса. Вопросу изучения воздействия на биопленки до недавнего времени много внимания уделялось за рубежом. Сейчас многие исследовательские коллективы и в нашей стране подключились к столь актуальной проблеме. И мне приятно сообщить, что совсем недавно были опубликованы впечатляющие результаты в отношении фермента из семейства гиалуронидаз (бовгиалуронидазы азоксимера).
Препарат Лонгидаза® привел к гидролизу матрикса бактериальных биопленок более чем в два раза у таких культур, как E.coli, E.faecalis, S.aureus и др. Это позволило антибиотикам повысить на несколько порядков свой бактерицидный эффект. При совместном воздействии препарата Лонгидаза® и ципрофлоксацина на E.faecalis число КОЕ было ниже на 8 порядков, чем в случае одиночного применения антибиотика. Амоксициллин в идентичном эксперименте показал бактерицидный эффект на 5 порядков больше. А потенцирование противомикробного эффекта антибиотиков субстанцией Лонгидаза у E.coli оказалось вообще поразительным. По сравнению с серийными пробами, где каждый из препаратов применялся отдельно, ципрофлоксацин, фосфомицин, амикацин, цефуроксим позволили снизить концентрацию бактерий на 5, 4, 6 и 3 порядков соответственно, а ведь даже 3 порядка – это изменение в 1000 раз! Так что надежды не потеряны!
– Что вы порекомендуете практикующему врачу в борьбе с биопленочной инфекцией?
– Прежде всего необходимо разделить лечебное и профилактическое применение подходов, таргетных к структуре биопленки. Так, превентивное применение антибиопленочных средств рекомендуется в случаях, где происходит весь этап формирования биопленки, начиная с ее адгезии к поверхности: наличие катетеров, стентов, высокий риск образования инфекционных камней, затяжное течение острого воспаления. Комплексный подход необходим при лечении хронических инфекционных заболеваний и должен включать антимикробные препараты, но для повышения их проникновения к клеткам бактерий за счет растворения матрикса биопленки, по данным проведенных исследований, может быть целесообразным применение препарата Лонгидаза®.
Читайте также:



