Какую инфекцию лечат антибиотиками так как они
Антибиотики – большая группа лекарственных препаратов, каждый из которых характеризуется своим спектром действия, показаниями к применению. Все назначаемые при бактериальной инфекции антибиотики могут воздействовать на микроорганизмы бактерицидно или бактериостатически. В первом случае бактерии погибают, а во втором микроорганизмы лишаются возможности размножаться. Отсутствие потомства приводит к гибели патогенов и их полному исчезновению.
Применяемые при бактериальной инфекции антибиотики могут вводиться в организм самыми разными способами. Препараты производят для всех возможных путей введения. Есть таблетки и капсулы для приема внутрь, растворы для внутривенного, внутримышечного введения, спреи, мази, свечи.

Особенности приема
Применение антибиотиков при бактериальной инфекции должно выполняться по следующим правилам:
- Антибиотики должны назначаться врачом. Выбор препарата зависит от характера, тяжести патологии.
- Противомикробные препараты не используются для лечения вирусных инфекций.
- Эффективность терапии антибиотиком оценивается в первые трое суток лечения. Если он оказывает желаемый эффект, то курс продолжается. В противном случае врач решает вопрос о замене медикамента.
- Во время приема препарата могут возникать побочные эффекты в виде тошноты, появления неприятного привкуса во рту. Эти проявления не всегда требуют отмены препарата. Зачастую достаточно скорректировать дозу, чтобы уменьшить побочное действие препарата. Точные меры по нейтрализации побочного действия препарата определяются лечащим врачом.
- В результате приема может возникнуть диарея. При появлении жидкого стула необходимо незамедлительно обратиться к врачу. Не стоит пытаться самостоятельно лечить диарею, возникшую на фоне приема антимикробного препарата.
- Запрещается самостоятельно изменять дозировку. В малых дозах препараты могут быть опасны, так как у микроорганизмов вырабатывается устойчивость к ним.
- Применять препарат следует строго в определенное время, чтобы поддерживать нужный уровень концентрации вещества в крови.
- Антибиотики должны применяться строго или до еды, или после – в зависимости от вида препарата. В противном случае лекарство будет хуже усваиваться. Особенности приема необходимо уточнить у лечащего врача.
Классификация антибиотиков
За последние сто лет создано огромное количество антибиотиков. При бактериальной инфекции применяют самые разные препараты. Какие-то только из антибиотиков только вводят в клиническую практику, а какие-то уже не применяют.
Все противомикробные препараты делят на следующие виды:
- По происхождению. Выделяют натуральные, полусинтетические, синтетические препараты. Природные получают из клеток растений, животных. Полусинтетические – путем модификации природных молекул, а синтетические получают в лабораторных условиях.
- Деление по направлению действия. Антибиотики могут применяться при кишечных, нейрохирургических инфекциях, патологиях дыхательных, мочевыводящих путей, половой системы, кожи, мягких тканей и пр.

Резистентность
В результате приема антибиотиков при бактериальной инфекции у детей и взрослых может возникать резистентность. Основной механизм развития этого явления заключается в генетической мутации, происходящей в бактериях. Бактерии получают информацию о генетической устойчивости и переносят эти сведения следующим поколениям. В результате у микроорганизмов изменяется обмен веществ, появляется невосприимчивость к определенному веществу. Исчезает мишень для воздействия антибиотика.
Резистентность возникает из-за нерегулярного применения препаратов, вопреки инструкции. Причиной может также быть самостоятельное лечение, без консультации с врачом.
Действие антибиотиков
При бактериальной или вирусной инфекции антибиотики назначаются, таким образом, понятно. На вирусы они никакого действия не оказывают, но могут назначаться при присоединении к вирусной бактериальной инфекции.
Антибиотики делят на две большие группы:
- Бактериостатические. Они препятствуют размножению патогенных микроорганизмов.
- Бактерицидные. Препараты, вызывающие гибель патогенных микроорганизмов.
Механизм биологического действия обеих групп основывается на следующем:
- подавляется синтез клеточной стенки - подобным образом на бактерии воздействуют пенициллины, цефалоспорины, фосфомицины, гликопептиды, карбопенемы, монобактамы;
- воздействует подавляюще на функции ДНК: сюда относятся препараты групп триметопримы, нитроимидазолы, анзамицины, нитрофураны;
- подавление синтеза белков на рибосомах: макролиды, линкозамины, левомицетины, аминогликозиды, тетрациклины;
- нарушение функции мембран: имидазолы, полимиксины, грамицидины, полиеновые препараты.
Группы антибактериальных препаратов
Бактериальные инфекции лечатся антибиотиками, которые должны подбирать индивидуально для каждого больного.
В основе классификации антибиотиков лежит химическая структура. Так, в одну группу включены препараты, имеющие схожую формулу, но отличающиеся некоторыми фрагментами.
Пенициллиновая группа
Цефалоспориновая группа
Цефалоспориновые антибиотики при бактериальной инфекции у детей и взрослых применяют в тех случаях, когда пенициллиновый ряд не дает желаемого результата или же у пациентов есть аллергическая реакция.
Цефалоспорины вырабатываются грибами и способны убивать микроорганизмы. Выделяют несколько поколений антибактериальных препаратов:
Различие поколений - в спектре действия. Более поздние препараты обладают широким спектром действия и считаются более эффективными.
Макролиды
Достоинством медикаментов группы является способность проникать в клетки человеческого организма. Из-за этой специфики макролиды применяют для лечения микоплазмоза, хламидиоза.
Аминогликозиды
Тетрациклиновая группа
Недостатком препаратов является то, что они способны вызывать устойчивость у бактерий. Причем если таковая возникнет, то микроорганизмы будут устойчивы ко всем препаратам группы.
Фторхинолоны
Фторхинолоны чаще всего применяются для лечения дыхательных путей, лор-органов.
Другие группы
А какие антибиотики при бактериальной инфекции еще могут быть назначены? Помимо вышеуказанных, есть следующие группы:
Применение
Подбирая терапию, врач должен определить, какие антибиотики лечат бактериальную инфекцию эффективнее всего. После этого определяется форма препарата, схема применения. К основным способам введения лекарств относятся:
Какие антибиотики принимать при бактериальной инфекции тому или иному пациенту, решает только врач. Он же определяет способ применения с учетом уровня всасываемости, общего состояния пациента. Некоторые медикаменты вводятся только одним способом.

Чувствительность к препаратам
Каждый организм привыкает к любым условиям, и микроорганизмы - не исключение. При длительном воздействии противомикробных препаратов у бактерий вырабатывается устойчивость. Из-за этой особенности было введено понятие устойчивости.
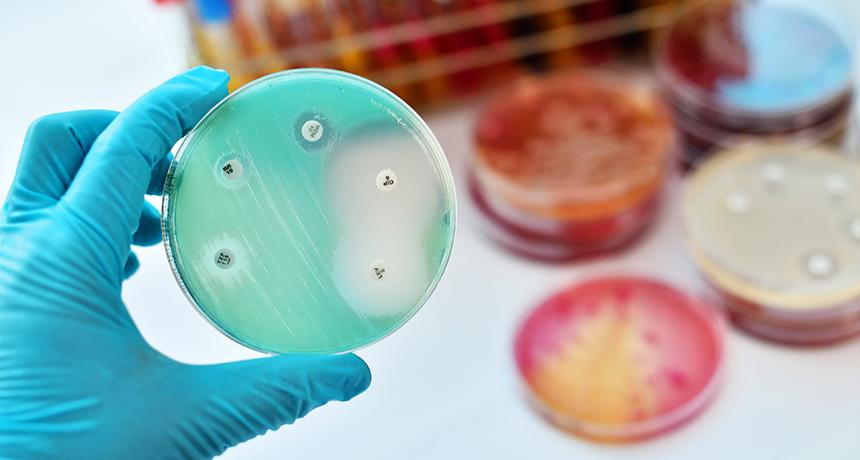
Выбор препарата основывается на знания ученых о чувствительности бактерии к антибиотику. В идеальных условиях доктора подбирают препараты, оказывающие воздействие на те бактерии, которые привели к патологии. Однако чтобы провести анализ по выявлению чувствительности патогена к препарату, необходимо несколько дней, а за это время инфекция может привести к серьезному осложнению, вплоть до летального исхода. Чтобы не терять времени, врачи подбирают препарат с учетом эпидемиологической обстановки в регионе. Обычно применяют препараты широкого спектра действия.
Как только результат анализа будет готов и станет известен возбудитель, доктор может сменить препарат на более эффективный. Также замена лекарства выполняется при отсутствии эффекта на третьи сутки терапии.
Эффективность препаратов
А обязательно ли пить антибиотики при бактериальной инфекции и всегда ли они помогают? При бактериальной и грибковой инфекции принимать противомикробный препарат обязательно. Это единственный способ избавиться от патогенных микроорганизмов.

Алкоголь и антибиотики
При одновременном приеме алкоголя и антибиотиков усиливается нагрузка на печень. Наличие в крови антибактериального препарата и спиртосодержащего напитка приводит к сильной нагрузке на печень – она не успевает обезвредить спирт. В результате повышается вероятность развития неприятных симптомов, таких как тошнота, расстройство кишечника, рвота.

Кирилл Стасевич, биолог
Какие слабые места антибиотики находят у бактерий?
Во-первых, клеточная стенка. Любой клетке нужна какая-то граница между ней и внешней средой — без этого и клетки-то никакой не будет. Обычно границей служит плазматическая мембрана — двойной слой липидов с белками, которые плавают в этой полужидкой поверхности. Но бактерии пошли дальше: они кроме клеточной мембраны создали так называемую клеточную стенку — довольно мощное сооружение и к тому же весьма сложное по химическому строению. Для формирования клеточной стенки бактерии используют ряд ферментов, и если этот процесс нарушить, бактерия с большой вероятностью погибнет. (Клеточная стенка есть также у грибов, водорослей и высших растений, но у них она создаётся на другой химической основе.)
Во-вторых, бактериям, как и всем живым существам, надо размножаться, а для этого нужно озаботиться второй копией
Третья мишень антибиотиков — это трансляция, или биосинтез белка. Известно, что ДНК хорошо подходит для хранения наследственной информации, но вот считывать с неё информацию для синтеза белка не очень удобно. Поэтому между ДНК и белками существует посредник — матричная РНК. Сначала с ДНК снимается РНК-копия, — этот процесс называется транскрипцией, а потом на РНК происходит синтез белка. Выполняют его рибосомы, представляющие собой сложные и большие комплексы из белков и специальных молекул РНК, а также ряд белков, помогающих рибосомам справляться с их задачей.
Например, клеточная стенка бактерий — мишень для хорошо известного антибиотика пенициллина: он блокирует ферменты, с помощью которых бактерия осуществляет строительство своей внешней оболочки. Если применить эритромицин, гентамицин или тетрациклин, то бактерии перестанут синтезировать белки. Эти антибиотики связываются с рибосомами так, что трансляция прекращается (хотя конкретные способы подействовать на рибосому и синтез белка у эритромицина, гентамицина и тетрациклина разные). Хинолоны подавляют работу бактериальных белков, которые нужны для распутывания нитей ДНК; без этого ДНК невозможно правильно копировать (или реплицировать), а ошибки копирования ведут к гибели бактерий. Сульфаниламидные препараты нарушают синтез веществ, необходимых для производства нуклеотидов, из которых состоит ДНК, так что бактерии опять-таки лишаются возможности воспроизводить свой геном.
Почему же антибиотики не действуют на вирусы?
Что произойдёт, если к клеткам с вирусной инфекцией добавить, например, антибиотик, прерывающий процесс образования клеточной стенки? Никакой клеточной стенки у вирусов нет. И потому антибиотик, который действует на синтез клеточной стенки, ничего вирусу не сделает. Ну а если добавить антибиотик, который подавляет процесс биосинтеза белка? Всё равно не подействует, потому что антибиотик будет искать бактериальную рибосому, а в животной клетке (в том числе человеческой) такой нет, у неё рибосома другая. В том, что белки и белковые комплексы, которые выполняют одни и те же функции, у разных организмов различаются по структуре, ничего необычного нет. Живые организмы должны синтезировать белок, синтезировать РНК, реплицировать свою ДНК, избавляться от мутаций. Эти процессы идут у всех трёх доменов жизни: у архей, у бактерий и у эукариот (к которым относятся и животные, и растения, и грибы), — и задействованы в них схожие молекулы и надмолекулярные комплексы. Схожие — но не одинаковые. Например, рибосомы бактерий отличаются по структуре от рибосом эукариот из-за того, что рибосомная РНК немного по-разному выглядит у тех и других. Такая непохожесть и мешает антибактериальным антибиотикам влиять на молекулярные механизмы эукариот. Это можно сравнить с разными моделями автомобилей: любой из них довезёт вас до места, но конструкция двигателя может у них отличаться и запчасти к ним нужны разные. В случае с рибосомами таких различий достаточно, чтобы антибиотики смогли подействовать только на бактерию.
До какой степени может проявляться специализация антибиотиков? Вообще, антибиотики изначально — это вовсе не искусственные вещества, созданные химиками. Антибиотики — это химическое оружие, которое грибы и бактерии издавна используют друг против друга, чтобы избавляться от конкурентов, претендующих на те же ресурсы окружающей среды. Лишь потом к ним добавились соединения вроде вышеупомянутых сульфаниламидов и хинолонов. Знаменитый пенициллин получили когда-то из грибов рода пенициллиум, а бактерии стрептомицеты синтезируют целый спектр антибиотиков как против бактерий, так и против других грибов. Причём стрептомицеты до сих пор служат источником новых лекарств: не так давно исследователи из Северо-Восточного университета (США) сообщили о новой группе антибиотиков, которые были получены из бактерий Streptomyces hawaiensi, — эти новые средства действуют даже на те бактериальные клетки, которые находятся в состоянии покоя и потому не чувствуют действия обычных лекарств. Грибам и бактериям приходится воевать с каким-то определённым противником, кроме того, необходимо, чтобы их химическое оружие было безопасно для того, кто его использует. Потому-то среди антибиотиков одни обладают самой широкой антимикробной активностью, а другие срабатывают лишь против отдельных групп микроорганизмов, пусть и довольно обширных (как, например, полимиксины, действующие только на грамотрицательные бактерии).
Более того, существуют антибиотики, которые вредят именно эукариотическим клеткам, но совершенно безвредны для бактерий. Например, стрептомицеты синтезируют циклогексимид, который подавляет работу исключительно эукариотических рибосом, и они же производят антибиотики, подавляющие рост раковых клеток. Механизм действия этих противораковых средств может быть разным: они могут встраиваться в клеточную ДНК и мешать синтезировать РНК и новые молекулы ДНК, могут ингибировать работу ферментов, работающих с ДНК, и т. д., — но эффект от них один: раковая клетка перестаёт делиться и погибает.
Возникает вопрос: если вирусы пользуются клеточными молекулярными машинами, то нельзя ли избавиться от вирусов, подействовав на молекулярные процессы в заражённых ими клетках? Но тогда нужно быть уверенными в том, что лекарство попадёт именно в заражённую клетку и минует здоровую. А эта задача весьма нетривиальна: надо научить лекарство отличать заражённые клетки от незаражённых. Похожую проблему пытаются решить (и небезуспешно) в отношении опухолевых клеток: хитроумные технологии, в том числе и с приставкой нано-, разрабатываются для того, чтобы обеспечить адресную доставку лекарств именно в опухоль.
Что же до вирусов, то с ними лучше бороться, используя специфические особенности их биологии. Вирусу можно помешать собраться в частицу, или, например, помешать выйти наружу и тем самым предотвратить заражение соседних клеток (таков механизм работы противовирусного средства занамивира), или, наоборот, помешать ему высвободить свой генетический материал в клеточную цитоплазму (так работает римантадин), или вообще запретить ему взаимодействовать с клеткой.
Вирусы не во всём полагаются на клеточные ферменты. Для синтеза ДНК или РНК они используют собственные белки-полимеразы, которые отличаются от клеточных белков и которые зашифрованы в вирусном геноме. Кроме того, такие вирусные белки могут входить в состав готовой вирусной частицы. И антивирусное вещество может действовать как раз на такие сугубо вирусные белки: например, ацикловир подавляет работу ДНК-полимеразы вируса герпеса. Этот фермент строит молекулу ДНК из молекул-мономеров нуклеотидов, и без него вирус не может умножить свою ДНК. Ацикловир так модифицирует молекулы-мономеры, что они выводят из строя ДНК-полимеразу. Многие РНК-вирусы, в том числе и вирус СПИДа, приходят в клетку со своей РНК и первым делом синтезируют на данной РНК молекулу ДНК, для чего опять же нужен особый белок, называемый обратной транскриптазой. И ряд противовирусных препаратов помогают ослабить вирусную инфекцию, действуя именно на этот специфический белок. На клеточные же молекулы такие противовирусные лекарства не действуют. Ну и наконец, избавить организм от вируса можно, просто активировав иммунитет, который достаточно эффективно опознаёт вирусы и заражённые вирусами клетки.
Итак, антибактериальные антибиотики не помогут нам против вирусов просто потому, что вирусы организованы в принципе иначе, чем бактерии. Мы не можем подействовать ни на вирусную клеточную стенку, ни на рибосомы, потому что у вирусов ни того, ни другого нет. Мы можем лишь подавить работу некоторых вирусных белков и прервать специфические процессы в жизненном цикле вирусов, однако для этого нужны особые вещества, действующие иначе, нежели антибактериальные антибиотики.
Очевидно, различия между бактериальными и эукариотическими молекулами и молекулярными комплексами, участвующими в одних и тех же процессах, для ряда антибиотиков не так уж велики и они могут действовать как на те, так и на другие. Однако это вовсе не значит, что такие вещества могут быть эффективны против вирусов. Тут важно понять, что в случае с вирусами складываются воедино сразу несколько особенностей их биологии и антибиотик против такой суммы обстоятельств оказывается бессилен.
Впрочем, главный побочный эффект от антибиотиков связан как раз с тем, что они вредят мирной желудочно-кишечной микрофлоре. Антибиотики обычно не различают, кто перед ними, мирный симбионт или патогенная бактерия, и убивают всех, кто попадётся на пути. А ведь роль кишечных бактерий трудно переоценить: без них мы бы с трудом переваривали пищу, они поддерживают здоровый обмен веществ, помогают в настройке иммунитета и делают много чего ещё, — функции кишечной микрофлоры исследователи изучают до сих пор. Можно себе представить, как чувствует себя организм, лишённый компаньонов-сожителей из-за лекарственной атаки. Поэтому часто, прописывая сильный антибиотик или интенсивный антибиотический курс, врачи заодно рекомендуют принимать препараты, которые поддерживают нормальную микрофлору в пищеварительном тракте пациента.
Разобрались вместе с врачами в главных мифах вокруг антибиотиков
С появлением антибиотиков — веществ, подавляющих рост бактерий и тем самым останавливающих воспалительный процесс в организме, вызванный этими бактериями, — люди перестали умирать от многочисленных инфекционных заболеваний и стали дольше жить в целом. Нередко антибактериальные препараты можно купить в аптеке без рецепта врача, хотя все эти средства рецептурные. Бесконтрольный прием ведет к тому, что бактерии сильно меняются (появляются устойчивые формы) и препараты против них больше не действуют. Кроме того, повышается риск побочной реакции, которая может оказаться тяжелее самой болезни. Как правильно принимать антибиотики, когда их пить бесполезно, а в каких случаях опасно, The Village выяснил у врачей.
Текст: Евгения Скворцова



к. м. н., инфекционист, терапевт клиники H-Clinic
Как работает антибиотик
Когда нужна профилактика антибиотиками
Другой пример так называемой постконтактной профилактики — назначение антибиотика ребенку, который контактировал с больным коклюшем или менингококковой инфекцией. Такая профилактика прерывает распространение возбудителя и снижает риск развития заболевания.
Почему антибиотики запрещают
Антибактериальные препараты делятся на группы, отличаются своим воздействием и нежелательными эффектами. Степень тяжести побочных эффектов и вероятность аллергии на антибиотик — то, что влияет на выбор антибактериального препарата в каждом конкретном случае. Реакция на препарат зависит не только от самого средства, но и от организма пациента. Если у человека есть хронические заболевания, их течение может ухудшиться во время приема назначенного антибиотика. Поэтому так важно рассказывать врачу о сопутствующих заболеваниях и наличии аллергии, даже если она была очень давно. Симптомы последней — кожный зуд, отек дыхательных путей или даже анафилактический шок (обычно после инъекции антибиотика), когда давление резко падает, возникает полуобморочное состояние и человеку требуется срочная реанимация.
Головокружение, головная боль, тошнота, рвота, вздутие живота, жидкий стул — частые проявления в ответ на антибактериальную терапию. Но это не весь список токсических реакций. Некоторые антибиотики гепатотоксичны (амфотерицин, эритромицин) — ухудшают работу печени и повышают риск желтухи, а в 60-е годы прием антибиотиков и вовсе мог обернуться потерей слуха. Виной тому вещества группы аминогликозидов: неомицин, стрептомицин, канамицин, гентамицин, амикацин. Раньше ими лечили кишечные инфекции (сегодня эту проблему научились решать по-другому — как правило, без антибиотиков). В настоящее время старые аминогликозиды применяются крайне редко и только по строгим показаниям (например, при гнойных инфекциях брюшной полости и малого таза в сочетании с другими средствами) — их вытеснили более современные и безопасные препараты.
Достаточно большая группа антибактериальных препаратов используется в педиатрии. Но есть антибиотики, которые противопоказаны в детском возрасте из-за способности влиять на рост и отсутствия данных об их безопасности. К примеру, тетрациклиновые антибиотики нельзя принимать до девяти лет, фторхинолоны — до 15 лет. При назначении антибиотика доза препарата должна быть рассчитана с учетом возраста и веса ребенка.
С большой осторожностью принимать антибиотики следует беременным, если без такого лечения действительно не обойтись (например, в случае пневмонии, пиелонефрита, холецистита). Они особенно опасны в первом триместре беременности, когда идет закладка основных органов и систем будущего организма. При беременности абсолютно противопоказаны тетрациклины (могут привести к нарушению формирования костей, зубов у плода), аминогликозиды (могут вызывать ото- и нефротоксичность), а также левомицетин, сульфаниламиды и нитрофураны. Беременным женщинам назначают только относительно безопасные антибиотики, официально разрешенные при беременности: пенициллины, цефалоспорины, макролиды.
Бактерии, которые не боятся антибиотиков
С другой стороны, устойчивость бактерий к антибиотикам — большая проблема в медицине. Микробы мутируют, и появляются формы бактерий, на которые существующие антибиотики уже не действуют. В результате эффективность привычных препаратов заметно снижается, а новые средства появляются крайне редко.
Один из ключевых факторов развития резистентности — бесконтрольное и неправильное применение антибактериальных препаратов. При неверно подобранном антибиотике, его недостаточной дозе, несоблюдении срока лечения микробы не погибают, а изменяют свою структуру, и в следующий раз тот же самый антибиотик пациенту уже не поможет. Выход из ситуации пока один: не принимать антибиотики без надобности, а если их назначил врач, то соблюдать все рекомендации. Важно помнить и о профилактике распространенных бактериальных и вирусных болезней с осложнениями: прививаться от гриппа следует ежегодно, а сделать прививку от пневмококка — одного из главных возбудителей заболеваний дыхательных путей — достаточно один раз.
Как пить антибиотики
Показания к применению должен определять лечащий врач. Вот правила, которые следует соблюдать, чтобы лечение антибиотиком было на пользу:
Не нарушать дозировку, время и кратность приема
Важно, чтобы концентрация препарата в крови сильно не снижалась: размножение бактерий не должно возобновляться.
Запивать антибиотики простой водой и пить больше жидкости во время всего лечения
Стоит также есть меньше жирной пищи и не увлекаться острыми приправами.
Следить за своими ощущениями
Эффективность противомикробной терапии определяется на третий день. Это не значит, что к этому времени наступает выздоровление, но положительная динамика должна быть. Если ее нет, врач может заменить антибиотик на другой. Незамедлительная помощь специалиста также потребуется, если на препарат возникнет аллергия (обычно она проявляется в первые сутки приема).
Проходить полный курс лечения
При острой неосложненной инфекции он обычно занимает пять — семь дней. Не нужно бросать прием назначенного препарата просто потому, что стало лучше: исчезновение симптомов — не всегда показатель того, что инфекция полностью уничтожена. Но и растягивать курс лечения без необходимости — лишнее: по словам врачей, при длительном применении антибиотики могут не только перестать помогать в дальнейшем, но и ухудшить работу иммунной системы.
Делать чекап, если лечение — долгое
Однако в тяжелых случаях и при хронических заболеваниях лечение может быть продлено до двух недель и более. К примеру, внутриклеточные инфекции быстро не лечатся. Самые длительные антибактериальные курсы применяются при туберкулезе, болезни Лайма и микобактериозах и могут занимать не один год.
Чтобы не посадить печень и не нанести еще больший вред здоровью, следует сдавать биохимический анализ крови: если показатели АЛТ и АСТ в норме, значит, печень справляется. При этом антибиотики могут иметь побочные эффекты — в таком случае врач назначит чекап с учетом хронических заболеваний пациента и особенностей антибиотика.
Таблетки или инъекции — что лучше?
Антибиотики и алкоголь
Любое вещество, попавшее внутрь организма, должно быть выведено из него. Для этого работают ферменты, которые расщепляют сложные молекулы до простых и выводят все лишнее. При наличии алкоголя в крови ферментные системы блокируются — организм получает двойное токсическое воздействие на собственные клетки и ткани. Реакция на такое воздействие может быть разной (зависит от группы антибиотика и количества выпитого спиртного) — от аллергической сыпи до анафилактического шока, поэтому лучше не рисковать.
Восстановление после лечения
Ценность лечения антибиотиками в том, что они бьют точно в цель: блокируют или убивают возбудитель заболевания. Однако во время такого лечения страдает не только патогенная, но и нормальная флора кишечника, которую необходимо восстановить.
Но пока использование пробиотиков носит только рекомендательный характер. А вот пить во время лечения много воды — точно не помешает.
Что касается витаминов, то, по словам врачей, в острый период инфекционного заболевания они не показаны, а эффективность иммуномодуляторов (веществ, способных оказывать регулирующее действие на иммунную систему) и вовсе под большим вопросом — не проводилось серьезных рандомизированных исследований этих препаратов, а значит, последствия их применения непредсказуемы.
К чему привела лекарственная устойчивость
Устойчивость к антибиотикам: угроза постантибиотиковой эры
Об устойчивости к противомикробным препаратам говорят в тех случаях, когда микроорганизмы (бактерии, грибки, вирусы и паразиты) оказываются способны выдерживать атаку противомикробных средств (антибиотиков, противогрибковых, противовирусных и противомалярийных препаратов), которые раньше успешно их подавляли. Как это происходит, расскажем на примере антибиотиков.
В 2001 году эксперты Всемирной организации здравоохранения (ВОЗ) впервые обратили внимание на то, что из-за нерационального назначения антибиотиков эти препараты вскоре могут начать терять свою эффективность. Сегодня антибиотикорезистентность — это мировая проблема, которая в то же время касается каждого жителя Земли.
Это уже происходит: 25 000 человек ежегодно умирают в Европе — как дома, так и в стационаре — от инфекций, вызванных резистентными микробами. При этом на новые антибиотики рассчитывать не приходится: за последние 30 лет не было открыто ни одного нового класса антибактериальных препаратов, и если даже разработки начнутся сегодня, лекарство появится не раньше, чем через 15 лет.
Болезни, которым не страшны антибиотики
Заболевания дыхательных путей. По статистике, чаще всего антибиотики назначаются при респираторных заболеваниях, отитах, воспалениях бронхов и легких. Один из самых опасных возбудителей этих заболеваний — пневмококк. Препараты, которыми раньше успешно лечилась пневмококковая инфекция, сегодня не могут назначаться лишь исходя из картины заболевания (быть препаратами выбора, как говорят врачи).
Дело в том, что устойчивость пневмококка к пенициллину достигла 50%, к тетрациклинам и левомицетину — 30%. Недавно подтверждена резистентность пневмококка и к антибиотикам группы макролидов — тоже в 30% случаев. При таком уровне лекарственной устойчивости врач должен сначала провести анализ на чувствительность возбудителя к антибиотикам и только потом назначить препарат, который точно будет работать. Но анализ этот дорогой, делается долго, а пневмококковая инфекция развивается стремительно.
Инфекции мочевыводящих путей. Чаще всего они вызываются кишечной палочкой (Escherichia coli) и до последнего времени хорошо лечились фторхинолонами, но сегодня устойчивость кишечной палочки к этим противобактериальным препаратам возросла настолько, что они тоже не могут считаться препаратами выбора.

Эпидемия гонореи?
Пример того, как социально опасная болезнь может стать неизлечимой, — современная ситуация с гонореей. Эта инфекция, передающаяся половым путем (ИППП), известна с древности, и сегодня ею в России болеют 36 человек на 100 тыс. населения. Ее возбудители — гонококки (Neisseria gonorrhoeae) вызывают гнойное воспаление мочеиспускательного канала и яичек у мужчин, маточных труб и яичников у женщин, что может привести к бесплодию и импотенции.
Проблема в том, что заболевание часто протекает бессимптомно, особенно у женщин. По статистике, средний срок обращения к врачу после заражения гонореей — полгода. Хотя специалисты советуют сдать анализы после любого незащищенного контакта с непостоянным половым партнером. Кроме того, в нашей стране до сих пор не принято в случае неприятных симптомов со стороны половых органов обращаться к врачу — многие сами назначают себе лекарства, почитав о них в интернете.
Это мировая тенденция: в Китае за 5 лет — с 1996 по 2001 гг. — устойчивость гонококка к антибиотикам увеличилась с 17 до 70%. Специалисты по ИППП говорят, что для лечения гонореи остается одна группа действующих препаратов — цефалоспорины, но и их уже нельзя использовать как монопрепарат, а надо комбинировать с другим антибиотиком. Рекомендации по лечению гонореи меняются буквально каждые несколько лет, и только врач знает, что именно эффективно в данный момент.
Что могут сделать пациенты?
Использовать антибиотики только в случае их назначения дипломированным медицинским специалистом.
Всегда доводить до конца полный курс лечения, даже если самочувствие уже улучшилось.
Не делиться антибиотиками с другими людьми и не использовать оставшиеся антибиотики, назначенные ранее.
Что могут сделать врачи и фармацевты?
Заниматься профилактикой инфекционных заболеваний.
Назначать и отпускать антибиотики только когда они действительно необходимы.
Назначать и отпускать правильные препараты для лечения болезни.
По медицинским вопросам обязательно предварительно проконсультируйтесь с врачом
Читайте также:


