Как определить очаг инфекции
Работа в инфекционном (эпидемическом) очаге на ФАП начинается с изучения эпидемического очага. При этом осуществляется выявление источника инфекции, факторов и путей передачи возбудителя инфекции, а также установление границ эпидемического очага и условий, способствовавших его возникновению. Каждый инфекционный очаг имеет свои особенности, поэтому особое внимание уделяется выяснению условий его возникновения, проводится эпидемиологическое обследование.
Эпидемиологическое обследование включает:
Опрос больного, родственников, сотрудников по работе, который включает следующие сведения: пребывание в командировке в районе, неблагополучном по тем или иным инфекциям, за рубежом, особенно в жарких странах; пребывание в отпуске (нахождение в лесу, санатории, на турбазе); для детей учитывается в оздоровительном лагере; период, предшествовавший заболеванию с учетом максимального инкубационного срока при данной болезни; наличие подобной болезни в семье, в рабочем коллективе, в семье друзей или знакомых, у детей — в детском коллективе, который они посещают; описание условий труда и быта, которые могли способствовать заражению; уход за больными животными и работа в полевых условиях; употребление продуктов с рынков (особенно молочных), из мест с неустановленными правилами торговли; общение с людьми, прибывшими из городов и районов, где имеются эпидемические очаги.
Ознакомление с медицинской документацией. Изучаются записи в медицинской карте амбулаторного больного, истории болезни, журналы учета прививок санаторные журналы детских учреждений. Это позволяет узнать о заболеваниях подобного рода в прошлом, выявить контактных по данному заболеванию, анализировать состояние иммунной прослойки населения (т. е. число прививок против этой болезни).
Получение зооветеринарных сведений, которые позволяют в ряде случаев установить связь возникновения эпидемического очага с наличием больных животных (при ящуре, бруцеллезе, сибирской язве).
Проведение лабораторных исследований (бактериологических, вирусологических, паразитарных) в ограниченных коллективах и при отсутствии госпитализации больного. В случае дифтерии, менингококковой инфекции проводится обследование всего коллектива детских учреждений или общежития на определение носительства, возможного источника инфекции. При кишечной инфекции лабораторные исследования обязательны у детей, посещающих детские учреждения (ясли, сады), и у работников категорированных профессий (работники пищеблока, торговли, водозабора и водоснабжения). Иногда может возникнуть необходимость лабораторного исследования воды, пищи, смывов с рук работников пищеблоков, с инвентаря и др. Проводится посев у отловленных либо умерших грызунов и др. животных (при чуме, туляремии, лептоспирозе).
Энтомологическое и эпизоотологическое обследования, предполагающие выявление мест (территорий) выплода и обитания комаров — переносчиков малярии, комариного энцефалита, москитов — переносчиков флеботомной лихорадки, аргасовых клещей — переносчиков клещевого возвратного тифа. На основании полученных данных разрабатываются конкретные меры борьбы с возбудителями и переносчиками инфекций. При эпизоотологическом обследовании учитываются сведения о падеже среди грызунов, о природной очаговости на той или иной территории (в случае, если больной выезжал на эти территории перед заболеванием).
Ознакомление с условиями труда и быта заболевшего. При этом учитывается характер рабочего места, санитарное состояние помещения, характер питания и метод осуществления медицинского надзора за столовой на предприятии, содержанием туалетов, соблюдением правил личной гигиены, а также санитарно-гигиенического содержания жилища больного.
Обследование и состояние источников водоснабжения, водозабора, объектов общественного питания, периодичность и состояние очистки территории в случаях массовых инфекционных очагах. Большое значение имеет учет миграции населения в данном населенном пункте и изучение предыдущей инфекционной заболеваемости.
Эпидемический очаг — это место пребывания источника (возбудителя инфекции — больного человека или носителя возбудителя) и прилегающая территория в пределах его способности передавать возбудителя окружающим. Протяженность очага, его границы определяются характером инфекционной болезни, условиями социально-бытовой обстановки и природными условиями. Так, для сыпного тифа эпидемический очаг — это место, где находится больной (единственный источник инфекции), лица, с ним соприкасающиеся, вещи, на которых могут оказаться заразившиеся от него вши. Границы такого очага могут ограничиться одной квартирой или целым общежитием или выходить за пределы населенного пункта. При чуме эпидемическим очагом считается не только место нахождения больного, соприкасавшиеся с ним люди, инфицированные вещи, но и территория, на которой обитают животные — хранители чумной инфекции и блохи — переносчики этой инфекции.
При эпидемиях и пандемиях эпидемический очаг может захватывать не только определенные районы и области, но и целые государства. Особое значение при обследовании эпидемического очага имеют сведения, характеризующие время появления первых больных, динамика возникновения заболевания или сезонность при некоторых инфекциях (например, малярии). После посещения и обследования эпидемического очага фельдшер проводит выявление лиц, общавшихся с больным (больными), проводит медицинское наблюдение за контактными в течение всего срока инкубационного периода, при необходимости — ежедневное измерение температуры, лабораторные исследования для выявления возможности носительства инфекции. Проводится анализ полученных данных, оценивается сложившаяся ситуация и составляется план дальнейших мероприятий в очаге по профилактике последующих заболеваний.
В план противоэпидемических мероприятий должны включаться меры по обезвреживанию источника инфекции, пресечению путей передачи и повышению специфической невосприимчивости населения. Меры в отношении источника инфекции в зависимости от эпидемиологии болезни имеют свои особенности. Так, при антропонозных инфекциях (брюшной тиф, паратифы, дизентерия) необходимо в максимально короткий срок выявить в очаге всех больных и носителей с целью их изоляции и лечения. При особо опасных (карантинных) инфекциях наряду с больным обязательно изолируют и всех лиц общавшимся с ним, в провизорные отделения. Одной из мер в отношении больных в инфекционном очаге является изоляция инфекционного больного.
Изоляция инфекционных больных — противоэпидемическое мероприятие, состоящее в разобщении больного заразной болезнью с окружающими людьми с целью предупреждения распространения инфекции. Наиболее совершенная форма изоляции инфекционных больных — госпитализация в инфекционные больницы или инфекционное отделение при ЦРБ. В случае невозможности срочной госпитализации в инфекционные отделения больных помещают в изолятор.
Обязательной госпитализации подлежат больные с особо опасными инфекциями, а также больные вирусным гепатитом, брюшным тифом, сыпным тифом, сибирской язвой, дифтерией, менингитами, геморрагическими лихорадками, бешенством, полиомиелитом. При других инфекциях больных госпитализируют в случаях тяжелого течения болезни, осложнений и плохих бытовых условий. Больных с воздушно-капельными инфекциями, тяжелыми формами желудочно-кишечных инфекций можно изолировать на дому при соблюдении условий, препятствующих распространению инфекции (отдельная комната, проведение текущей дезинфекции, соответствующее лечение).
Для пресечения путей передачи при зоонозных заразных болезнях добиваются либо уничтожения (дератизации), либо содержания больных (заразившихся) животных в условиях строгого санитарно-ветеринарного режима. В природных очагах это делают периодически с целью ослабить эпидемическую напряженность. Пресечение путей передачи при кишечных инфекциях достигается при осуществлении дезинфекции или соблюдении элементарных правил личной гигиены. В некоторых случаях приходится исключать возможность заражения через воду, продукты питания и инфицированные вещи. В очаге важно обеспечить обеззараживание выделений больного; при отсутствии канализации проводить дезинфекцию выгребных ям, помоек.
При повторных заболеваниях в очаге целесообразно провести дополнительное внеочередное обследование работников пищеблоков, объектов водозабора. Меры профилактики при передаче инфекций, передающихся воздушно-капельным путем: кварцевание, проветривание и обработку дезинфицирующими средствами помещений, где находится больной. При трансмиссивных (кровяных) путях передачи инфекции мерами может быть истребление комаров или клещей, дезинфекция различными средствами, а также ношение защитной одежды, сеток.
Меры, направленные на повышение невосприимчивости населения к той или иной инфекции, заключаются как в предварительной, так и в экстренной вакцинации. При ряде инфекций возможно проведение химиопрофилактики лицам с высоким риском заражения. С целью раннего выявления первых симптомов болезни за контактными устанавливается медицинское наблюдение в течение максимального срока инкубационного периода данной болезни с момента выявления последнего больного или его госпитализации. В эпидемическом очаге мероприятия проводятся в течение всего периода наблюдения, включая медицинские осмотры контактных, лабораторные исследования, в некоторых случаях — термометрию, проведение экстренной вакцинации, текущей дезинфекции, фагирование, прием иммуноглобулинов, химиопрофилактику.
Эпидемический очаг считается ликвидированным, когда обезврежен источник инфекции (изоляция, госпитализация, лечение), окружающие проверены на отсутствие или носительство возбудителей инфекции; в очаге осуществлены меры заключительной дезинфекции или дератизация; проведена экстренная иммунизация для профилактики этой инфекции, у контактных и по истечении срока максимального наблюдения во время инкубационного периода этой инфекции и лица, контактировавшие с больным, не заболевают. Все противоэпидемические и профилактические мероприятия в инфекционном очаге на фельдщерско-акушерском пункте осуществляет фельдшер под контролем районного отдела государственного санитарно-эпидемического надзора. Мероприятия в инфекционном (эпидемическом) очаге проводятся на основании приказа №3 Российской Федерации, приказов и постановлений администрации, областных, районных отделов здравоохранения и государственной службы санитарно-эпидемиологического надзора.
Очаговые инфекции вызывают, как известно, иногда, кроме тканевых и висцеральных определений, суставные, почечные, сердечно-сосудистые, эндокринные и пр., и различные неопределенные расстройства общего порядка: астению, адинамию, бессонницу или сонливость, кефалалгию, разные неопределенные мышечные и суставные алгии, пальпитации, диспептические расстройства.
В некоторых случаях, эти расстройства могут быть самостоятельными, могут появиться отдельно (без тканевого или висцерального определений, присущих очаговым инфекциям, более характерными, более примерными, следовательно, более разоблачающими) и могут создать подобные клинические картины, трудно постигаемые и диагностируемые из-за их исключительно субъективного или функционального характера. Были описаны состояния изнурения и астении, туманные, что касается причины (Вальб) или с протеиформной симптоматикой невротического типа (Кайзер), определенные, в действительности, очаговой инфекцией и обманывавшие долгое время врачей.
Больная, сообщенная Гурио, представляла боль языка, неба, дёсен, глотки и гортани, типа парестезии (как изжога), оставляя впечатление психогенных, простых сенесталгий; в действительности, они касались альвеолярной пиорреи, довольно стертой, и поддались лечению соответствующей вакциной.
Второе наблюдение, еще интереснее, одного врача (Тодя), который более двух десятилетий, между 15-ью и 39-ью годами, представлял ряд страданий, крайне разнообразных и изменчивых: диффузных или гемикранических кефалалгий, потов, состояния усталости и крайней адинамии в течение нескольких дней, периодических расстройств глотания, головокружения, парестезии, вздутия и разных кишечных расстройств, припадков тахикардии, сердцебиений, скептицизма, бессонницы, отсутствия инициативы, черных мыслей и т.д.
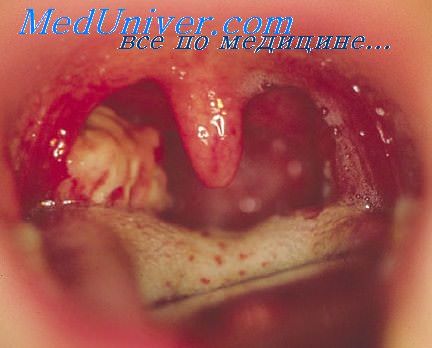
После многих лет лечения успокаивающими или стимулирующими и пр. средствами, обнаружилось, что он представляет хроническое воспаление миндалин. Их удаление вызвало исчезновение всех указанных проявлений, а состояние пациента радикально изменилось со всех точек зрения (настроения, работоспособности, сенестезического равновесия). Одно из миндалин было полно гноя. У пациента в детстве часто бывал острый амигдалит, но приступы не появлялись, как таковые, с 15-летнего возраста.
Два примера из наших наблюдений:
У больной в возрасте 54-ти лет, представлявшей всякого рода функциональные расстройства, с акуфенами, фосфенами, лицевыми сосудодвигательными явлениями, парестезиями ротовыми и в конечностях, пальпитациями, приливами крови к голове, которые были диагностированы как расстройства климакса, был обнаружен хронический амигдалит, без истории, без местных актуальных проявлений. Удаление миндалин привело к почти полному исчезновению расстройств больной (даже тех, видимо обоснованных климаксом, как прилив крови к голове, сосудодвигательные кризы), на которые гормональные и успокоительные средства почти не повлияли.
Другая больная, 29-ти лет, инженер, представляет в течение 3-ех лет головные боли, головокружение, выраженную прогрессивную адинамию — периодами в несколько дней, сонливость днем и бессонницу ночью, разные по локализации, интенсивности, мобильности, полиалгии — странные и трудно-относимые к какому-нибудь органу или заболеванию. Кроме того: она стала необщительной, раздражительной, менее восприимчивой в профессии, сверхчувствительной, по каковой причине избегает окружение, живёт все более отчужденно. Объективно: пальпебральный тремор, упорный дермографизм, гиперрефлекторность, Хвостека + , и Румпель-Лида +.
В остальном, все исследования отрицательные (повторные помещения в больнуцу). Невролог поставил диагноз астенического невроза с ипохондрической составной, но лечение успокаивающими, седативными, тоническими средствами не дало никаких результатов. Случайно, установлено, что больная является носительницей хронического амигдалита: у нее был маленький острый случайный припадок, во время которого общее состояние почти что дошло до провала, а психические явления были гораздо выраженнее. Решили удалить миндалины и провели вмешательство.
Следовательно, ясно, что токсическая импрегнация, с точкой отправки в очаговой инфекции также может определить неясные, комплексные, странные картины, вызывающие диагноз невроза, дизвегетоза.
эпидемический инфекция больной зооантропоноза
Эпизоотическим очагом называют место пребывания источника возбудителя инфекции (животного - больного или носителя) с окружающей его территорией в тех пределах, в которых он способен передавать заразное начало окружающим животным.
Эпидемический очаг, в котором имеется один источник инфекции, называется единичным, а в котором несколько больных или носителей - множественным. Первое заболевание в очаге называется первичным, а возникающие потом - вторичными (последующими).
При антропонозах эпидемический очаг существует, пока в нем имеются источник возбудителя инфекции или факторы его передачи.
При зоонозах источником инфекции является больное животное, которое является основой эпизотического очага. Когда человек соприкасается с больным животным, возникает эпидемический очаг зоонозной инфекции. Как только связь человека с больным животным разрывается, прекращается и существование эпидемического очага зоонозной инфекции.
При сапронозных инфекциях резервуаром возбудителей являются объекты окружающей среды (водная среда при легионеллезе, почва при микозах), служащие местами их естественного пребывания, откуда они способны передаваться человеку. При заболевании человека место нахождения возбудителей инфекции из резервуара превращается в эпидемический очаг. Как только разрывается связь человека с объектами окружающей среды, являющимися резервуаром возбудителя инфекции, существование эпидемического очага сапронозной инфекции прекращается.
Каждый очаг имеет не только продолжительность действия во времени, но и пространственные границы. Для определения границ эпидемического очага проводится его эпидемиологическое обследование.
Задачами эпидемиологического обследования являются: выявить источник инфекции, установить факторы передачи возбудителя и определить границы очага, т. е. определить круг лиц, подвергшихся риску заражения (контактных с больным). Только на основе тщательно проведенного эпидемиологического обследования можно разработать рациональные и исчерпывающие меры, направленные на ликвидацию очага и предупреждение дальнейшего распространения заболеваний. Разработка таких мероприятий и является главной задачей эпидемиологического обследования.
Эпидемиологическое обследование включает:
· опрос больного и окружающих его лиц,
· лабораторные и инструментальные исследования. Эпидемиологическое обследование очага начинают с опроса больного (больных) и окружающих его лиц. Цель опроса - сбор эпидемиологического анамнеза, т.е. сведений об источнике возбудителя инфекции, путях и факторах ее передачи, времени и условиях заражения, причинах возникновения очага. В ходе опроса выясняется возможность заражения в сроки, равные максимальной длительности инкубационного периода при данной болезни. При этом учитывают не только бытовые, но и производственные (учебные) связи больного. Внимание должно быть обращено на возможно здоровых носителей возбудителя данной инфекции, а также больных стертыми формами, что особенно важно при дизентерии, полиомиелите, дифтерии, коклюше и др.
Опрос окружающих больного лиц часто является единственным источником достоверной информации (когда больной не в состоянии отвечать на вопросы или не заинтересован в объективной характеристике ситуации). Население спрашивают о продуктах питания или питьевой воде, наличии кровососущих членистоногих, грызунов.
Осмотр очага помогает определить пространственные границы очага, выяснить, является ли данный дом, квартира или предприятие, учреждение, где обнаружен больной, единственным местом, где могут находиться источники возбудителя инфекции. Проводят визуальное обследование различных объектов, в ходе которого оценивают санитарно-гигиеническое состояние очага, включая как бытовую, так и производственную обстановку в окружении заболевших. При осмотре очага отбирают пробы для лабораторного исследования вероятных факторов передачи возбудителя, возможен также отлов диких и взятие материала от домашних животных, отлов членистоногих - вероятных переносчиков возбудителя - для определения их вида, численности, зараженности и др.
Изучение документов предусматривает сбор данных об учете и регистрации сходных инфекционных заболеваний на территории очага, которые позволяют судить об эпидемиологической ситуации в данной местности в период, предшествовавший возникновению очага. Собранный при опросе больного (больных) эпидемиологический анамнез должен быть дополнен сведениями из амбулаторной карты, истории болезни.
Лабораторные и инструментальные исследования включают в себя: микробиологические, гельминтологические, энтомологические и другие методы.
Микробиологические (бактериологические, вирусологические) исследования служат бесспорным основанием для выявления источника и лиц, заразившихся в окружении источника, а также для установления факторов передачи возбудителя (вода, пищевые продукты, почва).
Гельминтологические и протозоологические исследования проводятся для выявления зараженности источника инвазии и лиц, находившихся в его окружении, а также определения загрязненности паразитами объектов окружающей среды.
Зоологические исследования проводятся для выяснения эпидемиологической роли грызунов, птиц и диких животных. Для этого ставят ловушки, оборудуют контрольно-истребительные площадки, отстреливают млекопитающих.
Энтомологические исследования проводятся для изучения видового состава, численности, зараженности членистоногих - переносчиков возбудителей.
Иммунологические исследования проводятся для выявления источника инфекции, что особенно важно при отрицательных результатах микробиологических исследований. На каждого заболевшего в очаге заполняется карта эпидемиологического обследования очага инфекционного заболевания.
Не нашли то, что искали? Воспользуйтесь поиском:
Очаг инфекционного заболевания — это источник инфекции и окружающая его территория в тех пределах, в которых возможно заражение окружающих. Таким образом, размеры очага определяются возможностью заражения окружающих. Если в комнате находится больной корью (воздушно-капельный механизм передачи), то очагом инфекции будет считаться эта комната. За пределами этой комнаты (если больной из нее не выходит) заражение окружающих невозможно. В случае, когда источником инфекции является больной малярией, очагом инфекции будет считаться территория, в пределах которой могут перемещаться и заражать окружающих укусившие данного больного комары — это приблизительно круг радиусом 1-2 км.
В зависимости от количества источников инфекции в очаге различают одиночные очаги (с одним источником инфекции) и множественные очаги (с двумя и больше источниками инфекции). Множественные очаги в свою очередь подразделяются на:
очаги с одновременно возникшими источниками инфекции (в среднем в пределах одного инкубационного периода) — чаще всего они возникают при участии одного общего фактора передачи. Например, заболевание нескольких членов семьи сальмонеллезом после употребления зараженного мяса; очаги с вторично возникшими источниками инфекции. В таких очагах заражение происходит от первичного источника, как правило, бытовым путем. Например, вирусным гепатитом А в семье заболел отец, а затем заразил других членов. В этом случае заболевания у различных членов семьи будут регистрироваться в различные сроки. комбинированные очаги — механизм возникновения таких очагов имеет черты как очагов 1-го, так и очагов 2-го типов.
Эпидемиологическое обследование очага проводится для того, чтобы выяснить кто явился источником инфекции, каков преимущественный механизм и фактор передачи возбудителя в данном случае, сроки возникновения очага. Вся эта информация необходима для того, чтобы разработать эффективные санитарно-противоэпидемические мероприятия и в конечном итоге ликвидировать очаг инфекционного заболевания.
Для того, чтобы ответить на вышеперечисленные вопросы, производят обследование очага инфекции и наблюдение за ним. В ходе обследования собирают следующую информацию:
-
анкетные данные больного, место работы или учебы, дата последнего посещения места работы или учебы, основные симптомы в первые дни болезни, данные о последней иммунизации; выясняют обстоятельства, в которых находился больной в пределах срока заражения: нахождение в другом населенном пункте, посещение родственников, знакомых, отдых в природных условиях, нахождение в стационаре, переливания крови, медицинские манипуляции, общение с животными и др., собираются сведения о пищевых продуктах, воде, в результате употребления которых могло возникнуть данное заболевание, дается санитарно-гигиеническая характеристика очага: жилищные условия (квартира, гостиница, общежитие и др.), плотность населения, водоснабжение, вид сбора и удаления нечистот, удаление мусора, санитарное содержание помещения и др., дается санитарно-гигиеническая характеристика очагов по месту работы, учебы и т. д.: плотность размещения, изолированность, водообеспечение, канализация, санитарное содержание, хранение пищевой продукции. проводятся лабораторные исследования проб воды, почвы, смывов, пищевых продуктов, выделений больного.
На основании полученных в ходе эпидемиологического обследования данных разрабатывается система мероприятий по ликвидации очага.
Наблюдение за очагом устанавливается до полной его ликвидации. Его задачей является оценка динамики развития эпидемического процесса в очаге и эффективности проводимых противоэпидемических мероприятий.
Очаг считается ликвидированным после удаления из него источника инфекции и проведения заключительной дезинфекции при условии, что в пределах максимального инкубационного периода после удаления источника инфекции новых случаев заболевания в очаге не регистрируется. Например, при выявлении случая вирусного гепатита А на дому, больной госпитализируется (удаляется источник инфекции из очага — квартиры), в квартире проводится заключительная дезинфекция. Если в течение 35 дней (максимальный инкубационный период при гепатите А) новых случаев заболевания среди членов семьи не регистрируется — очаг считается ликвидированным.
В начале XX в. в работах американских ученых Биллингса и Розенау была предложена доктрина ротового сепсиса. Основные положения этой доктрины были следующими. Микроорганизмы стрептостафилококковой группы могут значительно изменять свою вирулентность в зависимости от условий внешней среды и особенно от содержания в ней кислорода. Кроме этого, патогенные микроорганизмы обладают феноменом избирательной локализации, т. е. микробы из очага одонтогенной инфекции способны проникать через ток крови и поражать различные внутренние органы и ткани, по отношению к которым они обладают определенным сродством. Отсюда следовал вывод, что любой зуб с некротизированной пульпой подлежит обязательному удалению.
Практическим результатом этой доктрины явилось массовое удаление зубов с хроническими периапикальными очагами одонтогенной инфекции и некрозом пульпы. Такой упрощенный подход к решению сложных клинических вопросов устранял необходимость какой-либо дифференциальной диагностики этих очагов инфекции и выбора метода их лечения.
В Европе, на основании экспериментальных работ стоматологов, терапевтов, бактериологов и других специалистов, доктрина ротового сепсиса подверглась в более поздние годы резкой критике, так как были получены новые данные и вскрыт ряд методических ошибок в экспериментах, проведенных Биллингсом и Розенау.
В СССР вопрос о хронической стоматогенной очаговой инфекции и сенсибилизации организма впервые глубоко освещался в 1925 г. на II Всесоюзном одонтологическом съезде. Отечественные ученые С. С. Стериопуло, Я. С. Пеккер, Н. А. Астахов, Д. А. Энтин и другие дали критическую оценку доктрине ротового сепсиса, феномену избирательной локализации микроорганизмов и высказали собственные научные представления о взаимосвязи между хроническим очагом инфекции и заболеваниями внутренних органов с учетом сенсибилизации организма человека, состояния его нервной системы и иммунитета. В результате проведенных исследований были разработаны новые методы консервативного лечения. Были также пересмотрены известные методы лечения, направленные на сохранение зубов. Однако патогенетическая роль хронических одонтогенных очагов инфекции в возникновении патологии внутренних органов сомнений ни у кого не вызывала.
Учение о хронической стоматогенной инфекции и сенсибилизации организма имело большое и важное значение в развитии стоматологии, внесло определенный вклад в развитие всей современной клинической медицины и остается актуальным и в настоящее время.
Ведущее место в этиологии хронических очагов одонтогенной инфекции занимает микробный фактор. Выделяемые из одонтогенных очагов инфекции микробы представляют собой ассоциации стрептококков, стафилококков, грамположительных и грамотрицательных палочек, спиралевидных форм бактерий. Реже высеваются монокультуры.
В последние годы раскрыты многие механизмы хронизации острых инфекционных одонтогенных процессов, чаще верхушечных периодонтитов. Сущность этих механизмов заключается в том, что в период острого воспаления в периодонте накапливаются антигены, среди которых основную роль играют эндотоксины грамотрицательных микроорганизмов. Эндотоксины оказывают сильное антигенное воздействие на иммунное состояние периодонта и окружающих его тканей (Максимовский Ю. М., 1996). Реакция тканей периодонта на непрерывное раздражение антигенами, поступающими из канала корня зуба, проявляется в виде антигенозависимых и клеточно-обусловленных процессов. К антигенозависимым относятся иммунокомплексы реакции типа Артюса и IgЕ-обусловленные реакции, к клеточно-обусловленным — реакции гиперчувствительности замедленного типа (Воложин А. И., 1990).
Развивающееся хроническое воспаление в периодонте при нормальном иммунном статусе следует рассматривать как защитный барьер, предотвращающий распространение продуктов распада тканей, микроорганизмов и их токсинов в общую кроволимфоциркуляцию из зоны инфекционного воспаления около верхушки корня зуба (Макашовский Ю. М., 1996).
Вместе с тем формирование такого защитного барьера может нарушаться из-за повышения вирулентности микрофлоры или из-за возникновения недостаточности функционирования иммунной системы.
При этом масштаб реакции иммунной системы может быть различным, она может протекать на уровнях всего организма, при локальных воспалительных процессах (пульпит, периодонтит) отмечаются изменения в иммунологических показателях преимущественно материала из десневой борозды, в меньшей степени — в иммунограмме ротовой жидкости, и совсем едва заметные сдвиги — в иммунограмме периферической крови (Максимовский Ю. М., 1996).
Наличие в организме человека хронических очагов инфекции может обусловить развитие, отягощать течение большого количества заболеваний. Известно более 70 нозологических форм различных очаговообусловленных заболеваний и состояний. Среди них наиболее часто упоминают ревматизм, нефриты, болезни суставов, сердечно-сосудистые и желудочно-кишечные заболевания, вегетоневрозы, болезни глаз, кожи и др.
Роль инфекционного очага может играть всякий длительно текущий инфекционно-воспалительный процесс в том или ином органе. Хроническими стоматогенными очагами инфекции (ХСОИ) являются верхушечные периодонтиты, околокорневые и фолликулярные кисты зубов, многие заболевания краевого пародонта и слизистой оболочки полости рта (гингивиты, пародонтиты, язвенно-некротические стоматиты и т. п.), кариес зубов и др. ХСОИ составляет от 50 % и более от очагов хронической инфекции организма.
Среди очагов хронической стоматогенной инфекции и сенсибилизации необходимо различать первичные, располагающиеся в органах и тканях полости рта; вторичные, находящиеся во внутренних органах и тканях организма человека, а также транзиторные, локализующиеся, как правило, в лимфатических узлах.
В начальные сроки существования очагов стоматогенной инфекции имеет место мобилизация защитных сил организма человека, которая достаточна для компенсации влияния этого очага за его пределами. Такое состояние компенсации может поддерживаться неопределенно длительное время. Однако самые различные экзогенные и эндогенные факторы, чаще неспецифического характера (перегревание или переохлаждение организма, переутомление, резкое изменение микроклимата или условий труда и быта человека, перенесенные заболевания и т. п.), приводят к быстрому истощению компенсаторных возможностей организма, активизации инфекционного очага и возникновению обусловленных заболеваний.
Взаимосвязь очага хронической стоматогенной инфекции и организма имеет весьма сложный характер. Лишь условно можно выделить следующие основные патогенетические механизмы, каждый из которых в большей или меньшей степени имеет место в развитии очаговообусловленных заболеваний.
1. Рефлекторный механизм. Ведущая роль отводится самому инфекционному агенту (микробам и их токсинам), который создает в очаге активные рецепторные поля раздражения. Последние рефлекторно через центры головного мозга вызывают нарушение функции вегетативной нервной системы и регуляции работы внутренних органов и систем организма с последующим развитием в них функциональных и дистрофических изменений.
2. Пиофагия. На развитие и клиническую картину заболеваний пищеварительной системы особенно неблагоприятно может влиять постоянное проглатывание больным гноя, выделяющегося из зубодесневых карманов при пародонтите или из свища при хроническом гранулематозном или гранулирующем периодонтите и околокорневой кисте челюсти.
3. Низкий уровень иммунологической реактивности организма человека, при котором возможно проникновение микробов из очагов стоматогенной инфекции в кровеносное русло, что клинически определяется как острый сепсис. С целью подтверждения диагноза и выбора лечебной тактики в таких случаях проводят бактериологическое исследование — посев крови на питательные среды для выявления возбудителя и определения его чувствительности к различным лекарственным препаратам (антибиотикам).
4. Токсемия. Поступление в кровь токсинов микроорганизмов, находящихся в очаге хронической стоматогенной инфекции, обусловливает затяжной субфебрилитет, изменения в картине крови и другие клинические симптомы, характерные для хронической интоксикации организма.
5. Аллергические механизмы. Микроорганизмы, находящиеся в очагах инфекции, вызывают сенсибилизацию организма человека и образование в нем специфических антител. При вторичном инфицировании организма тем же видом микробов возникают более выраженные общие и местные симптомы воспалительной реакции.
6. Аутоиммунный механизм. В крови появляются антигены тканевого происхождения (цитотоксины), которые образуются в результате повреждения тканей и распада белка. Цитотоксины, являясь аутоантигенами, также изменяют чувствительность организма человека и вызывают его сенсибилизацию и хронизацию воспалительного процесса.
7. Эндотоксикоз. Воспалительные процессы, локализующиеся в челюстно-лицевой области сопровождаются эндогенной интоксикацией, обусловленной поступлением в кровь фракции эндотоксинов лизосомального происхождения, продуктов тканевого распада, бактериальных токсинов и других токсических продуктов, образующихся в самом организме в результате тех или иных нарушений жизненных функций.
Для диагностики эндогенной интоксикации традиционно используют клинические и лабораторные методы исследования, которые взаимно дополняют друг друга. Совокупность тестов для диагностирования эндотоксикоза обычно произвольна и определяется опытом врача, его клиническим мышлением и представлениями о проблеме эндотоксикоза, а также техническими возможностями лабораторий лечебно-профилактического учреждения.
Различают специфическую и неспецифическую лабораторную диагностику эндогенной интоксикации организма. Специфическая диагностика преследует выявление эндогенных токсинов в организме (качественная оценка) и силы их действия (количественная оценка). Этим целям отвечают методики, основанные на биопробах. Отметим, что методики биологического тестирования при эндогенной интоксикации еще не получили большого распространения в клинической практике, и пока применяются в эксперименте.
В клинической практике чаще применяют функционально-морфологические тесты, косвенно характеризующие степень интоксикации (определение стадии деструкции лейкоцитов, НСТ-тест, лейкоцитозный индекс интоксикации Я. Я. Кальф-Калифа и др.).
Не утратили своего значения для диагностирования интоксикации следующие неспецифические методы: клинический и биохимический анализ крови, определение количества гемоглобина, СОЭ, мочевины, креатинина, остаточного азота, билирубина, трансаминаз и белков крови, амилазы, циркулирующие иммунные комплексы (ЦИК) и др. В основном для этих целей используют лабораторные показатели, характеризующие функции органов и систем естественной интоксикации - печени, почек, легких и кишечника. Нарушение экскреторной и метаболической функций перечисленных органов сопровождается увеличением концентрации многих, традиционно считающихся нетоксичными соединениями, которые в высоких концентрациях совместно могут проявлять неожиданно токсическую активность (Оболенский С. В., Малахова М. Я., 1991). Это относится не только к конечным, но и промежуточным продуктам обмена и таким веществам, как ренин, цис-аминофосфатная кислота (ц-АМФ), глюкагон, инсулин, паратгормон, серотонин, гистамин, адреналин и др.
Исследования последних продуктов обмена позволили уточнить, что субстрат эндотоксикоза более широк и представлен веществами низкой и средней молекулярной массы (мочевина, креатинин, мочевая кислота, глюкоза, молочная и другие органические кислоты, аминокислоты, жирные кислоты, фосфолипиды и их производные, продукты свободнорадикального окисления и др.), которые распределяются в крови между белками-носителями и гликокалексом эритроцитов, а также олигопептидами регуляторными (тканевые гормоны) и нерегуляторными (бактериальные, ожоговые и кишечные токсины, поступившие в организм извне, и продукты аутолиза, образовавшиеся внутри организма).
Именно это позволило предложить интегральный индекс эндотоксикоза, который включает определение концентрации веществ низкой и средней молекулярной массы и олигопептидов в различных средах организма: плазме крови, на эритроцитах, моче и слюне (Малахова М. Я., 1991) и индексы илиминации токсических продуктов с мочой и слюной и распределение этих продуктов между плазмой крови и эритроцитами (Шалак О. В., 2000).
О. В. Шалак (2000) было доказано, что развитие эндотоксикоза одонтогенной этиологии у больных с сердечно-сосудистыми заболеваниями обусловливает возникновение синдрома взаимного отягощения, углубляющего тяжесть их состояния. Выраженность эндотоксикоза при множественных хронических очагах одонтогенной инфекции достигает уровня интоксикации, наблюдаемой при остром ограниченном воспалении околочелюстных тканей, а в большинстве случаев значительно превосходит его (Шалак О. В., 2000). Это еще раз подтверждает необходимость своевременной санации органов и тканей полости рта у больных с заболеваниями внутренних органов и систем организма.
Какой-либо специфической клинической картины ХСОИ не существует. Нередко субъективные жалобы весьма неопределенны. Как правило, больные жалуются на головную боль, слабость, озноб, потливость, головокружение, быструю утомляемость, плохой ночной сон, потерю аппетита. В некоторых случаях преобладают жалобы на повышенную раздражительность, состояние стойкого возбуждения и беспокойства. Клиническая картина заболевания в основном определяется тем, какой орган подвергается атаке.
Из объективных симптомов ведущими являются затяжной субфебрилитет, явления подчелюстного и подподбородочного лимфаденита, а также изменения в картине крови: лабильность лейкоцитарной формулы, уменьшение содержания гемоглобина и эритроцитов (вторичная анемия), возрастание СОЭ до 30—35 мм/ч и более. Отмечаются сдвиги в белковых фракциях (гиперглобулинемия).
Диагностика ХСОИ важна на ранних стадиях развития. Однако это весьма сложная задача, особенно при сочетании ее с тонзиллогенными и риногенными очагами инфекции. Затрудняет диагностику ХСОИ самолечение больных, которое существенно изменяет клиническую картину заболевания.
При уже развившемся очаговом заболевании весьма трудно, а порой и невозможно установить причинный фактор, так как часто диагностируют сразу несколько очагов хронической инфекции (в носоглотке, миндалинах, околозубных тканях и др.). В свою очередь, общие заболевания организма приводят к более активному течению очаговой стоматогенной инфекции. Возникает своеобразный порочный круг: общее и местное заболевания взаимно отягощают друг друга. Разорвать такой круг бывает нелегко. Однако несомненно, что лечение ХСОИ необходимо для профилактики и комплексного лечения очаговообусловленных заболеваний организма человека. Только после санации полости рта и устранения всех выявленных хронических воспалительных процессов лечение основного заболевания бывает эффективным.
В настоящее время стоматологи располагают достоверными клиническими и лабораторными тестами для выявления очагов хронической стоматогенной инфекции и установления степени их активности.
Также можно использовать и конъюнктивальную гистаминовую пробу, для чего в конъюнктивальный мешок закапывают 1—2 капли гистамина в разведении 1:100 000 или 1:500 000. При наличии в жевательном аппарате очагов стоматогенной инфекции через 1 мин появляется выраженное расширение капилляров и покраснение слизистой оболочки глазного яблока и века. Указанная реакция не сопровождается какими-либо неприятными ощущениями и исчезает через 10—15 мин.
Гистаминовая проба не является специфичной для обнаружения очагов стоматогенной инфекции, однако комплексное применение указанных тестов позволяет проводить дифференциальную диагностику ХСОИ различной локализации. Например, положительная конъюнктивальная гистаминовая и отрицательная электрокожная пробы свидетельствуют о наличии не стоматогенного, а тонзиллогенного, риногенного или иных патологических процессов, оказывающих влияние на сосудистую реакцию.
В последние годы в связи с широким применением электродонтометрии и ортопантомографии практическая значимость гистаминовых проб существенно снизилась.
При устранении ХСОИ следует помнить, что сначала удаляют явные, а затем — менее выраженные хронические очаги одонтогенной инфекции (Энтин Д. А., 1938). Ликвидируют ХСОИ на фоне антимикробной, десенсибилизирующей терапии при участии врача-интерниста.
К срокам и объему ликвидируемых ХСОИ следует подходить индивидуально, в зависимости от состояния больного, характера течения заболеваний внутренних органов и систем организма. Иногда такие операции по устранению ХСОИ растягивают во времени, иногда выполняют симультанно (одновременно) с лечением сопутствующего заболевания. Важно помнить о необходимости устранения ХСОИ, так как их ликвидация сама по себе при многих заболеваниях организма человека носит лечебный характер (этиологический, десенсибилизирующий и др.).
Говоря об устранении хронических очагов одонтогенной инфекции, важно заметить, что стоматологические процедуры вызывают максимум бактериемии и считаются частым предрасполагающим фактором возникновения бактериального эндокардита. От 25 до 42 % больных с этим заболеванием в анамнезе имели стоматологические вмешательства.
При различных диагностических манипуляциях, где имеет место кровоточивость, а также при хирургических, акушерско-гинекологических вмешательствах, которые всегда сопровождаются транзиторной профилактикой инфекционного эндокардита (ИЭ), особенно у больных с пороком сердца любой природы, следует всегда назначать антибиотики.
Для практической реализации этого положения В. Н. Шелковский (1999) всех наблюдаемых им пациентов разделил по степени риска развития инфекционного эндокардита на две группы:
1-я группа (умеренная степень риска) — пациенты с врожденными или приобретенными пороками сердца, с имплантированными кардиостимуляторами, а также, если в анамнезе у них были ранения сердца с повреждением эндокарда;
2-я группа (высокая степень риска) — пациенты с искусственными клапанами сердца или имевшие в анамнезе ИЭ.
Пациентам с умеренной степенью риска (1-я группа) В. Н. Шелковский рекомендует за 2 ч до стоматологической операции (удаление зубов, кюретаж зубодесневых карманов, снятие зубных отложений) перорально принимать 2 г оксациллина или ампициллина.
Пациентам с высокой степенью риска (2-я группа) В. Н. Шелковский назначает за 3 ч до хирургической санации принять per os 3 г оксациллина или ампиокса. При необходимости за 12 ч до стоматологической операции он также назначает внутримышечно 2 г ампиокса, а за 1 ч до операции еще 2 г, затем следует вводить поддерживающие дозы в течение 2 сут. (Шелковский В. Н., 1999).
В заключение отметим, что с различными формами ХСОИ часто сталкиваются не только врачи-стоматологи, но и врачи терапевтических, хирургических, оториноларингологических, неврологических, гематологических, гинекологических и других отделений. Поэтому знание основных сведений по этиологии, патогенезу, клинике, принципам лечения и профилактики ХСОИ и интоксикации необходимо врачам любого профиля.
"Заболевания, повреждения и опухоли челюстно-лицевой области"
под ред. А.К. Иорданишвили
Читайте также:


