Инфекционная анемия в почках
Если у человека диагностируется анемия почек, значит, в организме происходит общее понижение уровня красных телец и гемоглобина. При болезнях почек анемия является сопутствующим заболеванием в силу того, что поврежденный орган перестает производить специфический белок, необходимый для обеспечения нормальной скорости синтеза и созревания эритроцитов. При дисфункции парного органа очищение крови происходит не должным образом, скапливаются токсины, что также замедляет процесс образования красных телец и усиливает анемию.
Знание сути проблемы поможет справиться с почечной анемией
Основным толчком к развитию почечной анемии является уменьшение производства белка — эритропоэтина. Этот вид белка очень важен для человеческого организма, так как он является регулятором производства и созревания клеток-эритроцитов. В периоде внутриутробной жизни и после рождения белок вырабатывается в клетках печени. По мере взросления ребенка эритропоэтин начинает синтезироваться в почках. При заболеваниях почек общее выведение вредных веществ замедляется, как следствие уровень белка снижается, и количество эритроцитов падает, в меньшем количестве синтезируется и гемоглобин.
С развитием ацидоза, предполагающего сбой кислотно-основного баланса, происходит накопление кислот. Такое изменение состав крови влияет на скорость жизни красных телец, уменьшая этот показатель в 2 раза. Больные, которым при прогрессирующей хронической почечной недостаточности показаны процедуры диализа, чаще страдают анемией. Связано это с тем, что частые, необоснованные заборы крови на анализы, как и сама процедура влияют на прогрессирование малокровия. Такие заболевания, как сахарный диабет и гипертония могут стать толчком к развитию почечной анемии.
Все внутренние органы и ткани страдают от анемии, так как происходит кислородное голодание из-за низкого уровня гемоглобина. Анемия при заболеваниях почек медленно развивается, поэтому на первых порах довольно сложно диагностировать заболевание. Спустя определенный промежуток времени проявляются такие характерные для анемии симптомы:
- частая головная боль;
- постоянная утомляемость;
- общая слабость организма;
- нарушение сна;
- агрессивность и раздражительность;
- потеря аппетита.
Со стороны сердечно-сосудистой системы возможны небольшие отклонения в работе по мере того, как происходит развитие болезни.
Пациенты отмечают наличие отдышки при слабых и интенсивных физических нагрузках, в то время как в спокойном состоянии она больных не беспокоит. При анемии учащается сердцебиение, ухудшается состояние миокарда. Малокровие в организме стимулирует постепенное развитие сердечной недостаточности. При малокровии кожа больного приобретает белый оттенок. Нервная система также испытывает негативное влияние, у больного наблюдаются постоянные депрессии, сопровождающиеся агрессией и раздражительностью.
В поисках методов излечения анемии почек
Первый этап на пути диагностики почечной анемии — сдача общего анализа крови. На основании проведенного результатов теста определяют уровень гемоглобина в крови. При проведении диагностики важны показатели возраста и пола. Это важно учитывать при сопоставлении данных. Норма гемоглобина для женщин составляет 120 г/л, для мужчин — 130 г/л. Для установления диагноза почечная анемия нужно сдать пробу на содержания в крови эритроцитов, железа и алюминия. Чтобы исключить скрытые кровотечения в организме, больным назначают анализ кала. Женщинам, которые отмечают у себя признаки обильных менструаций, обязательно необходимо провести осмотр у гинеколога, и в случае необходимости нормализовать гормональный фон.
Если больному еще не проводят диализ, будет уместно принимать препараты, содержащие железо и фолиевую кислоту. Для лечения болезни не стоит проводить переливание крови, связано это с тем, что вместе с донорской кровью могут передаваться активные агенты таких инфекций, как гепатит В и С, ВИЧ, а также склонность к аллергическим реакциям. Больным с низким уровнем гемоглобина (ниже показателя 90 г/л), назначают рекомбинантный эритропоэтин, чтобы улучшить показатели крови и снизить частоту переливаний. Не рекомендуется процедура переливания донорской крови, нагруженной эритроцитами, из-за риска перегрузки организма перед операцией по трансплантации почки. Такой компонент содержат следующие препараты:
Если в организме снижаются фоллаты, участвующих в создании и росте красных кровяных клеток, больным назначают комплекс препаратов с фолиевой кислотой в таблетках или внутривенно (зависит от стадии болезни). При почечной анемии важно контролировать уровень железа в организме, каждые 3 месяца измеряя показатели. Для поддержания уровня в крови назначают:
Врач назначает курс лечения на основании состояния здоровья пациента, учитывая все особенности протекания болезни. Самостоятельно лечить заболевания почек и анемию крайне опасно.
В чем опасность анемичных состояний?
Анемия провоцирует сбои в работе сосудистой, центральной нервной и половой систем. В результате ухудшается качество жизни, больных мучают постоянные депрессии. По мере прогрессирования заболевания развиваются серьезные осложнения, угрожающие жизни. У пациентов с запущенной почечной анемией диагностируются стенокардия, кровоизлияния в желудочно-кишечном тракте и в головном мозге. Особенно опасны анемичные состояния для умственного, физического и психического развития детей. Из-за изменения состав крови, нехватки гемоглобина при заболевании почек развиваются необратимые процессы в кровеносной системе с усугублением сердечной недостаточности, которая является одной из причин смерти пациентов.
Анемия является частой спутницей хронической болезни почек (ХБП) любой этиологии, что давно было подмечено вдумчивыми клиницистами.
По современным представлениям, анемия почечного генеза является наиболее ранним и частым осложнением хронической почечной недостаточности, и обычно наблюдается при снижении клиренса креатинина до 40–60 мл/мин (III стадия ХБП по классификации NKF-K/DOQI). Иногда анемия может наблюдаться и на более ранних стадиях ХБП. На выраженность анемии на ранних стадиях ХБП самым непосредственным образом может влиять этиология хронической почечной недостаточности (ХПН). Например, при диабетической нефропатии (ДН), заболеваемость которой, как и самим сахарным диабетом II типа, в последние годы приобрела эпидемиоподобный характер [22], анемия уже может наблюдаться при скорости клубочковой фильтрации (СКФ) 2 у мужчин и 2 у женщин. У пациентов с макроальбуминурией анемия может наблюдаться еще раньше. К III стадии ХБП более 20% больных ДН имеют анемию [24]. В последние годы все большее внимание уделяется профилактике и коррекции анемии на ранних стадиях в структуре рено- и кардиопротекции у больных с ХБП. У значительного числа больных к началу заместительной почечной терапии анемия весьма выражена. Возможно, что коррекция анемии может способствовать и уменьшению темпов прогрессирования ХБП. Поэтому коррекцию анемии можно рассматривать как важную часть ренопротективной стратегии для снижения риска заболеваемости и смертности этой категории пациентов как до, так и после начала заместительной почечной терапии (ЗПТ).
Закономерно, что степень анемии особенно выражена у больных в терминальной стадии почечной недостаточности к началу ЗПТ. Анемия почечного генеза широко распространена при всех видах ЗПТ, однако наибольшее число больных с анемией наблюдается на программном гемодиализе (ГД): при отсутствии лечения уровень гемоглобина 11 г/дл, и это в равной степени относится к больным как в преддиализных стадиях ХБП, так и больным на диализе и после аллогенной трансплантации почки (АТП) [5, 19, 21]. Нижняя граница целевого уровня гемоглобина должна быть достигнута не более чем через 4 мес от начала терапии. Ограничения верхней границы уровня гемоглобина установлены для лиц пожилого возраста, больных сахарным диабетом и пациентов с высоким кардиоваскулярным риском, больных с осложненным сосудистым доступом (сосудистыми протезами) [5]. Такие же ограничения справедливы в отношении больных с онкологическими и гематологическими заболеваниями. Вместе с тем при сочетании ХБП с заболеваниями, связанными с резко выраженной системной/локальной гипоксией (например, при хронической болезни легких), с определенной осторожностью целесообразно достижение более высоких значений Hb. У больных на гемодиализе не рекомендуется превышать преддиализный уровень Hb > 14,0 г/дл из-за рисков постдиализной гемоконцентрации вследствие ультрафильтрации в ходе диализа [4].
Доза и способ введения ССЭ. Лечение анемии ССЭ обычно проводят в два этапа:
В фазу коррекции применяют так называемые стартовые дозы рчЭПО, которые обычно на 30% (20–50%) выше поддерживающих доз. Диапазон стартовых доз в нашей стране при п/к введении обычно составляет 50–100 ед/кг веса в нед или в среднем 6000 ед/нед на 1 пациента. При внутривенном способе введения пациентам, находящимся на ГД, эпоэтин альфа или эпоэтин бета назначаются с частотой 3 раза в нед как на стадии коррекции, так и при поддерживающей терапии. Доступные данные не подтверждают целесообразность более редкого (1 раз в нед) внутривенного назначения эпоэтина альфа или бета. Однако при подкожном введении частота введения эпоэтина альфа или бета может быть снижена до 1 или 2 раз в неделю у пациентов, получающих ГД. Учитывая индивидуальную чувствительность больных к действию ССЭ, необходимо тщательно следить за уровнем Hb, особенно в фазу коррекции. Доза ССЭ должна титроваться в соответствии с уровнем Hb. Мониторирование уровня Hb в начальной фазе терапии следует проводить каждые 2 нед, в поддерживающей — 1 раз в мес. Скорость повышения концентрации Hb на начальном этапе терапии должна составлять 1–2 г/дл/мес. Изменение уровня Hb менее чем на 1 г/дл или более чем на 2 г/л указывает на необходимость поэтапной еженедельной коррекции дозы ССЭ на 25% в большую или меньшую сторону. Скорость увеличения концентрации Hb > 2 г/дл в месяц нежелательна. В этом случае необходимо снижение общей недельной дозы ССЭ на 25–50%. На протяжении фазы поддерживающей терапии при стабилизации уровня Hb, концентрация Hb должна определяться каждый месяц; у пациентов с ХБП, не получающих диализ, вероятно, возможно и более редкое измерение уровня Hb. Колебания концентрации Hb > 1 г/дл указывают на необходимость поэтапной коррекции дозы на 25% в большую или меньшую сторону и (или) изменения кратности введения соответственно типу ССЭ.
Способ введения ССЭ определяется категорией пациентов, а также зависит от типа используемого препарата. Подкожный способ введения рчЭПО предпочтителен, так как позволяет существенно экономить расход дорогостоящих препаратов рчЭПО: средняя недельная доза вводимого подкожно рчЭПО, необходимая в период поддерживающей терапии, примерно на 30% меньше дозировки при внутривенном способе введения. Фармакокинетические исследования подтверждают, что при подкожном введении период полувыведения используемых в нашей стране препаратов рчЭПО (эпоэтина альфа и эпоэтина бета) значительно возрастает. Хотя больным на гемодиализе и удобно вводить препараты рчЭПО внутривенно, по экономическим соображениям их следует вводить подкожно, за редким исключением плохой переносимости подкожных инъекций. Интраперитонеальный путь введения при лечении анемии с использованием ССЭ используется редко. Результаты исследований позволяют предположить, что этот способ введения менее предпочтителен по сравнению с подкожным или внутривенным вследствие низкой биодоступности и высокого риска развития перитонита. Поэтому исходя из экономических и практических соображений пациентам с ХБП, не получающим ГД, а также больным на постоянном амбулаторном ПД и после трансплантации почки, ЭПО рекомендуется вводить подкожно [4, 5].
Перспективы лечения анемии больных с ХПН. В последние 1–2 года в России зарегистрированы новые генерические препараты эпоэтина альфа и эпоэтина бета. В ближайшие годы, вероятно, эта тенденция сохранится. Наряду с отдельными преимуществами появления генериков (низкая цена, доступность) медицинских работников не могут не беспокоить вопросы безопасности их применения. Проблема в том, что биотехнологичные препараты крайне сложно воспроизвести полностью биоэквивалентными. Неизбежные различия в технологии их производства, малейшие нарушения в логистике (транспортировка, хранение) могут изменить иммуногенность препаратов ЭПО, что, как уже известно, чревато развитием серьезных побочных эффектов и осложнений, в том числе полная аплазия красного костного мозга (PRCA) [21]. Не случайно, что в странах Евросоюза с 2006 г. все генерические препараты ЭПО должны проходить полный цикл клинических испытаний перед своей регистрацией, включая фармакокинетические исследования на добровольцах и как минимум два проспективных, рандомизированных, плацебо-контролируемых исследования отдельно с внутривенным и подкожным путями введения продолжительностью 6 мес и последующим анализом данных по иммуногенности в течение 12 мес [15].
С целью разработки более удобных для больных схем введения препаратов и комплаентности больных созданы и продолжают создаваться новые ССЭ, позволяющие вводить их реже существующих препаратов рчЭПО. Одним из таких препаратов является препарат ЭПО второго поколения Аранесп (непатентованное название дарбопоэтин альфа), регистрация которого в России ожидается уже в текущем году. Молекула дарбопоэтина альфа содержит 2 дополнительные N-связанные карбогидратные цепочки, которые придают его молекуле большую метаболическую стабильность in vivo. Фармакокинетика препарата позволяет вводить его 1 раз в 2 нед больным как на ЗПТ, так и в преддиализный период. Еще более перспективно применение ССЭ третьего поколения — препарата CERA — пролонгированного активатора рецепторов эритропоэтина. CERA имеет большую полимерную цепочку в структуре своей молекулы, что обуславливает различия в фармакокинетике и ее взаимодействии с рецепторами ЭПО. К преимуществам CERA относится не только больший период полувыведения, многократно превышающий все имеющиеся на сегодняшний день ССЭ, что позволяет вводить препарат не чаще 1 раза в мес, но и стабильность гемопоэтического эффекта, что, в свою очередь, дает возможность значительно реже корректировать его дозу как в фазе коррекции, так и при поддерживающей терапии. Регистрация CERA в России (торговое название Мирцера), ожидается уже в следующем году. К новому классу ССЭ относятся ЭПО-миметики, химически синтезированные пептиды, обладающие способностью стимулировать эритроидные рецепторы. Один из первых препаратов этого класса, Гематид, успешно прошел II фазу клинических исследований. Начаты клинические испытания стабилизатора молекулы HIF в виде препарата для приема внутрь. Механизм его действия заключается в ингибировании фермента пролил гидралазы, расщепляющего молекулу данного фактора, что в конечном итоге ведет к активации экспрессии гена ЭПО.
Таким образом, в ближайшем будущем ожидается появление стимуляторов эритропоэза нового поколения, обладающих еще большими удобствами применения для больных и медицинского персонала.
В. Ю. Шило, кандидат медицинских наук
Н. Н. Хасабов, кандидат медицинских наук
Центр диализа при ГКБ №20, Кафедра нефрологии и гемодиализа РМАПО, Москва
Инфекционная анемия лошадей (ИНАН)
Вирус инфекционной анемии, попадая в организм лошади, разрушает эритроциты, а в костном мозгу угнетает эритропоез, вследствие чего развивается анемия. Вирусом повреждается также эндотелий капилляров. При этом клетки его набухают, отслаиваются и, как следствие, повышается проницаемость капилляров, что сопровождается множественными кровоизлияниями под серозные покровы, в слизистые оболочки, мозг и паренхиматозные органы. Одновременно с этим наблюдается размножение клеток ретикуло-эндотелиальной системы с образованием большого количества лимфоидных клеток, гистиоцитов и моноцитов. Эти клетки располагаются в просветах капилляров и вокруг них.
Клетки ретикуло-эндотелиальной системы печени, легких фагоцитируют поврежденные эритроциты, в результате распада которых в этих клетках накапливается бурый пигмент — гемосидерин. Поэтому эти клетки часто называют сидероцитами.
При инфекционной анемии изменения наблюдаются во всех паренхиматозных органах, причем в каждом из них имеются свои особенности. В легких обнаруживаются кровоизлияния и очаги серозно-фибринозного воспаления. Даже в макроскопически неизмененных участках межальвеолярные перегородки утолщены и инфильтрированы клетками ретикуло-эндотелиальной системы.
В сердце при остром течении болезни видны кровоизлияния под эпикардом, обнаруживается клеточная инфильтрация миокарда. При хроническом течении в миокарде находят рубцы. В печени наблюдаются дегенеративные изменения печеночных клеток, значительная инфильтрация паренхимы печени клетками ретикуло-эндотелиальной системы с отложением в них гемосидерина. Печень увеличивается в объеме, на разрезе имеет мускатный рисунок. Селезенка увеличена в объеме вследствие инфильтративного разроста лимфоидных клеток, поверхность ее бугристая как шагреневая кожа, содержание гемосидерина в ней уменьшено.
Почки также увеличены в объеме, под капсулой в корковом слое встречаются кровоизлияния. При гистологическом исследовании обнаруживают геморрагический нефрит и клеточную инфильтрацию межуточной соединительной ткани.
Кровоизлияния, клеточная инфильтрация и отложение пигмента в тканях при инфекционной анемии происходят в лихорадочный период болезни. При ремиссии — спадении температуры — функция кроветворных органов восстанавливается, анемия исчезает, кровоизлияния рассасываются. Скопления гистиоцитов и моноцитов уменьшаются, а затем они исчезают полностью. На месте их остается повышенное количество аргирофильных волокон и фибробластов. В миокарде при хроническом течении болезни образуются соединительнотканные рубцы.
При изучении морфологических изменений желательно использовать препараты, отражающие как острое, так и хроническое течение болезни.
Макропрепарат. Печень при ИНАН (табл. XV, А)
Печень увеличена в объеме, с поверхности хорошо заметна дольчатость. На разрезе печень пестрая, мускатная, на серовато-желтоватом фоне хорошо выражены красные или коричневые прожилки.
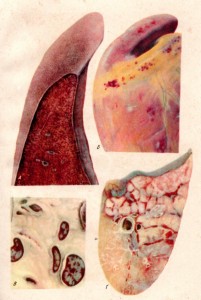
ТАБЛИЦА XV. А — печень при ИНАН; Б — сердце при хронической форме ИНАН; В — лимфатические узлы свиньи при чуме; Г — легкое
Гистопрепарат. Печень при ИНАН (рис. 107)
В препарате, окрашенном гематоксилин-эозином, при малом увеличении микроскопа хорошо видно балочное строение печени. В центре долек печеночные клетки находятся в различной стадии дегенерации и распада. Одни из них уменьшены в объеме в результате сдавливания сидероцитами и эксудатом, другие совершенно разрушены, сохранились лишь сидероциты, наполненные бурым пигментом. Между печеночными балками имеется большое количество клеток с интенсивно окрашенными ядрами, много таких же клеток и в межуточной ткани печени.
При большом увеличении микроскопа между печеночными балками видны скопления лимфоидных клеток, гистиоцитов и моноцитов.
Лимфоидные клетки мелкие, с круглым интенсивно окрашенным ядром. Гистиоциты— более крупные клетки, также с круглым,
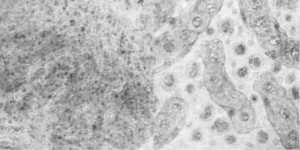
Рис. 107. Печень при ИНАН (слева малое, справа большое увеличение).
но более светлым ядром и хорошо выраженной протоплазмой. Моноциты — клетки, с овальным или бобовидным, слабо окрашенным ядром и базофильной протоплазмой. Ядра моноцитов расположены не в центре, а ближе к одному из краев клетки. В некоторых моноцитах и гистиоцитах можно видеть фагоцитированные, распадающиеся эритроциты и бурый пигмент — гемосидерин. Купферовские клетки набухшие-, некоторые из них отслаиваются в просвет капилляров, ядра клеток округлые. В межуточной соединительной ткани также имеется большое количество лимфоидных клеток и гистиоцитов.
В препарате, окрашенном по Перлсу, в клетках-сидероцитах (купферовских, гистиоцитах и моноцитах) содержится сине-зеленый пигмент (в препаратах, окрашенных гематоксилин-эозином, он бурый).
В одних клетках пигмент встречается в виде отдельных глыбок, в других его так много, что он заполняет всю клетку, закрывая собой ядро.
Макропрепарат. Сердце при хронической форме ИНАН (табл. XV, Б)
В мускулатуре предсердий и желудочков имеются беловатые пятна (рубцы) различной величины; одни из них едва заметны простым глазом и находятся только под эпикардом, другие пронизывают всю толщу миокарда. Одновременно с рубцами встречаются кровоизлияния под эпикардом, указывающие на обострение заболевания.
Гистопрепарam. Сердце при острой форме ИНАН (рис. 108)
При малом увеличении микроскопа под эпикардом и в сердечной мускулатуре видны кровоизлияния. Поперечная исчерченность в мышечных волокнах местами отсутствует. Между мышечными балками, а также вокруг сосудов можно
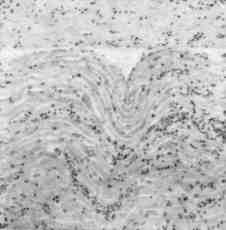
Рис. 108. Сердце при острой форме ИНАН.
рассмотреть скопление гистиоцитов и лимфоидных клеток, которые местами располагаются в виде тяжей по ходу капилляров или неравномерно рассеяны между мышечными перекладинами.
Макропрепарат. Легкие при острой форме ИНАН (рис. 109)
Легкое полуспавшееся, эластичной консистенции. Под плеврой и в глубине паренхимы, а также на слизистой трахеи и бронхов имеются множественные точечные и пятнистые кровоизлияния.
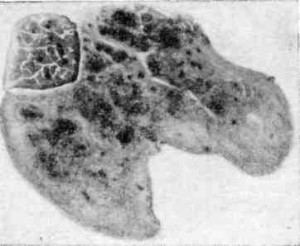
Гистопрепарат. Легкие при хронической форме ИНАН (рис. 110)
Рис. 110. Легкие при хронической форме ИНАН
При малом увеличении микроскопа видно, что легочные альвеолы спавшиеся, их полости уменьшены. Межальвеолярные перегородки сильно утолщены, содержит большое количество лимфоидных клеток и гистиоцитов. В препаратах, окрашенных на железо, в клетках межальвеолярных перегородок обнаруживаются сине-зеленые глыбки железосодержащего пигмента.
Макро препарат. Почки при острой форме ИНАН (рис. 111)
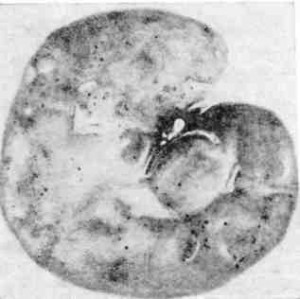
Почки увеличены в объеме, бледны, под капсулой встречаются точечные и пятнистые кровоизлияния.
В почках при хронической форме ИНАН кровоизлияний и выпота эксудата не наблюдается, но скопления лимфоидных клеток выражены сильнее, чем при острой форме.
Макроскопические и гистологические изменения имеют большое значение для диагностики инфекционной анемии.
Повреждения капилляров и вследствие этого кровоизлияния, размножение клеток ретикуло-эндотелиальной системы в разных органах, исчезновение гемосидерина из селезенки, накопление его в печени и легких являются характерными для этого заболевания. Некоторое сходство с изменениями при инфекционной анемии наблюдается при сепсисе и гемоспоридиозах, но между ними имеется и существенная разница, описанная при изложении этих заболеваний.
Любая запущенная стадия почечной патологии способна вызвать анемию органа и всей системы. Анемия органа — симптом выраженной хронической почечной недостаточности, а также показатель тяжёлой формы уремии. Нефрогенная анемия или анемия почечного происхождения — уменьшение уровня гемоглобина и количества эритроцитов в период почечной патологии. В этой статье мы расскажем, что такое почечная анемия, разберем симптомы и диагностику.
Причины образования дефицитной анемии
Развитие нефрогенной анемии или дефицитной, как ее еще называют, происходит вследствие уменьшения синтеза эритпротеинов. Эритропротеин — это белок, основная задача которого, регулировать и способствовать созреванию эритроцитов.
Для информации! В период внутриутробного развития плода эритропротеин вырабатывают почечные клетки.
В период взросления эритропротеин начинает самостоятельно синтезироваться почечными клетками. При снижении скорости фильтрации уровень образования также снижается, вследствие чего концентрация гемоглобина значительно падает. Такое нарушение влечет за собой не полное выведение из организма вредных продуктов обмена и препятствует процессу синтезирования эритропротеина.
Для информации! Нарушение кислотно-основного равновесия сокращает в два раза жизнедеятельность эритроцитов, а впоследствии их полностью разрушает.
В период прогрессирования почечной недостаточности терминальной стадии пациентам назначается процедура гемодиализа. Чрезмерные и необоснованные сдачи крови для анализов влекут за собой образование анемии. Процесс развития почечной недостаточности завершающей или финальной стадии препятствует усвоению из продуктов пищи фолиевой кислоты и железа, которые являются основой для образования эритроцита. Дефицит полезных веществ в организме и несвоевременное их восполнение, также способно вызвать анемию. Стоит отметить, существуют определенные заболевания, вызывающие образование почечной недостаточности:
- поликистоз почек;
- гипертоническая патология;
- сахарный диабет;
- пиелонефрит хронической формы;
- мочекаменные заболевания;
- подагра;
- амилоидоз;
- гломерулонефрит;
- красная волчанка системная.
Симптомы и вред почечной анемии
Как правило, симптомы анемии проявляются при хронических заболеваниях почек, в особенности, при уровне креатинина 308 мкмоль/литр. Патология сопровождается следующим симптомомкопмлексом:
- слабость, появление усталости;
- головокружение;
- появление бледного цвета кожного покрова и губ;
- общее недомогание, подавленное состояние.
Для информации! Анемия, спровоцированная любой почечной патологией значительно ухудшает работоспособность органов, всей системы и усложняет протекание болезни.
При наличии долгосрочной патологии почек нарушается функциональность всей системы, а также развиваются другие заболевания, способные привести к летальному исходу. Из опасных заболеваний могут развиться: сердечная недостаточность, желудочно-кишечное кровотечение, стенокардия, кровоизлияние в головной мозг.
Важно! Развитие тяжелой анемии у детей в раннем возрасте влияет на физическое и умственное развитие, а также нарушает функциональность других внутренних органов.
Диагностика заболевания
Диагностирование для подтверждения малокровия назначают при условии, что у мужчин уровень гемоглобина снизился до 130 г/литр, а у женщин до 120г/литр. Для точного выявления уровня малокровия пациенты сдают следующие лабораторные анализы, которые позволяют определить тесты:
- количество В12 в плазме крови;
- уровень процентного насыщения железа, который позволяет установить насколько данное вещество задействовано в процессе образования гемоглобина;
- точное число ретикулоцитов, который отвечают за процесс образования эритроцитов;
- показатель эритроцитов для дифференциальной диагностики;
- уровень запаса железа в организме.
Для информации! Уровень гемоглобина классифицируют по степени тяжести:
- легкая — уровень ниже нормы, но не менее 90 г/литр;
- средняя — уровень гемоглобина составляет 70-90 г/литр;
- тяжелая — уровень составляет не менее 70 г/литр.
В период выполнения диагностирования следует применять специальные методы, которые помогают выявить скрытые кровотечения. Как правило, кровотечения могут быть в желудочно-кишечном тракте или ректальные. В период менструального цикла женщинам рекомендуется пройти дополнительную консультацию у врача гинеколога.
Лечение малокровия
Лечение почечного малокровия состоит из нейтрализации инфекции и очагов воспаления в почечном органе. Терапия включает в себя лекарственные препараты, направленные на восстановление, поддержание и стимулирование выработки эритпротеина. При выявлении пониженного уровня железа в организме пациента назначаются щадящие лекарственные препараты с высокой концентрацией данного вещества, например, внутривенный Ферковен в дозировке от 2 до 5 миллиграмм.
Для информации! Лекарственные препараты с высоким содержанием железа способны вызвать приступы тошноты и рвоты. Для исключения образования побочных действий железо принимается в комплексе с раствором Атропина, который вводится подкожно.
Дополнительно с приемом медицинских препаратов назначается диетотерапия, с обязательным содержанием продуктов богатых на кобальт и железо. Как правило, больным включают в рацион пищу, которая способствует быстрому усвоению железа в организме, к ним относят:
- гречневая крупа;
- чечевица;
- зеленый горошек;
- свёкла;
- яичный желток;
- гранат;
- земляника;
- брусника.
Помимо диеты, назначается терапия с приемом лекарственных препаратов в основе, которых высокая концентрация кобальта. Кобальт оказывает благоприятное влияние на организм больного и способствует включению железа в общий гем, который способен увеличивать эритропоэтическую активность сыворотки крови.
Для информации! В лечении почечного малокровия не используют хлористый кобальт, т.к. он провоцирует диспепсические расстройства.
Стоит отметить кобальт могут и заменить в случае абсолютной почечной недостаточности и резкого ухудшения функциональности почек. Полностью исключать данное вещество в лечении не рекомендуется, поэтому его чередуют с переливанием эритроцинтарной массы.
Помните, выраженные признаки малокровия почек способны значительно ухудшить состояние здоровья больного при почечной недостаточности. Важно, своевременно выполнить диагностирование, выявить патологию, пройти лечение лекарственными препаратами и диетотерапией. Своевременные принятые меры значительно улучшат общее состояние, помогут восстановить почечную систему, а также поддержат работоспособность других важных внутренних органов.
Читайте также:


