Цитомегаловирусная инфекция и аутизм
Что такое цитомегаловирус?
Цитомегаловирус – этот вирус распространен во всем мире. Как заболевание чаще отмечается в перинатальном периоде и в детском возрасте. Инфицирование происходит воздушно-капельным путем, при поцелуях и сексуальных контактах, при переливании препаратов крови.
ПОЛУЧИТЬ КОНСУЛЬТАЦИЮ
Цитомегаловирус и беременность
Цитомегаловирус, врожденная цитомегаловирусная (ЦМВ) инфекция является одной их наиболее частых причин внутриутробного инфицирования эмбриона и плода. В связи с отсутствием до настоящего времени корректного обследования беременных женщин на активность хронической ЦМВ инфекции, внутриутробное инфицирование этим вирусом происходит гораздо чаще, чем диагностируется. Женщина, которая является невольным источником заражения для своего самого любимого в мире человека, сама, в подавляющем большинстве случаев, не болеет и даже не знает о том, что произошло. Инфекция проникает через матку (первые 8-10 недель беременности) или через плаценту.
При раннем заражении ребенка в эмбриональном периоде развития (первые 12 недель) обычно беременность прерывается из-за выкидыша, замирания и других осложнений раннего периода беременности. Могут также развиваться различные пороки внутриутробного развития, многие из которых бывают несовместимы с жизнью. Некоторые сложные пороки развития ребенка, которые относят к генетическим заболеваниям (например, синдром Денди-Уокера) также могут быть индуцированы ранним заражением цитомегаловирусом в первом триместре беременности. При инфицировании на более поздних сроках гибель плода наступает реже, но заражение ЦМВ может приводить к различным заболеваниям новорожденных и детей грудного возраста.
Среди детей этой возрастной группы острая врожденная ЦМВ-инфекция встречается примерно в 2-4% случаев от общего числа внутриутробно инфицированных новорожденных. Обычно уже в первые часы или сутки после рождения у таких новорожденных повышается температура, развивается гепатит, появляется желтуха, обильная геморрагическая сыпь на лице, туловище, конечностях, воспаление легких. Могут возникнуть кровоизлияния в слизистые оболочки, кровотечения из пупочной ранки, явления гемоколита (кровь в стуле). У новорожденных с острым поражением головного мозга наблюдаются дрожание рук, сонливость, судороги; возможны нарушения зрения и слуха. При острой врожденной ЦМВ-инфекции проводят специфическую противовирусную терапию, прогноз серьезный.
Чем раньше начато лечение первично хронической врожденной цитомегаловирусной инфекции у детей с ее клиническими проявлениями – тем лучше прогноз. Лечение, начатое в первые 3-4 месяца жизни, в большинстве случаев позволяет полностью восстановить зрение, купировать дальнейшее прогрессирование эпилепсии, гидроцефального синдрома и наверстать отставание в развития. Дети с аутизмом, которым адекватное лечение врожденной ЦМВ-инфекции проведено в первые 2-3 года жизни, нередко затем могут проходить обучение в обычных, а не в специализированных школах.
ПОЛУЧИТЬ КОНСУЛЬТАЦИЮ
Опасность представляет только врожденная ЦМВ-инфекция. Заражение ЦМВ после рождения (с грудным молоком, от других детей и взрослых) у иммунокомпетентных детей (без иммунодефицита) уже никаких заболеваний вызвать не может.
Следует помнить, что обнаружение у ребенка антител IgG в первые 6-9 месяцев после рождения не имеет самостоятельного диагностического значения. Это могут быть материнские антитела, попавшие к ребенку через плаценту и пуповину во время беременности. А антитела IgMу 80% детей старше 2-3 месяцев с активной формой врожденной ЦМВ-инфекции вообще отсутствуют. Поэтому сегодня единственным адекватным методом лабораторной диагностики для подтверждения врожденной и хронической ЦМВ-инфекции являются положительные результаты одновременного ПЦР-исследования крови, слюны и мочи с количественным определением вирусной нагрузки.
Цитомегаловирус, цитомегаловирус лечение, чем лечить цитомегаловирус, цитомегаловирус при беременности.
– Прививки и болезни – Аутизм, вакцины и иммунный ответ
Доклад проф. Виджендры К. Сингха экспертной комиссии
|
| Гипотеза аутоиммунности Факторы внешней среды (вирусы/вакцины) --> дисфункция иммунной системы --> аутоиммунность к мозгу --> аутизм |
2. Вирусы как причинные факторы возникновения аутизма: корь — возможный этиологический агент
Среди ведущих специалистов в этой области бытует мнение, что вирусные инфекции дают начало реакции аутоиммунности и в конечном счете приводят к органоспецифичным аутоиммуным заболеваниям. Запускающий механизм при аутизме остается неизвестным, но подозреваются вирусные инфекции. Вирусы могут попасть в мозг через слизистую носоглотки или вызвать аутоиммунную реакцию против мозга, влияя тем самым на развитие ЦНС. Поскольку начало болезни приходится на самое начало жизни, вирусы могут послужить тератогенами (агентами, вызывающими нарушения в развитии), этиологически связанными с аутизмом. У детей с врожденной краснухой наблюдалось в некоторой степени характерное для аутизма поведение. Некоторые дети не вырабатывали антитела к вакцине краснухи даже после повторной иммунизации от нее. Было описано несколько случаев аутизма у детей с врожденной инфекций цитомегаловируса.
С недавних пор мы приняли новый подход к изучению вирусной этиологии аутизма [7–8]. Мы решили изучить два простых вопроса: во-первых, встречается ли у аутичных детей аномальная вирусная серология (уровень антител), и, во-вторых, имеется ли связь между вирусной серологией и антителами к мозгу. Мы изучали реакцию иммунной системы на вирусы, измеряя уровни антител к ним. Для этого мы измерили антитела к пяти вирусам: вирусу кори, свинки, краснухи, цитомегаловируса и вирусу герпеса человека шестого типа. К нашему удивлению, мы обнаружили, что уровень антител только вируса кори, в отличие от других тестируемых вирусов, был в значительной степени выше у детей-аутистов, чем у нормальных детей [4,9; табл. 1 и рис. 1]. К тому же мы обнаружили интересную взаимосвязь между антителами к вирусу кори и аутоиммунностью мозга, имеющую отношение к антителам основного белка миелина. Оба этих иммунных маркера присутствовали у более чем 90% аутичных детей, наводя на мысль о возможной связи вируса кори и аутоиммунности аутизма. Но серология других вирусов и аутоантител мозга на подобную взаимосвязь не указывала. Это важное открытие побудило нас заявить о наличии временнóй связи вируса кори с этиологией аутизма [Singh et al., 1998; 7]. По этой же причине заслуживает внимания и тот факт, что реакция иммунной системы на инфицирование вирусом кори достаточно сходна с аномалиями иммуной системы у аутичных детей, косвенно указывая на этиологическую связь кори и аутизма.
Табл. 1. Вирусные антитела в вирусной серологии аутичных детей
Пишу впервые здесь! Моей дочери 3,5 года и 2 месяца назад невропатолог поставил нам АУТИЗМ! София в принципе развивалась очень хорошо с самого рождения, и росла как на дрожжах и окружающий мир воспринимала с интересом.

Единственно что мне не нравилось это, на грудной клетке у нее небольшая открытая пора(оказалась киста), с нее всегда что то выходило(подобие как с прыща), врачи ничего плохого в этом не видели! Но в 9 месяцев эта дырдочка в один момент превратилась в огромную шишку! Привезли ее к хирургу, ЕСТЕСТВЕННО надо вскрывать(хотя по УЗИ показало что гной иза которой шишка, во внутрь не пойдет, выйдет хоть и через месяц наружу)… короче, пролежав в хирургии мы перенесли стресс не только от операции, но и мы лежали в палате с мальчиком у которого(оказывается)кишечная инфекция… Их выписали, нас естественно никуда не перевели(а я дура молодая) не знала что это может или на меня или на ребенка перейти… Естественно через сутки ночью Соне стало плохо(рвота, понос, есть ничего не может)дошло до температуры 40… В общем за эти 3 дня мы выплакали столько слез, не спала, дочь была как живой труп… В общем лечила я ее сама(врачам это не надо было, они спокойно обвинили меня, что я ее чем то накормила… и почему то я тоже так думала)… ВЫшли мы бледные и похудевшие(почти как с курорта((()через неделю опять операция(так же киста воспалилась), потом после операции (уже дома)она раз 20 воспалялась но я уже народными средствами… в общем это все так чтоб понять нашу ситуацию… После всего этого у нас пошло все не так((((Дочь пошла в годик, носилась как спортсмен.

Интереса кушать не появлялось, ковыряться с игрушками тоже особо не любила начнет и сразу бросит, на одном месте не сидит и главное не начинает разговаривать ПО РУССКИ(на своем она отлично болтала, рот не закрывался)… Решили подождать до 2х лет(мало ли)… Вот ей 2 года все так же не к чему интереса нет, и не говорит(кроме мама, папа и на своем языке)… пошли к платному невропатологу(не люблю очереди в поликлиниках, и доча после операции видя поликлинику нашу орет, даже если мы не заходим)… Она лишь обратила внимание на то что она ходит на носочках, отправила на физиотерапии и массаж, таблетки выписала, но Софии они не шли, все время рвала… Потом наш невропатолог выписал кортексин и поставил диагноз Отставание в развитии речи… Кортексин нам ни как не помог, хотя надежда на него была.

В 3 года мы пошли опять к невропатологу, требовать чтоб она нас направила в коррекционный детсад, на что она отнекивалась и сказала что мы можем и в обыкновенный хорошо ходить(на тот момент Соня не особо хотела играть с детьми, если только приспичит это в догонялки), я волновалась, но все таки решили пойти попробовать… но неудачно… она и болела там постоянно, воспитатели жаловались, намекали что нам там не место… Мое желание пойти в коррекционный детсад усилилось.

В 3,4 я решила ее повести к другому невропатологу, на приеме у нее мы были час(очень понравилась мне)карточку Софии всю проглядела(в отличии от других врачей)… Нашла она кучу причин к чему прицепится:1.При выписке из роддома меня выписали с инфекцией(какой не понятно)2.В 1 месяц планово делали УЗИ головы и там оказалась сосудистая киста(врачи нам говорили мол не переживайте рассосется)3. Могло и повлиять то что ее оперировали, серьезный стресс… Сказала нам сделать: МРТ головного мозга, сдать анализы на инфекции и вирусы, пройти сурдолога(вдруг она не слышит), генетика(но у нас в Казахстане это проблемы, сдать генетический анализ)… МРТ сделали все нормально(ТТТ), у сурдолога тоже ничего нет, а вот анализы показали что мой ребенок носитель ЦМВ и Эпштен Барра… Вопрос: ОТКУДА? Я беременная проверялась с ног до головы и было все норм(лишь легкий тонус)… Невропатолог ставит диагноз АУТИЗМ… Направила нас в коррекционный детсад… На вопрос как лечить эти все болячки ответ был НИКАК, лишь поддерживать иммунитет((((Выйдя с больницы слез было не сдержать… в голове куча вопросов… Как она могла подхватить эти вирусы? Если от меня, то я как могла? Почему раньше никто не мог определить. В общем взяли себя в руки, записались на очередь на комиссию в коррекционный сад,17 января пойдем. (ждем очень)

Подруга посоветовала зарегистрироваться на БЕЙБИ.РУ, рассказать о своей проблеме… Ведь у кого то тоже может была похожая ситуация… Расскажите как вы справляетесь либо справились(добились успехов) с таким не легким диагнозом?
Герпес и аутизм
Принято считать, что аутизм имеет генетическую природу. Инфекционная и токсическая причины аутизма не противоречат генетической теории. Вирусы типа герпесных могут спровоцировать развитие аутистических расстройств, если у ребенка есть такая предрасположенность.
Инфицирование вирусом Герпеса или патогеном, способным вызвать ненормальный иммунный ответ организма. Вирус может повлечь развитие аутизма у детей и другие аутоиммунных заболеваний.
Вот некоторые инфекционные заболевания, которые были обнаружены у большинства аутичных детей. Они могут быть очень опасными для развивающегося мозга малыша, но при этом довольно часто протекают бессимптомно:
Герпес 1 и 2 типа (HerpesVirus 1,2)
Ветряная оспа — Варицелла (Human herpesvirus 3)
Мононуклеоз – Вирус Эпштейн-Барр (HerpesVirus 4)
Цитомегаловирус (HCMV — HerpesVirus 5)
Розеола (HerpesVirus 6, 7)
Если у малыша по наследству слабый иммунитет, вирус может быть вытеснен из его организма поздно или не полностью. Но при этом ребенок не будет выглядеть больным.
Из-за изначально пониженного иммунитета у детей увеличивается риск влияния вируса на мозг и нервную систему. Это грозит аутоиммунной реакцией. То есть организм ребенка начинает бороться сам с собой и поражает клетки собственного организма, что может быть причиной аутизма и отставания развития.
Откуда берется вирус?
У ребенка может быть внутриутробное поражение вследствие вирусной инфекции. Плод, зараженный цитомегаловирусом, вирусом Эпштейна-Барр, герпесом, ведет себя иначе, чем здоровый. Если здоровый ребенок во время родов активно двигается, помогает матери, то больной малыш — не может этого сделать, он вялый, очень слабо сосет грудь.
Малыш также может заразиться вирусами от матери — через материнское молоко, слюну, или же подхватить его в яслях. Так происходит с вирусом Эпштейн-Барра, (вирус герпеса 4-ого типа) 90% людей являются его переносчиками и почти бессимптомно переносят его в раннем возрасте.
Вирус герпеса 1 и 2 типа способен проникать в области мозга через нейроны. При этом может не наблюдаться признаков явного воспаления мозговой оболочки мозговых оболочек уточнить у доктора оболочки или оболочек, в литературе по-разному (энцефалит, менингит и пр.).
Области мозга, которые не участвуют напрямую в управлении организмом – ходьба, пищеварение, дыхание – подвержены удару в первую очередь. Наиболее слабые области отвечают за коммуникацию и наше эмоциональное самочувствие.
А ведь нарушения в области общения – замкнутость, отсутствие зрительного контакта и эмоций – основной признак аутизма у детей. Подробнее о признаках в статье.
Грибки и иммунитет 
Ученые доказали, что свойства клеточного механизма очень важны для защиты организма от вирусов, инфекций и болезней, вызванной грибковой бактерией рода Кандида (Candidaalbicans). Научно обосновано, что при ослабленном иммунитете (иммунный ответ от Th 1 к Th 2) резко возрастает вероятность развития у детей молочницы. [3] И как раз у аутичных детей отмечается сдвиг иммунного ответа в строну Th 2. То есть такие дети больше склонны к молочнице слизистых оболочек.
При кандидозе (молочнице) очень помогает специальная диета БГБК (без молочного и мучного) и сахара. Грибки не получают питательную среду и погибают. Многие мамы детей с аутизмом отмечают выраженный эффект от диеты в довольно короткие сроки.

Я всегда буду благодарна этой матери, так же как и остальным дотошным родителям, которые вынудили меня читать и учиться, чтобы помочь их детям. Я вернулась к учебникам, исследованиям и некоторым новым источникам, таким как публикации и неформальные заметки Терезы Бинсток по патогенам, вирусам и аутоиммунности. Пока я готовилась работать со Сьюзи, я начала изучать всю возможную информацию по этой сложной проблеме.
Сьюзи была (и остается) симпатичной хрупкой девушкой, которой я на вид дала бы скорее 14 лет, чем 16 – ее возраст на тот момент. Ее мать, учитель/писатель, которая стала домохозяйкой после рождения Сьюзи, описала мне целую команду репетиторов, которые приходили ежедневно, включая выходные, а также прочие мероприятия и огромные усилия, которые она прикладывала годами, чтобы ее дочь училась в общеобразовательной школе.
Хотя Сьюзи и соответствовала уровню своего класса, она, как первоклашка, прилагала огромные усилия, чтобы не расстроить родителей и учителей. При этом в социальном плане она была замкнутой, не имела друзей, молодые люди никогда не интересовались ей, хотя она была миловидна и обладала привлекательной, хотя и юношеской фигурой.
Она казалась немного мечтательной и рассеянной, хотя довольно неплохо отвечала на вопросы по существу. У нее были странные пристрастия в еде – она годами отказывалась есть вместе со всеми и ограничивала себя всего лишь несколькими продуктами. Что касается ее истории болезни, ее мать сказала, что Сьюзи развивалась нормально примерно до четырех лет, когда она заболела краснухой, обычно легко и быстро протекающей детской болезнью, которая вызывается вирусом герпеса 6 типа и характеризуется сыпью.
После болезни она стала вести себя по-другому и, хотя она не перестала говорить, казалось, что она учится не так хорошо, как другие дети в ее классе. Мать показала мне фотографии Сьюзи за все годы — на руках и ногам Сьюзи можно было заметить периодически появлявшуюся небольшую сыпь, похожую на короткие обострения краснухи. (Оказалось, что у нее была хроническая бессимптомная инфекция вируса герпеса 6 типа, которая периодически обострялась).
Я назначила стандартные анализы, которые все были в пределах нормы, ввела Сьюзи комплекс пищевых добавок (на что она согласилась) и предложила изменить рацион (на что ее было трудно уговорить). Гораздо легче посадить трех- или четырехлетних детей на БГБК-диету, чем подростка!
Ее анализы показали положительный IgG (прошлое или хроническое инфицирование) и IgM (недавнее инфицирование или обострение) к вирусу герпеса 6 типа (краснуха). У нее также оказались слишком низкие показатели цитотоксичности НК-клеток, что означало, что в иммунной системе имелось нарушение первой линии защиты, которая борется с вирусами.
Она уже несколько месяцев получала SSRI и комплекс питательных веществ, когда я ввела ей Ацикловир (антивирусный препарат, эффективный при многих вирусов герпеса и Варицелла-Зостер, и в разной степени эффективный при вирусе Эпштейна-Барра и вирусе герпеса 6 типа).
Примерно через неделю или десять дней после начала приема Вальтрекса в Сьюзи произошли поразительные изменения. Ее глаза прояснились, она стала менее отрешенной, более сообразительной и в целом более эмоциональной, завела друзей. Казалось, как будто ее одноклассники никогда не видели ее раньше.
В течение трех месяцев она стала нормальным непослушным подростком, что совершенно поразило ее родителей и удивило репетиторов, которые занимались с ней годами. Вскоре она стала протестовать против такого количества занятий и, несмотря на то, что большую часть из них отменили, она как обычно продолжала получать оценки В и С, что приятно удивило ее родителей.
Впервые в жизни она начала привлекать внимание мальчиков и, как и все нормальные школьники, участвовать в обычных школьных интригах со своими радостями и несчастьями. У нее все еще оставались некоторые трудности в обучении, но положительные изменения во всех сферах ее жизни были очевидны для всех, кто знал ее до лечения.
Сьюзи принимала SSRI всего несколько месяцев, а Вальтрекс (1500 мг в сутки) 18 месяцев; ее титры к вирусам снижались, тогда как количество НК-клеток увеличилось. Периодически в ходе лечения она принимала TransferFactor и натуральное антивирусное средство Монолаурин (Лаурицидин). Даже после стабилизации показателей мать Сьюзи не хотела прекращать прием Вальтрекса несмотря на то, что Сьюзи ненавидела стандартные анализы крови, которые она сдавала для проверки состояния печени в ходе лечения (печень была в порядке).
Наконец, к моменту окончания школы мы постепенно отменили все лекарства. Она также устала от необходимости принимать такое количество пищевых добавок, когда стала чувствовать себя лучше. Когда осенью прошлого года она уезжала сдавать экзамен в один частный художественный колледж, у нее все еще оставались несколько эксцентрические привычки в еде, но мы все примирились с этим.

Источники:
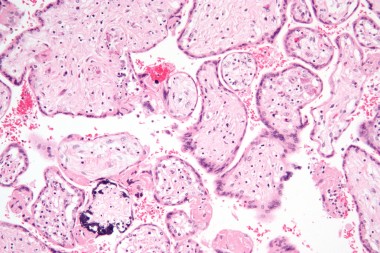
В статье проанализированы опубликованные данные по вопросам адекватной диагностики антенатальной и постнатальной цитомегаловирусной инфекции (ЦМВИ), а также лечению острых ЦМВИ у беременной, плода и новорожденного. Представлены отечественные клинические р
The article gives analysis of the data on the issues of relevance of diagnostics of antenatal and postnatal cytomegaloviral infection (CMVI), as well as treatment of acute CMVI in the pregnant, fetus and newborns. National clinical guidelines on diagnostics and treatment of congenital CMVI developed by the Russian Association of antenatal medicine in 2016, were presented; as well as the first unofficial international guidelines on the issues of diagnostics and treatment of congenital CMVI.
Цитомегаловирус (ЦМВ) — чрезвычайно распространенный вирус, поражающий людей всех возрастов и формирующий пожизненную персистенцию в организме инфицированного человека. Считается, что в большинстве случаев персистенция начинается в ранние годы жизни и протекает латентно, не оказывая выраженного патологического влияния на состояние здоровья инфицированного. С другой стороны, доказано, что персистенция вируса может сопровождаться хроническим воспалением, формировать разнообразные многочисленные иммунные дисфункции и определять развитие вторичных иммунных, аутоиммунных и дегенеративных нарушений. Различного рода иммунокомпрометации могут приводить к рецидивам размножения вируса и многообразным клиническим проявлениям с поражением любых органов и систем в любом возрасте.
Особое значение имеют врожденные инфекции детей, которые отличаются высоким риском развития тяжелых генерализованных форм и инвалидизирующих исходов заболевания, таких как потеря слуха, зрения, умственная отсталость, микроцефалия, судорожный синдром и пр. Такие пожизненные проблемы со здоровьем развиваются примерно у каждого пятого ребенка с врожденной цитомегаловирусной инфекцией (ЦМВИ), что определяет потребность в своевременном пренатальном выявлении беременных и плодов с высоким риском развития врожденной ЦМВИ и ранней диагностике и лечении инфекций у новорожденных.
Теоретические дискуссии по вопросам адекватной диагностики антенатальной и постнатальной ЦМВИ, а также лечению острых ЦМВИ у беременной, плода и новорожденного продолжаются с 1990-х гг., но отсутствие единых руководящих принципов затрудняет практическую работу врачей. Российской ассоциацией специалистов перинатальной медицины в 2016 г. выработаны отечественные клинические рекомендации по диагностике и лечению врожденной ЦМВИ. Созданная в рамках 5-й Международной конференции по ЦМВИ (Брисбен, Австралия, 19 апреля 2015) международная группа экспертов на основе консенсусных дискуссий и обзора литературы выработала первые неофициальные международные рекомендации по вопросам диагностики и лечения врожденной ЦМВИ, которые опубликованы в Lancet Infect Dis в марте 2017. Все эти рекомендации будут нуждаться в постоянном обновлении по мере поступления дополнительных данных.
ЦМВ — двухцепочечный ДНК-вирус, член семейства герпес-вирусов (β-герпесвирус человека). Синтез вирусного генома ДНК происходит в ядре клетки-хозяина. Исследования последних лет подтверждают гипотезу о том, что штаммы ЦМВ могут варьировать в их вирулентности, тропизме и патогенном потенциале, который, в свою очередь, вероятно, связан с генетической изменчивостью ключевых для патогенеза генов. Внешняя оболочка вируса содержит множественные гликопротеины, кодируемые вирусом. Гликопротеин B и гликопротеин H, по-видимому, являются основными факторами для формирования гуморального иммунитета — антитела к ним способны нейтрализовать вирус. Эти гликопротеины используют сегодня при разработке анти-ЦМВ-вакцин [3].
Вирус распространяется различными способами: через продукты крови (переливание, трансплантация органов), грудное вскармливание, пролиферацию в местах контактов (кожа, любые слизистые оболочки), перинатально и половым путем. ЦМВИ может протекать в виде первичной инфекции ранее неинфицированных (серонегативных) пациентов, реинфекции или реактивации у инфицированных (серопозитивных) людей; может вызывать острое, латентное и хроническое течение врожденных или приобретенных форм болезни [4].
При острой ЦМВ-инфекции могут поражаться практически все типы клеток человеческого организма — эндотелиальные клетки, эпителиальные клетки, клетки гладкой мускулатуры, фибробласты, нейронные клетки, гепатоциты, трофобласты, моноциты/макрофаги, дендритные клетки и пр. Все типы клеток поражаются и в мозге: нейроны, астроциты, клетки эпендимы, выстилающие желудочки, макроглия, эндотелий капилляров, оболочек, микроглия, сплетения сосудистой оболочки, дендриты и аксоны — т. е. вирус в мозге не имеет избирательной клеточной цели, что объясняет многообразие клинических форм поражения нервной системы у больных [5].
Считается, что ЦМВ реплицируется в эндотелиальных клетках с низкой скоростью, вызывая преимущественно подострые инфекции, однако истинная скорость репликации вируса в клетках определяется эффективностью цитотоксического Т-клеточного иммунитета и степенью иммуносупрессии хозяина. Так, например, на моделях ЦМВИ у животных продемонстрировано, что отсутствие CD4 Т-клеток сопровождалось более тяжелым и стремительным заболеванием ЦМВИ. Известно также, что ВИЧ-инфицированные новорожденные имеют очень высокую частоту врожденной ЦМВИ с высоким риском смерти, неврологических дефектов и прогрессии ВИЧ-инфекции [6–7].
Особое свойство ЦМВИ — способность вызывать депрессию практически всех звеньев иммунитета, резко угнетать продукцию интерферонов (ИНФ), в первую очередь ИНФ-α. Внедрение ЦМВ приводит к иммунной перестройке в виде снижения реакции лимфоцитов на вирусы в связи с угнетением экспрессии антигена макрофагами, подавлением пролиферативной активности лимфоцитов (что коррелирует с тяжестью болезни), угнетением фагоцитарной активности и завершенности фагоцитоза [7].
Доказано, что и первичные и латентные ЦМВИ сами могут индуцировать хронические воспалительные системные реакции с устойчивой иммунной активацией, запускать и поддерживать аутоиммунные процессы, усиливать аллореактивность Т-клеток после трансплантации и, возможно, участвовать в комплексе причин повышения частоты нейродегенеративных состояний с возрастом человека (Jones R. P. The debility cascade in neurological degenerative disease). Установлено также, что ЦМВ-индуцированные иммунные изменения в пожилом возрасте могут отвечать, например, за замедленную элиминацию вируса гриппа из легких, сниженный поствакцинальный иммунитет на гриппозные вакцины, измененную реакцию организма на терапию интерферонами [8].
Многие годы риск развития врожденных инфекций плода ассоциировали преимущественно с первичной инфекцией матери, однако к настоящему моменту не вызывает сомнения, что большая доля врожденных ЦМВИ (до 75%) встречается в условиях рецидивирующей во время беременности материнской инфекции. Допускаются также и экзогенные реинфекции с новыми штаммами ЦМВ — доказательства основываются на молекулярных данных, подтверждающих получение нового штамма вируса.
Вместе с тем степень риска вертикального инфицирования плода в условиях первичной инфекции матери рассматривают по-прежнему как чрезвычайно высокую — в 30–50% случаев острой первичной инфекции беременной развивается врожденная инфекция ребенка. Показано, что ранее существовавший материнский иммунитет хоть и не гарантирует полной защиты, тем не менее обеспечивает снижение риска врожденной ЦМВИ при следующих беременностях на 69% [9].
Недавними исследованиями установлено, что ЦМВ может поражать амниотическую мембрану, ухудшая цитотрофобласт-индуцированный лимфангиогенез и ремоделирование сосудов в плаценте и задерживая правильное развитие клеток — предшественников трофобласта, одновременно вызывает врожденную провоспалительную иммунную реакцию. Это приводит к гипоксии плода, задержке внутриутробного развития и возможным последующим гипоксическим повреждениям головного мозга. Степень поражения плода определяется сроками антенатального инфицирования и вирусной нагрузкой в размножающихся клетках — чем меньше гестационный возраст, тем более выражена альтерация (разрушение) тканей с формированием пороков развития [10]. Особенно быстро ЦМВ достигает максимума в астроцитарных и глиальных клетках, при этом максимальная экспрессия вируса найдена в глиальных клетках развивающегося мозга мышат (что объясняет микрогирию, микроцефалию и другие пороки ЦМВ-инфицированного мозга детей). По мере увеличения срока гестации в клинической картине инфекционного заболевания плода преобладают симптомы системного воспаления с выраженной пролиферацией и экссудацией. У 1/3 умерших от ЦМВИ новорожденных (из них 60% — недоношенные) при морфологическом исследовании выявляют различные пороки развития. У 43% — признаки генерализованной внутриутробной инфекции с геморрагическими и ишемическими инфарктами (в том числе в головном и спинном мозге) [11].
Способность вируса реплицироваться в любых клетках человеческого организма определяет многообразие клинических форм болезни; ЦМВ может вызывать как генерализованные инфекции, так и поражения отдельных органов: печени, головного мозга, сердца, легких, мочеполовых органов, желудочно-кишечного тракта и др.
У беременных острая первичная ЦМВИ протекает чаще бессимптомно (25–50%) или малосимптомно — с неспецифическими проявлениями (обычно лихорадка, астения и головная боль).
Как первичная, так и рецидивирующая ЦМВИ матери может стать причиной антенатальных ультразвуковых признаков поражения плода в результате трансплацентарной инфекции. Самые частые УЗИ-признаки: задержка роста плода, вентрикуломегалия, микроцефалия, перивентрикулярная гиперэхогенность, кальцификаты в мозге, плевральный выпот или асцит, гепатоспленомегалия, гиперэхогенный кишечник и мекониальный илеус и др. Эти УЗИ-аномалии эмбриона прогнозируют тяжелую генерализованную манифестную врожденную ЦМВИ новорожденного с высоким риском формирования инвалидизирующих исходов болезни и смерти. Поэтому первичная острая ЦМВИ во время беременности может являться показанием к ее искусственному прерыванию. Установлено, что около 4% детей с антенатальной ЦМВИ умрут в утробе матери или вскоре после рождения, среди остальных около 60% будут иметь когнитивные дефекты, нейросенсорную потерю слуха и другие неврологические и прочие проблемы [11–12].
Сегодня установлено также, что нейросенсорная тугоухость является прогрессирующим заболеванием и может формироваться в течение 5–6 лет жизни даже у детей, родившихся с бессимптомной ЦМВИ (это связывают с многолетней репликацией ЦМВ в перилимфе), что требует соответствующей длительности наблюдения ребенка.
При инфицировании в поздние сроки гестации ЦМВИ у новорожденного может проявляться и как генерализованная инфекция, и как поражение отдельных органов с нетяжелыми транзиторными симптомами болезни, например, умеренной гепатомегалией, изолированным снижением количества тромбоцитов или повышенным уровнем аланинаминотрансферазы. Возможна и клинически бессимптомная ЦМВИ с изолированной нейросенсорной тугоухостью.
У 10% всех новорожденных в течение первого месяца жизни возникают инфекционные заболевания в результате в основном семейных контактов, в том числе грудного вскармливания. Экскреция ЦМВ с грудным молоком в течение первых недель после родов бывает низкой, достигает максимума к 4–8 неделям, завершается к 9–12 неделям. Считается, что риск трансмиссии вируса коррелирует с вирусной нагрузкой в молоке, передача максимальна при высокой экскреции. У доношенных детей в результате инфицирования ЦМВ через молоко матери формируется, как правило, субклиническое течение инфекции без остаточных явлений; в клинической картине более вероятно развитие энтероколита и транзиторного холестатического гепатита с минимальным цитолизом. Недоношенные дети (вес
И. Я. Извекова 1 , доктор медицинских наук, профессор
М. А. Михайленко
Е. И. Краснова, доктор медицинских наук, профессор
ФГБОУ ВО НГМУ МЗ РФ, Новосибирск
Цитомегаловирусная инфекция в практике врача: современный алгоритм диагностики и лечения/ И. Я. Извекова, М. А. Михайленко, Е. И. Краснова
Для цитирования: Лечащий врач № 4/2018; Номера страниц в выпуске: 90-95
Теги: новорожденные, беременность, инфекция, персистирование
Читайте также:
- Можно ли колоть бициллин собаке от чумки
- Инфекция боль в ногах паху
- Задачи по аденовирусной инфекции с ответами
- Для чего провокация мазок инфекция
- После прививки от клещевого энцефалита можно в лес
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.

