Биопленка как эндодонтическая инфекция

Важным аспектом каждодневной деятельности стоматолога-эндодонтиста является, на мой взгляд, четкое понимание биологии происходящих процессов. Долгие годы многие такие аспекты, как микробиология или иммунология, казались очень далекими от клинической работы. Накопленные сегодня знания подталкивают нас к изменению наших клинических решений. Одна из наиболее изучаемых и дискутируемых сегодня тем — это тема биопленки.
Биопленка — это конгломерат колоний микроорганизмов, которые погружены во внеклеточный матрикс и прикреплены к поверхности. Микроколонии занимают примерно 15% от общей массы биопленки.
Экстрацеллюлярный матрикс, состоящий из экзополисахаридов, выделяемый микробами и несущий важные функции в жизнедеятельности биопленки, занимает 85% массы биопленки. Несмотря на название биопленка не является однородной субстанцией, она гетерогенна в пространстве и во времени, сквозь биопленку проходят водные каналы, несущие питательные вещества и вымывающие продукты жизнедеятельности микроорганизмов.
Экстрацеллюлярный матрикс является мощным биологическим клеем, с помощью которого биопленка прочно прикрепляется к поверхности. В области стоматологии речь идет о эмали зубов, если мы обсуждаем начальный кариес, и о поверхности корня, если говорим о патологии пародонта, в области эндодонтии мы говорим о биопленке, прикрепляющейся к поверхности дентина канала корня.
Стадии развития биоплёнки
- Сначала происходит первичное прикрепление микроорганизмов к поверхности (адгезия, сорбция) из окружающей среды (обычно жидкости). Эта стадия обратима.
- Окончательное (необратимое) прикрепление, иначе называемое фиксацией. На этой стадии микробы выделяют внеклеточные полимеры, обеспечивающие прочную адгезию.
- Созревание (в англоязычной литературе — созревание-I). Клетки, прикрепившиеся к поверхности, облегчают прикрепление последующих клеток, внеклеточный матрикс удерживает вместе всю колонию. Накапливаются питательные вещества, клетки начинают делиться.
- Рост (в англоязычной литературе — созревание-II). Образована зрелая биоплёнка, и теперь она изменяет свой размер и форму. Внеклеточный матрикс служит защитой клеток от внешних угроз.
- Дисперсия (выброс бактерий): в результате деления периодически от биоплёнки отрываются отдельные клетки, способные через некоторое время прикрепиться к поверхности и образовать новую колонию.

Чем же так интересна эта структура? Внутри биопленки создаются уникальные условия с точки зрения взаимодействия между микроорганизмами: близкий контакт позволяет резко усилить обмен генетической информацией, соответственно, образование резистентных штаммов микроорганизмов происходит намного быстрее, чем у микроорганизмов, находящихся в форме планктона.
Между колониями микробов возникает свой язык общения по типу феромонов: сигнальные молекулы вызывают изменение в поведении микроколоний и влияют на скорость размножения микробов и проявления тех или иных фенотипических свойств [3]. И наконец, внутри биопленки возникают сложнейшие пищевые цепочки, где продукты жизнедеятельности одних микроорганизмов являются основой для существования других. Экстрацеллюлярный матрикс защищает микробов от воздействия внешних факторов, к которым относятся и наши попытки их уничтожения.
Как выяснилось, большинство международных микробиологических исследований изучало микробов в форме планктона, и поэтому часто исследователи не понимали, в чем такая большая разница результатов исследований in vitro и конечного эффекта in vivo. Характерным примером являются данные о возможной разнице резистентности микробов к амоксициллину в форме планктона и биопленки в 1000 раз [4].
Понимание взаимодействия микробов в биопленке помогает нам ответить на старый вопрос микробиологов: все ли микробы, что мы находим в инфицированном канале, нужны для возникновения апикального периодонтита или есть главные игроки, а часть микробов просто попала в канал и никакой роли в патогенезе не играет? Учитывая наши знания о биопленке, мы понимаем, что безобидные, на первый взгляд, микробы несут такие важные функции, как образование экстрацеллюлярного матрикса, и являются незаменимыми в пищевых цепочках [5]. Все эти данные рисуют непростую картину борьбы с инфекционными заболеваниями как в области общей медицины, так и в стоматологии. Наиболее логичным путем является механическое удаление биопленки с поверхности.
В терапевтической стоматологии мы часто совмещаем удаление биопленки с подлежащей поверхности. Пародонтологи уже много лет говорят о необходимости качественного удаления зубного камня и полировки корня как об основе любого пародонтологического лечения. Абсолютно естественно, что мы акцентируем наше внимание на инструментальной обработке канала как на основном этапе борьбы с биопленкой. Однако данные последних десятилетий неутешительны: даже при агрессивной обработке канала при использовании вращающихся никель-титановых инструментов 25—35% поверхности каналов остаются необработанными [6]. Мы не должны забывать, что основной целью инструментальной обработки канала является придание ему формы, а за очистку в основном ответственны ирригация и внутриканальная антисептическая обработка.
В эндодонтии корневой канал прокрашивается, как правило, метиленовым синим или толуидиновым синим, и эти фотосенситайзеры прикрепляются к наружной поверхности микробов. После этого канал облучается низкоэнергетическим лазером (CO2) с длиной волны 665 нм. Данная процедура вызывает уничтожение бактерий. Естественно, что если бактерии находятся в форме планктона, такая система работает со 100%-ной эффективностью, но биопленка не позволяет красителям достичь внутренних слоев, и поэтому многие исследователи [8] показывают невозможность полного уничтожения микробной биопленки такими системами и как вывод пишут о создании мощной дополнительной антибактериальной системы, но не альтернативной [9].
Last Updated: 3 года ago в разделе Эндодонтия
Исторически концепции использования силеров в эндодонтии в Американской и Европейской школах были полярными. Европейский подход предполагал наличие у силера выраженных антибактериальных свойств. Американская научная эндодонтическая школа предпочитала рекомендовать для обтурации каналов инертные силеры. Причина заключается в том, что антибактериальные ингредиенты, являясь активными веществами, выделяются из основного материала (силера) и поэтому со временем исчезают [1] — в этот момент материал теряет антибактериальные свойства, а заодно свой объём и, следовательно,герметичность. Процесс потери активного растворимого ингредиента ускоряется апикальной перколяцией — движением периапикальной жидкости в апикальную часть корневого канала вовремя жевания. Современные методики дезинфекции не способны стерилизовать корневые каналы [2], поэтому исследователи полагают, что качественная обтурация выполнит функцию замуровывания оставшихся в канале микроорганизмов и тем самым нарушит их жизнедеятельность [3]. Важная роль при этом принадлежит тем силерам, которые на этапе твердения обладают выраженными антибактериальными свойствами, становясь инертными после затвердевания [4].Одна из наиболее рекомендуемых групп корневых герметиков — эпоксидные силеры, которые при затвердевании обладают антибактериальным эффектом, а после затвердевания становятся полностью инертными [4].Проблема современных обтурационных материалов в том, что они не в силах на длительный срок справиться с проникновением новых микроорганизмов из ротовой полости при нарушенном коронковом герметизме [5]. Как правило, через 3 месяца контакта с ротовой полостью обтурированный корневой канал инфицируется и подлежит перелечиванию [6].
С момента обнаружения и осознания того факта, что бактериальная инфекция в нашем организме, и в частности в корневом канале зуба, существует в большинстве случаев в форме биопленки [7], начался поиск новых методов борьбы с ней. Одно из новейших направлений — это применение нерастворимых дезинфицирующих макромолекул, которые уничтожают бактерии при прямом контакте, ничего не выделяя и не растворяясь. Механизм их действия следующий: макромолекулы обладают положительным (+) электрическим зарядом, а микробы — отрицательным (-) электрическим зарядом, в то время как клетки человеческого организма электрическим зарядом не обладают. При контакте макромолекулы с бактерией нарушается проницаемость мембраны микроба с последующей его гибелью [8]. Важнейшим свойством макромолекулы является то, что,действуя, она не исчезает, не растворяется и не теряет своих свойств [8] в отличие от классических антибактериальных веществ: гипохлорита натрия (NaOCl), хлоргексидина биглюконата (CHX),гидроксида кальция (Ca(OH)2) и йодоформа. Существует несколько новых направлений в использовании дезинфицирующих макромолекул в эндодонтии. Одно из них — это использование наночастиц величиной от 1 нм до 100 нм. Например, природная наночастица Хитозан добываетсяиз хитинового покрова мелких ракообразных [9]. Исследователи группа Шресты и Кишена попытались применить ее для ликвидации биопленки [10]. Однако они не получили значимого улучшения результата по сравнению с классическими методами с применением Ca(OH)2 и фотоактивируемой дезинфекции [10]. Была также попытка использовать наночастицы серебра для уничтожения биопленки, однако результат не был значимым [11].
На мой взгляд, проблема кроется в электрическом заряде. Биопленка имеет (-) заряд, и поэтому наночастицы будут притягиваться к поверхности биопленки, не проникая в ее внутренние слои. Безусловно, это предположение требует научного подтверждения. Параллельно возникло направление, связанное с использованием наночастиц для предотвращения возникновения биопленки. В Иерусалимском Университете была создана синтетическая наночастица Quaternary ammonium polyethyleneimine(QA-PEI), называемая также I-ABN(Insoluble Anti-Bacterial Nanoparticles, Нерастворимыe Анти-Бактериальныe Наночастицы) [12]. В серии экспериментов данную частицу добавляли в различные стоматологические материалы [12,14, 15, 18, 19]. Как результат, в течение 1-3 месяцев (длительность экспериментoв) полностью предотвращалось образование биопленки на поверхности материалов. В группе материалов, например композитов, без добавления наночастицуже через 24 часа поверхность была покрыта биопленкой [13, 14, 15].
В эндодонтии возникла идея создания силера с добавлением наночастиц. Был создан новый эпоксидный силер BJM Root Canal Sealer. Данный силер с добавлением наночастицы как минимум 3 месяца предотвращает образование биопленки при прямом контакте с инфекцией [19]. Идея добавления наночастицы в силер была проверена и другой группой исследователей. Наночастица была добавлена в такие силеры, как AH Plus и Root Canal Sеaler; результаты показали выраженное действие против биопленки [20]. Однако с использованием наночастиц возникла определенная проблема: наночастицы могут проходить через любые барьеры в человеческом организме, включая плацентарный и гематоэнцефалический [21, 22], и исследователи не знают, к каким биологическим последствиям это может привести. В настоящее время разрабатываются новые методики проверок, и пока министерства здравоохранений многих стран не дают разрешение на использование материалов, содержащих наночастицы [23, 24]. В качестве решения этой проблемы возникло направление использования дезинфицирующих макромолекул, не являющихся наночастицами.
Одной из наиболее широко используемых таких макромолекул в общей медицине является материал BioSafe, который широко применяется в качестве добавки к пластикам, из которых делаются катетеры и покрытия клавиатуры [25]. Добавке BioSafe в эндодонтии было присвоено маркетинговое обозначение Immobilized AntibacterialTechnology (IABT). BJM Root Canal Sealer выпускается сегодня с этой добавкой. Так как BJM Root Canal Sealer — новый силер, важно проверить, соответствуют ли его свойства стандартам ISO, не изменятся ли его физические свойства при добавлении BioSafe и, конечно, каков уровень его биосовместимости. Такое исследование было проведено и сейчас готовится к публикации [26]. Свойства материалa были проверены в сравнении с классическими эпоксидными силерами AH Plus и MMSeal. BJM Root CanalSealer соответствует стандартам ISO и демонстрирует высокую биосовместимость. Существует необходимость в дополнительных исследованиях, которые могли бы проверить длительность действия макромолекул в контакте с биопленкой в максимально приближенных к ротовой полости условиях. Если будет доказана неограниченная длительность действия, как нам обещают химики, то мы можем оказаться в качественно новой ситуации — прогноз эндодонтического лечения практически не будет зависеть от качества корональной герметизации! Безусловно, это гипотеза, и мы будем ждать результатов исследований.





Эндодонтические силеры как профилактика биопленки: факты и гипотезы*
Исторически концепции использования силеров в эндодонтии в Американской и Европейской школах были полярными. Европейский подход предполагал наличие у силера выраженных антибактериальных свойств. Американская научная эндодонтическая школа предпочитала рекомендовать для обтурации каналов инертные силеры.
Причина заключается в том, что антибактериальные ингредиенты, являясь активными веществами, выделяются из основного материала (силера) и поэтому со временем исчезают [1] – в этот момент материал теряет антибактериальные свойства, а заодно свой объем и, следовательно, герметичность. Процесс потери активного растворимого ингредиента ускоряется апикальной перколяцией – движением периапикальной жидкости в апикальную часть корневого канала во время жевания.
Современные методики дезинфекции не способны стерилизовать корневые каналы [2], поэтому исследователи полагают, что качественная обтурация выполнит функцию замуровывания оставшихся в канале микроорганизмов и тем самым нарушит их жизнедеятельность [3]. Важная роль при этом принадлежит тем силерам, которые на этапе твердения обладают выраженными антибактериальными свойствами, становясь инертными после затвердевания [4].
Одна из наиболее рекомендуемых групп корневых герметиков – эпоксидные силеры, которые при затвердевании обладают антибактериальным эффектом, а после затвердевания становятся полностью инертными [4].
Проблема современных обтурационных материалов в том, что они не в силах на длительный срок справиться с проникновением новых микроорганизмов из ротовой полости при нарушенном коронковом герметизме [5]. Как правило, через 3 месяца контакта с ротовой полостью обтурированный корневой канал инфицируется и подлежит перелечиванию [6].
С момента обнаружения и осознания того факта, что бактериальная инфекция в нашем организме, и в частности, в корневом канале зуба, существует в большинстве случаев в форме биопленки [7], начался поиск новых методов борьбы с ней.
Одно из новейших направлений – это применение нерастворимых дезинфицирующих макромолекул, которые уничтожают бактерии при прямом контакте, ничего не выделяя и не растворяясь.
Механизм их действия следующий: макромолекулы обладают положительным (+) электрическим зарядом, а микробы – отрицательным (–) электрическим зарядом, в то время как клетки человеческого организма электрическим зарядом не обладают. При контакте макромолекулы с бактерией нарушается проницаемость мембраны микроба с последующей его гибелью [8]. Важнейшим свойством макромолекулы является то, что, действуя, она не исчезает, не растворяется и не теряет своих свойств [8] в отличие от классических антибактериальных веществ: гипохлорита натрия (NaOCl), хлоргексидина биглюконата (CHX), гидроксида кальция (Ca(OH)2) и йодоформа.
Существует несколько новых направлений в использовании дезинфицирующих макромолекул в эндодонтии. Одно из них – это использование наночастиц величиной от 1 нм до 100 нм. Например, природная наночастица Хитозан добывается из хитинового покрова мелких ракообразных [9].
Исследователи группа Шресты и Кишена попытались применить ее для ликвидации биопленки [10]. Однако они не получили значимого улучшения результата по сравнению с классическими методами с применением Ca(OH)2 и фотоактивируемой дезинфекции [10]. Была также попытка использовать наночастицы серебра для уничтожения биопленки, однако результат не был значимым [11]. На мой взгляд, проблема кроется в электрическом заряде. Биопленка имеет (–) заряд, и поэтому наночастицы будут притягиваться к поверхности биопленки, не проникая в ее внутренние слои. Безусловно, это предположение требует научного подтверждения.
Параллельно возникло направление, связанное с использованием наночастиц для предотвращения возникновения биопленки. В Иерусалимском университете была создана синтетическая наночастица Quaternary ammonium polyethyleneimine (QA-PEI), называемая также I-ABN (Insoluble Anti-Bacterial Nanoparticles, Нерастворимыe Анти-Бактериальныe Наночастицы) [12]. В серии экспериментов данную частицу добавляли в различные стоматологические материалы [12, 14, 15, 18, 19]. Как результат, в течение 1–3 месяцев (длительность экспериментoв) полностью предотвращалось образование биопленки на поверхности материалов. В группе материалов, например композитов, без добавления наночастиц уже через 24 часа поверхность была покрыта биопленкой [13, 14, 15].
В эндодонтии возникла идея создания силера с добавлением наночастиц. Был создан новый эпоксидный силер BJM Root Canal Sealer. Данный силер с добавлением наночастицы как минимум 3 месяца предотвращает образование биопленки при прямом контакте с инфекцией [19].
Идея добавления наночастицы в силер была проверена и другой группой исследователей. Наночастица была добавлена в такие силеры, как AH Plus и Root Canal Sеaler; результаты показали выраженное действие против биопленки [20].
Однако с использованием наночастиц возникла определенная проблема: наночастицы могут проходить через любые барьеры в человеческом организме, включая плацентарный и гематоэнцефалический [21, 22], и исследователи не знают, к каким биологическим последствиям это может привести. В настоящее время разрабатываются новые методики проверок, и пока министерства здравоохранений многих стран не дают разрешение на использование материалов, содержащих наночастицы [23, 24].
В качестве решения этой проблемы возникло направление использования дезинфицирующих макромолекул, не являющихся наночастицами. Одной из наиболее широко используемых таких макромолекул в общей медицине является материал BioSafe, который широко применяется в качестве добавки к пластикам, из которых делаются катетеры и покрытия клавиатуры [25]. Добавке BioSafe в эндодонтии было присвоено маркетинговое обозначение Immobilized Antibacterial Technology (IABT). BJM Root Canal Sealer выпускается сегодня с этой добавкой.
Так как BJM Root Canal Sealer – новый силер, важно проверить, соответствуют ли его свойства стандартам ISO, не изменятся ли его физические свойства при добавлении BioSafe и, конечно, каков уровень его биосовместимости. Такое исследование было проведено и сейчас готовится к публикации [26]. Свойства материалa были проверены в сравнении с классическими эпоксидными силерами AH Plus и MMSeal. BJM Root Canal Sealer соответствует стандартам ISO и демонстрирует высокую биосовместимость.
Существует необходимость в дополнительных исследованиях, которые могли бы проверить длительность действия макромолекул в контакте с биопленкой в максимально приближенных к ротовой полости условиях. Если будет доказана неограниченная длительность действия, как нам обещают химики, то мы можем оказаться в качественно новой ситуации – прогноз эндодонтического лечения практически не будет зависеть от качества корональной герметизации! Безусловно, это гипотеза, и мы будем ждать результатов исследований.
Полный список литературы находится в редакции.
Важным аспектом каждодневной деятельности стоматолога-эндодонтиста является, на мой взгляд, четкое понимание биологии происходящих процессов. Долгие годы многие такие аспекты, как микробиология или иммунология, казались очень далекими от клинической работы. Накопленные сегодня знания подталкивают нас к изменению наших клинических решений. Одна из наиболее изучаемых и дискутируемых сегодня тем — это тема биопленки.
Биопленка — это конгломерат колоний микроорганизмов, которые погружены во внеклеточный матрикс и прикреплены к поверхности. Микроколонии занимают примерно 15% от общей массы биопленки.
Экстрацеллюлярный матрикс, состоящий из экзополисахаридов, выделяемый микробами и несущий важные функции в жизнедеятельности биопленки, занимает 85% массы биопленки. Несмотря на название биопленка не является однородной субстанцией, она гетерогенна в пространстве и во времени, сквозь биопленку проходят водные каналы, несущие питательные вещества и вымывающие продукты жизнедеятельности микроорганизмов.
Экстрацеллюлярный матрикс является мощным биологическим клеем, с помощью которого биопленка прочно прикрепляется к поверхности. В области стоматологии речь идет о эмали зубов, если мы обсуждаем начальный кариес, и о поверхности корня, если говорим о патологии пародонта, в области эндодонтии мы говорим о биопленке, прикрепляющейся к поверхности дентина канала корня.
Чем же так интересна эта структура? Внутри биопленки создаются уникальные условия с точки зрения взаимодействия между микроорганизмами: близкий контакт позволяет резко усилить обмен генетической информацией, соответственно, образование резистентных штаммов микроорганизмов происходит намного быстрее, чем у микроорганизмов, находящихся в форме планктона.
Между колониями микробов возникает свой язык общения по типу феромонов: сигнальные молекулы вызывают изменение в поведении микроколоний и влияют на скорость размножения микробов и проявления тех или иных фенотипических свойств [3]. И наконец, внутри биопленки возникают сложнейшие пищевые цепочки, где продукты жизнедеятельности одних микроорганизмов являются основой для существования других. Экстрацеллюлярный матрикс защищает микробов от воздействия внешних факторов, к которым относятся и наши попытки их уничтожения.
Как выяснилось, большинство международных микробиологических исследований изучало микробов в форме планктона, и поэтому часто исследователи не понимали, в чем такая большая разница результатов исследований in vitro и конечного эффекта in vivo. Характерным примером являются данные о возможной разнице резистентности микробов к амоксициллину в форме планктона и биопленки в 1000 раз [4].
Понимание взаимодействия микробов в биопленке помогает нам ответить на старый вопрос микробиологов: все ли микробы, что мы находим в инфицированном канале, нужны для возникновения апикального периодонтита или есть главные игроки, а часть микробов просто попала в канал и никакой роли в патогенезе не играет? Учитывая наши знания о биопленке, мы понимаем, что безобидные, на первый взгляд, микробы несут такие важные функции, как образование экстрацеллюлярного матрикса, и являются незаменимыми в пищевых цепочках [5]. Все эти данные рисуют непростую картину борьбы с инфекционными заболеваниями как в области общей медицины, так и в стоматологии. Наиболее логичным путем является механическое удаление биопленки с поверхности.
В терапевтической стоматологии мы часто совмещаем удаление биопленки с подлежащей поверхности. Пародонтологи уже много лет говорят о необходимости качественного удаления зубного камня и полировки корня как об основе любого пародонтологического лечения. Абсолютно естественно, что мы акцентируем наше внимание на инструментальной обработке канала как на основном этапе борьбы с биопленкой. Однако данные последних десятилетий неутешительны: даже при агрессивной обработке канала при использовании вращающихся никель-титановых инструментов 25—35% поверхности каналов остаются необработанными [6]. Мы не должны забывать, что основной целью инструментальной обработки канала является придание ему формы, а за очистку в основном ответственны ирригация и внутриканальная антисептическая обработка.
В эндодонтии корневой канал прокрашивается, как правило, метиленовым синим или толуидиновым синим, и эти фотосенситайзеры прикрепляются к наружной поверхности микробов. После этого канал облучается низкоэнергетическим лазером (CO2) с длиной волны 665 нм. Данная процедура вызывает уничтожение бактерий. Естественно, что если бактерии находятся в форме планктона, такая система работает со 100%-ной эффективностью, но биопленка не позволяет красителям достичь внутренних слоев, и поэтому многие исследователи [8] показывают невозможность полного уничтожения микробной биопленки такими системами и как вывод пишут о создании мощной дополнительной антибактериальной системы, но не альтернативной [9].
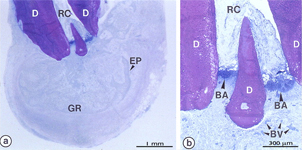
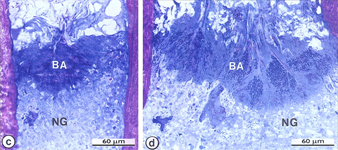
Биопленка, прикрепленная в области апикального отверстия зуба при верхушечном периодонтите.
a, b – апикальная дельта, с,d – латеральные канальцы
BA – скопления бактерий, NG – нейтрофильные гранулоциты, EP - эпителий (По Nair, 2002.)
Огромное значение играет его способность растворять органический матрикс, в данной ситуации это растворение экстрацеллюлярного матрикса биопленки, и за счет этого — проникновение NaOCl в глубокие слои биопленки. Без ирригации NaOCl современная качественная эндодонтия невозможна. И естественно, что методики, повышающие эффективность ирригаций NaOCl, — в центре внимания исследователей. Рекомендую обратить ваше внимание на направление пассивной ультразвуковой ирригации. На базе научных данных о том, что Ca(OH)2 обладает свойством растворять органическую ткань [14], можно предположить, что его использование в случаях с зубами со сложным анатомическим строением и хроническими инфекционными состояниями тоже имеет смысл.
В будущем наиболее интересное решение — это поиск биологических методов борьбы с инфекцией, в основе которых будет лежать расшифровка языка микробов и управление биопленкой путем использования сигнальных молекул или воздействие на ключевые бактерии с точки зрения функционирования биопленки.
Итак, мы должны продолжать внимательно изучать новые данные о биопленке, следя за достижениями не только исследователей в области стоматологии, но также экстраполировать достижения микробиологов и общих врачей в нашу специальность. При анализе современных исследований, описывающих результаты антибактериального воздействия тех или иных препаратов, следует обращать внимание на то, проверялись ли эти материалы, методики на биопленке или нет.
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 |

.Пути проникновения инфекции в верхушечный периодонт:
1) через корневой канал;
2) через пародонтальный карман;
3) гематогенный и лимфогенный;
4) по протяженности (per continuitatem
Этиология инфекционного периодонтит
.- первичная внутриканальная инфекция
- вторичная интраканальная инфекция (ранее эндодонтически леченные зубы)
Эндодонтическая микробная биопленка
Эндодонтическая микрофлора менее разнообразна по сравнению с микрофлорой полости рта. Прогрессирование инфекции изменяет пищевой и средовой статус в пределах корневого канала. Среда становится анаэробной и запас питательных веществ истощается. Эти изменения предлагают жесткую экологическую нишу для выживших микроорганизмов. Полной стерилизации корневых каналов очень трудно достигнуть. Персистирующие микробные комплексы обнаружены в перешейке, дельте, апикальной части корневого канала. Бактерии могут обнаруживаться за пределами апикального отверстия. Анатомические сложности корневого канала защищают прикрепившиеся бактерии от очистки и расширения корневого канала. Биопленка – это способ бактериального роста в неблагоприятных условиях среды и питания. Эндодонтическая микробная биопленка подразделяется на внутриканальную (1), экстрарадикулярную (2) периапикальную (3).
Внутриканальная микробная биопленка
Внутриканальная микробная биопленка – это микробная биопленка, которая формируется на корневом дентине эндодонтически инфицированных зубов. Эндодонтическая микробная биопленка представлена кокками, палочками и нитевидными бактериями. Обнаружены одно и многослойный биопленки, прикрепленные к дентину корневого канала. Интерстициальный матрикс биопленки имеет микробное происхождение. Изучены стадии образования E. faecalis биопленки, прикрепленной к поверхности корневого дентина. В первой стадии E. faecalis прикрепляется и формирует колонии на поверхности корневого дентина. Во второй стадии происходит инициация растворения бактериями минеральной фракции дентина. В третьей стадии локальное увеличение концентрации ионов кальция и фосфатов способствует минерализации (кальцификации) E. faecalis биопленки. Зрелая структура биопленки образуется после 6 недель инкубации и показывает признаки минерализации и определенные структурные различия. Способность E. faecalis биопленки противостоять многим антимикробным агентам и формировать микробную биопленку в жестких условиях среды и питания позволяет им персистировать в эндодонтически леченных зубах.
Экстрарадикулярная микробная биопленка
Экстрарадикулярная микробная биопленка также называется биопленкой поверхности корня и формируется на цементе корня около его верхушки в эндодонтически инфицированных зубах. Экстрарадикулярная биопленка наблюдается с зубах с хроническими периодонтитами. Биопленка может кальцифицироваться, она ассоциируется с периапикальным воспалением и задерживает восстановление периапикальных тканей после эндодонтического лечения.
Периапикальная микробная биопленка.
Эти гранулы структуры биопленки состоят центральной массы переплетающихся ветвей бактериальных нитей, удерживаемых вместе экстрацеллюлярным матриксом с периферическими радиальными участками. Стуктура биопленки защищает ее от биологических антимикробных агентов. Периапикальная область патрулируется полиморфноядерными лейкоцитами и макрофагами, которые легко фагоцитируют прибывающие из корневого канала плангтонные бактерии. Однако фагоциты неспособны поглощать бактерии, заключенные в матрикс биопленки. Многие серные гранулы кальцифицированы. Источником минерализации могут служить воспалительный экссудат или активность периапикальных бактерий.
I.Острый периодонтит (Periodontitis acuta).
П. Хронические периодонтиты
· Хронический периодонтит фиброзный (Periodontitis chonica fibrosa).
· Хронический гранулирующий периодонтит (Periodontitischonica granulans).
· Хронический гранулематозный периодонтит или гранулема (Periodontitis chonica granulomatosa s. granuloma).
III. Хронический периодонтит в стадии обострения (Periodontitis chonica exacerbata).
МКБ, 1980г., Международная классификация болезней
Классификация периодонтитов ВОЗ (МКБ-10)
К04.4 Острый апикальный периодонтит пульпарного происхождения
Острый апикальный периодонтит
К04.5 Хронический апикальный периодонтит
К04.6 Периапикальный абсцесс со свищом
К04.60 Имеющий сообщение (свищ) с верхнечелюстной пазухой
К04.61 Имеющий сообщение (свищ) с носовой полостью
К04.62 Имеющий сообщение (свищ) с полостью рта
К04.63 Имеющий сообщение (свищ) с кожей
К04.69 Периапикальный абсцесс со свищом неуточненный
К04.7 Периапикальный абсцесс без свища
К04.8 Корневая киста
К04.80 Апикальная и боковая
К04.82 Воспалительная парадентальная
К04.89 Корневая киста неуточненная
К04.9 Другие и неуточненные болезни пульпы и периапикальных тканей
Классификация верхушечного периодонтита, адаптированная к классификации периодонтитов ВОЗ (МКБ-10)
Острый верхушечный периодонтит в стадии интоксикации. (Periodontitis acuta).
К04.4 Острый апикальный периодонтит пульпарного происхождения.
Острый верхушечный периодонтит в стадии экссудации. (Periodontitis acuta).
К04.4 Острый апикальный периодонтит пульпарного происхождения.
Хронический фиброзный периодонтит (periodontitis chronica fibrosa)
К04.5 Хронический апикальный периодонтит.
Хронический гранулирующий периодонтит (periodontitis chronica granulans),
К04.5 Хронический апикальный периодонтит,
К04.6 Периапикальный абсцесс со свищом.
Хронический гранулематозный периодонтит (periodontitis chronica granulematosa).
К04.5 Хронический апикальный периодонтит.
Обострение хронического периодонтита (Periodontitis chonica exacerbata) К04.7 Периапикальный абсцесс без свища
Клинические проявления острого верхушечного периодонтита в стадии интоксикации. К04.4 Острый апикальный периодонтит пульпарного происхождения.
Острый верхушечный периодонтит
(в стадии интоксикации)
· усиливается при накусывании на зуб;
· боль локализованная (больной точно указывает на причинный зуб)
· боль беспокоит в течение нескольких часов (до 2-х суток);
· ранее отмечались боли, характерные для пульпита;
· часто возникает в процессе лечения пульпита, препарирования под искусственную коронку
Отек мягких тканей челюстно-лицевой области
могут быть слегка увеличены и слабо болезненны
Состояние слизистой оболочки десны
· зуб может быть интактным, под пломбой, но чаще имеет глубокую кариозную полость
вертикальная, слабо болезненная
отсутствует реакция на температурные раздражители
изменений в периапикальных тканях нет
Клинические проявления острого верхушечного периодонтита в стадии экссудации. К04.4 Острый апикальный периодонтит пульпарного происхождения.
Острый верхушечный периодонтит
(в стадии экссудации)
· усиливается при накусывании на зуб
· боль может иррадиировать, но больной точно указывает на причинный зуб.
2. возможно ухудшение общего состояния (головная боль, озноб, повышение температуры тела
3. могут быть жалобы на отек лица
· ранее отмечались боли, характерные для пульпита;
· часто возникает в процессе или после лечения пульпита, препарирования под искусственную коронку, ортодонтического лечения.
· боль беспокоит от 2-х дней до 2-х недель
Отек мягких тканей челюстно-лицевой области
не изменен, может быть тусклым
Состояние слизистой оболочки десны
отечна, гиперемирована, болезненна, иногда имеется инфильтрат
· в большинстве случаев имеется глубокая кариозная полость, также зуб может быть интактным или под пломбой, на этапах лечения пульпита, препарирован под искусственную коронку;
· резко болезненна вертикальная;
· может быть болезненна горизонтальная
пальпация переходной складки в проекции верхушки корня болезненна
отсутствует реакция на температурные раздражители
утрата четкости рисунка губчатого вещества в периапикальных тканях
Клинические особенности хронического фиброзного периодонтита К04.5 Хронический апикальный периодонтит.
Читайте также:


