Живые вирусные вакцины в ветеринарии
Живые вакцины изготовляют из живых ослабленных (аттенуированных) штаммов вирусов. Такие штаммы должны обладать следующими стабильными, наследственно закрепленными свойствами:
- утрата вирулентности исходного вируса;
- сохранение способности приживаться и размножаться в организме;
- сохранение специфической иммуногенности исходного патогенного штамма;
- способность вызывать образование иммунитета у привитых животных.
Введенные в организм вакцинные штаммы должны вызывать не заболевание, а особое, качественно новое состояние — так называемый вакцинальный процесс.
Получение вакцинных штаммов с перечисленными свойствами удается путем культивирования вирулентных вирусов (обычно выделенных от больных животных в очаге инфекции) в условиях, не соответствующих их природным потребностям адаптирования к маловосприимчивым или невосприимчивым животным, а также выращивания в развивающихся куриных эмбрионах или в культуре клеток. При многократном пассировании на живых системах вирусы постепенно теряют патогенность, сохраняя антигенные свойства.
К перспективным методам получения вакцинных штаммов следует отнести селекцию природно-ослабленных штаммов вирусов при атипично или латентно протекающих инфекциях, а также селекцию мутантов, индуцированных физическими и химическими мутагенами (пониженная температура культивирования, ультрафиолетовое облучение, воздействие ультразвуком и др.).
Для приготовления живых вакцин используют также гетеротипичные антигенно-родственные апатогенные штаммы: штаммы вируса оспы голубей для профилактики оспы кур, вирус кори для защиты собак от чумы плотоядных, вакцинный штамм вируса чумы свиней для профилактики диареи крупного рогатого скота и др.
Технология изготовления живых вакцин сводится к культивированию вакцинного штамма вируса в какой-либо биологической живой системе (животные, куриные эмбрионы, культуры тканей и клеток). Полученный вируссодержащий материал подвергают очистке от балластных (клеточных компонентов и др.) веществ. Далее проводят контроль на чистоту (посев на бактериальные питательные среды), безвредность и активность на восприимчивых животных. При соответствии этим требованиям полученный материал разливают по ампулам или флаконам и подвергают лиофильному высушиванию.
Живые вакцины, полученные на основе аттенуированных вакцинных штаммов вирусов, обладают рядом преимуществ перед инактивированными. Главное из них — напряженность и длительность создаваемого ими иммунитета, приближающегося к постинфекционному. Важное достоинство большинства живых вакцин — однократное введение. При этом происходит репродукция вакцинного штамма в организме в результате образования и поступления в организм в течение длительного времени активных антигенных субстанций, обеспечивающих формирование напряженного иммунитета. Вторым преимуществом живых вакцин является возможность вводить их не только подкожно, но и перорально, интраназально и аэрозольно.
Однако живые вакцины наряду с отмеченными преимуществами имеют и ряд недостатков, связанных с тем, что действующее начало этих препаратов (живых вирусов) весьма чувствительно к неблагоприятным факторам, возникающим в производстве, при транспортировке, хранении и применении, а также не исключена возможность реверсии вируса.
В специальных требованиях предусматривается качество компонентов живых вакцин и особенно чистота вируссодержащего материала. При получении живых вакцин на культурах клеток, в куриных эмбрионах субстраты могут оказаться контаминированными посторонними вирусами, микоплазмами, бактериями, и это может привести к серьезным последствиям.
Живые вакцины не содержат консервантов, поэтому при вскрытии ампул и растворении их содержимого необходимо строго соблюдать правила асептики. При накожном методе вакцинации необходимо использование для предварительной обработки таких дезинфицирующих средств, которые длительное время сохраняются на месте применения препарата.
Это биопрепараты, содержащие штаммы вирусов, утратившие способность вызывать клинически выраженное заболевание, но сохранившие способность репродуцироваться в организме восприимчивого животного и стимулировать выработку факторов специфического противовирусного иммунитета.
Принцип получения живых вакцин. Основным в технологии производства живых вакцин является получение аттенуированных штаммов вирусов путем:
1) адаптации патогенных вирусов к маловосприимчивым или совсем невосприимчивым лабораторным животным. Так был получен штамм ЛЗ Накамура для профилактики чумы крупного рогатого скота (путем серийных пассажей на кроликах), штамм К для профилактики чумы свиней. При пассажах на животных успех во многом зависит от выбора метода заражения. Так, Л. Пастер путем серийных (130—140) интрацеребральных пассажей уличного вируса бешенства на кроликах получил вакцинный штамм, известный под названием вирус-фикс. Получены аттенуированные штаммы вирусов инфекционного бронхита, инфекционного ларинготрахеита птиц, катаральной лихорадки овец и другие путем адаптации к куриным эмбрионам. Методом адаптации к культурам клеток (пассирование в сочетании с селекцией в культуре клеток) вируса чумы крупного рогатого скота (штамма ЛЗ Накамура) удалось получить аттенуированный ареактогенный вакцинный штамм ЛТ. Аналогичным путем получены вакцинные штаммы вирусов инфекционного ринотрахеита, парагриппа-3, вирусной диареи крупного рогатого скота, чумы плотоядных и др.
При многочисленных серийных пассажах вируса происходит накопление случайных мутаций.
В основе изменчивости вируса лежат мутации, т. е. изменения состава и последовательностей нуклеотидов вирусного генома.
Исследователь, используя различные методы селекции, отбирает штаммы по признаку утраты вирулентности (к естественно восприимчивому животному) при сохранении иммуногенности. Это очень длительная, кропотливая работа, которая не всегда может быть успешной;
2) селекции природно-ослабленных штаммов вирусов при атипично или латентно протекающих инфекциях. Так были выделены вакцинные штаммы вируса болезни Ньюкасла В1, Н, Ф, Ла Сота, Бор-74 (ВГНКИ), аттенуированные штаммы ротавирусов человека;
3) использование гетеротипичных антигеннородственных апатогенных штаммов в качестве живых вакцин. Например, вирус оспы голубей создает иммунитет против оспы кур; вирус герпеса индеек защищает кур от болезни Марека; вирус фиброматоза создает у кроликов иммунитет от миксоматоза; вирус кори человека в состоянии защитить щенков от чумы плотоядных;
Первые успехи в аттенуации вирусов с использованием методов генной инженерии достигнуты в опытах с ДНК-содержащими вирусами животных. Делеционные мутанты по тимидинкиназе получены у вируса инфекционного ринотрахеита крупного рогатого скота и вируса болезни Ауески. Так, мутанты вируса инфекционного ринотрахеита вследствие делении в гене тимидинкиназы не способны кодировать синтез этого фермента в клетках инфицированного организма. Нарушение этой функции генома вируса сопровождается его аттенуацией при сохранении антигенных свойств.
Основное требование к живым вакцинам на основе делеционных мутантов вирусов — их выраженная репликация in vitro и in vivo с тем, чтобы производство вакцин было экономически выгодным, а применение достаточно эффективным.
Любой вакцинный штамм должен быть хорошо изучен, клонирован, паспортизирован и комиссионно сдан во Всероссийский государственный научно-исследовательский институт контроля, стандартизации и сертификации ветеринарных препаратов, где он хранится, поддерживается и контролируется.
Так как свойства вакцины определяются вакцинным штаммом, то к ним предъявляются следующие основные требования:
генетическая стабильность — способность сохранять свои свойства в различных условиях пассирования на восприимчивых животных, в системе культивирования, хранения и т. д., т. е. штамм не должен подвергаться реверсии (возврату в исходное состояние);
При идеальном исходе аттенуации вирус должен практически утрачивать способность поражать клетки-мишени, но сохранять способность размножаться в других клетках, обеспечивая создание выраженного и напряженного иммунитета при минимальной реактогенности и полной безопасности.
Живые вакцины обладают рядом существенных преимуществ перед инактивированными вакцинами:
1) создают высокую напряженность и длительность иммунитета (более чем на 1 год, иногда на всю жизнь), так как в организме вакцинные штаммы размножаются, вызывая развитие вакцинной реакции, сходной с естественным постинфекционным процессом, происходит активация всех компонентов иммунной системы, стимулируется общий (системный) и местный ответ;
2) требуются малые прививочные дозы и для большинства из них однократное введение;
3) возможное применение их не только подкожно, внутримышечно, но и перорально, интраназально и аэрозольно;
4) иммунитет вырабатывается в более короткий срок, на первых этапах обычно за счет интерферона, а затем уже — накопления вируснейтрализирующих антител;
5) технология и экономичность изготовления их превосходят создание инактивированных вакцин.
Несмотря на преимущества живых вакцин по некоторым позициям, у них есть недостатки:
1) иногда возможны поствакцинальные осложнения у молодых, ослабленных и беременных животных;
2) возможно, хотя и в редких случаях, внесение в организм животных контаминантов (латентных вирусов, микроорганизмов), загрязняющих вакцины. Например, культуры клеток из тканей крупного рогатого скота нередко инфицированы аденовирусами, вирусами диареи, парагриппа-3; куриные эмбрионы — вирусами лейкозно-саркоматозного комплекса, аденовирусами, микоплазмами; культуры клеток свиного происхождения — парвовирусами, классической чумы свиней. Неконтролируемое попадание посторонних агентов в вакцину может привести к серьезным последствиям;
3) возможна реверсия вакцинного штамма;
4) живые вакцинные штаммы весьма чувствительны к неблагоприятным факторам, возникающим при производстве, хранении, транспортировке и применении;
5) нужен довольно длительный срок для получения аттенуированных вакцинных штаммов.
Генетический механизм аттенуации недостаточно изучен. Это обстоятельство не дает возможности предложить единое правило получения вакцинных штаммов. Несмотря на попытки многих исследователей, до сих пор не получено аттенуированных вакцинных штаммов вирусов ящура, инфекционной анемии лошадей и др.
Живые вакцины широко применяют в основном для животных на откорме и не рекомендуются в репродуктивных стадах. Готовят их на биофабриках, биокомбинатах или других предприятиях по производству биопрепаратов, которые получают вакцинные штаммы из Всероссийского государственного научно-исследовательского института контроля, стандартизации и сертификации ветеринарных препаратов.
Таким образом, технология изготовления живых вакцин сводится к культивированию вакцинного штамма в какой-либо биологической системе (животные, эмбрионы птиц, культуры тканей и клеток); определению концентрации вируса (его титра) в вируссодержащем материале; контролю на стерильность (отсутствие посторонних контаминантов); фасовке и лиофилизации (перед лиофилизацией для сохранения биологической активности вируса добавляют стабилизирующие вещества). Затем вакцины проходят контроль на стерильность, биологическую активность, реактогенность, безвредность, антигенную и иммуногенную активности. Если вакцина отвечает всем установленным показателям, ее этикетируют и выпускают для применения.
Живую вакцину обычно называют вирусвакциной. Анализ данных применения живых вакцин свидетельствует о достаточно высокой эффективности многих из них, например, таких, как вакцины против чумы крупного рогатого скота, чумы плотоядных, болезни Ньюкасла и др.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.

Живые вакцины представляют собой взвесь вакцинных штаммов микроорганизмов (бактерий, вирусов, риккетсий), выращенных на различных питательных субстратах. Живые вакцины содержат ослабленные бактерии (бруцеллезная, туляремийная, чумная, антиязвенная, туберкулезная) или вирусы (против натуральной оспы, желтой лихорадки, бешенства, полиомиелита, гриппа, кори, эпидемического паротита). 
Вакцины готовятся на основе апатогенных возбудителей, аттенуированных в искусственных или естественных условиях. Вакцинные штаммы, применяемые в производстве живых вакцин, получают разными путями: путем выделения аттенуированных мутантов от больных, селекцией из внешней среды вакцинных клонов, длительного пассирования в организме экспериментальных животных.
Наряду с генетически закрепленной утратой патогенных свойств и потерей способности вызывать у человека инфекционное заболевание, вакцинные штаммы сохраняют способность размножаться в месте введения, а в дальнейшем в регионарных лимфатических узлах и внутренних органах. Вакцинная инфекция продолжается несколько недель, не сопровождается клинической картиной заболевания и приводит к формированию иммунитета к патогенным штаммам микроорганизмов. Лишь в единичных случаях могут возникать вакцинно-ассоциированные заболевания.
Живые вакцины создают прочный и длительный иммунитет, по напряженности приближающийся к постинфекционному иммунитету. Так, противооспенная и туляремийная вакцины обеспечивают 5-7-летний иммунитет, противогриппозная – 6-8-месячный. Для создания прочного иммунитета во многих случаях достаточно одной инъекции вакцины. Такие вакцины могут вводиться в организм достаточно простым методом, например, скарификационным или пероральным методом.
Недостатки живых вакцин
К сожалению, живые вакцины имеют ряд недостатков:
- сложно комбинируются и плохо дозируются;
- обладают высокой реактогенностью и аллергогенностью;
- категорически противопоказаны людям, страдающим иммунодефицитом;
- вызывают вакциноассоциированные заболевания, в т.ч. генерализацию вакцинного процесса;
- относительно нестабильны;
- в процессе производства, транспортировки, хранения и применения необходимо строго соблюдать меры, предохраняющие микроорганизмы от отмирания и гарантирующие сохранение активности препаратов (холодовая цепь);
- естественно циркулирующий дикий вирус может тормозить репликацию вакцинного вируса и снизить эффективность вакцины. Так, например, это отмечалось в отношении вакцинных штаммов полиовируса, размножение которого может подавляться при инфицировании другими энтеровирусами.
Форма выпуска живых вакцин
Живые вакцины, за исключением полиомиелитной, выпускают в лиофилизированном виде, что обеспечивает их стабильность в течение срока годности.
В живых вакцинах нет консервантов и других ингибиторов роста и развития вакцинных штаммов, при работе с такими вакцинами следует строго соблюдать правила асептики. Нарушение целостности ампул и потеря вакуума приводит к инактивации препарата в связи с проникновением воздуха и влаги. При наличии в ампулах трещин и изменении внешнего вида содержимого следует изъять такие ампулы и уничтожить их.
Правила перевозки живых вакцин
В связи с тем, что действующим началом вакцин являются живые микроорганизмы, следует строго соблюдать требования, обеспечивающие сохранение жизнеспособности микроорганизмов и специфической активности препарата. Живые вакцины следует хранить и транспортировать при температуре в интервале 0…+ 8С. Замораживание таких вакцин не оказывает существенного влияния на их активность. Оптимальная температура при замораживании – 20С.
Живые вирусные вакцины — это, как правило, искусственно ослабленные посредством культивирования или природные авирулентные либо слабовирулентные иммуногенные штаммы вируса, которые, размножаясь в естественно восприимчивом организме, не проявляют повышения вирулентности и потеряли способность к горизонтальной передаче.
Безопасные высокоиммуногенные живые вакцины являются лучшими из всех существующих вирусных вакцин. Применение многих из них дало блестящие результаты в борьбе с наиболее опасными вирусными болезнями человека и животных. В основе эффективности живых вакцин лежит имитация субклинической инфекции. Живые вакцины вызывают иммунный ответ на каждый протективный антиген вируса.
Основным преимуществом живых вакцин считается активизация всех звеньев иммунной системы, вызывающая сбалансированный иммунный ответ (системный и локальный, иммуноглобулиновый и клеточный). Это имеет особое значение при тех инфекциях, когда клеточный иммунитет играет важную роль, а также при инфекциях слизистых оболочек, где требуется как системный, так и локальный иммунитет. Местное применение живых вакцин обычно является более эффективным для стимулирования локального ответа у непраймированных хозяев, чем инактивированные вакцины, вводимые парентерально.
В идеале, вакцинация должна повторять иммунологические стимулы естественной инфекции, сводя до минимума нежелательные эффекты. Она должна вызывать напряженный продолжительный иммунитет при введении в небольшой дозе. Ее введение, как правило, не должно сопровождаться слабой, кратковременной общей и местной реакцией. Хотя после введения живой вакцины иногда допускается развитие у небольшой части реципиентов отдельных слабовыраженных клинических признаков, напоминающих легкое течение естественной болезни. Живые вакцины больше, чем другие, отвечают этим требованиям и, кроме того, отличаются низкой стоимостью и простотой применения разными способами.
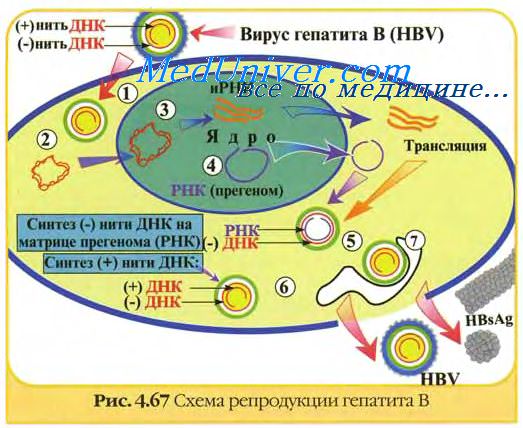
Вакцинные вирусные штаммы должны обладать генетической и фенотипической стабильностью. Их приживляемость в привитом организме должна быть выраженной, а способность к размножению ограниченной. Вакцинные штаммы обладают значительно менее выраженной инвазивностью, чем их вирулентные предшественники. Это связано в значительной мере с их частично ограниченной репликацией в месте проникновения и в органах-мишенях естественного хозяина. Репликация вакцинных штаммов в организме легче ограничивается естественными неспецифическими защитными механизмами. Вакцинные штаммы размножаются в привитом организме до тех пор, пока его защитные механизмы не затормозят их развитие.
В течение этого времени образуется такое количество антигена, которое значительно превышает его при введении с инактивированной вакциной.
Для аттенуации вирусов обычно применяют пассажи вируса в неестественном хозяине или культуре клеток, пассажи при пониженной температуре и мутагенез с последующей селекцией мутантов с измененным фенотипом.
Большинство современных живых вакцин, используемых для профилактики инфекционных болезней человека и животных, получены пассажами вирулентного вируса в гетерологичном хозяине (животные, куриные эмбрионы, различные клеточные культуры). Аттенуированные в чужеродном организме вирусы приобретают множественные мутации в геноме, препятствующие реверсии вирулентных свойств.
В настоящее время в практике широко применяют живые вакцины против многих вирусных заболеваний человека (полиомиелит, желтая лихорадка, грипп, корь, краснуха, паротит и др.) и животных (чума крупного рогатого скота, свиней, плотоядных, бешенство, герпес-, пикорна-, коронавирусные и другие болезни). Однако еще не удалось получить эффективных вакцин против ряда вирусных болезней человека (СПИД, парагрипп, респираторно-синциальная инфекция, денгевирусная инфекция и другие) и животных (африканская чума свиней, инфекционная анемия лошадей и другие).
Имеется много примеров тому, что традиционные методы аттенуации вирусов еще не исчерпали своих возможностей и продолжают играть существенную роль в разработке живых вакцин. Однако их значение постепенно уменьшается по мере увеличения масштабов использования новой технологии конструирования вакцинных штаммов. Несмотря на значительный прогресс в этой области, принципы получения живых вирусных вакцин, заложенные Л. Пастером, до сих пор не потеряли своей актуальности.
Список сертификатов
- Номер сертификата и наименование продукции Изготовитель Зарег-ан
- № РОСС RU С-NL.СС07.В.00260/19
Вакцины вирусные профилактические живые Интервет Интернешнл Б.В. 28 Ноя
2019 - № РОСС RU С-ES.СС07.В.00265/19
Вакцины вирусные профилактические живые Зоэтис Мануфактуринг энд Ресерч Спейн, Эс. Эл 28 Ноя
2019 - № РОСС RU С-ES.СС07.В.00253/19
ЭВАНТ вакцина против кокцидиоза птиц живая с разбавителем - лекарственный препарат в форме суспензии для применения методом крупнодисперсного распыления - вакцина; раствора для подготовки суспензии . Лабораториос Хипра С.А. / Laboratorios Hipra, S.A. 28 Ноя
2019 - № РОСС RU С-BE.СС07.В.00264/19
Вакцины вирусные профилактические живые Зоэтис Бельджиум Эс.Эй. 28 Ноя
2019 - № РОСС RU С-RU.СС07.В.00250/19
"Оралрабивак" вирусвакцина для оральной иммунизации диких плотоядных животных против бешенства - лекарственный препарат в форме суспензии для перорального применения, заключенной в брикет-приманку (живая вакцина) ФКП ЩЕЛКОВСКИЙ БИОКОМБИНАТ 26 Ноя
2019 - № РОСС RU С-HU.СС07.В.00249/19
"АУФИЛ® Плюс" вакцина против болезни Ауески свиней живая с разбавителем - лекарственный препарат в форме лиофилизата для приготовления эмульсии для инъекций (вакцина), эмульсии для инъекций . Сева-Филаксия Ветеринари Биолоджикалз Компани 26 Ноя
2019 - № РОСС RU С-RU.СС07.В.00246/19
МУЛЬТИКАН-8 вакцина против чумы, аденовирусных инфекций, парвовирусного, коронавирусного энтеритов, лептоспироза и бешенства собак - лекарственный препарат в форме: сухой компонент - лиофилизат для приготовления суспензии . ВЕТБИОХИМ 25 Ноя
2019 - № РОСС RU С-RU.СС07.В.00245/19
МУЛЬТИКАН-6 вакцина против чумы, аденовирусных инфекций, парвовирусного, коронавирусного энтеритов и лептоспироза собак - лекарственный препарат в форме: сухой компонент - лиофилизат для приготовления суспензии для . ВЕТБИОХИМ 25 Ноя
2019 - № РОСС RU С-BE.СС07.В.00247/19
Вакцины вирусные профилактические живые Зоэтис Бельджиум Эс.Эй. 25 Ноя
2019 - № РОСС RU С-US.СС07.А.00244/19
Вакцина Г.Е. ВАК - вакцина против геморрагического энтерита индеек - лекарственный препарат в форме замороженной суспензии для профилактики геморрагического энтерита индеек в благополучных и неблагополучных . Арко Лабораториз, ЛТД 22 Ноя
2019 - № РОСС RU С-ES.СС07.В.00241/19
Вакцины вирусные профилактические живые Laboratorios Hipra, S.A./ Лабораториос Хипра С.А. 21 Ноя
2019 - № РОСС RU С-ES.СС07.В.00235/19
вакцины вирусные профилактические живые Зоэтис Мануфактуринг энд Ресерч Спейн, Эс. Эл 14 Ноя
2019 - № РОСС RU С-RU.СС07.В.00234/19
Дипентавак вакцина против бешенства, чумы плотоядных, парвовирусного энтерита, инфекционного гепатита, аденовироза и лептоспироза собак - лекарственный препарат в форме: сухого компонента "Дивак" лиофилизата для приготовления . ФИРМА НПВИЗЦ ВЕТЗВЕРОЦЕНТР 08 Ноя
2019 - № РОСС RU С-RU.СС07.В.00233/19
Гексаканивак вакцина против чумы плотоядных, парвовирусного энтерита, инфекционного гепатита, аденовироза и лептоспироза собак - лекарственный препарат в форме: сухого компонента лиофилизата для приготовления суспензии для . ФИРМА НПВИЗЦ ВЕТЗВЕРОЦЕНТР 08 Ноя
2019 - № РОСС RU С-ES.СС07.В.00230/19
вакцины вирусные профилактические живые Зоэтис Мануфактуринг энд Ресерч Спейн, Эс. Эл 31 Окт
2019 - № РОСС RU С-ES.СС07.В.00228/19
вакцины вирусные профилактические живые Зоэтис Мануфактуринг энд Ресерч Спейн, Эс. Эл 24 Окт
2019 - № РОСС RU С-IL.СС07.А.00227/19
Вир-117 ИБ (Vir-117 IB) живая лиофилизированная вакцина для профилактики инфекционного бронхита кур - лекарственный препарат в форме лиофилизата для приготовления раствора Биовак ЛТД / Biovac LTD 23 Окт
2019 - № РОСС RU С-RU.СС07.В.00226/19
МУЛЬТИКАН-4 - вакцина против чумы, аденовирусных инфекций, парвовирусного и коронавирусного энтеритов собак - лекарственный препарат в форме: сухой компонент - лиофилизат для приготовления раствора для . ВЕТБИОХИМ 22 Окт
2019 - № РОСС RU С-US.СС07.А.00222/19
вакцины вирусные профилактические живые Зоэтис Инк. 14 Окт
2019 - № РОСС RU С-US.СС07.В.00218/19
"ВЕКТОРМУН FP-LT" вакцина против оспы и инфекционного ларинготрахеита птиц живая векторная с разбавителем - лекарственный препарат в форме лиофилизата для приготовления раствора для инъекций - . Биомун Компани 11 Окт
2019 - № РОСС RU С-RU.СС07.В.00220/19
Вакцины вирусные профилактические живые ФКП КУРСКАЯ БИОФАБРИКА 11 Окт
2019 - № РОСС RU С-IL.СС07.В.00213/19
Би АйПиВи - вакцина против метапневмовирусной инфекции птиц живая сухая - лекарственный препарат в форме лиофилизата для приготовления суспензии для интраназального/окулярного применения, методами крупнокапельного распыления . АБИК Биологические Лаборатории Лтд. 23 Сен
2019 - № РОСС RU С-BR.СС07.А.00212/19
вакцины вирусные профилактические живые Зоэтис Индастриа де Продутос Ветеринариос Лтда. 23 Сен
2019 - № РОСС RU С-IL.СС07.В.00209/19
ТАБИК IBVAR2-06 вакцина против инфекционного бронхита кур живая сухая - лекарственный препарат в форме таблетки АБИК Биологические Лаборатории Лтд. 16 Сен
2019 - № РОСС RU С-FR.СС07.В.00203/19
Акипор 6.3 - вакцина против болезни Ауески с растворителем - лекарственный препарат в форме лиофилизата для приготовления эмульсии для инъекций (живая вакцина), эмульсии для инъекций . Мериал 29 Авг
2019 - № РОСС RU С-ES.СС07.В.00202/19
ХИПРАБОВИС IBR MARKER LIVE вакцина против инфекционного ринотрахеита крупного рогатого скота живая, маркированная с разбавителем - лекарственный препарат в форме лиофилизата для приготовления суспензии для . Laboratorios Hipra, S.A./ Лабораториос Хипра С.А. 26 Авг
2019 - № РОСС RU С-IL.СС07.В.00199/19
вакцины вирусные профилактические живые АБИК Биологические Лаборатории Лтд. 23 Авг
2019 - № РОСС RU С-HU.СС07.В.00198/19
ВЕКТОРМУН® ND вакцина против болезней Ньюкасла и Марека живая замороженная векторная с разбавителем - лекарственный препарат в форме замороженной суспензии (вакцина) и раствора для инъекций . Сева-Филаксия Ветеринари Биолоджикалз Компани 23 Авг
2019 - № РОСС RU С-NL.СС07.В.00197/19
вакцины вирусные профилактические живые Интервет Интернешнл Б.В. 19 Авг
2019 - № РОСС RU С-NL.СС07.В.00189/19
Вакцины вирусные профилактические живые Интервет Интернешнл Б.В. 02 Авг
2019 - № РОСС RU С-NL.СС07.В.00187/19
Вакцины вирусные профилактические живые Интервет Интернешнл Б.В. 31 Июл
2019 - № РОСС RU С-NL.СС07.В.00186/19
Вакцины вирусные профилактические живые Интервет Интернешнл Б.В. 31 Июл
2019 - № РОСС RU С-US.СС07.А.00185/19
вакцины вирусные живые профилактические Зоэтис Инк. 30 Июл
2019 - № РОСС RU С-FR.СС07.В.00184/19
Акипор 6.3 - вакцина против болезни Ауески с растворителем - лекарственный препарат в форме лиофилизата для приготовления эмульсии для инъекций (живая вакцина), эмульсии для инъекций . Мериал 29 Июл
2019 - № РОСС RU С-US.СС07.А.00183/19
Бурсин Плюс - вакцина против инфекционной бурсальной болезни живая лиофилизированная – лекарственный препарат в форме лиофилизата для приготовления раствора для применения методом выпаивания Зоэтис Инк. 25 Июл
2019 - № РОСС RU С-NL.СС07.В.00181/19
Нобилис® Reo 1133 – вакцина против реовирусной инфекции птиц живая сухая Интервет Интернешнл Б.В. 25 Июл
2019 - № РОСС RU С-FR.СС07.В.00182/19
Акипор 6.3 вакцина против болезни Ауески с растворителем - лекарственный препарат в форме лиофилизата для приготовления эмульсии для инъекций (живая вакцина), эмульсии для инъекций (растворитель) Мериал 25 Июл
2019 - № РОСС RU С-RU.СС07.В.00179/19
Вирусвакцина сухая культуральная ВНИВИП против вирусного энтерита гусей - лекарственный препарат в форме лиофилизата для приготовления раствора для подкожного и внутримышечного применения ФНЦ ВНИТИП РАН 24 Июл
2019 - № РОСС RU С-NL.СС07.В.00178/19
Вакцины вирусные профилактические живые Интервет Интернешнл Б.В. 24 Июл
2019 - № РОСС RU С-NL.СС07.В.00177/19
Вакцины вирусные профилактические живые Интервет Интернешнл Б.В. 24 Июл
2019
Топ компаний по количеству сертификатов
Список компаний, которые чаще встречаются в сертификатах с этой группой продукции
Вакцины для людей и домашних животных загрязнены ретровирусами
Автор – Sayer Ji
Исследования показывают, что ретровирусы загрязняют мировые запасы вакцин для домашних животных и людей
Могут ли рост заболеваемости домашних животных и растущая многомиллиардная ветеринарная промышленность иметь отношение к иммунокомпрометирующей роли вакцин, зараженных ретровирусами кошек, которые получают миллионы животных по всему миру?
Весьма тревожащее исследование, опубликованное в журнале “Biologicals” под названием “Эндогенные ретровирусы как потенциальные риски для вакцин “, показало, что процессы производства вакцин для животных практически не гарантируют защиты от загрязнения скрытыми ретровирусами, которые присутствуют в основном семенном фонде клеток, используемых для их производства. Как изложено в исследовании:
Многие живые ослабленные вакцины для животных производятся с использованием клеточных линий животных, которые, как известно, производят инфекционные [эндогенные ретровирусы] ERV; однако риски заражения ERV от чужеродных видов посредством вакцинации игнорируются, а это может способствовать и вызывать серьезные заболевания, такие как рак в подвергшихся данному воздействию популяциях.
В частности, в исследовании рассматривалась вероятность заражения ветеринарных вакцин кошачьим вирусом, ассоциированным с лейкемией у кошек. Учитывая тот факт, что лейкемия кошек является первичным раком, диагностируемым у кошек, новое исследование может дать ключ к пониманию того, почему наши домашние животные подвержены этой современной эпидемии.

Статья “Эндогенные ретровирусы как потенциальные риски для вакцин” из журнала “Biologicals”
Наш примитивный процесс изготовления вакцины
Современный процесс производства вакцин, как ветеринарных, так и для человека, всё ещё зависит от использования живых человеческих и животных клеток (диплоидных, эмбриональных) в качестве основного семенного материала. В действительности многие из этих производственных процессов были разработаны задолго до открытия обратной транскриптазы (1970) и химической структуры ДНК (1953), что делает истинные риски использования живых клеток, загрязнённых ДНК и ретровирусами, непостижимыми для того времени (а это означает неизменное введение чужеродной животной ДНК в соматические и зародышевые клетки хозяина). В то время как так называемые капсидные (или поверхностного антигена) методы и генетически модифицированные вакцины (которые не содержат живых клеточных компонентов) в настоящее время заменяют более старые методы, очевидно (молчаливо признавая проблемы безопасности, связанные с живыми клеточными методами), современный график прививок Центров по контролю и профилактике заболеваний США (CDC) всё ещё содержит клеточные вакцины (включая линии человеческих эмбриональных клеток). А рынок ветеринарных вакцин почти полностью основан на животных клетках.
Учитывая широкое использование этих клеток, бросается в глаза то, как мало внимания уделяется их заражённости эндогенными ретровирусами. Это может быть связано с тем, что первоначальные вакцины против полиомиелита были заражены потенциально канцерогенным обезьяньим ретровирусом, известным как вирус обезьян 40 или SV-40 – весьма спорная тема, которую мы исследуем в нашем предыдущем исследовании: “Что на самом деле вызвало эпидемию СПИДа?” Более того, исследования показывают, что вакцина Ротатек содержит не один, а два обезьяньих ретровируса пока неизвестного происхождения и патогенности. Это вдобавок к уже хорошо охарактеризованному свиному цирковирусу, обнаруженному в них в 2011 году. Тем не менее, по-прежнему недостаточно, если вообще проводится какой-либо надзор или исследование того, каковы их непредусмотренные, неблагоприятные последствия для здоровья. Как обсуждалось в недавней статье Джуди Миковиц, озаглавленной “Ретровирусы: плохо изученные проводники изменений”.
В качестве всего лишь одного примера среди сотен ретровирусных заражений вакцин, взгляните на историю ротавирусной вакцины. В 2010 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) созвало группу экспертов для проведения проверки полученных сведений о том, что ротавирусные вакцины, проставляемые младенцам в США, Rotateq, производимые Merck Pharmaceuticals и Rotarix, производимые Glaxo Smith Kline, заражены вирусами свиней. Rotarix, перорально вводимая ротавирусная вакцина, содержала нуклеиновые кислоты от цирковируса свиней-1 (PCV1) и RotaTeq, как было показано, содержит нуклеиновые кислоты от PCV1 и PCV2, патогена свиней, который связан с истощением и иммунодефицитом. Признавая, что хотя все краткосрочные и долгосрочные риски, связанные с цирковирусами свиней PCV1 и PCV2, пока неизвестны, консультативная группа решила, что “преимущества вакцины превосходят её риски.
Как вакцины оказались заражены ретровирусами?
Геномная инфраструктура млекопитающих содержит большое количество ретровирусных последовательностей (
8% их ДНК ретровирусны по происхождению), возникших из древних ретровирусных инфекций, которые включились в зародышевые линии вида и которые стали доброкачественными или, по крайней мере, полностью подавленными (неактивными) компонентами нашей ДНК в течение сотен тысяч лет эволюции (процесс, известный как эндогенизация). Ретровирусы, как правило, безвредны и могут рассматриваться как попутчики в геноме и микробиоме человека.
Однако эти” спящие” ретровирусные последовательности могут снова стать активными и потенциально вредоносными при воздействии на клетки других видов и когда имеет место перекрещивание – или “инфекция чужеродного вида” – и тогда они занимают и заражают другой вид. В этот момент такие “воскресшие” ретровирусные последовательности могут привести к нарушению иммунной функции, а также способствовать доброкачественным поражениям и возникновению злокачественного рака (подробнее об этом ниже в обсуждении вируса кошек).
Как может произойти такое перекрещивание?
Как процесс производства, так и введение вакцин, содержащих клеточные компоненты из видов, которые вводятся различным другим видам, создает прекрасную возможность для такого события. В исследовании упоминается о такой возможности:
Многие живые аттенуированные (ослабленные) вакцины для животных производятся с использованием клеточных линий животных, которые, как известно, продуцируют инфекционные [эндогенные ретровирусы] ERV; однако риски заражения ERV от чужеродных видов посредством вакцинации игнорируются. В этом кратком обзоре дается обзор ERV у кошек, потенциальных рисков заражения ERV при вакцинации, биологических характеристик вируса RD-114 (кошачий ERV), который, возможно, загрязняет вакцины для домашних животных, и методов обнаружения инфекционного вируса RD-114.
Как мы впервые пришли к пониманию опасности заражения ERV чужого вида?
В исследовании упоминается классический пример опасности ERV, а именно вред, причиняемый ксенотрансплантацией органов или тканей свиньи человеку:
“Технические инновации в области животноводства позволяют нам разрабатывать генетически модифицированных свиней с целью ксенотрансплантации свиных органов или тканей человеку; однако cвиньи имеют репликативно-компетентные ERV, называемые свиными ERV (PERV) [17]. Открытие PERV, способных инфицировать человеческие клетки, повлекло за собой половину всех клинических испытаний ксенотрансплантации, и риски PERV при ксенотрансплантации были тщательно исследованы”.
Другими историческими примерами инфекционных заболеваний, о которых упоминалось выше, являются:
- ERV привнесённые от мышей АКР индуцируют лимфому у своих хозяев. (Примеч.пер. – линия подопытных мышей АКР отличается высокой частотой опухолей лимфатической ткани)
- ERV от азиатских грызунов заражали обезьян гиббона и вызывали лимфому.
- Ретровирус появился у коал в Австралии около двухсот лет назад и эндогенизировался. Вирус, названный ретровирусом коалы, вызывает неопластические заболевания и подавление иммунитета у нового хозяина.
- У людей недавно был обнаружен новый гаммаретровирус у пациентов с раком предстательной железы. Этот вирус был генетически тесно связанной с вирусом ксенотропного вируса мышиной лейкемии (X-MLV) и обозначается как вирус лейкоза мышей ксенотропного вируса мышиной лейкемии (XMRV).
Дополнительные примеры таковы:
В области ветеринарии, по крайней мере, мыши, свиньи, кошки и куры имеют инфекционные эндогенные ретровирусы (ERV). Многие живые ослабленные вакцины для животных производятся с использованием клеточных линий этих животных. Кроме того, несколько живых аттенуированных вакцин производятся с использованием клеток, которые, как известно, вызывают инфекционные ERV; однако риски заражения ERV от чужеродных видов игнорировались.

Вероятные риски заражения живых ослабленных вакцин вирусами RD-114. Определённые кошачьи клеточные линии производят вирусы RD-114. Если эти клетки будут использованы для производства кошачьих или собачьих вакцин, произойдёт заражение инфекционными агентами вирусов RD-114. Вне инструкции такие заражённые вакцины могут быть применены в отношении экзотических животных.
Кот из мешка
Затем исследование было сосредоточено на кошачьих ERV, из которых было выявлено несколько:
“В геноме кошки присутствуют по меньшей мере два ERV: эндогенный вирус FeLV и вирус RD-114. В дополнение к этим ERV были зарегистрированы еще два ERV”.
Вирус RD-114 вызывает особую озабоченность, поскольку он обнаружен в широком спектре вакцин для собак, а также в вакцинах, используемых” вне рецепта” в зоопарках для разных экзотических животных, и, конечно же, способен повторно заражать кошек при введении им таких препаратов.
Важно отметить, что так называемый “кошачий” вирус RD-114 был впервые выделен из линии опухолевых клеток человека, которая была “передана”, или предварительно обнаружена, от эмбрионов кошек. Предположительно, эмбриональные клетки кошки содержали провирус RD-144, который при воздействии на опухолевые клетки человека давал им возможность “пересечься”, то есть стать ксенотропными. Учитывая близость человека к одомашненным кошкам или таким животным, как собаки, которые в настоящее время вакцинированы и предположительно инфицированы вирусом RD-114, существует явный риск для здоровья человека, поскольку прецедент его специфической инфицированности был установлен с момента обнаружения вируса:
“RD-114 был впервые выделен из линии опухолевых клеток человека (клетки RD), полученных из рабдомиосаркомы человека после прохождения через эмбрионов кошек, и считается ксенотропным, т. е. результативного заражения клеток кошек вирусом RD-114 не происходит. Однако известно, что вирус RD-114 заражает несколько клеточных линий кошек [1,4] в дополнение к клеточным линиям от чужеродных видов, таких как люди и собаки; поэтому вирус RD-114 политропен, но не является строго ксенотропным “in vitro”. В клеточных линиях человека вирус RD-114 взаимодействует с BaEV, ретровирусами обезьян 1, 2, 3, 4 и 5 (бетаретровирусами приматов), вирусом ретикулоэндотелиоза птиц и вирусом некроза селезенки уток; поэтому считается, что эти ретровирусы задействуют один и тот же рецептор в клетках человека. В 1999 году две группы независимо идентифицировали рецептор для этой большой группы интерференции вирусов”.
Затем исследователи обратились к проблеме с “потенциальным заражением вакцин для домашних животных вирусом RD-114″, заявив, что единственный способ устранить проблему – это исключить из процесса производства вакцины все клетки, не являющиеся кошачьими. Исследователи пришли к выводу, что:
Пока клетки кошек используются для производства вакцин, существует риск заражения инфекционным вирус RD-114 живых аттенуированных вакцин. Поскольку вирус RD-114 продуктивно заражает клетки кошек и собак, вирус может заражать этих животных “in vivo”. Поскольку некоторые ERV заражают новые виды хозяев и вызывают заболевания, следует пересмотреть потенциальные риски заражения ERV у людей и животных. Недавно мы разработали чувствительную систему анализа, пробу LacZ marker rescue (LMR), для обнаружения инфекционного вируса RD-114. В настоящее время мы исследуем наличие инфекционного вируса RD-114 в продаваемых живых ослабленных вакцинах для домашних животных.
Действительно, другое исследование 2010 года, опубликованное в Журнале Клинической Микробиологии, показало, что инфекционный эндогенный ретровирус кошек, или то, что они назвали вирусом, связанным с RD-114, заражает около трети из 25 доступных в продаже протестированных вакцин (3 для собак и 5 для кошек). Авторы пришли к выводу, что:
В заключение следует отметить, что при оценке чистоты живых аттенуированных ветеринарных вакцин необходимо учитывать наличие инфекционных ERV. Методы, используемые в настоящее время для скрининга ветеринарных вакцин на ретровирусы, нуждаются в переоценке.
ERV заражают не только кошек, но и собак, а также людей
Исследования изучали потенциал кошачьих ERV в плане “прыжка” через видовой барьер к людям, и результаты, хотя и неубедительные, такой возможности не исключают. Считается, что совместное проживание может привести к межвидовому инфицированию между домашними животными, вредителями и людьми, что теоретически объясняет присутствие вируса опухоли молочной железы мыши при злокачественном раке молочной железы у человека [5]. Хотя я думаю, что это в равной мере правдоподобное объяснение как-то, что событие перекрещивания MMTV между мышами и людьми может быть связано с лабораторными условиями, вакциной, или биологическим заражением лекарственных препаратов.”
Действительно, проблема заражения вакцин, как и других биологических препаратов, широко распространена.
В другом исследовании 2013 года исследователи упоминают результаты, полученные британскими и японскими исследователями, которые подтвердили присутствие кошачьего ERV как в кошачьих, так и в собачьих вакцинах:
Недавно японские и британские исследовательские группы обнаружили, что некоторые вакцины для кошек и собак действительно были заражены инфекционным вирусом RD-114. Это был первый случай заражения “инфекционными” ERV в живых аттенуированных вакцинах. Вирус RD-114 эффективно размножается в клеточных линиях собак и первичных клетках. Таким образом, возможно, что вирус RD-114 заражает собак после прививки зараженными вакцинами и индуцирует пролиферативные заболевания и подавление иммунитета, если он адаптируется к эффективному росту у собак. В данном обзоре мы суммируем частоту заражения вирусом RD-114 в живых ослабленных вакцинах и потенциальные риски заражения вирусом RD-114 у собак.
В исследовании также упоминается вероятность присутствия ERV в человеческих вакцинах, таких как MMR:
В предыдущих исследованиях сообщалось, что вакцины MMR (против кори, паротита и краснухи) и вакцины против жёлтой лихорадки, которые были размножены в куриных эмбрионах, были заражены эндогенными вирусами птичьего лейкоза (ALV) и эндогенными ретровирусами птиц (EAVs), которые происходят из субстратов фибробластов куриных эмбрионов.
Правда состоит в том, что любая вакцина, произведенная посредством использования клеток животных, насекомых и даже растений, несёт в себе риск скрытого вирусного заражения эндогенными ретровирусами. Тот факт, что современные производственные процессы вакцинации были разработаны до открытия обратной транскриптазы, помогает объяснить, как такое серьёзное упущение и недопонимание ретровирусной контаминации действует сегодня в рамках глобальной повестки дня в вопросах вакцинации. Проблемы безопасности, которые не могли быть предвидены на относительно примитивном уровне научного познания, на котором находились основатели современной вакцинологии и иммунологии, продолжают преследовать тех, кто даёт и получает программы вакцинации. К счастью, исследование, наконец-то, выходит на свет.
Чтобы узнать больше об этом вопросе, послушайте, как Джуди Миковиц обсуждает свою работу на эту тему, прослушав интервью на “Бесстрашном родителе”.
Эпидемия хронических заболеваний во всем мире из-за вакцинации? (открытое . | kla.tv/15391
ПРАВДА О РАКЕ У ДОМАШНИХ ЖИВОТНЫХ. Серия 1
Опасная вакцина. Что колют нашим детям?
Читайте также:


