Выделение вирусов из клетки
Процесс репродукции вируса завершается формированием и освобождением вирионов из клетки. Зрелые вирионы образуются из синтезированных в клетке вирусных компонентов: нуклеиновой кислоты и белков. Как только их концентрация достигнет определенного уровня, начинается процесс самосборки вирионов, в основе которого лежит специфическое узнавание-взаимодействие вирионных компонентов.
В инфицированных клетках вирусные нуклеиновые кислоты и вирусспецифические белки синтезируются в значительно большем количестве, чем включаются в вирусные частицы. Синтез вирусных нуклеиновых кислот и вирусспецифических белков происходит почти одновременно и не менее чем на 1 ч опережает начало созревания вирусных частиц.
Разнообразие структуры вирусов отражается на способе их формирования и выходе из клетки. У просто устроенных вирусов формируются провирионы, которые затем в результате модификаций белков превращаются в вирионы.
Все безоболочечные вирусы позвоночных имеют кубическую симметрию. Структурные белки просто устроенных вирусов связываются спонтанно, образуя капсомеры, которые благодаря самосборке образуют капсиды, в которые упаковывается вирусная нуклеиновая кислота.
В процессе морфогенеза пикорнавирусов образуются различные вирусные структуры с последовательно возрастающими коэффициентами седиментации. Комплектование вириона часто связано с протеолитическим расщеплением одного или более капсидных белков, что хорошо изучено на примере полиовируса и вируса ящура.
Перед образованием зрелых вирионов из трех структурных полипептидов VPO, VP1 и VP3 (по 60 копий каждого) формируется прокапсид. Затем белок VPO расщепляется на два структурных белка (VP2 и VP4), и образуются зрелые частицы пикорнавирусов.
Механизм укладки вирусной нуклеиновой кислоты в переформированный прокапсид был выяснен у аденовирусов. Особый белок, прикрепленный к нуклеотидной последовательности на одном конце вирусной ДНК-известный как упаковывающая последовательность, помогает ДНК входить в прокапсид, прикрепляясь к базовым белкам ядра, после чего некоторые капсидные белки расщепляются и вирион становится зрелым. Большинство безоболочечных вирусов накапливается в цитоплазме или ядре и их можно обнаружить, как внутриклеточные инфекционные вирионы перед освобождением путем цитолиза.
Вирионы могут освобождаться из клетки при ее разрушении в результате лизиса или медленного, контролируемого процесса. По первому типу выходят из клетки вирусы, лишенные оболочки. Второй тип выхода из клетки характерен для оболочечных вирусов.
У оболочечных вирусов сначала формируются нуклеокапсиды, или сердцевины, которые затем покрываются белками наружных оболочек. Вирусы, имеющие оболочку (кроме вирусов оспы и реовирусов), формируются на клеточных мембранах.
Все оболочечные вирусы млекопитающих со спиральным нуклеокапсидом, так же как некоторые вирусы с икосаэдрическим нуклеокапсидом (герпесвирусы, тогавирусы и ретровирусы), созревают при почковании через плазматическую мембрану, через внутреннюю цитоплазматическую мембрану или через мембрану ядра.
Выход этих вирусов из клетки является одновременно и завершающей стадией формирования зрелого вириона. Образование зрелых вирионов у оболочечных вирусов осуществляется при почковании их нуклеопротеинов через модифицированные участки цитоплазматических или ядерных (герпесвирусы) мембран, в которых клеточные белки заменены вирусспедифическими.
Внутриклеточные и внеклеточные (полные) вирионы вируса оспы различаются между собой в антигенном отношении. Вирус выходит из ядра только через те участки мембраны, которые образовались после заражения. Именно этим и объясняется наличие вирусспецифических белков в вирусной оболочке.
Включение вирусных гликопротеинов в липидную двуслойную оболочку зараженной клетки происходит в результате замещения клеточных белков. Вирусные гликопротеины, объединенные в олигомеры, образуют типичные палочкообразные или булавообразные пепломеры с гидрофильными участками, экспонируемые над наружной поверхностью мембраны, а гидрофобный трансмембранный якорный домен и короткий гидрофильный цитоплазматический домен проецируется слабо в цитоплазме. В случае с икосаэдрическими вирусами, каждая молекула белка нуклеокапсида соединена непосредственно с цитоплазматическим доменом олигомера мембранного гликопротеина, окружающего нуклеокапсид.
Вирусы со спиральными нуклеокапсидами в большинстве случаев имеют матриксный белок, который прикрепляется к цитоплазматическому участку гликопротеинового пепломера; а противоположным концом к матриксному белку и это инициирует почкование. Освобождение отдельного вириона и массы вирионов не сопровождается образованием бреши в плазматической мембране и ее заметным повреждением. Многие, но не все вирусы, которые почкуются через плазматическую мембрану, являются цитопатогенными и могут быть связаны с персистентной инфекцией.
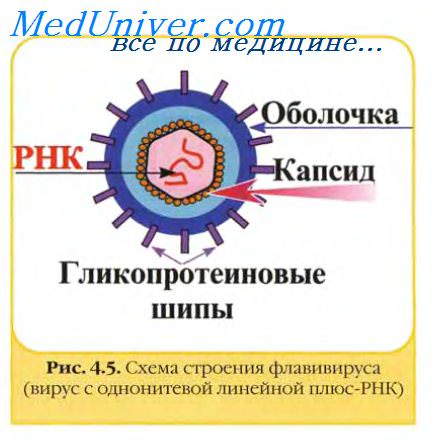
Флавивирусы, коронавирусы, артеривирусы и буньявирусы созревают, почкуясь через мембрану комплекса Гольджи или гладкой эндоплазматической сети; везикулы, содержащие вирус, затем мигрируют к плазматической мембране, с которой они сливаются, освобождая вирионы экзоцитозом. Уникальным для герпесвирусов является то, что их оболочка формируется при почковании через внутренний слой ядерной мембраны. Такие вирионы выходят из клетки через каналы цитоплазматического ретикулума, соединяющие ядерную оболочку с наружной мембраной клетки.
Благодаря такому механизму выделения, эти вирусы могут передаваться от клетки к клетке, несмотря на наличие антител в экстрацеллюлярном пространстве. Таким образом, возможна передача вируса от клетки к клетке без выхода во внешнюю среду.
Особую проблему представляет механизм формирования зрелых вирусных частиц, содержащих несколько различных молекул РНК (ортомиксо-, рео-, бир-на- и аренавирусы). Трудно представить, каким образом из пула нуклеиновых кислот в данный вирион попадает строго определенный комплект молекул РНК. Вероятно, важную роль в отборе нужных молекул играет специфическое взаимодействие нуклеиновой кислоты с определенными структурными белками вирионов.
- Вернуться в оглавление раздела "Микробиология."
Лабораторные исследованияпри проведении идентификации вирусов и диагностике вирусных инфекций включают следующие этапы: выделение, культивирование, индикация (выявление) и идентификация вирусов.
2.3.1 Культивирование вирусов
Вирусы не растут на искусственных питательных средах, а размножаются только внутриклеточно. Крупным достижением было предложение Р. Гудпасчура в 1932 г. использовать для культивирования вирусов куриные эмбрионы. Окончательное решение проблемы культивирования вирусов оказалось возможным лишь после того, как были разработаны основные способы культивирования клеток вне организма.
Использование куриных эмбрионов. Куриные эмбрионы – практически идеальные модели для культивирования некоторых вирусов (например, гриппа и кори). Замкнутая полость эмбриона препятствует проникновению микроорганизмов извне, а также развитию спонтанных вирусных инфекций. Эмбрионы применяют для первичного выделения вирусов из патологического материала; для пассирования и сохранения их, а также для получения необходимых количеств вируса. Некоторые возбудители (например, герпесвирусы) вызывают характерные изменения (по ним можно распознавать заболевание).
Для заражения обычно используют куриные эмбрионы 7–12-дневного возраста. Перед заражением определяют жизнеспособность эмбриона путем овоскопирования (просматривают в проходящем свете). Живые эмбрионы при овоскопировании проявляют двигательную активность, хорошо виден сосудистый рисунок. Простым карандашом очерчивают границы воздушной камеры.
Куриные эмбрионы заражают вируссодержащим материалом в асептических условиях стерильными инструментами, предварительно обработав скорлупу над воздушным пространством йодом и спиртом. Заражение проводят на хорион-аллантоисную оболочку, в амниотическую или аллантоисную полость, либо в желточный мешок (рисунок 29). Выбор метода заражения зависит от биологических свойств вируса.
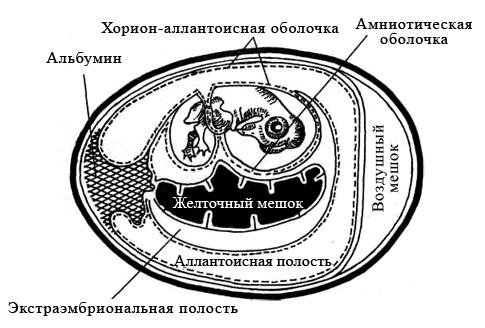
Рисунок 29 – Схематическое изображение развивающегося куриного эмбриона
Культура клеток. Вначале был использован метод переживающих тканей. Он заключался в том, что в колбу, содержащую питательную среду, вносили кусочек ткани. Клетки некоторых тканей в таких условиях могут переживать (но не размножаться) до 30 дней, а в них могут размножаться вирусы. Однако этот способ давал очень небольшой выход вирусов. Необходимо было разработать условия, при которых клетки ткани могли бы свободно размножаться.
Для получения культур клеток необходимо было решить четыре главных задачи:
– получить в необходимом количестве свободные (т. е. изолированные друг от друга) клетки;
– создать такие питательные среды и условия, в которых клетки могли бы активно размножаться;
– обеспечить условия, при которых в культурах клеток не могли бы размножаться бактерии;
– определить методы, с помощью которых можно было бы распознавать рост вируса в культуре клеток и идентифицировать его.
Для выделения изолированных (разобщенных), но жизнеспособных клеток из разрушенных тканей, стали использовать обработку их слабым раствором трипсина, разрушающего межклеточные мостики. Для культивирования клеток были предложены различные среды, содержащие все необходимые для размножения клеток питательные вещества (аминокислоты, основания, витамины и другие), минеральные соли, имеющие оптимальную рН и т. д. К питательным средам добавляли индикатор, по изменению цвета которого можно было судить о метаболизме клеток и их размножении. Было установлено, что в качестве основы, на которой клетки размножаются и образуют монослой, может быть использовано хорошо обработанное стекло пробирок и колб. Для подавления возможного роста бактерий вируссодержащий материал перед посевом его в культуры клеток стали обрабатывать антибиотиками.
В 1949 г. Дж. Эндерс, Т. Веллер и Ф. Роббинс показали, что вирус полиомиелита хорошо размножается в первично-трипсинизированных культурах клеток, полученных из почек обезьян. Основной недостаток первично-трипсинизированных клеток заключается в том, что после нескольких пересевов они перестают размножаться. Поэтому предпочтением стали пользоваться культуры таких клеток, которые способны размножаться in vitro бесконечно долго. Такие перевиваемые культуры клеток (клеточные линии характеризуются бессмертием и гетероплоидным кариотипом) получают из опухолевых тканей (HeLa получена из карциномы шейки матки, НЕр-2 – из карциномы гортани; Детройт-6 – из метастаза рака легкого в костный мозг; RН – из опухоли почки человека) или из мутантных клеток с полиплоидным набором хромосом. Однако опухолевые клетки нельзя применять для получения вакцин. Для этих целей используют только культуры таких клеток, которые не содержат никаких контаминантных вирусов и не обладают злокачественностью. Лучше всего этим требованиям отвечают культуры диплоидных клеток.
Полуперевиваемые (диплоидные) культуры клеток – клетки одного генотипа, способные in vitro выдерживать 50–100 пассажей, сохраняя при этом свой исходный диплоидный набор хромосом. Диплоидные линии фибробластов эмбриона человека используются как для диагностики вирусных инфекций, так и при производстве вирусных вакцин. Как оказалось, вирусы могут размножаться не только в культурах клеток, образующих монослой на стекле пробирок, но и в суспензиях живых клеток.
Для обеспечения жизнедеятельности культивируемых клеток необходимы питательные среды. По назначению они делятся на ростовые и поддерживающие. В ростовых питательных средах должно содержаться больше питательных веществ, обеспечивающих активное размножение клеток и формирование монослоя. Поддерживающие среды обеспечивают переживание клеток в уже сформированном монослое в период размножения в них вирусов.
2.3.2 Выделение вирусов
Выделение вирусов в культурах клеток. При выделении вирусов из различных инфекционных материалов (кровь, моча, слизистые отделяемые, смывы из органов) применяют культуры клеток, обладающих наибольшей чувствительностью к предполагаемому вирусу. Для заражения используют культуры в пробирках с хорошо развитым монослоем клеток. Перед заражением клеток питательную среду удаляют и в каждую пробирку вносят по 0,1–0,2 мл взвеси исследуемого материала, предварительно обработанного антибиотиками для уничтожения бактерий и грибов. После 30-60 мин контакта вируса с монослоем клеток удаляют избыток материала, в культуру вносят поддерживающую среду и пробы оставляют в термостате до выявления признаков размножения вируса.
Выделение вирусов на лабораторных животных. При невозможности выделить и идентифицировать вирус стандартными методами in vitro инфекционный материал вводят чувствительным к возбудителю животным, и после развития типичного инфекционного процесса проводят повторное заражение чувствительных клеточных культур. Наиболее часто используют мышей, кроликов и обезьян; для выделения некоторых вирусов (например, вирусов Коксаки) заражают мышат-сосунков. Вследствие дороговизны и сложности содержания лабораторных животных, практически повсеместно их вытеснили клеточные культуры. Тем не менее животные модели активно используют для изучения особенностей патогенеза и формирования иммунных реакций при вирусных инфекциях.
Таким образом, для выделения чистых культур вирусов в лабораторных условиях в настоящее время используются следующие живые объекты (биологические модели): 1) культура клеток (тканей, органов); 2) куриные эмбрионы; 3) лабораторные животные.
2.3.3 Индикация вирусов
Индикация вирусов в культурах клеток. Индикатором наличия вируса в зараженных культурах клеток может служить:
1) развитие специфической дегенерации клеток – цитопатическое действие вируса (ЦПД), имеющее три основных типа: крупно- или мелкоклеточная дегенерация; образование многоядерных гигантских клеток (симпластов); развитие очагов клеточной пролиферации, состоящих из нескольких слоев клеток (гроздевидная дегенерация клеток).
Различают два механизма гибели клеток, вызываемой вирусами, – некроз и апоптоз. Некроз происходит из-за необратимых нарушений целостности клеточных мембран, апоптоз – вследствие фрагментации ядерной ДНК под действием клеточной эндонуклеазы.
Цитопатические эффектыоценивают при микроскопии клеточных культур. По степени поражения клеток выделяют вирусы с высокой или умеренной цитопатогенностью:
2) обнаружение внутриклеточных включений, располагающихся в цитоплазме и/или в ядрах пораженных клеток;
3) положительная реакция гемагглютинации (РГА) или гемадсорбции (РГАдс). Некоторые вирусы, в частности, вирус гриппа, обладают особыми рецепторами (гемагглютининами), с помощью которых они адсорбируются на эритроцитах и вызывают их склеивание (гемагглютинацию). Такие вирусы легко обнаруживаются с помощью реакции гемагглютинации или гемадсорбции (эритроциты адсорбируются на инфицированных вирусами клетках культуры тканей);
4) феномен бляшкообразования. Широкое распространение получил предложенный в 1952 г. Р. Дюльбекко метод бляшек (негативных колоний), позволяющий производить количественное определение вирусов. Для выделения вирусов монослой клеток после удаления питательной среды заражают вируссодержащим материалом и покрывают слоем агара, содержащего индикатор нейтральный красный. Чашки (флаконы) инкубируют при 37 °С. Через 48–96 ч выявляются пятна – бляшки. Они имеют диаметр 1–3 мм и выглядят неокрашенными на розовом фоне. Пятна возникают за счет цитопатического действия вируса;
5) цветная реакция Солка. О росте вирусов в клетках можно судить с помощью индикатора, добавляемого к питательной среде. Если клетки активно осуществляют метаболизм, рН среды сдвигается в кислую сторону, и среда окрашивается в желтый цвет. В случае размножения вируса клетки погибают, рН среды мало меняется, и она сохраняет первоначальный (малиновый) цвет или (при нейтральной рН) приобретает оранжевый;
6) реакция интерференции (используется при отсутствии ЦПД, гемагглютинации и гемадсорбции): исследуемая культура повторно заражается вирусом, вызывающим ЦПД. В положительном случае ЦПД будет отсутствовать (реакция интерференции положительна). Если в исследуемом материале вируса не было, наблюдается ЦПД.
Кроме того, для обнаружения вируса в культурах клеток могут быть использованы различные серологические реакции.
Индикация вирусов на лабораторных животных. Индикация вируса основана на обнаружении у животных признаков инфекционного заболевания, регистрации их гибели, изучении характера патоморфологических и патогистологических изменений в тканях и органах, выявлении положительной реакции гемагглютинации.
2.3.4 Методы идентификации вирусов
Определение типа вируса (его идентификация) основано на нейтрализации биологической активности вируса с помощью типоспецифических сывороток. Конечный результат ее может быть установлен на основании следующих признаков:
1) нейтрализация цитопатического действия: в культуральную среду, содержащую изучаемый вирус, вносят коммерческую сыворотку (например, к вирусу краснухи при подозрении на неё), инкубируют и заражают вторую культуру; через 1–2 дня в неё вносят известный цитопатогенный вирус. При наличии цитопатогенного эффекта делают вывод о том, что первая культура была заражена вирусом, соответствовавшим антителам примененной сыворотки;
2) нейтрализация реакции гемадсорбции;
3) изменение проявления цветной пробы;
4) задержка (торможение) реакции гемагглютинации: смешивают культуральную среду, содержащую возбудитель, с известной коммерческой антисывороткой и вносят в культуру клеток. После инкубации определяют способность культуры к гемагглютинации и при её отсутствии делают заключение о несоответствии вируса антисыворотке.
5) нейтрализация в опытах на животных.
Таким образом РН (реакция нейтрализации) основана на подавлении соответствующей реакции, феномена, развития инфекционного процесса после внесения в культуру или введения в организм животного смеси вируса со специфичными AT, содержащимися в диагностической сыворотке.
Вопросы для самоконтроля
1 Назовите основные принципы классификации вирусов.
2 Приведите русские и латинские названия основных семейств вирусов человека и животных.
3 Назовите типовых представителей основных семейств вирусов и заболевания, вызываемые ими.
4 Каковы особенности морфологии и ультраструктуры вирусов человека и животных (основных семейств)?
5 Назовите РНК-геномные и ДНК-геномные фитовирусы.
6 Какие этапы включают в себя лабораторные исследования при идентификации вирусов и диагностике вирусных инфекций?
7 Какие биологические модели используются для выделения и культивирования вирусов человека и животных?
8 Как происходит заражение куриных эмбрионов в лабораторных условиях?
9 Какие методы получения культуры клеток вы знаете?
10 Как проводят идентификацию вирусов в курином эмбрионе и на лабораторных животных?
11 Какие существуют методы индикации вирусов на культуре клеток?
12 В чем заключается назначение и сущность реакций нейтрализации вирусов?
13 Назовите способы постановки реакций нейтрализации вирусов.
Вирусы размножаются только в живых клетках, и выделение возбудителя в заражённой культуре клеток — один из основных методов диагностики вирусных инфекций. Поскольку большинство патогенных вирусов отличает тканевая и типовая специфичность, то почти к каждому вирусу можно подобрать соответствующие клеточные или тканевые культуры, а также создать стандартные условия культивирования (наличие клеток одного типа). Размножение вируса обеспечивают чувствительные (пермиссивные) клетки. Поэтому при выделении неизвестного возбудителя проводят одномоментное заражение 3-4 культур клеток, предполагая, что одна из них может оказаться пермиссивной. Культуры клеток получают диспергированием соответствующих органов и тканей, но чаще используют эмбриональные ткани (человека и животных) либо трансформированные опухолевые клетки. При помещении на соответствующую плоскую поверхность клеточные культуры обычно растут в виде монослоя.
Первично-трипсинизированные культуры. Суспензии клеток получают гомогенизированием соответствующих тканей, предварительно обработанных трипсином. Культуры часто представлены клетками смешанного типа и не подлежат повторному культивированию. Жизнеспособность таких культур составляет 2-3 нед.
Полуперевиваемые линии клеток представлены диплоидными клетками человека и животных. Культуры ограниченно пригодны к повторному диспергированию и росту (как правило, не более 20-30 пересевов), сохраняя при этом жизнеспособность и не подвергаясь спонтанной трансформации.
Перевиваемые линии клеток (гетероплоидные культуры) представлены клетками, подвергнутыми длительному культивированию и спонтанным трансформациям. Культуры способны к многократному диспергированию и перевиванию. Работа с ними менее трудоёмка по сравнению с приготовлениями первичных культур; перевиваемые клетки относительно одинаковы по своей морфологии и стабильны по свойствам.
Не все виды клеток способны расти в виде монослоя, в некоторых случаях поддержание дифференцированных клеток возможно только в культуре органа. Обычно это суспензия ткани, обладающей специализированной функцией, также обозначаемая как культура переживающей ткани.
Куриные эмбрионы
Куриные эмбрионы — практически идеальные модели для культивирования некоторых вирусов (например, гриппа и кори). Замкнутая полость эмбриона препятствует проникновению микроорганизмов извне, а также развитию спонтанных вирусных инфекций. Эмбрионы применяют для первичного выделения вирусов из патологического материала; для пассирования и сохранения их, а также для получения необходимых количеств вируса. Некоторые возбудители (например, герпесвирусы) вызывают характерные изменения (по ним можно распознавать заболевание). Заражение проводят на хорион-аллантоисную оболочку, в амниотическую или аллантоисную полость либо в желточный мешок.
Заражение на хорион-аллантоисную мембрану. Обычно используют 10-12-суточные эмбрионы. Яйца просматривают в проходящем свете, отмечают локализацию воздушного мешка и выбирают область без сосудов. Осторожно удаляют фрагмент скорлупы, освобождают наружную оболочку и отслаивают её осторожным надавливанием. Затем делают отверстие у края воздушного мешка. При отсосе через это отверстие хорион-аллантоисная оболочка отслаивается от наружной оболочки. На неё наносят исследуемый материал, свободный от бактерий и простейших (пропущенный через бактериальные фильтры и обработанный бактерицидами).
Заражение в амниотическую полость. Обычно используют 7-14-суточные эмбрионы, у которых после отслоения хорион-аллантоисной оболочки (см. выше) расширяют отверстие, захватывают пинцетом амниотическую оболочку и выводят через хорион-аллантоисную оболочку. Через неё в амниотическую полость вводят исследуемый материал.
Заражение в аллантоисную по лость. 10-суточные эмбрионы заражают через отверстия, сделанные в скорлупе и подлежащих оболочках (см. выше).
Заражение в желточный мешок. Используют 3
8-суточные эмбрионы, у которых в этом возрасте желточный мешок занимает почти всю полость яйца. Заражение проводят через отверстие, сделанное в воздушном мешке
Наблюдение и учёт результатов. В качестве вируссодержащего материала можно использовать содержимое желточного мешка, аллантоисную и амниотическую жидкости либо весь эмбрион, нарезанный вместе с окружающими тканями на кусочки. Для выявления характерных поражений на хорион- развивающегося куриного эмбриона.
аллантоисной мембране удаляют скорлупу и наружную оболочку. Затем мембрану извлекают и помещают в стерильную воду. Характер поражений изучают на тёмном фоне.
При невозможности выделить и идентифицировать вирус стандартными методами in vitroинфекционный материал вводят чувствительным к возбудителю животным, и после развития типичного инфекционного процесса проводят повторное заражение чувствительных клеточных культур. Наиболее часто используют мышей, кроликов и обезьян; для выделения некоторых вирусов (например, вирусов Коксаки) заражают мышат-сосунков. Вследствие дороговизны и сложности содержания лабораторных животных, практически повсеместно их вытеснили клеточные культуры. Тем не менее, животные модели активно используют для изучения особенностей патогенеза и формирования иммунных реакций при вирусных инфекциях.
Идентификация вирусов
Качественное определение
Цитопатические эффекты оценивают при микроскопии клеточных культур. По степени поражения клеток выделяют вирусы с высокой или умеренной цитопатогенностью. Размножение вирусов в культурах клеток сопровождается нарушениями морфологии клеток монослоя. Некоторые вирусы вызывают характерные цитопатические изменения, что (с учётом клинической картины заболевания) позволяет быстро поставить предварительный диагноз. Например, размножение парамиксовирусов (вирусы кори, паротита, PC-вирус) сопровождается появлением характерных гигантских многоядерных клеток; аденовирусы вызывают образование скоплений больших круглых клеток, а при репродукции герпесвирусов клетки округлой формы диффузно располагаются по всему монослою.
Тельца включений. Многие вирусы вызывают появление в заражённых клетках характерных образований — скоплений вирусных белков или частиц, видимых в световой микроскоп. Тельца включений могут располагаться как в цитоплазме (тельца Гварнери при оспе), так и в ядрах клеток (аденовирусы).
Отсутствие цитопатического эффекта. Некоторые вирусы (например, вирус краснухи) не проявляют цитопатического эффекта. Их можно выявлять по интерференции другого вируса, способного вызывать дегенерацию заражённых клеток.
Феномен гемадсорбции. Многие заражённые вирусами клетки приобретают способность сорбировать на своей поверхности различные эритроциты. Феномен гемадсорбции имеет общие механизмы с гемагглютинацией и проявляется на ранних сроках, до проявления цитопатического эффекта, при его отсутствии либо слабой выраженности.
Экспресс-диагностика. Для быстрой идентификации вирусной инфекции разработаны многочисленные методы экспресс-диагностики, основанные на обнаружении вирусных Аг. Например, для ранней диагностики ВИЧ-инфекции широко используют ИФА, выявляющий поверхностные Ar вируса.
— Вирусная или бактериальная инфекция — чем они различаются? Как понять, какую подхватил?
— Как отличить вирусную инфекцию от бактериальной? Прежде всего обратите внимание на то, есть ли у вас болезненные ощущения в носоглотке, как изменяется температура тела. Если горло сильно болит, першит, резкого повышения температуры нет — значит, вы имеете дело с бактериальным заражением. А вот высокая температура тела (выше 39 градусов) без признаков чёткой локализации боли — факт встречи с вирусами. Это два основных признака, по которым можно отличить природу возбудителей.
Следует сказать, что при вирусной инфекции дебют заболевания скоротечен и не имеет видимой причины, отмечается выраженная общая интоксикация. Это и боль позади глазных яблок, и боль в мышцах при движении. Если говорить об отделяемом из верхних дыхательных путей, то при вирусной инфекции они (выделения. — RT) прозрачны, при бактериальной — жёлто-зелёные. Обратите внимание на сухой кашель! Но даже если вы считаете, что самостоятельно распознали причину недуга, вызовите врача на дом!
— Чем так опасен новый коронавирус в сравнении с теми вирусами, о которых мы уже наслышаны?
— Новая коронавирусная инфекция относится к острым респираторным вирусным инфекциям (ОРВИ), и осложнения у неё могут быть такие же, как и у других ОРВИ: пневмония, бронхит, синусит и другие. Опасность этого вируса в том, что он легко передаётся от человека к человеку. Особому риску подвержены пожилые люди.
— Какой у него принцип действия? Как влияет на организм?
Это усложняет распознавание вируса системой иммунитета. Так начинается разрушительная работа вируса в организме. Самой опасной точкой повреждения является система органов дыхания.
— Пара вопросов о профилактике. Кто-то говорит пить витамин С, кто-то — парацетамол. Кого слушать и слушать ли вообще?
— Ответ очень простой: слушать только вашего лечащего врача! Отдельно — о парацетамоле. Известен целый ряд случаев его бесконтрольного применения. А непреднамеренная передозировка парацетамола ведёт к отравлению, сопровождающемуся тяжёлым поражением печени. Крайне не рекомендуется принимать этот препарат с алкоголем! Итак, главный помощник — ваш лечащий доктор!
— Первое — чистота рук и окружающих поверхностей. Часто мойте руки водой с мылом и используйте дезинфицирующие средства.
Потрудитесь не касаться рта, носа и глаз руками (такие прикосновения неосознанно свершаются человеком более 15 раз в час).
Носите с собой дезинфицирующее средство для рук, чтобы в любой обстановке вы могли им воспользоваться.
Обязательно мойте руки перед едой.
Будьте особенно осторожны, когда находитесь в людных местах. Максимально сократите прикосновения к находящимся в таких местах поверхностям и предметам и не касайтесь лица.
Носите с собой одноразовые салфетки и всегда прикрывайте нос и рот, когда вы кашляете или чихаете, обязательно утилизируйте их после использования.
Не ешьте еду (орешки, чипсы, печенье и другие снеки) из общих упаковок или посуды, если другие люди погружали в них свои пальцы.
Избегайте приветственных рукопожатий и поцелуев.
Регулярно очищайте поверхности и устройства, к которым вы прикасаетесь: клавиатуру компьютера, панели оргтехники для общего использования, экран смартфона, пульты, дверные ручки и поручни.
Помните, почему предметы личной гигиены так называются!
— Рассмотрим пример: человек приехал из-за границы с кашлем и решил самоизолироваться. Врача не вызывает, думает, что это обычный ОРВИ или грипп, сейчас полечится — и пройдёт. Это рабочая схема, как думаете?
— Стоит ли вообще заниматься самолечением без диагноза? Какой порядок действий порекомендуете для тех, кто заболел?
— При подозрении на коронавирусную инфекцию самолечение абсолютно противопоказано. Не выходите из дома. Вызовите врача.
— Мыть руки — казалось бы, суперпросто, но об этом так часто сейчас говорят, как будто до этого вообще не мыли. Какие ещё полезные привычки посоветуете ввести в обиход?
— Мыть руки нужно правильно! То есть часто мыть руки с мылом (не менее минуты), причём не только ладони, но и тыльную их сторону, между пальцами, под ногтями. При этом очень важно их хорошо высушивать одноразовыми полотенцами, так как вирус на влажных руках также может сохраняться.
Обрабатывайте доступные поверхности общепринятыми дезинфицирующими средствами.
Используйте домашние ультрафиолетовые облучатели-рециркуляторы и кварцевые лампы.
Часто проветривайте помещение, где вы находитесь.
И самое главное: не паниковать! Инфекция не любит паники. Страх — первый помощник врага, и на всякую беду страха не напасёшься.
Читайте также:


