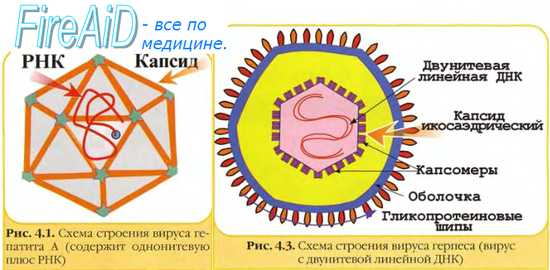
Выделение вируса из материала
Лабораторные исследованияпри проведении идентификации вирусов и диагностике вирусных инфекций включают следующие этапы: выделение, культивирование, индикация (выявление) и идентификация вирусов.
2.3.1 Культивирование вирусов
Вирусы не растут на искусственных питательных средах, а размножаются только внутриклеточно. Крупным достижением было предложение Р. Гудпасчура в 1932 г. использовать для культивирования вирусов куриные эмбрионы. Окончательное решение проблемы культивирования вирусов оказалось возможным лишь после того, как были разработаны основные способы культивирования клеток вне организма.
Использование куриных эмбрионов. Куриные эмбрионы – практически идеальные модели для культивирования некоторых вирусов (например, гриппа и кори). Замкнутая полость эмбриона препятствует проникновению микроорганизмов извне, а также развитию спонтанных вирусных инфекций. Эмбрионы применяют для первичного выделения вирусов из патологического материала; для пассирования и сохранения их, а также для получения необходимых количеств вируса. Некоторые возбудители (например, герпесвирусы) вызывают характерные изменения (по ним можно распознавать заболевание).
Для заражения обычно используют куриные эмбрионы 7–12-дневного возраста. Перед заражением определяют жизнеспособность эмбриона путем овоскопирования (просматривают в проходящем свете). Живые эмбрионы при овоскопировании проявляют двигательную активность, хорошо виден сосудистый рисунок. Простым карандашом очерчивают границы воздушной камеры.
Куриные эмбрионы заражают вируссодержащим материалом в асептических условиях стерильными инструментами, предварительно обработав скорлупу над воздушным пространством йодом и спиртом. Заражение проводят на хорион-аллантоисную оболочку, в амниотическую или аллантоисную полость, либо в желточный мешок (рисунок 29). Выбор метода заражения зависит от биологических свойств вируса.
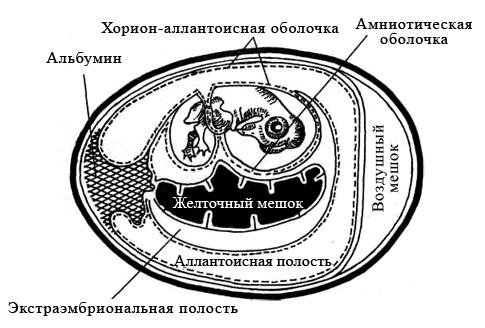
Рисунок 29 – Схематическое изображение развивающегося куриного эмбриона
Культура клеток. Вначале был использован метод переживающих тканей. Он заключался в том, что в колбу, содержащую питательную среду, вносили кусочек ткани. Клетки некоторых тканей в таких условиях могут переживать (но не размножаться) до 30 дней, а в них могут размножаться вирусы. Однако этот способ давал очень небольшой выход вирусов. Необходимо было разработать условия, при которых клетки ткани могли бы свободно размножаться.
Для получения культур клеток необходимо было решить четыре главных задачи:
– получить в необходимом количестве свободные (т. е. изолированные друг от друга) клетки;
– создать такие питательные среды и условия, в которых клетки могли бы активно размножаться;
– обеспечить условия, при которых в культурах клеток не могли бы размножаться бактерии;
– определить методы, с помощью которых можно было бы распознавать рост вируса в культуре клеток и идентифицировать его.
Для выделения изолированных (разобщенных), но жизнеспособных клеток из разрушенных тканей, стали использовать обработку их слабым раствором трипсина, разрушающего межклеточные мостики. Для культивирования клеток были предложены различные среды, содержащие все необходимые для размножения клеток питательные вещества (аминокислоты, основания, витамины и другие), минеральные соли, имеющие оптимальную рН и т. д. К питательным средам добавляли индикатор, по изменению цвета которого можно было судить о метаболизме клеток и их размножении. Было установлено, что в качестве основы, на которой клетки размножаются и образуют монослой, может быть использовано хорошо обработанное стекло пробирок и колб. Для подавления возможного роста бактерий вируссодержащий материал перед посевом его в культуры клеток стали обрабатывать антибиотиками.
В 1949 г. Дж. Эндерс, Т. Веллер и Ф. Роббинс показали, что вирус полиомиелита хорошо размножается в первично-трипсинизированных культурах клеток, полученных из почек обезьян. Основной недостаток первично-трипсинизированных клеток заключается в том, что после нескольких пересевов они перестают размножаться. Поэтому предпочтением стали пользоваться культуры таких клеток, которые способны размножаться in vitro бесконечно долго. Такие перевиваемые культуры клеток (клеточные линии характеризуются бессмертием и гетероплоидным кариотипом) получают из опухолевых тканей (HeLa получена из карциномы шейки матки, НЕр-2 – из карциномы гортани; Детройт-6 – из метастаза рака легкого в костный мозг; RН – из опухоли почки человека) или из мутантных клеток с полиплоидным набором хромосом. Однако опухолевые клетки нельзя применять для получения вакцин. Для этих целей используют только культуры таких клеток, которые не содержат никаких контаминантных вирусов и не обладают злокачественностью. Лучше всего этим требованиям отвечают культуры диплоидных клеток.
Полуперевиваемые (диплоидные) культуры клеток – клетки одного генотипа, способные in vitro выдерживать 50–100 пассажей, сохраняя при этом свой исходный диплоидный набор хромосом. Диплоидные линии фибробластов эмбриона человека используются как для диагностики вирусных инфекций, так и при производстве вирусных вакцин. Как оказалось, вирусы могут размножаться не только в культурах клеток, образующих монослой на стекле пробирок, но и в суспензиях живых клеток.
Для обеспечения жизнедеятельности культивируемых клеток необходимы питательные среды. По назначению они делятся на ростовые и поддерживающие. В ростовых питательных средах должно содержаться больше питательных веществ, обеспечивающих активное размножение клеток и формирование монослоя. Поддерживающие среды обеспечивают переживание клеток в уже сформированном монослое в период размножения в них вирусов.
2.3.2 Выделение вирусов
Выделение вирусов в культурах клеток. При выделении вирусов из различных инфекционных материалов (кровь, моча, слизистые отделяемые, смывы из органов) применяют культуры клеток, обладающих наибольшей чувствительностью к предполагаемому вирусу. Для заражения используют культуры в пробирках с хорошо развитым монослоем клеток. Перед заражением клеток питательную среду удаляют и в каждую пробирку вносят по 0,1–0,2 мл взвеси исследуемого материала, предварительно обработанного антибиотиками для уничтожения бактерий и грибов. После 30-60 мин контакта вируса с монослоем клеток удаляют избыток материала, в культуру вносят поддерживающую среду и пробы оставляют в термостате до выявления признаков размножения вируса.
Выделение вирусов на лабораторных животных. При невозможности выделить и идентифицировать вирус стандартными методами in vitro инфекционный материал вводят чувствительным к возбудителю животным, и после развития типичного инфекционного процесса проводят повторное заражение чувствительных клеточных культур. Наиболее часто используют мышей, кроликов и обезьян; для выделения некоторых вирусов (например, вирусов Коксаки) заражают мышат-сосунков. Вследствие дороговизны и сложности содержания лабораторных животных, практически повсеместно их вытеснили клеточные культуры. Тем не менее животные модели активно используют для изучения особенностей патогенеза и формирования иммунных реакций при вирусных инфекциях.
Таким образом, для выделения чистых культур вирусов в лабораторных условиях в настоящее время используются следующие живые объекты (биологические модели): 1) культура клеток (тканей, органов); 2) куриные эмбрионы; 3) лабораторные животные.
2.3.3 Индикация вирусов
Индикация вирусов в культурах клеток. Индикатором наличия вируса в зараженных культурах клеток может служить:
1) развитие специфической дегенерации клеток – цитопатическое действие вируса (ЦПД), имеющее три основных типа: крупно- или мелкоклеточная дегенерация; образование многоядерных гигантских клеток (симпластов); развитие очагов клеточной пролиферации, состоящих из нескольких слоев клеток (гроздевидная дегенерация клеток).
Различают два механизма гибели клеток, вызываемой вирусами, – некроз и апоптоз. Некроз происходит из-за необратимых нарушений целостности клеточных мембран, апоптоз – вследствие фрагментации ядерной ДНК под действием клеточной эндонуклеазы.
Цитопатические эффектыоценивают при микроскопии клеточных культур. По степени поражения клеток выделяют вирусы с высокой или умеренной цитопатогенностью:
2) обнаружение внутриклеточных включений, располагающихся в цитоплазме и/или в ядрах пораженных клеток;
3) положительная реакция гемагглютинации (РГА) или гемадсорбции (РГАдс). Некоторые вирусы, в частности, вирус гриппа, обладают особыми рецепторами (гемагглютининами), с помощью которых они адсорбируются на эритроцитах и вызывают их склеивание (гемагглютинацию). Такие вирусы легко обнаруживаются с помощью реакции гемагглютинации или гемадсорбции (эритроциты адсорбируются на инфицированных вирусами клетках культуры тканей);
4) феномен бляшкообразования. Широкое распространение получил предложенный в 1952 г. Р. Дюльбекко метод бляшек (негативных колоний), позволяющий производить количественное определение вирусов. Для выделения вирусов монослой клеток после удаления питательной среды заражают вируссодержащим материалом и покрывают слоем агара, содержащего индикатор нейтральный красный. Чашки (флаконы) инкубируют при 37 °С. Через 48–96 ч выявляются пятна – бляшки. Они имеют диаметр 1–3 мм и выглядят неокрашенными на розовом фоне. Пятна возникают за счет цитопатического действия вируса;
5) цветная реакция Солка. О росте вирусов в клетках можно судить с помощью индикатора, добавляемого к питательной среде. Если клетки активно осуществляют метаболизм, рН среды сдвигается в кислую сторону, и среда окрашивается в желтый цвет. В случае размножения вируса клетки погибают, рН среды мало меняется, и она сохраняет первоначальный (малиновый) цвет или (при нейтральной рН) приобретает оранжевый;
6) реакция интерференции (используется при отсутствии ЦПД, гемагглютинации и гемадсорбции): исследуемая культура повторно заражается вирусом, вызывающим ЦПД. В положительном случае ЦПД будет отсутствовать (реакция интерференции положительна). Если в исследуемом материале вируса не было, наблюдается ЦПД.
Кроме того, для обнаружения вируса в культурах клеток могут быть использованы различные серологические реакции.
Индикация вирусов на лабораторных животных. Индикация вируса основана на обнаружении у животных признаков инфекционного заболевания, регистрации их гибели, изучении характера патоморфологических и патогистологических изменений в тканях и органах, выявлении положительной реакции гемагглютинации.
2.3.4 Методы идентификации вирусов
Определение типа вируса (его идентификация) основано на нейтрализации биологической активности вируса с помощью типоспецифических сывороток. Конечный результат ее может быть установлен на основании следующих признаков:
1) нейтрализация цитопатического действия: в культуральную среду, содержащую изучаемый вирус, вносят коммерческую сыворотку (например, к вирусу краснухи при подозрении на неё), инкубируют и заражают вторую культуру; через 1–2 дня в неё вносят известный цитопатогенный вирус. При наличии цитопатогенного эффекта делают вывод о том, что первая культура была заражена вирусом, соответствовавшим антителам примененной сыворотки;
2) нейтрализация реакции гемадсорбции;
3) изменение проявления цветной пробы;
4) задержка (торможение) реакции гемагглютинации: смешивают культуральную среду, содержащую возбудитель, с известной коммерческой антисывороткой и вносят в культуру клеток. После инкубации определяют способность культуры к гемагглютинации и при её отсутствии делают заключение о несоответствии вируса антисыворотке.
5) нейтрализация в опытах на животных.
Таким образом РН (реакция нейтрализации) основана на подавлении соответствующей реакции, феномена, развития инфекционного процесса после внесения в культуру или введения в организм животного смеси вируса со специфичными AT, содержащимися в диагностической сыворотке.
Вопросы для самоконтроля
1 Назовите основные принципы классификации вирусов.
2 Приведите русские и латинские названия основных семейств вирусов человека и животных.
3 Назовите типовых представителей основных семейств вирусов и заболевания, вызываемые ими.
4 Каковы особенности морфологии и ультраструктуры вирусов человека и животных (основных семейств)?
5 Назовите РНК-геномные и ДНК-геномные фитовирусы.
6 Какие этапы включают в себя лабораторные исследования при идентификации вирусов и диагностике вирусных инфекций?
7 Какие биологические модели используются для выделения и культивирования вирусов человека и животных?
8 Как происходит заражение куриных эмбрионов в лабораторных условиях?
9 Какие методы получения культуры клеток вы знаете?
10 Как проводят идентификацию вирусов в курином эмбрионе и на лабораторных животных?
11 Какие существуют методы индикации вирусов на культуре клеток?
12 В чем заключается назначение и сущность реакций нейтрализации вирусов?
13 Назовите способы постановки реакций нейтрализации вирусов.
Журнал Lancet опубликовал результаты исследования 191 китайского пациента с COVID-19. Показано, что шансы на летальный исход увеличиваются с возрастом (отношение шансов 1,10, доверительный интервал 95% 1,03–1,17, на каждый год; p = 0,0043), с более высокой оценкой органной недостаточности по шкале SOFA балл (5,65, 2,61–12,23; р


Вам будет интересно


Вирус, вызывающий COVID-19, стабилен в течение нескольких часов или дней в аэрозолях и на различных поверхностях, согласно исследованию, опубликованному в The New England Journal of Medicine. Исследователи имитировали попадание вируса SARS-CoV-2 от зараженного человека на поверхности, например, при кашле или прикосновении к предметам, а затем выясняли, как долго он остается инфекционным. Жизнеспособный вирус обнаруживался в аэрозолях на протяжении трех часов, на меди до четырех часов, на картоне до 24 часов и до двух-трех дней— на пластике и нержавеющей стали. В исследовании стабильности точно такие же характеристики показал SARS-CoV-1, возбудитель атипичной пневмонии. Причиной того, что COVID-19 распространился гораздо шире, могут быть менее выраженные симптомы. В отличие от SARS-CoV-1, большинство вторичных случаев передачи вируса SARS-CoV-2, по-видимому, происходит не в медицинских учреждениях, а вне их. Тем не менее медицинские учреждения также уязвимы, отмечают авторы.


Профессор Либер известен своими работами с наноматериалами и по созданию биосенсоров.




В Москве создан комитет по борьбе с коронавирусом, в который вошли главврачи коронавирусных стационаров. Одно из его первых предложений — отказаться от разделения стационаров на коронавирусные и стационары для лечения пневмонии, сообщает московский оперштаб.
Медики предложили включить больницы для лечения коронавируса и пневмонии в единую систему, а также изменить маршрутизацию пациентов — если при помещении в стационар у пациента еще нет результатов теста, но выявляются КТ-признаки пневмонии-COVID 19, то его госпитализируют в стационар и ведут как больного с COVID-инфекцией.
Как рассказал Денис Проценко, главврач больницы в Коммунарке, где находятся пациенты с коронавирусом, точность существующих тестов для выявления COVID-19, применяемых при постановке диагноза пациентам с симптомами или контактным лицам, составляет 70–80 %. Ключевую роль, по его словам, играет оценка клинической картины в сочетании с данными компьютерной томографии или рентгена.
ГКБ №52, которая несколько месяцев принимала больных с пневмонией, также теперь станет новым коронавирусным стационаром.




Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в мае 2019 года одобрило препарат для генной терапии Zolgensma для лечения детей в возрасте до двух лет со спинальной мышечной атрофией. Цена препарата — $ 2,1 млн. за дозу. Новые испытания должны продемонстрировать, что Zolgensma можен быть назначена и детям в возрасте до пяти лет. Однако, по сообщению Wall Street Journal , компания объявила, что у приматов, получавших Zolgensma в виде инъекции в позвоночник, наблюдалось воспаление нервных клеток и в некоторых случаях их дегенерация. (В виде спинальной инъекции препарат получают также пациенты старшего возраста, младшие пациенты — внутривенно.) Поэтому испытания частично приостановлены. Вероятно, это временная задержка, поскольку ни у одного из детей не наблюдалось такого эффекта.
Разработка Zolgensma ранее оказалась в центре скандала из-за манипулирования данными во время тестирования.




Как сообщает агентство Синьхуа, одобрена заявка на проведение клинических испытаний противовирусного препарата ремдесивира (Gilead Sciences). Первая группа пациентов с пневмонией, вызванной коронавирусом 2019-nCoV, должна начать принимать препарат 6 февраля. В рандомизированное, двойное слепое, плацебо-контролируемое исследование включен в общей сложности 761 пациент.
Сообщается также про обнадеживающие результаты применения хлорохина и лопинавира/ритонавира .




Американский биофизик, который является одним из наиболее цитируемых исследователей в мире, исключен из редакционной коллегии одного журнала и лишен права быть рецензентом другого после неоднократных манипуляций с процессом рецензирования для сбора ссылок на его собственную работу, сообщает Nature .




Как отмечает Роспотребнадзор, на 8-й неделе 2020 года (17.02.2020-23.02.2020) превышение недельных эпидемических порогов среди населения в целом отмечено в 27 субъектах Российской Федерации, а также в трех центральных городах субъектов РФ. Доля вирусов гриппа А и В в пейзаже циркулирующих респираторных вирусов продолжает возрастать.




С 6 апреля Центр молекулярной диагностики Роспотребнадзора (CMD) начинает массовый скрининг всех, кто хочет обследоваться на наличие вируса COVID-19. Для проведения анализа специалисты Центра молекулярной диагностики используют высокочувствительную тест-систему, разработанную в ЦНИИ Эпидемиологии Роспотребнадзора.
Услуга доступна для жителей Москвы и Подмосковья. Действует ограничение: у пациента не должно быть признаков простудных заболеваний и контактов с людьми, инфицированными COVID-19. Исследование не может быть проведено анонимно, и при оформлении заказа обязательно указание паспортных данных.
Платные услуги по тестированию на коронавирус также оказывают Г емотест, Хеликс и LabQuest .


Как сообщает РБК, компания уже ведет закупку тест-систем и разрабатывает необходимую технологическую базу. Начать прием анализов планируется в течение ближайшего месяца.
Производство собственных тест-систем на коронавирус также планирует запустить Центр молекулярной диагностики CMD.


Во многих диагностических лабораториях перед проведением ПЦР-теста на SARS-CoV-2 образец инактивируется инкубированием на 56℃. Однако эта процедура может способствовать разрушению РНК вируса и повышать вероятность ложноотрицательного результата. Китайские ученые проверили , как влияет термическая инактивация на обнаружение SARS-CoV-2 с помощью ПЦР в реальном времени.


Исследователи из Университета Миннесоты определили кристаллическую структуру рецепторсвязывающего домена (RBD) S-белка SARS-CoV-2 в комплексе с человеческим рецептором ACE2 (Nature, 30 марта ).
По сравнению с RBD возбудителя атипичной пневмонии SARS-CoV комплекс ACE2 с RBD SARS-CoV-2 имеет более компактную конформацию. Кроме того, несколько замен аминокислотных остатков в RBD SARS-CoV-2 стабилизируют две точки связывания между вирусным и человеческом белком и усиливают сродство вируса к рецептору.
Авторы показали, кроме того, что RaTG13, коронавирус летучей мыши, обладающий значительным сходством с SARS-CoV-2, также использует человеческий ACE2 в качестве рецептора. Это подсказывает, что вирус летучей мыши способен инфицировать человека, и авторы допускают, что новый коронавирус человек мог возникнуть в ходе эволюции этого или других подобных вирусов летучих мышей. Различия взаимодействия белков SARS-CoV-2, SARS-CoV и RaTG13 с человеческим ACE2 проливают свет на то, каким образом вирус мог перейти от животного к человеку, отмечают авторы. Кроме того, это исследование может помочь в разработке терапевтических стратегий, нацеленных на связывание вируса с рецептором.
Недавно группа исследователей под руководством Рольфа Хильгенфельда определила кристаллическую структуру вирусной протеазы M pro , что позволило предложить потенциальное лекарство против SARS-CoV-2 — улучшенный альфакетоамидный ингибитор, обладающий выраженным легочным тропизмом и пригодный к применению в ингаляционной форме. Статья опубликована в Science 20 марта.


Минздрав России разработал временные методические рекомендации для медицинских работников по профилактике, диагностике и лечению коронавируса. Представленные рекомендации учитывают фактические данные, опубликованные специалистами Всемирной организации здравоохранения, китайского и американского центра по контролю за заболеваемостью, а также Европейского Центра по контролю за заболеваемостью в материалах по лечению и профилактике этой инфекции.
Инфекции, вызванной 2019-nCoV, считается подтвержденной при наличии клинических проявлений острой респираторной инфекции, бронхита, пневмонии в сочетании с данными эпидемиологического анамнеза (посещение эпидемиологически неблагополучных районов, контакты с возможными носителями инфекции и т.п.) и положительных результатов лабораторных тестов на наличие РНК 2019-nCoV методом ПЦР. Для лечения рекомендованы, в частности, рибавирин в комбинации с лопинавиром/ритонавиром, а также препараты интерферона-бета.
Рекомендации носят временный характер и будут обновляться.


В качестве мишеней лекарств против SARS-CoV-2 часто называют S-белок и протеазу (протеиназу), необходимую для процессинга вирусной репликазы. Однако мишенью может быть и белок хозяина. Как показали опыты с частицами вируса везикулярного стоматита, которые несли на себе белок S нового коронавируса, SARS-CoV-2 использует для входа в клетку тот же рецептор, что и SARS, — ACE2. При этом проникновение вируса блокирует ингибитор клеточного фермента, необходимого для прайминга белка S,— протеазы TMPRSS2. Таким ингибитором может быть камостат (camostat mesylate) . Статья немецких ученых, ранее размещенная на сервисе препринтов BioRxiv (подробнее на PCR.news), теперь опубликована в Cell.
Другая статья, опубликованная в Science, представляет крио-ЭМ структуру полноразмерного человеческого рецептора АСЕ2 с рецептор-связывающим доменом S-белка SARS-Co-2 или без него. Это новый уровень понимания молекулярных механизмов инфекции.
В Европейском регионе ВОЗ зарегистрировано 5569 случаев COVID-19 (из них 5 марта более 1300) и 158 летальных исходов. Число подтвержденных случаев в мире превысило 100 тысяч, умерло 3404 человека.


Чжан Синьминь, директор Национального центра развития биотехнологий Китая, на пресс-конференции во вторник в Пекине сказал, что препарат признан эффективным. Испытания проводились в городах Ухань и Шэньчжэнь, и в них приняли участие соответственно 240 и 80 человек.
У пациентов из Шэньчжэня, получавших лекарство, медианное время до первого отрицательного теста на вирус составило 4 дня, в контрольной группе — 11 дней. Рентгеновские снимки подтвердили улучшение состояния легких примерно у 91% пациентов, которым давали лекарство, и у 62% контрольной группы.
18 марта в NEJM опубликованы данные рандомизированного контролируемого открытого исследования лопинавира/ритонавира в терапии COVID-19. У взрослых пациентов с тяжелой формой заболевания не было обнаружено никаких преимуществ по сравнению со стандартной терапией. Авторы не исключают возможности, что в других испытаниях результат может быть иным.
|