Вирусы могут репродуцироваться только
- Введение
- Обозначения и сокращения
- 1 История вирусологии, природа и происхождение вирусов
- 2 Химический состав вирусов
- 3 Морфология, морфогенез, биофизические свойства и генетика вирусов
- 4 Репродукция вирусов
- 5 Основные процессы, контролирующие наследственность и изменчивость вирусов
- 6 Классификация и патогенез вирусных инфекций
Приведённый ознакомительный фрагмент книги Общая вирусология с основами таксономии вирусов позвоночных ( Коллектив авторов, 2012) предоставлен нашим книжным партнёром — компанией ЛитРес.
5 Основные процессы, контролирующие наследственность и изменчивость вирусов
Вирусам, как и всем живым организмам, свойственны наследственность и изменчивость. Так же как и у прочих форм жизни нуклеиновые кислоты вирусов подвержены мутациям.
Модификации. Модификациями называются не наследуемые (фенотипические) изменения у вирусов, обусловленные клеткой-хозяином. Эти изменения лежат в основе адаптации вируса к новому хозяину и преодоления зависимого от хозяина ограничения. Модификации нуклеиновых кислот вирусов осуществляют клеточные ферменты, ответственные за ограничение (рестрикцию) репродукции вируса.
Мутации. В основе изменчивости вирусов лежат мутации, т.е. изменения состава и последовательностей нуклеотидов вирусного генома. Мутации происходят у всех вирусов, независимо от того, является ли их генетическим аппаратом ДНК или РНК. В результате мутаций отдельные вирионы могут приобретать новые свойства. Дальнейшая судьба таких вирусов зависит от естественного отбора, сохраняющего популяцию, наиболее приспособленную к условиям существования.
Мутации могут иметь разные последствия. В одних случаях они ведут к изменению фенотипических проявлений в нормальных условиях. Например, увеличивается или уменьшается размер бляшек под агаровым покрытием; увеличивается или ослабляется нейровирулентность для определенного вида животных; вирус становится более чувствительным к действию химиотерапевтического агента и т.п.
В других случаях мутация является летальной, так как вследствие ее нарушается синтез или функция жизненно важного вирусспецифического белка, например вирусной полимеразы.
В некоторых случаях мутации являются условно летальными, так как вирусспецифический белок сохраняет свои функции в определенных, оптимальных для него, условиях и теряет эту способность в неразрешающих (непермиссивных) условиях. Типичным примером таких мутаций являются температурно-чувствительные (temperature sensitive) – ts-мутации, при которых вирус теряет способность размножения при повышенных температурах (от 39 °С до 42 °C), сохраняя эту способность при обычных температурах выращивания (от 36°С до 37 °C).
По своему механизму мутации могут быть тоже разными. В одних случаях происходит деления, т.е. выпадение одного или нескольких нуклеотидов, в других случаях происходит встраивание одного или нескольких нуклеотидов, а в некоторых случаях – замена одного нуклеотида другим.
Мутации могут быть прямыми и обратными. Прямые мутации меняют фенотип, а обратные мутации – реверсии – его восстанавливают. Возможны истинные реверсии, когда обратная мутация происходит в месте первичного повреждения, и псевдореверсии, если мутация происходит в другом участке дефектного гена (интрагенная супрессия) или в другом гене (экстрагенная супрессия). Реверсия не является редким событием, так как ревертанты обычно более приспособлены к данной клеточной системе. Поэтому при получении мутантов с заданными свойствами, на пример вакцинных штаммов, приходится считаться с возможной их реверсией к дикому типу.
Мутации носят случайный характер и объясняются статистическими законами.
В качестве физических мутагенов наиболее часто применяется ультрафиолетовое облучение, так как его энергия сопоставима с энергией химических связей.
Реже применяются более жесткие виды облучения – рентгеновское и g-облучение, а также обработка вирусных суспензий нейтронами, протонами, электронами и ядрами гелия, так как они вызывают сильные разрушения вирусных геномов и их инактивацию.
В качестве химических мутагенов применяют аналоги оснований (бромурацил, бромдезоксиуридин, 2-аминопурин, нитрозогуанидин и пр.), алкилирующие и флуоресцирующие соединения (профлавин), интеркалирующие агенты (актиномицин, этидий бромид), азотистую кислоту, гидроксиламин и многие другие.
5.1 Генетические и негенетические взаимодействия между вирусами
Как в естественных, так и в экспериментальных условиях одна клетка может быть заражена не одним, а несколькими вирусами. В процессе такой смешанной инфекции могут иметь место различные формы взаимодействия как между вирусными геномами, так и между продуктами генов. При взаимодействии геномов могут наблюдаться такие формы генетических взаимодействий, как множественная реактивация, рекомбинация, пересортировка генов, кросс-реактивация, гетерозиготкость. При взаимодействии на уровне продуктов генов могут иметь место негенетические взаимодействия: комплементация, интерференция, фенотипическое смешивание и др.
Множественная реактивация. Вирусная инфекция может возникнуть при заражении клетки несколькими вирионами с поврежденными геномами вследствие того, что функцию поврежденного гена может выполнять вирус, у которого этот ген не поврежден. Этот феномен был вначале обнаружен на бактериофагах и получил название множественной реактивации. В основе множественной реактивации лежит кооперативный процесс, при котором вирионы с поражением разных генов дополняют друг друга путем генетической рекомбинации, в результате чего репродуцируется исходный неповрежденный вирус.
Эффективность множественности реактивации зависит от многих причин: степени повреждения генома вирионов, числа проникших в клетку вирионов, концентраций их в определенных участках клетки, аутоинтерференции поврежденных вирионов. Для множественной реактивации важное значение имеет расстояние между вирионами с поврежденными геномами внутри клетки. Обработка вирионов двухвалентными ионами металлов, ведущая к их агрегации, усиливает множественную реактивацию.
Рекомбинация. Генетической рекомбинацией называют обмен генетическим материалом, происходящий между родительскими вирусами. Возможен обмен полными генами (межгенная рекомбинация), так и участками одного и того же гена (внутригенная рекомбинация). Образующийся вирус-рекомбинант обладает свойствами, унаследованными от разных родителей.
Обычно рекомбинируемые штаммы обладают характерными признаками, которые обозначаются как маркеры. Например, были получены рекомбинанты между вирусами полиомиелита, обладающие повышенной устойчивостью и повышенной чувствительностью к гуанидину, разной ней-ровирулентностью, разной устойчивостью к повышенной температуре, разной чувствительностью к ингибиторам сывороток лошадей и коров и т.п. Для получения рекомбинантов используют штаммы, содержащие два или большее число маркеров.
Тест рекомбинации применяют для генетических исследований вирусов. С его помощью возможно построение генетических карт вирусов, в которых определяется, в каких участках генома произошли мутации, а также в условных единицах измеряется расстояние между разными мутациями.
Пересортировка генов. Вариантом рекомбинации является феномен, получивший название пересортировки генов. Она наблюдается при генетических взаимодействиях между вирусами, имеющими сегментированный геном. Образующиеся при этом гибридные формы вирусов называют реассортантами. Реассортанты вирусов гриппа получают при совместном культивировании вирусов с разными генами гемагглютинина и нейраминидазы. В этом случае из общего потомства путем нейтрализации соответствующих антигенов можно выделить интересующие исследователя варианты.
Существуют определенные группировки (констелляции или созвездия) генов, которые в данной системе клеток более стойки и делают вирус более жизнеспособным.
Сходные процессы пересортировки генов имеют место у вирусов гриппа типов А, В и С и у других вирусов с фрагментарным геном – у буньявирусов, аренавирусов (однонитчатые РНК) и реовйрусов (ротавирусов) (двунит-чатая РНК), Однако эти процессы не столь интенсивны и доступны изучению, как у вирусов гриппа.
Гетерозиготность. При совместном культивировании двух штаммов вируса может происходить формирование вирионов, содержащих в своем составе два разных генома или по крайней мере один полный геном и часть второго генома. Это явление названо гетерозиготностью.
Комплементация. Комплементация (дополнение) является таким видом негенетического взаимодействия при смешанной инфекции двумя вирусами, которое стимулирует репродукцию обоих партнеров или одного из них, но не изменяет генотипы вирусов. Принцип комплементации заключается в том, что вирус снабжает партнера недостающими компонентами, обычно белками, структурными или неструктурными.
Комплементация широко распространена среди вирусов и встречается как между родственными, так и неродственными вирусами. Феномен тесно связан с проблемой дефектности вирусов.
Поскольку в вирусной популяции помимо стандартных обычно присутствуют дефектные неинфекционные вирусные особи, в частности дефектные частицы, утратившие часть генетического материала, комплементация имеет место в инфекционном цикле многих вирусов и заключается в том, что члены популяции снабжают друг друга продуктами генов, которые дефектны у партнеров (негенетическая реактивация). Отличие комплементации от генетической рекомбинации заключается в отсутствии обмена генетическим материалом.
Комплементация встречается и у неродственных вирусов, принадлежащих к разным семействам. Одним из семейств, вирусы которого наиболее часто участвуют в комплементации, является семейство аденовирусов. В одних системах аденовирусы могут действовать как дефектные вирусы, в других – как помощники. Например, в культуре клеток почек макак резусов аденовирусы могут репродуцироваться только в присутствии SV40, который является в данном случае вирусом-помощником. В других системах сами аденовирусы действуют как вирусы-помощники, а вирусомсателлитом является аденоассоциированный вирус, относящийся к семейству парвовирусов. Репродукция этого вируса полностью зависит от комплементирующего действия аденовирусов. Вирус гепатита В является помощником для дельта-агента, который покрывается его наружным белком – HBs-антигеном. Сочетание обоих вирусов обнаружено при наиболее тяжелых формах гепатита.
Возможна не только межцистронная, но и внутрицистронная комплементация в том случае, когда один ген кодирует несколько белков.
Фенотипическое смешивание. При совместном культивировании двух вирусов может наблюдаться феномен фенотипического смешивания, когда геном одного вируса бывает заключен в капсид, состоящий частично или полностью из белков другого вируса.
Фенотипическое смешивание наблюдается при смешанной инфекции многими вирусами, причем эти вирусы могут быть как близкими друг другу (например, вирусы гриппа А и В или разные серологические подтипы вируса гриппа А), так и весьма далекими (онковирусы и рабдовирусы).
Культивирование вирусов — выращивание вирусов в искусственных условиях путем заражения животных, культур клеток и тканей. Культивирование вирусов производят в диагностических целях (выделение от больных и носителей), при экспериментальной работе (изучение вирусов), для производства вирусных вакцин и диагностикумов.
Гальтье (V. Galtier) впервые осуществил в 1879 г. культивирование вируса бешенства, заразив кролика мозгом больной собаки. Левенштейн (A. Lowenstein, 1919) первый опубликовал данные об успешной передаче вируса герпеса от человека кролику. Грютер (W. Gruter, 1920) доказал возможность культивирования вируса герпеса на кроликах. Способность вируса вакцины (коровьей оспы) репродуцироваться в тканевой культуре была доказана Паркером и Наем (F. Parker, В. N. Nye) в 1925 г. В 1931 г. Вудрафф (А. М. Woodruff) и Э. Гудпасчер показали возможность К. в. на хорион-аллантоисной оболочке эмбрионов кур (вирус оспы птиц).
Вирусы репродуцируются только в живых клетках, поэтому для их накопления заражают вирусами животных или культуры клеток и тканей. При этом происходит адаптация вируса, полученного из организма больного или носителя, к новым условиям. Чем меньше отличается искусственная система от естественной, тем легче осуществляется адаптация вируса.
Для оптимальной репродукции вируса необходимо использовать наиболее чувствительную систему и проводить заражение сильно разведенным свежим материалом, поскольку инактивированные вирусные частицы могут тормозить размножение инфекционных вирионов. Система, в к-рой вирус проходит полный цикл репродукции, носит название пермиссивной (разрешающей). В непермиссивной (неразрешающей) системе происходит неполный цикл репродукции вируса либо он вообще не репродуцируется. Пермиссивная для данного вируса система может стать для него непермиссивной при изменении условий культивирования, напр, при изменении температуры.
На животных культивируют те вирусы, которые вызывают у них четкую клиническую или патологоанатомическую картину (напр., развитие у мышей параличей при заражении вирусом бешенства или пневмонии при гриппозной инфекции). Многие вирусы лучше растут в мало-дифференцированных тканях эмбрионов птиц и новорожденных млекопитающих, чем в организме взрослых особей.
Для Культивирования вирусов используют мышей, крыс, морских свинок, кроликов, сирийских хомячков, африканских хорьков, обезьян, кур и др. На взрослых мышах культивируют вирусы гриппа, бешенства, многие тогавирусы; мыши-сосунки незаменимы при выращивании ряда вирусов Коксаки и тогавирусов ряда ареновирусов — возбудителей вирусных геморрагических лихорадок.
Сосунков белых крыс и сирийских хомячков часто используют для культивирования онкогенных вирусов. Морские свинки служат для выращивания вирусов ящура, марбургской болезни и др. Из обезьян наиболее часто используют зеленых африканских мартышек и разные виды макаки. Так, изучение вирусов полиомиелита и желтой лихорадки стало возможным после их адаптации к организму макак. Культивирование возбудителей некоторых медленных инфекций (куру, болезни Крейтцфельдта—Якоба), а также вирусов гепатитов А и В впервые удалось при заражении шимпанзе. Чувствительными к вирусу гепатита А также оказались южноамериканские обезьяны мармозеты.
Для получения стандартных результатов животные, используемые для работы с вирусами, должны быть генетически однородными. Этой цели служит инбредное скрещивание лаб. животных — братьев и сестер или родителей и детей, чем достигается возрастающая степень гомозиготности.
Для успешного К. в., помимо вида и возраста животных, имеет значение путь введения материала, что обусловлено тропностью вируса. Поэтому в большинстве случаев для размножения вируса в организме животного необходима его инокуляция в чувствительную ткань. Лишь некоторые вирусы патогенны для животных при любых способах инокуляции (напр., вирус венесуэльского энцефалита лошадей для мышей).
Большинство нейротропных вирусов культивируют путем введения их в полушария головного мозга животных. Этим путем заражают мышей различными тогавирусами, буньявирусами и другими арбовирусами. Вирус бешенства вводят таким же образом мышам, кроликам, овцам и собакам, вирус лимфоцитарного хориоменингита — мышам и морским свинкам. При культивировании вируса полиомиелита на обезьянках его инокулируют в спинной мозг или таламус головного мозга. Часто при культивировании нейротропных вирусов их вводят животным в брюшную полость, однако этот путь инокуляции уступает по чувствительности внутримозговому. Респираторные вирусы культивируют обычно путем интраназального заражения — их закапывают в нос наркотизированным животным или вводят в виде аэрозоля в специальной камере.
Аденовирусы инокулируют сирийским хомячкам подкожно или в слизистую оболочку защечных мешков, вирус герпеса обезьян — кроликам внутрикожно, а оспенные вирусы — на скарифицированную кожу (кроликам, телятам, курам). Вирусы оспы и герпеса можно культивировать на скарифицированной роговице кролика. Введение вирусов в мышцу, внутривенно, через рот и per rectum применяют редко. Внутривенное заражение морских свинок, хомячков и хорьков технически сложно, вместо этого материал чаще вводят в полость сердца.
Культивирование вирусов на животных очень затрудняется наличием в их организме различных бактерий, микоплазм и вирусов, которые могут загрязнить культивируемый вирус. Иногда вирус, находящийся в организме животного, создает иммунитет к культивируемому вирусу, напр, возбудитель эктромелии у мышей к вирусу вакцины.
Для уменьшения риска загрязнения культивируемых вирусов посторонними возбудителями все чаще используют животных, выращенных в условиях изоляции. С этой целью получают животных, свободных от специфических для данного вида патогенных агентов,— SPF (specific pathogen free). У их матерей не должно быть инфекций, передающихся через плаценту. Детенышей извлекают при помощи кесарева сечения, вводят им в кишечник апатогенные бактерии, напр, молочнокислые, после чего они вскармливаются SPF самками. В дальнейшем эти животные размножаются обычным путем. Содержат их в закрытых помещениях, куда подается стерильный воздух, пища, вода и пр.
Животных, свободных от всяких возбудителей, содержат в специальных боксах в условиях еще более строгой изоляции (см. Стерильные животные).
Эмбрионы птиц с их малодифференцированными тканями пригодны для культивирования очень многих вирусов. Для получения оптимальных результатов имеет значение вид и возраст эмбрионов, путь заражения, введенная доза и температура инкубации. Чаще всего используют эмбрионы кур. Они наиболее чувствительны до 13-го дня инкубации. Инокулируют вирусы обычно на хорион-аллантоисную оболочку, в желточный мешок, аллантоисную и амниотическую полость; в мозг эмбрионов и внутривенно (в сосуды оболочек) вирусы вводят редко. В желточном мешке культивируют многие тогавирусы; вирусы гриппа и инфекционного паротита хорошо культивируются в амниотической полости 10 —11-дневных эмбрионов, при этом вирус гриппа размножается не только в клетках амниона, но также в трахее и легких эмбриона. Вирусы оспенной группы и др. культивируют на хорион-аллантоисной оболочке, заражая 10—13-дневные эмбрионы через естественный воздушный мешок или через отверстие на боковой поверхности яйца после создания искусственного воздушного мешка. При заражении любым путем эмбрионы могут быть травмированы, поэтому их гибель в первые 24 часа расценивается как неспецифическая. Оптимальное количество вируса при заражении — 1000 — 10 000 инфекционных доз. К. в. в эмбрионах обычно происходит при t° 36—37°. Некоторые вирусы, напр, вирус вакцины, могут размножаться при температуре выше 40°, в то время как возбудитель натуральной оспы необходимо культивировать при температуре не выше 38,5°. Температурно-чувствительные мутанты вирусов, обладающие, как правило, сниженной патогенностью, культивируют при t° 25—28°.
При размножении в эмбрионах вирусы могут вызвать их гибель (многие арбовирусы, вирус энцефаломиокардита и др.), появление изменений на хорион-аллантоисной оболочке (оспенные вирусы) или в теле эмбриона, накопление в эмбриональных жидкостях гемагглютининов (вирусы гриппа, паротита) и комплементсвязывающего вирусного антигена.
Большинство известных вирусов можно выращивать в культурах клеток и тканей (см.). Чаще всего используют однослойные первичные или перевиваемые клеточные культуры на стекле, реже применяют суспензионные культуры. К первичным культурам клеток вирусы адаптируются легче, чем к перевиваемым. Вирусы человека лучше всего размножаются в культурах человеческих клеток и почечных клеток обезьян.
Оптимальная доза вируса при заражении — 0,1—0,001 50% тканевой цитопатической дозы вируса на клетку. Объем инокулята должен быть небольшим. Адсорбцию вируса проводят в течение 1—2 час. при t° 37°, после чего инокулят удаляют, если он токсичен для клеток. Питательная среда должна иметь pH 6,9 — 7,2. Если к ней прибавлена сыворотка, последняя не должна содержать антител или неспецифических ингибиторов по отношению к культивируемому вирусу. Наиболее интенсивная репродукция большинства вирусов происходит при t 36 — 37°; при более низкой температуре (33°) культивируют риновирусы.
При К. в. с целью их выделения из инфицированных органов весьма эффективно культивирование клеток самой исследуемой ткани после ее трипсинизации (напр., ткани миндалин для выделения аденовирусов).
Размножение большинства вирусов сопровождается цитопатическими изменениями. Максимальное количество вируса в культуре обычно наблюдается при дегенерации 75% клеток. Размножение вирусов, не обладающих цитопатической активностью, можно установить с помощью реакции гемадсорбции (многие миксо- и тогавирусы), методом иммунофлюоресценции, путем исследования культуральной жидкости на наличие гемагглютининов (напр., миксовирусы) или комплементсвязывающего вирусного антигена, а также в опытах на животных (вирус бешенства). Некоторые вирусы можно выявить по их способности подавлять размножение цитопатогенного вируса, т. е. по феномену интерференции (напр., в культурах клеток эмбрионов кур, инфицированных вирусами лейкоза птиц, не размножается вирус саркомы Рауса). Некоторые вирусы образуют в клетках включения.
Большинство вирусов после размножения в клетках выходит в культуральную среду, ряд других остается связанным с клетками (вирусы оспы, аденовирусы), некоторые герпетические вирусы необходимо пересевать вместе с неповрежденными клетками, поскольку при разрушении клеток они инактивируются. Иногда при взаимодействии вируса и клетки развивается хроническая инфекция. Напр., инфицированные вирусом лимфоцитарного хориоменингита перевиваемые человеческие клетки могут продуцировать инф. вирус в продолжение многих поколений.
Для выращивания коронавирусов человека и некоторых других используют тканевые культуры, т. е. культивируемые вне организма тканевые фрагменты. Чаще всего используют ткань трахеи кролика. О размножении вируса в этом случае судят по прекращению движения ресничек культуры ткани.
Следует учитывать возможность присутствия в культурах клеток и тканей различных вирусов и микоплазм. Они могут быть внесены вместе с клетками, если последние взяты из инфицированного организма, попасть из трипсина или используемой в качестве ингредиента питательной среды сыворотки.
Адаптация вируса к искусственным условиям размножения требует проведения нескольких пассажей, быстро следующих друг за другом при заражении небольшой дозой вируса. Обычно интенсивность репродукции вируса при этом значительно возрастает. Иногда вирус после адаптации к одной системе приобретает способность размножаться также в других системах. Свежевыделенные вирусы более пластичны, чем долго культивировавшиеся в каких-либо одних условиях. К. в. в искусственных условиях нередко приводит к снижению их патогенности для естественных хозяев, чем пользуются для получения вакцинных штаммов. В неблагоприятных условиях культивирования (малочувствительных системах или при заражении слишком большой дозой) могут формироваться дефектные вирусные частицы, содержащие лишь часть генома или не имеющие нуклеиновой к-ты. Некоторые вирусы вообще не удается культивировать в искусственных условиях или их репродукция прекращается после нескольких пассажей.
Сохранять вирусы в течение нескольких дней можно при t° 4° в среде с pH ок. 7,0. Устойчивость их возрастает при удалении клеточных фрагментов и прибавлении сыворотки (10%), глицерина (50%) или обезжиренного молока (50%). Все вирусы хорошо сохраняются при t° —70° и ниже в герметически закрытых сосудах; многие остаются жизнеспособными месяцы и даже годы. Оспенные вирусы и энтеровирусы хорошо сохраняются при t° —20°. Замораживание вируса должно происходить быстро. Для повышения устойчивости вируса прибавляют к среде сывороточный белок, куриный желток, пептон, сахарозу или глюкозу. Влияние стабилизаторов на разные вирусы неодинаково. Вирусы могут оставаться жизнеспособными длительное время и после лиофилизации. В качестве стабилизаторов при этом используют пептон (10%), молоко (50%), сахарозу с желатиной или куриным желтком (по 10 %). Лиофилизированный вирус должен сохраняться в вакууме или нейтральном газе (напр., азоте) при t° 4° или —15°.
Библиография: Лабораторная диагностика вирусных и риккетсиозных заболеваний, под ред. Э. Леннета и Н. Шмидт, пер. с англ., М., 1974; Соколов М. И., Синицкий А. А. и Ремезов П. И. Вирусологические и серологические исследования при вирусных инфекциях, Л., 1972; Штарке Г. и др. Практическая вирусология, пер. с нем., М., 1970, библиогр.; Comparative diagnosis of viral diseases, ed. by E. Kurstak a. C. Kurstak, v. 1—2, N. Y. a. o., 1977.
Для вирусов характерен дизъюнктивный (от disjuncus — разобщенный) способ репродукции-размножения. Потомство вируса возникает в результате сборки нуклеиновых кислот и белковых субъединиц, которые синтезируются раздельно клеткой хозяина.
Проникновение вируса в клетку и воспроизведение себе подобных проходит в несколько фаз:
1.проникновение в клетку хозяина,
2.синтез ферментов, необходимых для репликации вирусных нуклеиновых кислот,
3.синтез вирусных частей,
4.сборка и композиция зрелых вирионов,
5.выход зрелых вирионов из клетки.
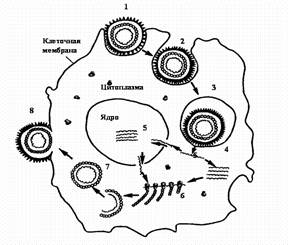
Стадии репродукции вирусов.
1 - адсорбция вириона на клетке; 2 - проникновение вириона в клетку путем виропексиса;
3 - вирус внутри вакуоли клетки; 4 - `раздевание вириона вируса; 5 - репликация вирусной нуклеиновой кислоты; 6 - синтез вирусных белков на рибосомах клетки; 7 - формирование вириона; 8 - выход вириона из клетки путем почкования.
Фаза I — адсорбция вириона на поверхности клетки.
Протекает в две стадии: первая — неспецифическая, когда вирус удерживается на поверхности клетки при помощи электростатических сил, т. е. благодаря возникновению противоположных зарядов между отдельными участками мембраны клеток и вируса. Эта фаза взаимодействия вируса с клеткой обратима, на нее оказывают влияние такие факторы, как рН и солевой состав среды.
Вторая стадия — специфическая, когда взаимодействуют специфические рецепторы вируса и рецепторы клетки, комплементарные друг другу. По химической природе рецепторы клетки могут быть мукопротеидами (или мукополисахаридами) и липопротеидами. Разные вирусы фиксируются на разных рецепторах: вирусы гриппа, парагриппа, аденовирусы — на мукопротеидах, а вирусы клещевого энцефалита, полиомиелита — на липопротеидах.
Фаза II — проникновение вируса в клетку. Электроноскопические наблюдения за процессом проникновения вирусов в чувствительные к ним клетки показали, что оно осуществляется посредством механизма, напоминающего пиноцитоз, или, как чаще называют, виропексис. В месте адсорбции вируса клеточная стенка втягивается внутрь клетки, образуется вакуоль, в которой оказывается вирион. Параллельно клеточные ферменты (липазы и протеазы) вызывают депротеинизацию вириона — растворение белковой оболочки и освобождение нуклеиновой кислоты.
Фаза III — скрытый период (период эклипса — исчезновения). В этот период в клетке невозможно определить наличие инфекционного вируса ни химическими, ни электронно-микроскопическими, ни серологическими методами. О сущности этого явления и его механизмов пока известно мало. Предполагается, что в скрытой фазе нуклеиновая кислота вируса проникает в хромосомы клетки и вступает с ними в сложные генетические взаимоотношения.
Фаза IV — синтез компонентов вириона. В этой фазе вирус и клетка представляют единое целое, вирусная нуклеиновая кислота выполняет генетическую функцию, индуцирует образование ранних белков и изменяет функцию рибосом. Ранние белки подразделяются на:
а) белки-ингибиторы (репрессоры), подавляющие метаболизм клеток
б) белки-ферменты (полимеразы), обеспечивающие синтез вирусных нуклеиновых кислот.
Синтез нуклеиновых кислот и белков протекает неодновременно и в разных структурных частях клетки. У вирусов, содержащих ДНК или РНК, эти процессы имеют некоторые различия и особенности.
Процесс формирования вирионов начинается спустя определенное время после того, как начал осуществляться синтез составляющих их компонентов. Продолжительность этого периода довольно вариабельна и предопределяется природой вируса — для РНК-содержащих обычно короче, чем для ДНК-вирусов. Например, продукция полных вирусных частиц осповакцины начинается приблизительно спустя 5—6 ч после инфицирования клеток и продолжается в течение последующих 7—8 ч, т. е. после того как синтез вирусной ДНК уже завершен.
Между нуклеиновой кислотой и соответствующим белковыми субъединицами образуются очень прочные связи, о чем свидетельствуют трудности отделения белка от вирусной нуклеиновой кислоты. Большую прочность вирусной частице придают входящие в ее состав углеводы и особенно липиды.
Формирование вирионов, так же как и синтез компонентов вируса, происходит в разных местах клетки, при участии различных клеточных структур. После завершения процесса формирования образуется зрелая дочерняя вирусная частица, обладающая всеми свойствами родительского вириона. Но иногда наблюдается образование так называемых неполных вирусов, которые состоят или только из нуклеиновой кислоты, или из белка, или из вирусных частиц, формирование которых остановилось в какой-то промежуточной стадии.
Фаза VI — выход зрелых вирионов из клетки. Существуют два основных механизма выхода зрелых вирионов из клетки:
1) выход вириона с помощью почкования. В этом случае наружная оболочка вириона происходит из клеточной мембраны, она содержит как материал клетки хозяина, так и вирусный материал;
2) выход зрелых вирионов из клетки через бреши в мембране. Эти вирусы не имеют наружной оболочки. При таком механизме выхода вирусов клетка, как правило, погибает и в среде появляется большое количество вирусных частиц.
Причиной гибели зараженной клетки могут быть три механизма:
2.защитная реакция клетки, запускающая генетическую программу ее гибели (апоптоз);
3. иммунная система организма, уничтожающая зараженную клетку.
Кроме продуктивного типа взаимодействия вируса и клетки возможно интегративное сосуществование или вирогения. Вирогения характеризуется интеграцией (встраиванием) нуклеиновой кислоты вируса в геном клетки, а также репликацией и функционированием вирусного генома как составной части генома клетки. Для интеграции с клеточным геномом необходимо возникновение кольцевой формы двунитевой ДНК вируса. Встроенная в состав хромосомы клетки вирусная ДНК называется провирусом. Провирус реплицируется в составе хромосомы и переходит в геном дочерних клеток, т.е. состояние вирогении наследуется. Под влиянием некоторых физических или химических факторов провирус может переходить в автономное состояние с развитием продуктивного типа взаимодействия с клеткой. Дополнительная генетическая информация провируса при вирогении сообщает клетке новые свойства, что может быть причиной развития опухолей, аутоиммунных и хронических заболеваний. На способности вирусов к интеграции с геномом клетки основаны персистенция (от лат. persisto - постоянно пребывать, оставаться) вирусов в организме и развитие персистентных вирусных инфекций. Например, вирус гепатита В способен вызывать персистирующие поражения с развитием хронического гепатита и часто опухолей печени.
Читайте также:


