Вирус aav2 что это
Адено-ассоциированный вирус (AAV) - это дефектный парвовирус человека, свойства которого позволяют использовать его в качестве вектора для переноса генов. Вирусный вектор с высоким титром в норме для человека не патогенен, но в условиях in vitro инфицирует клетки различных типов. Геном AAV представлен одпоцепочечной линейной молекулой ДНК длиной 5 тыс. п.н. AAV дикого типа сайт-специфичным образом интегрируется в особый участок 19-й хромосомы человека длиной 7 тыс. п.н.
Геном AAV фланкирован попарно-инвертированными терминальными повторами (по 145 п.н. каждый), содержащими последовательности, необходимые для упаковки, репликации ДНК и ее интеграции. Кодирующая область содержит две открытых рамки считывания, которые в процессе конструкции вектора удаляются и заменяются одной или более молекулами кДПК вместе с транскрипционными регуляторными единицами.
AAV-векторы связывают трансгенные кассеты (упакованный генетический материал, содержащий более одного гена и предназначенный для вставки в геном клетки.) длиной не более 4-5 тыс. п.н., что лимитирует число их вариантов. Для репродукции AAV-векторов необходима сложная упаковка, включающая белки Rep и Сар, специфические для AAV, и пять аденовирусных белков (Е1А, Е1В, Е2А, Е4 и VA). Столь жесткие требования к упаковке исключают конструкцию линии клеток-хелперов AAV. В настоящее время векторы конструируют путем котрансфекции клеток AAV-всктором и неупаковываемой плазмидой, содержащей присущие AAV белки Rep и Сар.
Вслед за этим трансфектированные клетки инфицируют аденовирусом-помощником дикого типа или мутантным. AAV отделяют от аденовируса путем нагревания и центрифугирования в равновесном градиенте плотности. В работе изложены протоколы конструкции AAV-векторов.
В условиях in vitro AAV-векторы инфицируют многие типы клеток, однако возможность их применения в условиях in vivo остается неопределенной. Неясной остается возможность трансдукции сосудистых эпдотелиальных клеток и ГМК. К дополнительным ограничениям можно отнести отсутствие упаковочных клеточных линий и необходимость коинфекции с аденовирусом, что затрудняет приготовление чистых AAV-векторов в значительных количествах.

Удаление вирусных генов в процессе конструкции вектора ограничивает их способность к сайт-специфичной интеграции, по ставит вопрос о возможности инсерционного мутагенеза. Теоретически AAV векторы весьма привлекательны, однако еще многое предстоит сделать, прежде чем они найдут применение в клинике.
Катионные липиды — это препараты положительно заряженных клеток, которые спонтанно образуют комплексы с отрицательно заряженной ДНК, формируя ДНК-липидные конъюгаты. Липидный компонент способствует доставке ДНK в клетки путем слияния с мембраной плазмиды или с мембранами эндосом после завершения эпдоцитоза. После выхода из эндосом плазмидная ДНК находится вне хромосом.
Катионные липосомы были апробированы в исследованиях по переносу генов в клетки артерий на многих животных моделях, включая крыс, кроликов, собак и свиней. К преимуществам применения катионных липосом следует отнести их благоприятный профиль безопасности, отсутствие вирусных кодирующих последовательностей и ограничений на размер кДНК.
Эти липосомы отличает минимальное токсическое действие на биохимические процессы, гемодинамику и сердечную функцию как у животных, так и у человека. Эти векторы практически готовы к использованию в экспериментах и в клинике, Лимитирует их внедрение низкая эффективность трансфекции и кратковременность генной экспрессии.
Нуклеиновые кислоты и лекарственные препараты в виде полимерных гелей, которыми изнутри покрывали стенты или баллоны, вводили непосредственно в артерии. Использование многих полимеров первого поколения ассоциировалось с интенсивными воспалительными реакциями. Новые составы успешно применяют в разработке стентов с лекарственным покрытием.
06 февраля 2015
- 1325
- 1,1
- 0
- 2
Калифорнийские ученые разработали беспромоторную и безнуклеазную стратегию компенсации мутаций гена свертывающего фактора IX, тем самым избавив от повышенной кровоточивости разновозрастных мышей. Остроумный способ конструирования и введения терапевтического вектора предполагает наименьшее количество возможных побочных эффектов этиологического лечения не только гемофилии B, но и других наследственных заболеваний.
Спектр дефектов генов F8 и F9 чрезвычайно широк: потери целых генов или делеции их фрагментов, инверсии интронов, инсерции, дупликации, сплайсинг-, нонсенс- и миссенс-мутации. В зависимости от типа мутации развивается заболевание определенной тяжести.
Для гемофилий A и B характерен отсроченный геморрагический синдром, обусловленный нарушением первой фазы свертывания крови — образования активного плазменного тромбопластина. При минимальных травмах или даже спонтанно возникают болезненные кровоизлеяния: в мягкие ткани (подкожные, внутримышечные, в забрюшинное пространство, стенки кишечника и др.), в кости и суставы (инвалидизирующие гемартрозы), мозг [5]. Носовые или связанные с удалением зубов кровотечения иногда не удаётся остановить несколько часов.
Профилактика травм и заместительная терапия — все, чем на сегодняшний день располагает больной гемофилией. Замещение недостающего фактора свертывания производится в целях профилактики и купирования кровотечений свежезамороженной плазмой и концентратами человеческих (или полученных из животных) факторов VIII и IX. Но: факторы быстро выводятся из организма, существует риск переноса хронических вирусных инфекций, как и риск выработки ингибиторов — антител, нейтрализующих вводимый антигемофильный фактор. Тогда назначаются антиингибиторные комплексы, плазмаферез и даже иммунодепрессанты.
Недавно начаты клинические испытания некоторых генотерапевтических подходов, однако ни один из них пока не признан безоговорочно безопасным даже теоретически.
Как перенести терапевтический ген в нужные клетки и обеспечить его поддержание?
Аденоассоциированные вирусы (AAV), содержащие одноцепочечную ДНК, почти всем хороши: не вызывают болезней у человека (потому и иммунная система их почти игнорирует), обладают тропизмом к разным тканям, могут производить терапевтические продукты как в виде эписом, так и очень быстро и даже специфично рекомбинировав с хромосомной ДНК. Одно плохо: клонировать в такие векторы можно до 4,5 тыс. нуклеотидов — капсиды миниатюрные. И на некоторые серотипы иммунная система таки реагирует, что выяснилось уже в клинических испытаниях.
Анализ накопленного опыта применения описанных генотерапевтических подходов побудил группу Ади Барцеля, работающую с мутантными по гену F9 мышами-гемофиликами, сделать ставку на аденоассоциированные вирусы (rAAV) и специфичную интеграцию. Только ещё и беспромоторную, и осуществляемую посредством гомологичной рекомбинации без всяких нуклеаз [1].
Мы свой, мы новый ген построим.
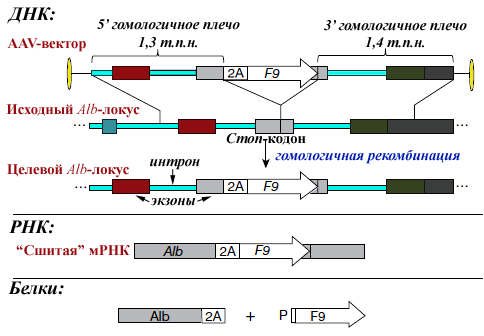
Прежде всего ученые амплифицировали 2,7-т.п.н. участок мышиного гена альбумина, содержащий примерно в середине стоп-кодон (рис. 2), клонировали его между вирусными инвертированными концевыми повторами. А вот дальше авторы использовали новомодный трюк — непосредственно перед альбуминовым стоп-сигналом ввели оптимизированный по кодонам человеческий ген F9, а прямо перед ним — ДНК-фрагмент, кодирующий 2А-пептид (см. справку по 2А-пептидам). В целевой конструкции гены Alb и F9 должны ко-транскрибироваться с единственного Alb-промотора, а трансляция F9 следовать сразу за трансляцией Alb, но полипептиды не будут связаны физически. Специфичность интеграции в геном гепатоцитов должны обеспечивать два (5′ и 3′) плеча гомологии.
И стар и млад мышиный рад — их гемостаз пошёл на лад
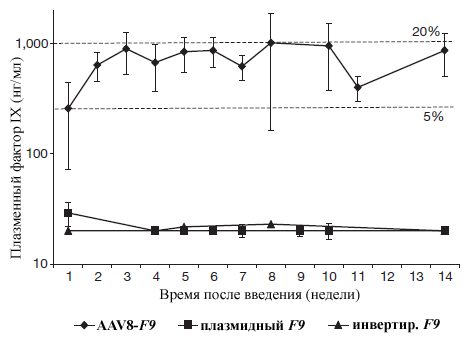
Рисунок 3. Экспрессия человеческого фактора IX (уровень FIX в плазме по данным ELISA) у взрослых мышей, которым в возрасте ввели либо терапевтическую конструкцию (AAV8-F9 получили 7 особей), либо инвертированную (получили 3 особи), либо плазмидную (получили 3 особи). Пунктирными линиями ограничен диапазон от нормального уровня FIX. Рисунок из [1].
Первым делом терапевтический вектор внутрибрюшинно ввели шести двухдневным мышатам в количестве 2,5×10 11 молекул на особь, а контрольный — трем. Начиная с четвертой недели, иммуноферментным анализом (ELISA) еженедельно определяли уровни фактора IX в плазме мышат. У экспериментальной группы уже во время первого измерения они вышли на плато ( от нормы). Известно, что достижение даже может улучшить качество жизни людей, страдающих гемофилией, а радикально снизить кровоточивость. В контрольной группе плазменные уровни фактора IX оставались за пределом детекции, что указывает на отсутствие нецелевого встраивания (или его неуловимо редкие случаи). Эписомную экспрессию исключило быстрое восстановление терапевтического уровня фактора IX после удаления 2/3 печени.
Доказательств много не бывает
Да, хоть и сложно продумывать все нюансы эксперимента и доказывать его успешность, чтобы потом ни один рецензент не подкопался, но в случае генотерапии на кону стоит не только публикация в Nature, а чье-то здоровье. Потому группа А. Барцеля потрудилась на славу.
Вроде бы стройно все получается.
Сомнения и перспективы
Настоящий учёный не перестаёт сомневаться, даже если теория железобетонная и результаты экспериментов проверены и перепроверены. А. Барцеля и соавторов статьи [1], в частности, беспокоит следующее:
Несмотря на понятную осторожность, Ади Барцель и коллеги считают, что их беспромоторная и безнуклеазная интегративная rAAV-стратегия — идеальный кандидат для проведения клинических испытаний не только с целью терапии гемофилии и иных генетических дефектов, но и для компенсации каких-то состояний секрецией нужных белков. Конечно, этот подход не слишком напоминает идеал — замену бракованной детали, но сулит, возможно, самое маленькое кладбище (как у хорошего врача) по сравнению с ранними и даже зреющими методиками генной терапии.
АДЕНОАССОЦИИРОВАННЫЕ ВИРУСЫ (греческое aden — железа и латинское associare — соединять; синоним: аденосателлитные, аденоассоциированные сателлитные вирусы) — мелкие ДНК-содержащие вирусы, размножающиеся только в присутствии аденовирусов; входят в состав группы парвовирусов.
Впервые описаны итальянскими вирусологами Аркетти и Боччарелли (1963).
Аденоассоциированные вирусы обнаруживаются в культурах аденовирусов (см.), изолированных от людей и животных.
Размер частиц аденоассоциированных вирусов 22—24 нм, они обладают кубической симметрией икосаэдрального типа. Их вес 7,5 * 10 6 дальтон. Плавучая плотность большинства частиц в изопикническом градиенте хлористого цезия составляет от 1,38 (типы 1—3 и Х7) до 1,43 г/см 3 (тип 4). Кроме того, имеются более плотные частицы, диаметр которых на 12% меньше, их плавучая плотность составляет от 1,43 (вирус Х7) до 1,47 г/см 3 (А. в. тип 3). В культурах также обнаруживаются пустые капсиды с плотностью 1,33—1,36 г/см 3 .
Предполагают, что капсид аденоассоциированных вирусов состоит из 12 капсомеров. В состав вириона входят три структурных белка с молекулярным весом около 66 тыс., 80 тыс. и 92 тыс. дальтон. Аденоассоциированные вирусы типа 4 и вирус Х7 имеют гемагглютинин. Первый из них наиболее интенсивно склеивает эритроциты человека группы 0 при t° 4°, а второй — эритроциты человека, морской свинки и мыши. При t° 37° наблюдается элюция вируса без разрушения рецепторов эритроцита.
Аденоассоциированные вирусы содержат однонитчатую ДНК с молекулярным весом 1,5—1,7 * 10 6 дальтон. На нее приходится от 18,9 (тип 1) до 26,5% (тип 4) веса вириона, причем гуанин-цитозин составляет от 53% (аденоассоциированных вирусов типа 2) до 58—62% (тип 4) веса ДНК.
аденоассоциированный вирус весьма устойчивы к нагреванию: при t° 80° они инактивируются за 30 мин., а при t° 60° — лишь через 4 часа. Они не изменяются в течение 30 дней при t° 25° и 6 мес.— при t° 2—4°. Устойчивы к действию эфира. Инактивируются ультрафиолетовыми лучами.
Известно несколько серологических типов аденоассоциированного вируса. У приматов встречаются аденоассоциированный вирус четырех типов: у людей типы 1, 2, 3, у обезьян — типы 1, 2, 3, 4. У типов 2 и 3 имеется некоторая антигенная общность. Обнаружены аденоассоциированные вирусы также у крупного рогатого скота (вирус Х7), свиней, собак и кур. Клинически выраженных заболеваний аденоассоциированного вируса, по-видимому, не вызывают. Они нередко выделяются вместе с аденовирусами из глоточных и ректальных смывов у людей при аденовирусных болезнях (см.). Антитела к аденоассоциированных вирусов типов 1—3 обнаруживаются в сыворотках 20—50% людей; инфицирование происходит обычно в раннем детстве. Еще шире данные вирусы распространены среди обезьян (макаки-резусы и зеленые африканские мартышки). Вирус Х7, помимо крупного рогатого скота, может, очевидно, инфицировать людей, поскольку у них найдены соответствующие антитела.
Наличие аденоассоциированных вирусов определяется чаще всего с помощью электронной микроскопии, используется также РСК, преципитация в геле и обработка зараженных клеток флуоресцирующими иммунными сыворотками. Аденоассоциированные вирусы типа 4 и Х7 можно выявить по их способности агглютинировать эритроциты.
Библиография: Blacklow N. R., Hoggan М. D. а. МсСLanahan М. S. Adenovirus-associated viruses, Proc. Soc. exp. Biol. (N. Y.), v. 134, p. 952, 1070; Blacklow N. R. a. o. A seroepidemio-logic study of adenovirus-associated virus infection in infants and children, Amer. J. Epidemiol., r. 94, p. 359, 1971; В о u-cher D. W., Mel nick J. L. a. Mayor H. D. Nonencapsi dated infectious DNA of adeno-satelllte virus in cells coinfected with herpesvirus, Science, v. 173, p. 1243, 1971; Hogg an M. D. Adenovirus associated viruses, в кн.: Progr. med. Virol., ed. by J. L. Melnick, p. 211, MQn-chen — N. Y., 1970; Johnson F. B., Ozer H. L. a. H о g g a n M. D. Structural proteins of adenovirus-associated virus type 3, J. Virol., v. 8, p. 860, 1971; T orpl er G., D’ H a 1 1 ui n J.-C. a. Boulanger P. Electron microscopic observations of KB cells infected with adeno-associated satellite virus, J. Microec. (Paris) , v. 11, p. 259, 1971.
| СТАТЬИ | КНИГИ | ФОРУМ | ГОСТЕВАЯ КНИГА | ССЫЛКИ | ОБ АВТОРЕ |
|---|
Об авторе : Михаил Васильевич Супотницкий - кандидат биологических наук.
Основным объектом при проведении экспертизы на возможность медицинского применения генетических конструкций на основе вирусов, предназначенных для введения генов в геном человека, являются получаемые биотехнологическим путем структуры, имитирующие в организме человека поведение вирусной частицы, но не вызывающие инфекционный процесс. В их состав входят: белки вируса, формирующие оболочку частицы, способную к узнаванию клеток-мишеней и к интернализации в цитоплазму; и трансген-экспрессирующая кассета, осуществляющая после доставки в клетку длительную экспрессию одного или нескольких генов. Распространение в практике генной терапии наследственных и инфекционных болезней приобрели векторные системы на основе лентивирусов, аденовирусов, аденоассоциированных вирусов, ортопоксвирусов, герпесвирусов и отдельных РНК-вирусов, не относящихся к ретровирусам. Достигнутый уровень генной инженерии позволяет создавать векторные системы, нацеленные на разные типы клеток и участки генома человека (векторы на основе ВИЧ). Векторные системы, полученные на основе лентивирусов и аденоассоциированных вирусов, способны интегрировать трансген-экспрессирующую кассету с геномом клеток-мишеней. Псевдотипирование векторов с гликопротеинами оболочки вируса бешенства придает им способность ретроградно транспортировать трансгены по нейрональным аксонам в ЦНС. Для изменения тропизма векторных систем исследователями используются несколько приемов: физический таргетинг, заключающийся в покрытии вирусной частицы специальной оболочкой, изменяющей ее природный тропизм и делающей ее неузнаваемой для иммунной системы человека; и генетическая модификация вируса, предполагающая модификацию белков оболочки вектора. Повышение эффективности транскрипции трансгена в клетке-мишени достигается путем транскрипционального таргетинга, предполагающего введение в трансген-экспрессирующую кассету специфических для данных тканей промоторных последовательностей.
Библиографическое описание: Супотницкий М.В. Генотерапевтические векторные системы на основе вирусов // Биопрепараты. - 2011. - № 3. - С. 15-26.
The main objects of performing the expertise of the possibility of medical application of genetic constructions based on viruses, developed for inserting genes into human genome, are structures derived by biotechnologies, imitating virus particle behavior, but not causing infectious process. They content of viral proteins, forming the particle's coat, able to recognize target-cells and to internalize into cytoplasm; and transgene expression cassettes, performing longtime expression of one or more genes after being delivered to a cell. In gene therapy of hereditary and infectious diseases vector systems based on lentiviruses, adenoviruses, adeno-associated viruses, orthopoxvirus, herpesviruses and single RNA- viruses, which do not relate to retroviruses are widespread. The achieved level of gene engineering allows to create vector systems, aimed at different cell types and parts of human genome (vectors, based on HIV). Vector systems, derived based on lentiviruses and adeno-associated viruses are able to integrate transgene expression cassette into target cells genome. Pseudotyping of vectors with lyssavirus glycoproteins coat provides them with a capability to retrograde transportation of transgenes to CNS by neuronal axons. For the purpose of changing vector systems tropism the scientists use few methods: physical targeting, which means covering virus particle with a special coat, changing it's natural tropism and making it incognoscible for human immune system; and virus genetic modification, which means modifying proteins of vector cover. Increasing of transgene transcription efficacy in a target-cell is performed by transcriptional targeting, which means inserting specific for the given tisues promotor sequences into transgene expression cassette.
Bibliographical description: Supotnitskiy M.V. Genotherapeutic vector systems based on viruses // Biopreparats (Biopharmaceuticals). - 2011. - No. 3. - P. 15-26.
Ретровирусные векторные системы. Ретровирусы относятся к группе вирусов, РНК-геном которых в инфицированных клетках конвертируется в ДНК. Геном ретровирусов включает три структурных гена, обозначенные как gag, pol и env, фланки- рованых элементами, названными длинными терминальными повторами (LTR, viral long terminal repeat). В LTR содержатся регуляторные элементы, выполняющие важные функции в жизненном цикле ретровируса. Эти повторы необходимы для интеграции ДНК копии генома вируса с геномом хозяина. Они определяют, где начало и где конец вирусного генома. LTR также служат энхансер-промоторными последовательностями, т.е. они контролируют экспрессию генов вируса. Большой геном ретровирусов облегчает генетические манипуляции.
После инфицирования клетки-мишени копия ретровирусной ДНК интегрируется с ее геномом строго определенным образом. Практически все инфицированные клетки способны экс- прессировать гены, привнесенные вирусом. Мощные транскрипционные энхансеры существенно повышают уровень экспрессии генов, клонированных в клетках различных типов. С их помощью можно переместить до 8 т.п.о., что в большинстве случаев более чем достаточно для синтеза крупномолекулярных белков. Весьма удобным для исследователя является то обстоятельство, что ретровирусные векторы можно размножать, достигая их высокой концентрации в небольшом объёме - более 10 9 вирусных частиц/см 3 . В опытах по инфицированию ретровирусами мозга, печени, мышц, глаз или клеток панкреатических островков грызунов показана устойчивая экспрессия трансгенов в течение более 6 мес. [9]. Ранние этапы жизненного цикла ретровирусов и векторов на их основе показаны на рис. 1.
Векторы на основе ретровирусов с самого начала их разработки предназначались для введения через неповрежденные клетки за счет механизмов слияния, обеспечиваемых поверхностными белками оболочки вируса. Чувствительность дыхательного эпителия к ретровирусным инфекциям подразумевает возможность ингаляционного пути введения в организм человека векторных конструкций на основе ретровирусов. Сравнение свойств наиболее распространенных генотерапев- тических векторных систем приведено в табл. 1.
Таблица 1. Сравнение свойств наиболее распространенных генотерапевтических векторных систем
Гамма- ретровирусные (MLV, FLV и др.)
Лентивирусные (ВИЧ-1 и ВИЧ-2, FIV, CAEV, EIAV, JDV, MVV и др.)
Вирус герпеса первого типа (HSV-1)
Адено- ассоциированный вирус (AAV)
Плазмидная ДНК (в искусственной векторной системе)
Максимальный размер вставки, т.п.о.
До 30 (на основе рекомбинантного вируса), до 150 т.п.о на основе ампликона
Концентрация (количество вирусных частиц в мл)
Сайт СТУДОПЕДИЯ проводит ОПРОС! Прими участие :) - нам важно ваше мнение.
Варианта вирусных частиц
РЕТРОИДНЫЕ (ПАРАРЕТРО) ВИРУСЫ.
( СОДЕРЖАТ ДНК, НО КОДИРУЮТ ОБРАТНУЮ ТРАНСКРИПТАЗУ)
Эти вирусы используют матричную РНК, построенную на матрице ДНК не только для синтеза белков, но и для репликации дочерних геномов вируса.
Общие свойства параретровирусов:
Кольцевая частично двунитевая геномная ДНК: т е есть одно кольцо полностью и второе, комплементарное ему, незамкнутое и не соответствующее полностью по длине (-)ДНК.
• Небольшой размер генома – примерно 3000-8000 нуклеотидов.
• Обратная транскриптаза (RT) присутствует в составе вирионов.
• Нет необходимости встраиваться в хозяйскую хромосому для успешной репликации. Репликация происходит в цитоплазме, ДНК при этом образует в ядре зараженной клетки эписому – сверхспирализованную замкнутую 2-цепочечную структуру, которая необходима для транскрипции.
• Группа VII ( по Балтимору)
Обнаружены и у животных и у растений. Организованы в 2 семейства:
• Семейство Hepadnaviridae,(заражают только гепатоциты), передаются через кровь, половым путем и вертикально (от матери к ребенку)
род Orthohepadnavirus (млекопитающие) и
род Avihepadnavirus (птицы).
HBV, вирус гепатита B. Вирионы – икосаэдр,
покрытый липидной оболочкой.
• Семейство Caulimoviridae, 7 родов. CaMV,
cauliflower mosaic virus, вирус мозаики цветной капусты. Икосаэдрической или бацилловидной формы, липидная оболочка
отсутствует, заражают растения
род Badnavirus
• 1 – инфекционные частицы Дейна
42 нм;(70% приходится на белок S). Австралийский ген, или HВsAgв крови говорит о носительстве вируса гепатита В и о риске образования карциномы печени.
К 5 концу (-)цепи присоединен белок Р (полимераза, по сути ревертаза). На 5 конце (+) цепи находится фрагмент РНК, т о + и – цепи используют различные затравки для своей репликации.
• 2 – неинфекционные сферические 20нм, это HВsAg (почти только S белок) и мембрана и все. Они накапливаютя, 10 тыс – 1 млн на 1 частицу Дейна, полезно для диагностирования.
• 3 -нитевидные различной длины диаметром 20нм.
Вирионы 2 и 3 содержат только поверхностный антиген HBsAg (S-белок) без геномной ДНК и белка сердцевины (core) и
присутствуют в большом избытке.
Еще раз о белках: HВsAg
3 поверхностных антигена – L(39кДа),M(31кДа),S(24кДа).
• Антиген S – основной компонент оболочки: L и M составляют 2% и 5-10% от общего количества.
• Антиген L необходим для связывания с клеточным рецептором и для созревания вирусных частиц. Взаимодействует с коровой частью вириона и приводит к его переносу через мембрану эндоплазматической сети.
· После попадания в ядро неполная (+) нить ДНК достраивается до полного размера, рибонуклеотидный праймер удаляется с ее 5 конца.
· С 5 конца (-) ДНК удаляется молекула полимеразы
· Все разрывы в молекулах лигируются с помощью ферментов клетки
· Двуцепочечная ДНК вируса гепатита В сверхспирализуется тоже с помощью ферментов клетки, находящихся в ядре
· Итак, в виде такой эписомы ДНК служит матрицей для транскрипции
· Эта эписома в ядре может реплицироваться, но в незначительном количестве, основная репликация вирусного генома будет происходить в цитоплазме
ORF – открытая рамка считывания, HВsAg – зеленый
Есть несколько ORF:
ORF P - revertase.
ORF S/preS - гликопротеиды оболочки
ORF C - белок нуклеокабпсида, С-белок
ORF X HBX, 17 кда, неструктурный белок, трансактиватор экспрессии
генов, основной фактор онкогенного потенциала гепатита Б. Геном
вируса гепатита Б 3.5 кб - небольшой. Здесь опять используется
перекрывание генов - все гены перекрываются. Транскрипция на
эписоме идет с помощью клеточной РНК полимеразы. ранскрибируется
4 мРНК, все кэпировано, полиаденилировано.Промоторы, с которых идет образование этих матричных РНК ,находятся в разных участках генома, а 3 концы идентичны. Начинается их синтез в разных точках, но оканчивается в одной, они котерминальны.
С самой маленькой м-РНК транслируется белок Х.
АУГ белка S находится ближе всего к 5 концу и кэпу, а АУГ М белка находится чуть дальше в другой рамке считывания, а т к эукариотические рибосомы предпочитают 1ый АУГ , белка S на капливается очень много, а белок М инициируется от случая к случаю и его образуется меньше. Аналогично происходит при трансляции прегеномной РНК.
Итак, вот эта РНК является матрицей для белка кора и ревертазы и матрицей для репликации белка.
Оказывается, что длина прегеномной РНК больше самого генома! С нее транслируется тоже 2 белка НВс и полимераза.
В вирусную частицу входит около 200 копий корового белка и всего одна молекула полимеразы. АУГ С белка находится ближе к 5 концу и происходит нормальная кэп-зависимая инициация, эффективная, а АУГ полимеразы находится на некотором расстоянии, тоже со сбоем рамки, и полимеразы образуется очень мало, где-то 1 молекула на вирусную частицу.
Для того ,чтобы начать процесс обратной транскрипции обратная транскриптаза взаимодействует с прегеномной РНК и блокирует трансляцию прегеномной РНК. Трансляции не происходит и начинается формирование кора, в котором и происходит обратная транскрипция. пгРНК длиннее, т к участок геномной РНК при ее транскрипции прочитывается дважды, что приводит к образованию повторов на 5 и 3 концах пг РНК. Повторы довольно крупные, примерно 200нуклеотидов(R-повторы) внутри них более короткие повторы - DR1 (всего несколько нуклеотидов). Кроме того, на 5' 3'-концевого R повтора есть DR2 повтор. Рядом с короткими повторами DR1 есть эпсилон-шпилька на 3 конце. Первый акт при начале репликации – связывание полимеразы со структурой эпсилон инициирует инкапсидирование РНК в капсидный белок и формирование сердцевины вириона и одновременно инициируется процесс обратной транскрипции с образованием короткого фрагмента (-)цепи ДНК (всего несколько нуклеотидов), при этом молекула полимеразы выполняет роль затравки, через тирозин ковалентно связывается с первыми нуклеотидами ДНК, СВЯЗЬ ОСТАЕТСЯ НА ВСЕ ВРЕМЯ И ИМЕННО В ТАКОМ ВИДЕ ПОЛИМЕРАЗА ПОПАДАЕТ В ВИРУСНУЮ ЧАСТИЦУ.
| Р.прямоугольники с циферками - это повторы, по порядку слева направо: 1, 2, 1 |
Итак, на пгРНК строится участок, комплементарный боксу DR1, происходит прыжок полимеразы ,
она транслоцируется в область другого DR1
повтора. Обратная транскриптаза обладает РНКаза Н активностью и постепенно удаляет РНК в гетеродуплексе РНК-ДНК. По непонятным причинам остается небольшой участок прегеномной РНК, ее 5 конец.
Происходит второй прыжок полимеразы между DR2 и DR1, (они комплементарны). Т о образуется свободный 3 конец, необходимый для синтеза (+)ДНК, т е затравкой для синтеза (+)цепи ДНК является фрагмент прегеномной РНК. Ну и происходит синтез этого небольшого участка (+)ДНК с помощью полимеразы. Дальше за счет той же комплементарности (-)ДНК образует кольцо, благодаря этому полимераза переходит на 3 конец (-)цепи и продолжается синтез (+)ДНК. (+)цепь наращивается полимеразой до тех пор, пока сердцевина вириона, в которой идет этот процесс, не связывается с L белком на мембране (он находится в составе мембранной эндоплазматической сети), это связывание ведет к небедленной остановке синтеза (+) нити. Процесс может быть растянут по времени, поэтому разные вирионы могут иметь (+)ДНК разной длины, но никогда (+)ДНК не успевает сделать полный круг. А кусочек пгРНК остается ковалентно связанным с (+)ДНК вируса и в составе вириона.
Итак, репликация идет в цитоплазме, внутри коровой частицы,
которая параллельно формируется из продуктов трансляции. В образовании этих коровых частиц участвуют шапероны клетки, более того часто сами входят в состав созревших вирусных частиц (БТШ 90).
Суммируем: частица взаимодействует с неизвестным пока рецептором, ДНК идет в ядро, там происходит изменение 5' концов, ДНК достраивается, лигируется и образуется эписома, с нее идет транскрипция, затем с прегеномной РНК в цитоплазме связывается обратная транскриптаза и идет
репликация, одноврменно при участии клеточных шаперонов
образуется кор, он связывается с HBS L на ЭПР и репликация
преркащается, при этом +цепь не успевает достроиться. Важно, что
гепатит б распространен неравномерно, очень много его в Китае.
Заражается только один тип клеток, в патогенезе важна иммунная система, 95 процентов излечивается самостоятельно с помощью цитотоксических Т-лимфоцитов. При этом больные теряют часть печени - отсюда симптомы. У 5 процентов слабый иммунный ответ и они становятся хрониками. Сейчас в мире 300млн носителей. Это огромный резервуар и среди них 10 процентов
получают рак печени.
Почему вирус онкогенный? Геном вируса способен интегрировать в клеточный геном. И при этой случайной интеграции вирус нарушает транскрипцию клеточных генов, что очень часто приводит к потере контроля над клеточным делением. Есть другая версия: при интеграции ген Х никогда не теряется, он является транскрипционным активатором, помимо своих, активирует факторы транскрипции самой клетки, ну и, соответственно, белков, которые регулируют клеточные деления.
Семейство Parvoviridae
Около 50 представителей, образуют 2
подсемейства: Parvovirinae (позвоночные) и Densovirinae (насекомые).
• Геном – линейная ssДНК
• Группа II (по Балтимору)
• Различают автономные и дефектные или
ассоциированные парвовирусы (род Dependovirus, аденосателлит AAV2).
Наиболее известный парвовирус, заражающий человека – это парвовирус В-19, он вызывает инфекционную эритему, а у младенцев – пятую болезнь, размножается в крови, костном мозге, в тканях эмбриона, около 70% людей – носители этого вируса.
• Автономные парвовирусы размножаются только в S- фазе клеточного цикла, но не способны стимулировать деление зараженной клетки, они имеют все компоненты для самостоятельного размножения.
• Ассоциированным (дефектными) парвовирусам необходим помощник – адено- или герпесвирус, в его отсутствие способны встраиваться в геном
клетки-хозяина (провирус) и таким образом спасаются(очень четко, в 19 хромосому человека и поэтому к образованию опухолей не приводит). Помощник стимулирует транскрипцию клетки.
Дальше все обсуждаем на примере AAV2.
2 открыты рамки считывания (регулят и структур белки).
Проникают в различные типы клеток посредством эндоцитоза.. В кислой среде эндосомы вирионы претерпевают конформационные изменения,выходят в цитоплазму. Терминальный участок белка VP1 обладает активностью фосфолипазы и обеспечивает транспорт фирусных частиц через эндолизосому.
Оказавшись в цитоплазме, вирусные частицы транспортируются по микротрубочкам к ядру и проникают через ядерные поры (размер позволяет). В ядре ДНК освобождается от капсида и начинается репликация, она осуществляется ДНК-полимеразой клетки.
Прописная и заглавная буквы на картинке – это участки, комплементарные между собой. Благодаря вторичной структуре мол-лы не нужно никакой затравки, полимераза сразу же может начинать свою работу.
-Половина дочерних нитей ДНК аденосателлита имеет положительную, а другая – отрицательную полярность.
• Часть материнской молекулы входит в состав дочерней молекулы ДНК.
• Нуклеотидная последовательность концевых повторов у дочерних молекул ДНК отличается от последовательности родительской ДНК.
• Происходит инверсия нуклеотидной последовательности внутри концевого повтора.
• Структура концевой последовательности (инвертированный повтор) сохраняется
• Изменения не затрагивают смысловых нуклеотидных последовательностей (как кодирующих, так и регуляторных) и не влияют на репликацию вируса.
| | | следующая лекция ==> | |
| Тема 14. Процесс объективации внутреннего духовного мира человека | | | Историография сравнительной политики |
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Читайте также:


