Титр вируса метод рида и менча
Этот метод более универсален. Количество вируса (титр вируса) при этом измеряется в эффективной 50% дозе – ЭД50.
1 ЭД50 = доза вируса, способная вызывать инфекционный эффект у 50% зараженных тест-объектов.
Для каждого вируса подбирают чувствительный к нему тест-объект - лабораторные животные (обычно белые мыши), куриные эмбрионы или культура клеток. Инфекционный эффект или действие вируса на разных тест-системах может проявляться гибелью, клиническими симптомами, патологоанатомическими изменениями и цитопатическим эффектом. У лабораторных животных и куриных эмбрионов действие вируса оценивается в летальной и инфекционной дозах:
1 ЛД50 - доза вируса, убивающая 50% лабораторных животных;
I ЭЛД50 - доза вируса, убивающая 50% куриных эмбрионов;
1 ИД50 - доза вируса, вызывающая клинические симптомы или патологоанатомические изменения у 50% зараженных лабораторных животных;
1 ЭИД50 - доза вируса, вызывающая патологоанатомические изменения у 50% зараженных куриных эмбрионов.
В культуре клеток действие вируса оценивается по цитопатическому эффекту или действию (ЦПД):
1 ЦПД50 - доза вируса, вызывающая цитопатический эффект в 50% пробирок с зараженной культурой клеток.
Количество ЭД50 (ЛД50, ЭЛД50, ИД50, ЭИД50 и ЦПД50) вируса, содержащееся в единице объема вируссодержащего материала, будет выражением титра вируса в этом материале. Так, запись Т = 103.48 ЦПД50/0,1 мл означает, что в каждом 0,1 мл вируссодержащего материала содержится 103.48 доз, каждая из которых способна вызвать цитопатический эффект в 50% пробирок с культурой клеток.
Метод титрования вирусов по 50% инфекционному действию пригоден для титрования практически любого вируса, если подобрать чувствительную к нему живую тест-систему. Недостатком является трудоемкость, длительность и необходимость статистического расчета.
Методика определения титра вируса в единицах 50% инфекционного действия (ЛД50, ЭЛД50, ИД50, ЭИД50 и ЦПД50) заключается в том, чтобы найти такое разведение испытуемого вируссодержащего материала, в объеме заражающей дозы которого содержалась бы одна ЭД50, а затем рассчитать, сколько таких единиц вируса содержится в таком же объеме вируссодержащего материала. Это и будет титр вируса. Для этого:
1) из исследуемого вируссодержащего материала готовят ряд последовательных 10-кратных разведений. Количество разведений необходимо делать больше (т.е. столько, чтобы последнее наиболее высокое уже не давало инфекционного эффекта совсем). Для 10 последовательных разведений в каждую из 10 стерильных пробирок наливают по 9 мл стерильного физиологического раствора, а затем в первую вносят ровно 1 мл исследуемой суспензии. Перемешивают содержимое первой пробирки, набирают 1 мл смеси и вносят во вторую пробирку, перемешивают содержимое и 1 мл из второй пробирки - в третью, и т. д,
2) одинаковыми объемами каждого разведения вируссодержащего материала заражают чувствительных к данному вирусу живых тест-объектов. В каждой их группе требуется не менее 4-6 тест-объектов (для статистической достоверности);
3) по истечении времени учитывают результат действия вируса на зараженные объекты (гибель, заболевание, патологоанатомические изменения или цитопатический эффект). Гибель лабораторных животных, КЭ впервые 48 часов считают неспецифической. Учет заканчивают через 2 -3 суток после прекращения падежа;
4) определяют, в каком разведении вирус проявил свое действие на 50 % чувствительных объектов. Действие вируса определяют в ЛД50, ЭЛД50, ИД50, ЭИД50 и ЦПД50. Считают, что доза в этом разведении соответствует 1 ЭД50. Дозу вируса подсчитывают различными методами (по Риду и Менчу, Керберу).
Для проведения титрования из исследуемого вируссодержащего материала готовят ряд последовательных десятикратных разведений от 1:10, т.е. 10 -1 до 1:10.000.000, т. е. 10 -7 , и более (10 -1 , 10 -2 , 10 -3 , 10 -4 , 10 -5 и т.д.). Количество разведений зависит от предполагаемого титра вируса, их нужно готовить столько, чтобы последнее (наиболее высокое) разведение уже не давало бы инфекционного эффекта. Инфекционное действие вируса (величина инфекционного эффекта) с каждым разведением убывает пропорционально логарифму разведения (или дозы). То есть при разведении 1:100 (10 -2 ) инфекционное действие уменьшается в два раза, если 1:1000 (10 -3 ) в три раза и т. д.
Каждым разведением исследуемого вируссодержащего материала в определенном одинаковом объеме заражают равные группы чувствительных к данному вирусу живых тест-объектов (лабораторных животных, куриные эмбрионы, культуры тканей). При этом учитывают тропизм и дозы вируса, общепринятые для данного способа введения материала. В каждой группе должно быть не менее 4-6 тест-объектов, т. к. при меньшем количестве статистическая обработка материала будет иметь слишком большую погрешность.
Однако, при определении титра вируса очень трудно подобрать такие разведения, чтобы одно из них в точности вызывало бы гибель 50% зараженных животных. Часто при титровании количество живых и павших животных бывает неравным. В этом случае для более точного определения титра широко используют в вирусологии метод, предложенный Ридом и Менчем. Они рекомендуют при титровании брать в опыт большое количество групп по 4-6 чувствительных моделей в каждой группе. Отклонение от истинной величины ЛД50, обусловленное применением малого количества подопытных животных в группе, исправляется тем, что при исчислении процента летальности оперируют данными кумулятивной летальности (кумуляция - накопление).
Метод Рида и Менча основан на логической предпосылке о том, что животные (и другие модели), погибшие при заражении каким-либо разведением вируса, например 10 -5 , погибнут и при заражении более низким разведением (10 -4 , 10 -3 ) вируса. Если же животное не пало при данном разведении, то останется живым и при заражении более высоким разведением (10 -6 , 10 -7 ). На этом основании полученные результаты подвергают интерполяции и выражают их в виде кумулятивных данных, на основании которых рассчитывают % летальности.
При вычислении кумулятивных данных мышей, павших от более высокого разведения, прибавляют к числу погибших от более низкого разведения. Мышей, оставшихся живыми от более низкого разведения, прибавляют к числу животных, не погибших от более высокого разведения (направление показано стрелкой). После получения кумулятивных данных определяют % летальности. Процент летальности для каждого разведения вычисляют по формуле:
%летальности = Кол-во павших (кумулятивные данные)/Кол-во зараженных (кумулятивные данные) х 100
Разведения, при которых % летальности приближаются к 50%, называют высшей и низшей критической дозой.
ЛД50 определяют по формуле:
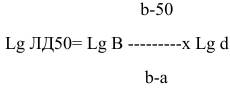
,
где ЛД50 - искомое разведения вируса; В - разведение, вызывающее гибель более 50% животных; b - процент летальности, соответствующий разведению В; а - процент летальности, соответствующий разведению, дающему гибель менее 50% животных; d - коэффициент разведения.
Титр вируса, выраженный числом с дробным показателем степени, обычно в таком виде и оставляют. Его можно легко превратить и в абсолютную величину с помощью таблицы антилогарифмов (4-х значные математические таблицы Брадиса). По таблице антилогарифмов находят абсолютное значение разведения, соответствующее 1 ЛД50.
Дата добавления: 2014-12-17 ; просмотров: 8061 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Читайте также:
|
1. Готовят ряд последовательных 10тикратных разведений из исходного ВСМ.
2. Начиная с последнего (максимального) разведения заражают по 4 куриных эмбриона или культуры клеток. В случае гибели подсчитывают количество оспин (бляшек). В первых разведениях будет слишком много оспин, их не подсчитать, поэтому берут разведение 10 -4 , где видны отдельные оспины.
В 1м – 10, во 2м – 12, в 3м – 10, в 4м – 12 (к примеру)
Подсчитывают среднее арифметическое = 11.
3. Титр определяют по формуле: 
n – среднее арифметическое количества оспин в 1 эмбрионе (11)
V – объем ВСМ (0,2 мл)
а – степень разведения вируссодержащего материала, в котором подсчитали количество оспин (1/10000)
Т = 11*10000/0,2 = 550000 ООЕ/см 3
Метод имеет ограниченное применение, потому что очень мало вирусов вызывают локальные поражения биологических моделей.
У большинства вирусов определяют титр в LD50.
73 Определение титра вируса. Методика расчета ЛД50 по Риду и Менчу.
Определение титра вируса в LD50 по способу Рида, Менча
1. Готовят ряд последовательных 10тикратных разведений, начиная с максимального разведения заражают по 4 биологических модели каждым разведением.
2. Абсолютные данные о гибели зараженных эмбрионов заносят в протокол.
3. Определяют кумулятивные данные (накопительные). При подсчете кумулятивных данных количества выживших эмбрионов суммируют вышестоящую цифру с нижестоящей, начиная с маленькой. Считают, что если эмбрион выжил при введении большей дозы, то выживет и при введении меньшей дозы. При подсчете кумулятивных данных количества павших эмбрионов суммируют нижестоящую цифру с вышестоящей. Считают, что если эмбрион погиб при введении меньшей дозы, то он погибнет и при введении большей дозы.
4. Определяют % летальности: кумулятивное количество Павших * 100 / (кумулятивное количество павших + кумулятивное количество выживших)
5. Определяют коэффициент пропорциональности.
10 -8 – высшая критическая доза, летальность = 54% (ВКД)
10 -9 – низшая критическая доза, летальность = 29% (НКД)
КП = (% летальности ВКД -50) / (% летальности ВКД - % летальности при НКД) = (54-50)/(54-29) = 0,16
Т = ВКД – КП = 10 -8 – 0,16 = 10 -8,16 = LD50/0,2 см 3
8 – характеристика, показывает, сколькизначным будет конечный результат (+1)
16 – мантисса. С помощью мантиссы по таблице антилогарифмов находят число (1445)
1:144500000 LD 50 /0,2см 3
1 LD50 = 1:144500000 в 0.2 см 3
10 LD50 = 1:14450000 в 0,2 см 3
100 LD50 = 1:1445000 в 0,2 см 3
1000 LD50 = 1:144500 в 0,2 см 3
Чтобы приготовить такое разведение, готовят сначала 10тикратные разведения (7 пробирок)
0.5 вируса, 4,5 физраствора – как обычно, из последней берут 1 мл жидкости и добавляют 13,45 мл воды. Чтобы получить меньшее разведение – уменьшают количество пробирок (не 7, а 6).
Титрование вирусов необходимо проводить при постановке серологических реакций, например, реакции нейтрализации, а также при получении биологических иммунных препаратов.
РИФ. Техника постановки ее такая же, как и при диагностике аденовирусной инфекции крупного рогатого скота. Обращают внимание на свечение антигена в цитоплазме и перинуклеарной зоне неповрежденных клеток. Ярко-зеленая флюоресценция в виде гранул или диффузного свечения цитоплазмы не менее чем в 10% клеток позволяет оценить препарат как положительный. Предварительный диагноз ставят при наличии не менее 30% положительных препаратов от общего количества исследованных проб. В мазках из влагалища и конъюнктивы специфическую флюоресценцию отмечали через 24 ч, из препуция - через 48, из носа и трахеи-через 72 ч после заражения. Присутствие специфического антигена удается подтвердить заражением культуры клеток почки телят, в которой обнаруживается специфическая перинуклеарная и диффузная цптоплазматическая флюоресценция, свойственная ринотрахеитной инфекции. Использование культуры клеток почки кролика позволяет освободиться от неспецифического свечения.
Совпадаемость результатов РИФ и патогистологических изменений составляет 87%, а иммунофлюоресценции и вирусологических исследований - 44%. При параллельном исследовании сывороток в РН и РИГА результаты совпадали в 94% случаев.
В полевых условиях РИФ оказалась положительной в 18,5%, а метод вирусовыделения - в 15,9% случаев.
Таким образом, РИФ можно использовать для экспресс-диагноз диагностики ИРТ с последующим подтверждением диагноза вирусологическими методами.
РН. При наличии ЦПД в культурах клеток, зараженных изолятом, и положительной нммунофлюоресценции проводят окончательное типирование вируса в РН. Перед ее постановкой специфическую и отрицательную сыворотки разводят в соотношении 1:10 раствором Хенкса или питательной средой для кулыуры клеток, содержащих ангионотики, и прогревают в водяной бане 30 мин при 56 °С. РН ставят общепринятым методом в первичной культуре ПЭК или перевиваемой линии клеток МДВК.
Результаты РН учитывают по ЦПД вируса, для чего определяют титр типируемого изолята в присутствии специфической и отрицательной (контрольной) сывороток. Титр рассчитывают по методу Рида и Менча и выражают в lg ТЦД 50/мл.
Затем вычисляют индекс нейтрализации (И) по формуле И = Т1 : Т2,
где Т1 — титр изолята в присутствии контрольной сыворотки; Т2 — титр изолята в присутствии специфической сыворотки.
Видовую принадлежность изолята устанавливают при разности в титрах вируса не менее 2 lg. При индексе нейтрализации от 1 lg до 2 lg реакцию считают сомнительной, в этом случае ее повторяют. Индекс нейтрализации менее 1 lg считают отрицательным. При положительных результатах РН изолят считают полностью идентифицированным.
Приготовление гипериммунной сыворотки для РН. Гипериммунную вируснейтрализующую сыворотку готовят по следующей схеме: подкожно вводят кроликам 1 мл культурального вируса с адъювантом Фрейнда, далее следует трехкратное внутривенное введение вируса в объеме 1 мл с интервалом через 7 дней. Через 10 дней после последней инокуляции вируса кроликов обескровливают, сыворотку замораживают и хранят при минус 30 °С.
РТГА. Ставят ее микрометодом при 4 °С с 0,5 — 1%-ной взвесью эритроцитов белых мышей, разбавитель — трис-буферный раствор с 0,2% бычьего сывороточного альбумина. В качестве антигена используют культуральную вируссодержащую жидкость, которую концентрируют ПЭГ-6000 или ультрацентрифугированием.
После обнаружения гемагглютинирующего агента, определения его гемагглютинирующего титра готовят 4 ГАЕ и проводят его идентификацию в РТГА с эталонной положительной сывороткой.
Иммуноферментная идентификация вируса. Иммунопероксидазный метод можно использовать для исследования прижизненно взятых нозофарингиальных мазков-отпечатков в клетках, полученных из легочных
Кроме того, рекомендован непрямой антикомплементарный иммунопероксидазный метод (НАИП) для лабораторной идентификации вируса ИРТ. Методика заключается в следующем: на покровных стеклах, в пробирках готовят чувствительную культуру клеток к вирусу ИРТ (ПЭК, ТБ и др.) по общепринятой методике. Монослой заражают исследуемым вирусом. Через 48 ч стекла с инфицированными клетками извлекают, отмывают в фосфатно-буферном растворе с рН 7,2-7,4 и фиксируют в охлажденном ацетоне 5-10 мин.
На фиксированный монослой клеток наносят 1-2 капли смеси из специфической иммунной сыворотки и комплемента морской свинки в разведении 1:10. Перед работой противовирусные сыворотки сорбируют гетерологичными исследуемыми вирусами, т. с. получают моносыворотки. При обработке контрольных препаратов на монослой наносят смесь комплемента и нормальной сыворотки.
Препараты инкубируют во влажной камере при 37 °С в течение 40-60 мин, затем промывают проточной водой 5-10 мин, слегка подсушивают и обрабатывают меченной пероксидазой антикомплементарной сывороткой (1-2 капли), предварительно разведенной 1:20 фосфатным буфером, и снова помещают препарат на 40-60 мин во влажную камеру при 37 °С. Затем их промывают, подсушивают и для выявления образовавшегося комплекса (антигенан-титело-пероксидаза) на препарат наносят на 40-60 мин бензидиновый реагент (50 мг бензидина в 100 мл трис-НС1-буфера с рН 6,8 с добавлением после фильтрации 6-7 капель 3%-ной перекиси водорода на каждые 5 мл рабочего раствора). Препарат выдерживают во влажной камере, промывают в дистиллированной воде, высушивают, монтируют на предметном стекле и изучают в световом микроскопе под объективом с иммерсией.
При световой микроскопии непрямой антикомплементарный иммунопероксидазный метод обеспечивает четкое выявление вирусного антигена в цитоплазме инфицированных клеток в виде окрашенных в коричневый цвет образований, которые видны при увеличении в 140 раз.
Специфичность показателей, полученных этим методом, подтверждается постановкой специальных иммунологических контролей. При постановке перекрестной иммунопероксидазной реакции с гетерологичными антителами эта реакция имеет выраженный видоспецифический характер: антиген реагирует только с гомологичной сывороткой. Эндогенная пероксидаза в культуре клеток ПЭК и LF не выявляется.
Непрямой антикомплементарный иммунопероксидазный метод является перспективным при диагностике острых респираторных вирусных инфекций крупного рогатого скота.
При использовании иммунопероксидазного метода для индикации вируса ИРТ в культуре клеток ПЭК антиген выявляется через 18, 22 ч после заражения. Три прямых серологических метода быстрого обнаружения вирусных антигенов (РИФ, иммунопероксидазный и ELISA) одинаково применимы для обнаружения вируса во время лихорадки, но не на поздних стадиях болезни.
Вирусный антиген обнаруживают в носовых смывах методом ELISA с 3-го по 10-й день после заражения. В конъюнктивальных смывах его выявляют на 5-е сутки.
Идентификация вируса ИРТ посредством рестрикционного анализа вирусной ДНК. Описаны метод клонирования фрагментов генома вируса ИРТ, выделение и характеристика рекомбинантного ДНК-зонда, который позволяет определять вирус в клинических пробах. С помощью метода дот-блот-гибридизации выявлена ДНК вируса ИРТ в пробах спермы, полученной от серопозитивных животных, когда выделение вируса в культуре клеток давало отрицательный результат. Хороший результат также получен при использовании инфицированных культур клеток.
Серодиагностика и ретроспективная диагностика. Антитела к вирусу ИРТ можно обнаружить в сыворотках крови больных и переболевших животных в РН, РНГА и др. Для постановки ретроспективного диагноза используют парные пробы сывороток, взятые с интервалом в 3 нед. Результат серодиагностики учитывают по возрастанию титра антител в парных пробах сыворотки, а также числа серопозитивных животных через указанный интервал. Перед исследованием сыворотки прогревают в водяной бане при температуре 56 °С в течение 30 мин.
РН. Ставят методом разведения испытуемых сывороток с постоянной дозой вируса в культуре клеток 'ПЭК или ТБ. Вирус предварительно титруют в культуре клеток. Для этого сухой вирус ИРТ из набора диагностикумоя стерильно разводят в объеме, указанном на этикетке, и готовят из него десятикратные разведения от 10 -1 до 10 -6 на питательной среде (конечный титр су.хого вируса указан на этикетке).
Разведение готовят в общем объеме 5 мл, затем заражают по 4 пробирки с культурой клеток, предварительно отмытой от ростовой среды, каждым разведением вируса в объеме I мл. Зараженные и контрольные культуры клеток (4-6) инкубируют при 37 °С, ежедневно учитывают ЦПД вируса заключительно — на 5-7-е сутки.
Титром вируса считают обратную величину его наибольшего разведения, вызывающего ЦПД в 50% культур клеток, который высчитывают по методу Рида и Менча пли Кербера и выражают в ТЦД50/мл. Титры 1:32, 1:64 обнаруживаются редко. В неблагополучных по данной болезни стадах ВНА выявляются у 12% клинически здорового скота. Ретроспективный диагноз на ИРГ ставят при 4-кратном и более приросте AT в пробах сывороток реконвалесцентов. В настоящее время широко используют микрометод РН.
РНГА. Биологическая промышленность нашей страны выпускает эритроцитарный диагностикум. РНГА ставят согласно методическим указаниям в микропанелях с U -образными лунками наборов микротитрования Такачи или Титертек по общепринятой методике. Результаты РНГА с используемыми сыворотками оценивают по титрам; положительные – 1:16 и выше, сомнительные - 1:8, отрицательные - 1:4, 1:2 и нулевые. Увеличение титров АТ в парных сыворотках в 2-4 раза свидетельствует о наличии инфекции. Применяя РНГА, можно обнаружить AT в более ранний период инфекции, чем с помощью РН. Установлено соответствие результатов РНГА и РН в 95% случаев. С помощью данной реакции легче и быстрее, чем РН проводить типирование АТ к вирусу ИРТ. Титры AT были в 7-10 раз выше выявляемых в РН.
РДП. Не нашла широкого применения в диагностической практике, исследователи рекомендуют её использовать для серодиагностики ИРТ. По наличию ПА можно уловить недавно прошедшую инфекцию, в то время как ВНА длительно циркулируют в организме, и заболевание можно уловить по парным сывороткам. При выявлении ПА кровь лучше брать на 8-й и последуюшие дни болезни.
РТГА. Может использоваться для выявления и количественной оценки AT к вирусу ИРТ. Титр анти-ГА коррелирует с титром ВНА. Положительный результат РТГА уже в 1-ом разведении сыворотки (1:4) указывает на наличие AT к вирусу ИРГ в данной пробе сыворотки.
4-кратный и более прирост титров анти-ГА в парных пробах сыворотки является показателем активной инфекции.
ELISA. Широко применяют в Нидерландах, США, Великобритании, Швеции, странах бывшего СССР. Он оказался пригодным для обнаружения AT к вирусу ИРГ в молоке. Для этого достаточно получения проб смешанного молока от 5-10 коров. AT определяют после предварительного концентрирования в них Ig. Совпадаемость данных серологических реакций в пробах сыворотки крови и молока составляла 92,8%. С помощью данного метода можно оперативно определять иммунологический статус поголовья лактирующих коров целого региона, а также проводить обследование экспортируемых и импортируемых животных. В ФРГ разработан и применяется метод ТРАХИТЕСТ для ИФА проб сборного молока поров с целью диагностики скрытого вирусоносительства.
Предложен непрямой метод IgM-ELISA для определения недавней инфекции ИРТ. Ранние AT IgM выделены на 6-й дн после заражения, к 9-му дн происходил рост титра AT Ig, a к 13-му дн - ВНА. У телят, привитых инактивированной вакциной, раннего иммунного ответа не происходило - AT IgM не выявлялись, a IgM и ВНА появлялись позже, чем после заражения. Однако при этом следует иметь в виду, что наличие в сыворотке КРС ревматоидного фактора может привести к ложноположительным результатам диагностики в IgM-ELISA. В этом случае предварительная обработка проб сыворотки антибычьими IgM позволяет избежать ложноположительных результатов. Тест IgM-ELISA имеет большую ценность в диагностике ИРТ, особенно у молодых животных. В группе позитивных сывороточных проб корреляция между ELISA и РНГА составляла 98,3%, a EL1SA с ИФ - 95,7%.
ELISA с использованием монАТ. Основан на конкуренции между AT сыворотки крови КРС и нейтрализующими мышиными монАТ. Для его проведения лунки микротитрационных панелей обрабатывают очищенным вирусом ИРТ, и после высушивания их можно использовать немедленно или хранить при - 20°С. В обработанные вирусом лунки панелей последовательно вносят неразведенную испытуемую сыворотку, специфические к вирусу ИРТ монАТ, конъюгированные пероксидазой, субстрат пероксидазы. Результаты реакции учитывают в спектрофотометре при А405. В случае положительной реакции связывание монАТ ингибируется AT сыворотки крови. Метод оказался намного чувствительнее и специфичнее РН.
Аннотация научной статьи по ветеринарным наукам, автор научной работы — Неминущая Л.А., Скотникова Т.А., Токарик Э.Ф., Ковальский И.В., Еремец Н.К.
На модели вирусвакцины против ньюкаслской болезни проведена автоматизация процесса статистической обработки экспериментальных результатов определения инфекционной активности вирусвакцины с помощью специализированных программных сред. Методологические подходы могут быть применены для автоматизации статистической обработки других вирусологических и микробиологических исследований.
Похожие темы научных работ по ветеринарным наукам , автор научной работы — Неминущая Л.А., Скотникова Т.А., Токарик Э.Ф., Ковальский И.В., Еремец Н.К.
ЭКОЛОГИЧЕСКИЕ ПРОБЛЕМЫ ПРОИЗВОДСТВА
Л. А. Неминущая, Т. А. Скотникова, Э. Ф. Токарик, И. В. Ковальский, Н. К. Еремец, Ю. Д. Фролов, В. И. Смоленский, З. А. Канарская
ПРИМЕНЕНИЕ СТАТИСТИЧЕСКИХ МЕТОДОВ В БИОТЕХНОЛОГИЧЕСКИХ ИССЛЕДОВАНИЯХ
ЧАСТЬ 2. СТАНДАРТИЗАЦИЯ УСЛОВИЙ ОПРЕДЕЛЕНИЯ ТИТРА ИНФЕКЦИОННОСТИ ВИРУСА
Ключевые слова: вакцина, культивирование вируса, титр, реакция гемагглютинации, метод Кербера, стандартизация,
На модели вирусвакцины против ньюкаслской болезни проведена автоматизация процесса статистической обработки экспериментальных результатов определения инфекционной активности вирусвакцины с помощью специализированных программных сред. Методологические подходы могут быть применены для автоматизации статистической обработки других вирусологических и микробиологических исследований.
Keywords: a vaccine, virus cultivation, titre, hemagglutination, hemagglutination reaction, a method of Kerbera, standardization, the
On model virusvaccine against Newcastle disease automation of process of statistical processing of experimental results of definition of infectious activity ND virus by means of specialised program environments is spent. Methodological approaches can be applied to automation of statistical processing of other virologic and microbiological researches.
Актуальность. Вакцины - это препараты, содержащие живые или инактивированные микроорганизмы (вирусы или бактерии), являющиеся возбудителями инфекционной болезни. Путем введения в организм человека или животного ослабленных или инактивированных
микроорганизмов в количестве, которое не может вызвать заболевание, но достаточном, чтобы организм начал реагировать на них, вырабатывается невосприимчивость организма, то есть иммунитет. При повторной встрече, но уже с настоящим (живым) возбудителем болезни организм человека или животного в состоянии предупредить заражение или ослабить последствия заболевания.
Живые вакцины содержат ослабленные живые микроорганизмы. Они способны размножаться в организме и вызывать выработку защитных факторов, которые обеспечивают невосприимчивость человека и животного к данному патогену [1]. Живые вакцины готовят, в основном, в сухом виде. Это связано с тем, что живые вакцинные штаммы микроорганизмов (вирусов и бактерий) весьма чувствительны к неблагоприятным факторам, возникающим при хранении, транспортировке и применении, особенно в условиях повышенных температур. Поэтому жидкие живые вакцины имеют короткие сроки годности и узкий температурный интервал (плюс 8 -10 °С) хранения и транспортировки
Традиционная технология изготовления сухих живых вирусных вакцин включает следующие основные этапы:
- размножение вируса в чувствительной к нему биологической системе (культуры клеток и тканей, эмбрионы птиц, организмы животных);
- приготовление вируссодержащих суспензий;
- смешивание с защитной средой;
- укупорка и этикетирование;
- контроль готовой формы вакцины по основным показателям качества [2, 3, 4, 5].
Согласно международным требованиям качество вирусных вакцин обеспечивается тремя основными показателями: безопасность,
эффективность и стабильность [6, 7].
Для культивирования вирусов предложены различные методы, однако для получения их в больших количествах, для целей изготовления противовирусных специфических препаратов с 30-х годов XX в. применяется размножение в организме восприимчивых животных, в частности, в развивающемся курином эмбрионе (КЭ), а также в тканевых культурах. Большинство известных вирусов, в том числе вирус ньюкаслской болезни (НБ), обладают способностью размножаться в курином эмбрионе. По сравнению с культурами клеток КЭ значительно реже контаминированы вирусами и микоплазмами, а также обладают сравнительно высокой жизнеспособностью и устойчивостью к различным воздействиям. Однако нельзя полностью гарантировать стерильность этой живой системы, так как эмбрионы могут нести в своем содержимом вирусы и другие патогенные агенты (вирусы инфекционного бронхита кур, ньюкаслской болезни, гриппа, лейкоза, хламидии и микоплазмы), которые могут искажать результаты исследования. Поэтому в настоящее время используют СПФ-эмбрионы (СПФ - свободные от патогенного фактора), для получения которых используют специальные технологии выращивания и контроля [1, 6, 8].
Согласно требованиям ВОЗ [9] при тестировании любого материала (объекта) необходимо использование эталонной серии (ЭС) -образца для сравнения, который предварительно должен быть охарактеризован для получения статуса эталонного. Это особенно важно, когда для контроля используют тест-системы биологической природы (например, культуры клеток и тканей, куриные эмбрионы, лабораторные животные), нестандартность которых может привести к получению ошибочных результатов.
По рекомендациям ВОЗ ЭС применяется для следующих целей:
- определение биологической активности при серийном производстве препаратов;
- комиссионное испытание препарата в случае возникновения спорных ситуаций;
- испытание нового биологического препарата;
- сравнение результатов научных исследований.
В производстве фармацевтических лекарственных средств используются хорошо поддающиеся стандартизации химико-
фармацевтические субстанции, химические и физические методы, обеспечивающие высокую степень стабильности качества самих лекарств и технологических процессов их изготовления. В отличие от них производство иммунобиологических препаратов (ИБП), в частности, вакцин, связано с биологическими материалами и сложными многооперационными процессами, и подвержено влиянию различных факторов (качество питательных сред, растворов и вирусного сырья, методов сушки, способов оценки биологических свойств полученных препаратов и т.д.). Это приводит к непостоянству спектра и природы конечных продуктов. Поэтому необходимо применение статистических методов анализа, сбора, систематизации данных для всех показателей качества [10, 11].
Контроль качества в данной отрасли относится к разрушающим видам контроля, это определяет его выборочный характер, который характеризуется применением статистических методов обработки результатов [12, 13]. Обязательной частью процесса производства является анализ характера разброса данных, количественная характеристика величины разброса и сравнение с нормативными показателями. Эталонные серии препаратов используют для стандартизации условий определения: титра инфекционности вируса, безвредности и иммуногенности образцов вакцины. В качестве эталонной серии используют часть серии вакцины, приготовленной в соответствии с нормативной документации в стандартных условиях. Образцы эталонной серии хранят при температуре Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Формула расчета дозы (титра) вируса по методу Кербера:
ЬяЭИД50/мл = - с(ЕЬ1 - 0.5), (1)
где - максимальное разведение вирус
содержащего материала, с - логарифм кратности разведения, Ь1 - отношение числа эмбрионов, которые при введении данного разведения вируса дали положительную реакцию ГА, к общему числу эмбрионов, инокулированных данным разведением вируса, ЕЫ - сумма значений Ь1, найденных для всех испытанных разведений. Для каждого значения титра вычисляется стандартная ошибка, которая впоследствии повлияет на значение стандартизации эксперимента.
Стандартная ошибка вычисляется по формуле:
(8эид50)2 = ^(^(1 - рО/(т - 1)), (2)
где И - интервал между разведениями (десятикратный), Р1 - вероятность положительного ответа в РГА, п1 - количество эмбрионов в одном разведении, используется при расчете доверительного интервала.
Результаты обсчета экспериментальных данных методом Кербера можно обрабатывать статистически. Однако в доступной нам литературе не найдено конкретных рекомендаций по автоматизации этого процесса.
Цель представленной работы - на модели вирусвакцины против ньюкаслской болезни
стандартизовать метод определения активности вакцинного вируса и автоматизировать процесс статистической обработки экспериментальных результатов, используя специализированные программные среды.
Стандартизацию титра инфекционности вируса НБ проводили путем многократного титрования образцов эталонной серии вакцины на различных партиях РКЭ в течение 3,5 лет. В результате получена матрица из 135 значений титра инфекционности вируса эталонной серии.
Анализ результатов многократного (n = 135) определения титра инфекционности ЭС складывается из:
- определения характера статистического распределения вероятностей экспериментальных данных;
- определения вариабельности данных по наличию "временного дрейфа";
- определения вариабельности данных по наличию сезонной изменчивости чувствительности КЭ к вирусу НБ;
- определения среднего значения титра ЭС и его доверительного интервала.
Предобработку результатов экспериментов по методу Кербера в модификации Ашмарина проводили с использованием приложения MS Excel из пакета офисных программ компании Microsoft -MS Office. В результате получены следующие базы данных (с разбивкой по сезонам).
Таблица 1 - Исходные данные
(титры вируса эталонной серии, ^ЭИД5(/мл)
зима весна лето осень
01.09* 9,8 03.09 9,1 06.10 9,1 09.10 8,7
8,8 9,3 07.10 9,1 9,5
02.09 8,6 8,4 9,4 10.10 8,9
12.10 9,3 04.09 9,6 08.10 8.5 9,4
8,7 8,6 8,6 11.10 8,9
9,4 9,1 9,3 09.11 9,2
01.11 8,9 05.09 9,0 06.11 9.4 8,5
02.11 9,0 8,9 8,7 10.11 8,8
9,0 03.11 9,1 9,6 8,8
9,1 8,7 07.11 9,4 11.11 8,2
12.11 9,3 8,9 9,0 09.12 9,0
01.12 8,4 04.11 9,4 08.11 8,6 9,9
8,8 9,0 8,8 10.12 9,5
9,5 8,9 06.12 8,8 11.12 9,3
02.12 9,2 05.11 8,5 9,2
Примечание. *01.09 - январь 2009 и так далее.
Поскольку получение экспериментальных данных данных связано с биообъектами, на которые
влияет множество факторов, характер распределения данных не определен. Это говорит о том, что данные носят статистический характер взаимосвязи и работа с ними требует использования статистической модели [18].
Алгоритм обработки представленной базы данных был следующим:
1. Описание материала.
1.1. Расчет выборочных характеристик распределения.
1.2. Построение гистограмм и полигонов частот.
2. Оценивание. Непараметрические оценки плотности и функции распределения.
3. Проверки гипотез.
3.1 Параметрические задачи проверки гипотез.
- Проверка равенства математических ожиданий для двух нормальных совокупностей.
- Проверка равенства дисперсий для двух нормальных совокупностей.
3.2 Непараметрические задачи проверки гипотез.
- Проверка гипотезы согласия с нормальным семейством распределений по критерию типа Колмогорова-Смирнова.
- Проверка гипотезы однородности выборок с помощью критерия Уилкоксона.
Первой ступенью статистического анализа является проверка распределения на близость к нормальному распределению, поскольку она является необходимой предпосылкой для корректного применения большинства классических методов математической статистики [19].
Алгоритм оценки нормальности
складывается из анализа гистограммы распределения, графика Р-Р и обобщенных показателей (асимметрия и эксцесс). Если же эти методы не дают четкого описания нормальности распределения, то проводится проверка нормальности по критериям согласия, например, Колмогорова-Смирнова или Шапиро-Вилкса. Выбор критерия зависит от объема выборки [20].
В соответствии с поставленными задачами, в работе использованы следующие статистические модели их решения:
- Построение гистограммы и вычисление обобщенных показателей выборки; - Анализ данных на наличие сезонной изменчивости;
- Проверка на наличие временного дрейфа титра инфекционности вируса ЛРЭС;
- Расчет доверительного интервала.
Статистические критерии, примененные в этой работе, подробно описаны в статье [21].
Построение гистограммы и вычисление обобщенных показателей выборки. Для того чтобы проанализировать распределение по гистограмме, на ней выводится кривая распределения (графическое представление общей закономерности изменения ряда данных). Если эта линия имеет колоколообразную симметричную форму, то можно сделать предположение, что распределение считается нормальным.
По графику Р-Р можно сделать предположение о близости распределения к
нормальному: чем ближе к прямой нормальности расположены точки на графике, тем распределение ближе к нормальному.
График 0-0 используется для поиска в определенном семействе распределений того распределения, которое наилучшим образом описывает имеющиеся данные.
Анализ гистограммы распределения и графика 0-0 позволяет судить о нормальности распределения выборки, а также вычислить основные обобщенные показатели: выборочное среднее, выборочную дисперсию и стандартное отклонение; моду и медиану; асимметрию и эксцесс.
При реализации этого шага получены следующие результаты, отображенные на рис. 3, 4
Рис. 3 - Гистограмма распределения значений титра вируса ЭС (К=135;среднее значение = 9,0 ^ЭИД50/мл; стандартное отклонение = 356 ^ЭИД5о/мл)
Рис. 4 - График для ЭС с прямой
Исходя из изображений можно сделать предположение о нормальности распределения, т.к. гистограмма имеет колоколообразную форму, а на графике большинство точек располагается
очень близко к прямой.
По значениям асимметрии и эксцесса можно сделать предположение о близости распределения значений к нормальному
распределению, т. к. их значения имеют один ранг и близки к нулю.
Поскольку объем выборки п = 135 (> 50) для подтверждения предположения о нормальности выборки применен критерий Колмогорова-Смирнова.
Таблица 2 - Обобщенные статистические показатели титра инфекционности вируса ЭС
Статистический показатель Значение Стандартная ошибка
Титр Среднее 8,999 0,4308
95% доверительный интервал для среднего Нижняя граница 8,938
Верхняя граница 9,059
Стандартное отклонение 0,3976
Асимметрия 0,083 0,209
Эксцесс 0,034 0,414
Для выборки размером N=135 критическое значение = 0,117. Из неравенства Вэксп Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Методологические подходы могут быть применены для автоматизации статистической обработки данных других вирусологических и микробиологических исследований.
Перспективность внедрения на
промышленных биотехнологических предприятиях средств автоматизации статистической обработки результатов, полученных в ходе МБИ, особенно важна в связи с необходимостью соответствия системы обеспечения качества
иммунобиологических препаратов международным и национальным требованиям.
1. Сергеев В.А., Непоклонов Е.А., Алипер Т.И. Вирусы и вирусные вакцины. Библионика. М. 524 с. (2007).
2. Самуйленко А.Я., Василевич Ф.И., Воронин Е.С. Биотехнология: Уч. РАСХН. М. 746 с. (2012).
3. Скотникова Т.А. Авт. дисс. д-ра биол. наук, Щелково. 48с. (2010).
4. Школьников Е.Э., Еремец Н.К., Павленко И.В., Неминущая Л.А., Скотникова Т.А., Токарик Э.Ф., Бобровская И.В., Филимонов Д.Н., Гаврилов В.В., Ковальский И.В., Канарская З.А., Хусаинов И.А. Вест. Казан. технол. унив. Т. 17. № 13. с. 255 - 263 (2014).
5. Неминущая Л.А., Скотникова Т.А., Титова Е.И., Провоторова О.В., Еремец Н.К., Бобровская И.В., Канарская З.А. Вест. Казан. технол. унив. Т. 15. № 4, с. 69 - 74. (2012).
6. Скотникова Т.А., Неминущая Л.А., Еремец Н.К., Самуйленко А.Я., Кржижановская Е.В., Чулков А.К. III Межд. вет. Конг. по птицеводству. М. с.58 - 59. (2007).
7. Смоленский В.И., Зуев Ю.В., Руденко Т.В., Горева И.П. Ветеринария. № 1. с 44 - 47. (2011).
8. Самуйленко А.Я., Соловьев Б.В, Непоклонов Е.А., Воронин Е.С., Фомина Н.В., Гринь С.А., Белоусов В.И., Мельник Н.В., Рубан Е.А., Еремец В.И., Сапегина Е.П., Ямникова С. С., Цыбанов С. Ж. Инфекционная патология животных. Т. 2. ИкЦ Академкнига. М. 8007с. (2006).
9. Комитет экспертов ВОЗ по стандартизации биологических препаратов. 41 доклад. Женева. С. 22 -24. (1994).
10. Неминущая Л.А., Еремец О.В., Скотникова Т.А., Еремец Н.К., Токарик Э.Ф., Еремец В.И, Самуйленко А.Я., Безгин В.М., Егоров В.Е., Ганяев А.М. Ветеринарный врач. № 5, с. 29 - 32. (2010).
11. Неминущая Л.А., Скотникова Т.А., Токарик Э.Ф., Еремец Н.К., Люлькова Л.С., Бобровская И.В., Еремец О.В., Малышева М.А., Метод. пособие по применению статистических методов для оценки стабильности технологического процесса производства лекарственных средств для ветеринарии. Утв. РАСХН. М. 28с. (2011).
12. Белоусова Р.В., Троценко Н.И., Преображенская Э.А.. Практикум по ветеринарной вирусологии. Колос. М. 248 с. (2006).
13. Белоусова Р.В., Преображенская Э.А., Третьякова И.В.. Ветеринарная вирусология, Колос. М. 424 с. (2007).
14. Стандартизация результатов по титрованию инфекционности вирусов. Комитет экспертов ВОЗ по стандартизации биологических препаратов, СТД ВОЗ. № 658 (31-й доклад). Женева. С. 157-173. (1981).
15. ТУ 10-19-212-86. Вирусвакцина сухая против ньюкаслской болезни птиц, штамм Ла-Сота.
16. Метод. указания по определению по определению уровня антител к вирусу ньюкаслской болезни в РТГА. № 13-7-2/988. (1997)
17. Реброва О. Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ ВТАТКТГСА, М. 79с. (2003).
18. Стентон Г. Медико-биологическая статистика. Практика. М. 459 с. (1999).
19. Гмурман В.Е. Теория вероятностей и математическая статистика. Высшая школа. М. 480 с. 1997.
21. Павленко И.В., Самуйленко А.Я., Еремец В.И., Бобровская И.В., Нежута А.А., Канарский А.В., Канарская З.А. Вест. Казан. технол. унив. Т. 16. № 8 (3). с. 226-232. (2013).
22. Павленко И.В., Самуйленко А.Я., Раевский А.А., Еремец В. И., Нежута А. А., Канарский А. В., Канарская З.А. Вест. Казан. технол. унив. Т. 16. № 8 (3). с. 220-226. (2013).
23. Самуйленко А.Я., Раевский А.А., Павленко И.В., Еремец Н.К., Бобровская И.В., Канарский А.В., Канарская З.А. Вест. Казан. технол. унив. Т. 16. № 9. с. 165-171. (2013).
24. Павленко И.В., Самуйленко А.Я, Еремец В.И., Нежута А.А., Канарский А. В., Канарская З. А. Вест. Казан. технол. унив. Т. 16. № 9. с. 171 - 176. (2013).
25. Павленко И.В., Самуйленко А.Я, Еремец В.И., Нежута А.А., Канарский А.В. Вест. Казан. технол. унив. Т. 16. № 9. с. 176 - 181. (2013).
Читайте также:


