Репликация ретровирусов осуществляется по схеме
Стратегия репликации ретровирусов основана главным образом на заражении чувствительных клеток при контакте с инфекционными вирусными частицами и направлена на установление долгосрочной персистирующей инфекции, способной распространяться как вертикально (при делении клеток), так и горизонтально (от клетки к клетке).
Ретровирусы (за исключением лентивирусов ) не уничтожают инфицированные клетки. После проникновения в клетку РНК ретровирусов служит матрицей для синтеза линейной двухцепочечной комплементарной ДНК (кДНК) при участии фермента обратной транскриптазы (ревертазы) . На последующих этапах происходит интеграция полученной ДНК в хромосому клетки-хозяина.
Цикл развития ретровирусов ( рис. 192.1 ) состоит из двух этапов.
На первом этапе вирусы адсорбируются на специфических мембранных рецепторах клетки и проникают в цитоплазму, где при участии обратной транскриптазы на матрице вирусной РНК образуется двухцепочечная ДНК - провирус . Затем провирус переходит в ядро, встраивается в геном клетки-хозяина и сохраняется в таком состоянии в течение длительного времени. Хотя некоторые ретровирусы животных встраиваются только в один определенный участок генома во всех зараженных клетках, четыре ретровируса, патогенных для человека ( Т-лимфотропный вирус человека типа 1 , Т-лимфотропный вирус человека типа 2 , ВИЧ-1 и ВИЧ-2 ), встраиваются в клеточную ДНК случайным образом.
Первый этап репродукции полностью осуществляется вирусными белками и нуклеиновыми кислотами.
На втором этапе происходит синтез и процессинг вирусных геномов, мРНК и белков при участии структур клетки-хозяина, что тоже во многом контролируется продуктами вирусных генов. В дальнейшем происходит сборка вирусов и выход их из клетки путем отпочковывания; при этом белки клеточной мембраны нередко включаются в состав внешней оболочки вирусов.
Более последовательно жизненный цикл (т.е. период от заражения клетки-мишени до образования инфекционного вирусного потомства) ретровирусов можно разделить на следующие этапы ( рис. 2.14 ):
-> присоединение вируса к рецепторам клетки и последующее слияние мембран;
-> "раздевание" вируса; вирусная РНК освобождается от белков капсида и нуклеокапсида;
-> обратная транскрипция вирусной РНК с участием фермента обратной транскриптазы ; образуется двухцепочечная ДНК-копия вирусного генома;
-> миграция (транслокация) ДНК в ядро клетки; ДНК в составе преинтеграционного комплекса проникает через ядерную мембрану;
-> интеграция ДНК в хромосомную ДНК клетки с участием фермента интегразы; интегрированная ДНК получает название провирусной ДНК;
-> транскрипция провирусной ДНК с участием клеточного фермента РНК-полимеразы; регулируется взаимодействием вирусного LTR с клеточными факторами трансактивации;
-> сплайсинг РНК и транспорт сплайсированной и мРНК из ядра в цитоплазму; синтез вирусных белков с участием клеточных ферментов;
-> транспорт вирусных белков к месту сборки, упаковка и сборка новых вирионов ;
-> отпочковывание и созревание вирусных частиц с участием фермента протеазы.
Обратная транскрипция обеспечивается сочетанием нескольких активностей RT , включая собственно обратную транскрипцию (синтез минус- цепи ДНК на матрице РНК), разрушение РНК в составе образующегося гибрида РНК-ДНК (РНКазаН-активность), расплетание двухцепочечных спиралей ДНК (хеликазная активность) и ДНК-полимеразная активность. Включает несколько этапов ( рис. 2.15 ).
1. Синтез минус-цепи ДНК инициируется присоединением тРНК-праймера к 5'-концевому PBS вирусной РНК, имеющей структуру: 5'-R-U5-PBS-gag-pol-env-U3-R-3'. Синтезируется участок, комплементарный U5 и R, РНКазаН-RT разрушает R и U5 вирусной РНК; образовавшийся фрагмент ДНК носит название минус-цепи strong-stop ДНК, т.к. в этот момент происходит некоторая задержка синтеза.
2. Strong-stop ДНК вместе с RT совершает первый "прыжок" и комплементарно присоединяется к области R З'-конца вирусной РНК, где выступает в роли праймера; по мере элонгации минус-цепи ДНК образуется гибрид ДНК-РНК, РНКазаН-RT разрушает РНК в составе гибрида, за исключением РРТ , сохраняющим связь с ДНК.
3. Используя РРТ в качестве праймера, RT начинает синтез плюс-цепи ДНК; после разрушения РРТ (РНКазаН-RT) образуется плюс-цепь strong-stop ДНК, которая совершает второй "прыжок" и, закрепляясь на участке PBS минус-цепи ДНК, в свою очередь, служит праймером (на этом этапе тРНК утрачивается).
4. Применяя свою ДНК-полимеразную активность, RT достраивает обе цепи с образованием двухцепочечной провирусной ДНК, имеющей структуру с идентичными концами: 5'-U3-R-U5-PBS-gag-pol-env-U3-R-U5-3', соответствующими полной последовательности LTR.
В инфицированных клетках обнаруживают три вида провирусной ДНК: линейную форму и две кольцевые, содержащие два или один LTR. Образование кольцевых форм является результатом разных вариантов лигирования комплементарных друг другу LTR, но инфекционными являются только 2-LTR и линейная ДНК, причем максимально эффективно перемещается в ядро клетки и интегрируется в хромосому кольцевая молекула ДНК.
Гены провирусной ДНК ретровирусов в составе хромосомной ДНК находятся в том же порядке, в каком они расположены в геноме вируса. В результате интеграции происходит укорочение обоих концов вирусной ДНК на два нуклеотида (структура концов одинакова для всех ретровирусов 5'-TG . СA-3'), при этом хромосомная ДНК претерпевает дупликацию на 4-6 нуклеотидов, в зависимости от групповой принадлежности ретровируса; при этом события развиваются следующим образом.
1. В составе рибонуклеопротеидного комплекса, включающего вирусные CA белок , IN белок , RT белок и NC белок , вирусная ДНК попадает в ядро клетки.
2. В результате проявления экзонуклеазной активности IN на 3m-концах вирусной ДНК удаляются по два нуклеотида att-сайта (возможно, этот процесс происходит ранее в цитоплазме); на каждом из 3m-концов формируются гидроксильные (ОН-) группы (3m-процессинг ДНК).
3. Вследствие проявления эндонуклеазной и других активностей IN в хромосомной ДНК создаются одноцепочечные 5m-концы с избытком 4-6 нуклеотидов.
4. Клеточные ферменты репарации ДНК достраивают пробел и, используя лигазную активность IN, ковалентно сшивают концы вирусной и хромосомной ДНК (реакция переноса цепи); на обоих флангах провируса образуются короткие повторы клеточной ДНК.
Хромосома и последовательность ДНК в участке встраивания не имеют существенного значения, в выборе участка интеграции ведущую роль играет, по-видимому, транскрипционная активность участка ДНК. Несколько геномов ретровируса могут быть интегрированы в одну клетку.
Провирусы встраиваются в клеточный геном во время периода S клеточного цикла, поэтому ретровирусы (кроме лентивирусов ) не способны заражать непролиферирующие клетки. Однажды возникнув, ретровирусная инфекция сохраняется пожизненно.
Репликация ретровирусов
Репликативный цикл ретровирусов удобно разделить на пять фаз:
1. ранние события: адсорбция, проникновение и "раздевание";
2. превращение вирусного РНК-генома в полноразмерную неинтегрированную линейную (свободную) ДНК;
3. интеграция вирусной ДНК с хозяйским геномом;
4. экспрессия генов интегрированной вирусной ДНК;
5. синтез вирусных белков и сборка вирионов.

Рис. 1. Репликация ретровирусов и синтез вирусных белков.
По сравнению с другими вирусами, у ретровирусов есть три необычных свойства репликации. Во-первых, вирус должен превратить свой РНК-геном в ДНК. Во-вторых, эта ДНК длиннее, чем вирусная РНК. Это удлинение обусловлено удвоением части последовательности вирусной РНК. Дуплицированные последовательности образуют длинные концевые повторы (LTR – long terminal repeat) вирусной ДНК. Удвоенные последовательности расположены на концах провирусной ДНК. Размер LTR составляет от 0,3 до 1,4 kb в зависимости от вида вируса. Большинство последовательностей, образующих LTR, представлены в РНК лишь одной копией и расположены как на 5’-, так и на 3’-конце. Третья необычная черта ретровирусной репликации – эффективная интеграция свободной ДНК с геномом клетки в строго определенной ориентации, которая зависит от концевых последовательностей обоих LTR.
Фаза I : ранние события. Проникновению вирионов рестровирусов в клетки предшествует специфическое взаимодействие между поверхностным гликопротеином вируса и рецептором клетки хозяина. Сведения о способе попадания вириона внутрь клетки противоречивы: неясно, происходит ли проникновение непосредственно через плазматическую мембрану или путем эндоцитоза. Часть вирионов деградирует в лизосомах, однако не известно, ведет ли этот путь к инфекции или гибели вируса. Так или иначе, на первых этапах заражения вириона переходит в новое состояние, когда он готов начать синтез вирусной ДНК. В какой степени происходит при этом "раздевание" вирионов, остается неясным.
Фаза II : синтез неинтегрированной вирусной ДНК. Главная задача этого этапа инфекции – превратить одноцепочечный РНК-геном в линейную двухцепочечную вирусную ДНК. Синтез вирусной ДНК, который идет в цитоплазме и требует по крайней мере четырех часов, осуществляется обратной транскриптазой (ревертазой). В ходе этого процесса определенные последовательности, присутствующие в виде уникальных копий в РНК, должны быть дуплицированы, чтобы образовать LTR на обоих концах ДНК-продукта. Поэтому главными участниками второй фазы заражения являются ревертаза, последовательности на концах вирусной РНК и LTR.
Синтез вирусной ДНК начинается в течении первого часа после заражения с появлением одноцепочечной ДНК, комплементарной вирусной РНК. Это минус-цепь ДНК, поскольку вирусная РНК служит кодирующей плюс-цепью. Минус-цепь ДНК – единая и непрерывная молекула, хотя она и синтезируется в три этапа с трех различных матриц. Синтез минус-цепи ДНК идет справа налево относительно РНК, поскольку косплементарная цепь имеет противоположную полярность. Вместо того чтобы начаться у 3’-конца РНК, синтез ДНК начинается с тРНК-затравки вблизи ее 5’-конца. На первом этапе синтезируется последовательность, комплементарная фрагментам R и U5, расположенным перед сайтом связывания тРНК-затравки. Эта последовательность, комплементарная самой левой части в РНК, окажется затем самой правой в вирусной ДНК. На втором этапе синтез минус-цепи ДНК продолжается на правом конце одной из двух вирионных РНК и идет влево через сайт связывания тРНК-затравки (tb) возле левого конца РНК. На этих двух этапах образуется правый LTR путем соединения последовательностей, расположенных на левом и правом концах РНК, а также оставшаяся минус-цепь вирусной ДНК, за исключением левого LTR. На третьем этапе образуется левый LTR на матрице предварительно синтезированной плюс-цепи правого LTR.

Рис. 2. Этапы репликации ретровирусного генома от РНК до свободной двухцепочечной линейной ДНК.
Фаза III : интеграция вирусной ДНК.По крайней мере одна копия ДНК оказывается интегрированной с ДНК каждой успешно зараженной клетки, а большинство клеток, продуцирующих вирус, содержит 4-10 копий провирусов. Внедрившись в клеточный геном, провирус в дальнейшем реплицируется и передается дочерним клеткам вместе с остальной ДНК. Первые интегрированные провирусы обнаруживаются через восемь часов после заражения, большинство же копий вирусной ДНК интегрирует в течении трех дней после заражения. Зараженная клетка может вновь заражаться тем же вирусом, пока не приобретет резистентность к заражению в результате образования вирусного гликопротеина. По крайней мере некоторые из провирусов не в состоянии обеспечить продукции вируса, поскольку они не транскрибируются или оказываются повреждены мутациями. Первое вирусное потомство появляется еще до того, как клетка становится устойчивой к суперинфекции (обычно через 1-2 дня после заражения). Поэтому многие зараженные клетки могут вновь инфицироваться вирусами, появившимися в результате первого цикла репликации.
Свободные линейные провирусные ДНК представляют собой предшественники интегрированных провирусов. Для успешного осуществления интеграции необходимы концы LTR, поскольку мутанты, утратившие эти последовательности, не способны к ней. Интеграция требует также неизвестных клеточных факторов.
Анализ последовательностей клонированных провирусов, а также сайта их интеграции с хозяйской ДНК позволил установить как структуру провирусной ДНК, так и те изменения, которые происходят в клеточных последовательностях, прилегающих к месту интеграции, в ходе инфекции. Вирусная ДНК интегрирует с сохранением ДНК: LTR-gag-pol-env-LTR. Однако в клеточном геноме существует много мест, в которые может встроиться провирусной ДНК. Последовательности, в которые он встраивается, обычно не содержат гомологий с вирусной ДНК. Более того, у провирусов нет тенденции включаться в уже существующих в геноме последовательности эндогенных или экзогенных ретровирусов. Эти данные свидетельствуют о том, что провирус может внедриться в любое место хозяйской ДНК.
Фаза IV : экспрессия вирусной ДНК. В хронически инфицированных клетках вирусная РНК считывается с интегрированных провирусов. Свободная ДНК может экспрессироваться, но для сохранения провируса необходима его интеграция. В клетках, содержащих несколько провирусов, обычно бывает трудно разобраться, какой из них транскрибируется. Разные клетки одной популяции могут существенно различаться по уровню экспрессии вируса.
Провирус является транскрипционной единицей с собственными регуляторными последовательностями. Однако экспрессия конкретного провируса зависит как от вирус-специфических, так и от хозяйских факторов, в частности от места интеграции, физиологического состояния клетки и LTR. В отличие от многих других вирусов у ретровирусов продукты экспрессии, а экспрессия провируса зависит только от хозяйских ферментов.
Вирус-специфическая регуляция экспрессии осуществляется с помощью LTR, несущих промоторов, энхансер транскрипции. Транскрипция начинается на левом конце последовательности R левого LTR. Как и большинство эукариотических генов, провирусы транскрибируются с помощью клеточной РНК-полимеразы II.
В состав LTR входят также элементы, усиливающие транскрипцию (энхансеры) и работающие независимо от своего положения и ориентации. Относительная "сила" энхансера варьирует в зависимости от вида животного или стадии дифференцировки клеток.
Первичным продуктом транскрипции провируса является полноразмерная молекула РНК. Вирусная РНК обычно составляет от 0,1 до 1% тотакльной клеточной РНК. У полноценных вирусов эта РНК, как и ее процессированные варианты, выполняют две главные функции: формирует вирионную РНК и служит мРНК для синтеза продуктов генов gag, pol и env. Около половины полноразмерной РНК упаковывается в вирионы, остальная служит мРНК. В клетках обычно содержится несколько больше мРНК для gag, чем для env, причем продукта гена gag синтезируется примерно в 20 раз больше, чем продукта гена pol. Каждый из вирусных генов детерминирует синтез полипротеина-предшественника, который затем разрезается на два зрелых полипептида.
мРНК для продуктов гена env – результат сплайсинга полноразмерной РНК, из которой удалена большая часть последовательностей генов gag и pol. Одна из интересных особенностей этой мРНК состоит в том, что ее акцепторный сайт сплайсинга, а также часть env-кодирующих последовательностей расположены перед терминирующим кодоном гена pol.
До сих пор не выявлено различий между вирионной РНК и РНК, которая служит матрицей для синтеза продуктов gag и pol. Тем не менее времена полужизни различаются, что указывается на различие их путей метоболизма внутри клетки. Продукт гена pol синтезируется в виде длинного слитного полипротеина gag-pol. С большинства же молекул полноразмерной мРНК транслируется лишь продукт гена gag.
Гены v-onc экспрессируются сходно с обычными вирусными генами, поскольку находятся под тем же вирусным и клеточным контролем. Большинство генов v-onc являются слитными с генами gag и кодируют гибридные продукты gag-onc, у которых N-концевая часть кодируется геном gag, а С-концевая – онкогеном. Последовательности онкогенов в этих слитных генах могут замещать большую или меньшую часть гена gag и соответственно их экспрессия контролируется аналогично этому гену.
Фаза V : синтез вирусных белков и сборка вирионов. После завершения синтеза и процессинга РНК необходим синтез вирионных белков, которые собираются в частицы, содержащие вирионную РНК. Оболочка вириона образуется на плазматической мембране клетки, поскольку вирус освобождается из клетки почкованием. Сердцевины вирусов С-типа формируются в непосредственной близости от мембраны, тогда как у ретровирусов В- и D-типов капсиды образуются в цитоплазме.
Синтез белков и сборка вирионов идут сходным образом у разных видов ретровирусов, несмотря на то что молекулярные массы белков, выполняющих одни и те же функции, могут различаться. В качестве примера возьмем вирус, вызывающий мышиные лимфомы и лейкозы – MuLV. У вирусов этой группы нарезание полипротеинов-предшественников происходит в основном уже после сборки вирионов, поскольку свежесобранный вирус несет много неразрезанных предшественников. Следовательно последовательность белков в полипротеине имеет значение для их относительного расположения в составе вириона.
Из продуктов гена gag образуются все белки сердцевины вириона, за исключением ревертазы. Их одни достаточно, чтобы сформировать вирион, правда, неинфекционный. В случае MuLV белок-предшественник, кодируемый геном gag, имеет молекулярную массу 65 кДа (Pr65 gag ). Он нарезается на 4 белка. Неясно какой фермент осуществляет это нарезание – клеточная или вирусная протеаза.
Продукты гена pol синтезируются в виде белка-предшественника – полипротеина Pr180 gag-pol . Он участвует в сборке вирионов.
Продукт гена env Pr90 env гликолизируется и разрезается на два белка – gp70 и p15E – которые остаются связанными друг с другом дисульфидными мостиками. Вероятно, p15E – это трансмембранный белок, С-концевая часть которого находится внутри, а N-концевая – снаружи оболочки вириона. Заметные на электронных фотографиях шипы представляют собой молекулы p15E, а булавы на их вершине – это gp70. Гликозилированный белок gp70 детерминирует спектр хозяев и свойства вируса. Каким образом в состав вириона попадают две молекулы РНК и как формируется димерная структура вирионной РНК, неизвестно.

Учебник предназначен для студентов, аспирантов и преподавателей высших медицинских учебных заведений, университетов, микробиологов всех специальностей и практических врачей.
5-е издание, исправленное и дополненное
Книга: Медицинская микробиология, иммунология и вирусология
Репликация вирусных геномов
Репликация вирусных геномов
Тип геномной вирусной ДНК определяет особенности ее репликации.
1. Двунитевая ДНК – репликация происходит по обычному механизму полуконсервативной репликации: нити разделяются, и на каждой из них достраивается комплементарная ей нить.
3. У вирусов, геном которых представлен однонитевой РНК, ее репликация происходит по следующей схеме: вначале на вирионной РНК (вРНК) синтезируются комплементарные ей РНК (кРНК). Этот процесс катализируется специфической РНК-репликазой I. Затем на кРНК синтезируется комплементарная ей, но идентичная исходной вирионная РНК (вРНК), этот процесс также катализируется специфической репликазой II. Таким образом, репликация идет по схеме (рис. 80. II):
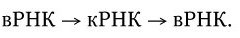
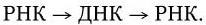
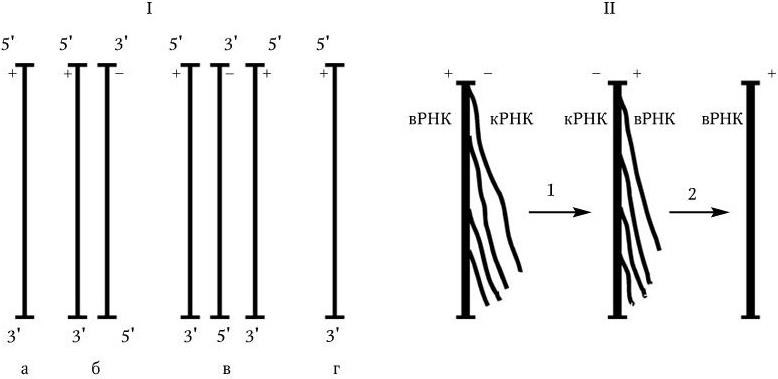
Рис. 80. Механизм репликации однонитевого вирусного ДНК-генома (I) и однонитевого вирусного РНК-генома (II):
а – геномная однонитевая ДНК; б – репликативная форма; в – промежуточная репликативная форма; г – однонитевая дочерняя геномная ДНК; вРНК – вирионная (геномная) РНК; кРНК – комплементарная РНК. Объяснение в тексте
5. Размножение вируса гепатита В также протекает с участием обратной транскриптазы, но вначале клеточная РНК-полимераза синтезирует на вирусной ДНК прегеномную РНК, после чего вирусная ревертаза синтезирует на ней минус-цепь ДНК, которая достраивается плюс-цепью ДНК. В виде двунитевой ДНК вирус интегрируется в хромосому клетки-хозяина, где на ней транскрибируется вирусная РНК.
Существуют некоторые общие закономерности размножения вирусов. Во-первых, все РНК-содержащие вирусы, кроме вирусов гриппа и ретровирусов, размножаются в цитоплазме. Для своего размножения вирусы гриппа А и В и ретровирусы проникают в ядро, что связано с особенностями поведения их генома. Во-вторых, размножение всех ДНК-содержащих вирусов, кроме вирусов оспы, протекает в ядре, где происходит транскрипция и репликация их геномных нуклеиновых кислот, и в цитоплазме, где происходит трансляция вирусных белков, их процессинг и морфогенез вирионов. Лишь размножение вирусов группы оспы происходит в цитоплазме клетки, поскольку они обладают собственными системами транскрипции.
Другая особенность размножения вирусов заключается в том, что их нуклеокапсидные белки синтезируются на свободных полирибосомах (не связанных с мембраной), а суперкапсидные белки – на рибосомах, ассоциированных с мембранами (на шероховатых мембранах). Кроме того, белки некоторых вирусов подвергаются протеолитическому процессингу и гликозилированию. Различают два типа протеолитического процессинга: каскадный и точечный.
При точечном протеолизе разрезанию подвергается один (реже несколько) из вирусных полипептидов. Разрезание происходит, как правило, в определенном участке полипептида. Такой тип протеолиза необходим для того, чтобы определенный белок вируса приобрел свою специфическую активность. Например, суперкапсидный белок вируса гриппа – гемагглютинин – разрезается на две субъединицы: боEльшую и меньшую. В результате меньшая субъединица приобретает способность сливаться с мембранами клетки-мишени и ее лизосомами. Благодаря этому вирус гриппа приобретает способность проникать в клетку. Такой точечный протеолиз наблюдается у ортомиксовирусов, парамиксовирусов, ротавирусов, вирусов группы оспы и др. Точечный протеолиз, как и каскадный, жизненно важен для вируса.
Наконец, еще одна особенность вирусов, обладающих суперкапсидом, заключается в том, что суперкапсидные белки подвергаются в ходе своей транспортировки на наружную поверхность клеточной мембраны гликозилированию.
Для большинства ретровирусов характерна высокая специфичность по отношению к клеткам-хозяевам. Спектр хозяев представляет собой важный признак для классификации вирусов. Известны по крайней мере три зависящих от хозяина механизма, которые могут препятствовать репликации вируса:
1. отсутствие рецепторов на поверхности клетки, необходимых для прикрепления вируса;
2. неспособность вирусного генома сохраниться в клетке после проникновения и обратной транскрипции;
3. невозможность сборки инфекционных вирионов, несмотря на экспрессию интегрированной провирусной ДНК.
Попадание ретровируса в клетку-хозяина осуществляется в результате специфического взаимодействия между поверхностным вирусным гликопротеином и рецептором клеточной поверхности. Ретровирусные гликопротеины полиморфны, и вирусы, несущие разные гликопротеины, используют разные клеточные рецепторы. Клетки не имеющие соответствующего рецептора, не могут быть заражены ретровирусом. Специфическое взаимодействие вирус-клетка обуславливает чувствительность или устойчивость хозяина к заражению и служит важным критерием при классификации ретровирусов. Некоторые из них могут заражать клетки разных видов животных, поскольку используемые ими рецепторы широко распространены и эволюционно консервативны, в то время как спектр хозяев других вирусов строго ограничен более редкими клеточными рецепторами.
В соответствии со способностью заражать определенных хозяев ретровирусы обычно делят на три основные группы:
1. экотропные, реплицирующиеся в клетках вида-хозяина и близкородственных видов;
2. ксенотропные, размножающиеся только в клетках, не принадлежащих к "родительскому виду";
3. амфотропные, реплицирующиеся как в клетках природного хозяина (родительских клетках), так и других видов.
Два вируса с идентичным спектром хозяев могут теоретически обладать разными env-кодируемыми гликопротеинами и попадать в клетку, используя разные рецепторы.
Один из видов устойчивости клетки-хозяина к вирусному заражению проявляется в клетках млекопитающих, зараженных определенными вирусами птиц (после того как вирус преодолел поверхностный барьер). Несмотря на то что в этих клетках птичьи вирусы способны осуществить большинство стадий своего репликативного цикла, включая интеграцию и экспрессию своих генов, сборки вирионов не происходит. Следовательно, клетки млекопитающих непермиссивны для вирусов птиц. Вероятно, для правильной сборки вирус нуждается в неких хозяйских факторах, отсутствующих в клетках млекопитающих.
Репликативный цикл ретровирусов удобно разделить на пять фаз:
1. ранние события: адсорбция, проникновение и "раздевание";
2. превращение вирусного РНК-генома в полноразмерную неинтегрированную линейную (свободную) ДНК;
3. интеграция вирусной ДНК с хозяйским геномом;
4. экспрессия генов интегрированной вирусной ДНК;
5. синтез вирусных белков и сборка вирионов.

Рис.2. Репликация ретровирусов и синтез вирусных белков.
По сравнению с другими вирусами, у ретровирусов есть три необычных свойства репликации. Во-первых, вирус должен превратить свой РНК-геном в ДНК. Во-вторых, эта ДНК длиннее, чем вирусная РНК. Это удлинение обусловлено удвоением части последовательности вирусной РНК. Дуплицированные последовательности образуют длинные концевые повторы (LTR - long terminal repeat) вирусной ДНК. Удвоенные последовательности расположены на концах провирусной ДНК. Размер LTR составляет от 0,3 до 1,4 kb в зависимости от вида вируса. Большинство последовательностей, образующих LTR, представлены в РНК лишь одной копией и расположены как на 5'-, так и на 3'-конце. Третья необычная черта ретровирусной репликации - эффективная интеграция свободной ДНК с геномом клетки в строго определенной ориентации, которая зависит от концевых последовательностей обоих LTR.
Фаза I: ранние события. Проникновению вирионов рестровирусов в клетки предшествует специфическое взаимодействие между поверхностным гликопротеином вируса и рецептором клетки хозяина. Сведения о способе попадания вириона внутрь клетки противоречивы: неясно, происходит ли проникновение непосредственно через плазматическую мембрану или путем эндоцитоза. Часть вирионов деградирует в лизосомах, однако не известно, ведет ли этот путь к инфекции или гибели вируса. Так или иначе, на первых этапах заражения вириона переходит в новое состояние, когда он готов начать синтез вирусной ДНК. В какой степени происходит при этом "раздевание" вирионов, остается неясным.
Фаза II: синтез неинтегрированной вирусной ДНК. Главная задача этого этапа инфекции - превратить одноцепочечный РНК-геном в линейную двухцепочечную вирусную ДНК. Синтез вирусной ДНК, который идет в цитоплазме и требует по крайней мере четырех часов, осуществляется обратной транскриптазой (ревертазой). В ходе этого процесса определенные последовательности, присутствующие в виде уникальных копий в РНК, должны быть дуплицированы, чтобы образовать LTR на обоих концах ДНК-продукта. Поэтому главными участниками второй фазы заражения являются ревертаза, последовательности на концах вирусной РНК и LTR.
Синтез вирусной ДНК начинается в течении первого часа после заражения с появлением одноцепочечной ДНК, комплементарной вирусной РНК. Это минус-цепь ДНК, поскольку вирусная РНК служит кодирующей плюс-цепью. Минус-цепь ДНК - единая и непрерывная молекула, хотя она и синтезируется в три этапа с трех различных матриц. Синтез минус-цепи ДНК идет справа налево относительно РНК, поскольку косплементарная цепь имеет противоположную полярность. Вместо того чтобы начаться у 3'-конца РНК, синтез ДНК начинается с тРНК-затравки вблизи ее 5'-конца. На первом этапе синтезируется последовательность, комплементарная фрагментам R и U5, расположенным перед сайтом связывания тРНК-затравки. Эта последовательность, комплементарная самой левой части в РНК, окажется затем самой правой в вирусной ДНК. На втором этапе синтез минус-цепи ДНК продолжается на правом конце одной из двух вирионных РНК и идет влево через сайт связывания тРНК-затравки (tb) возле левого конца РНК. На этих двух этапах образуется правый LTR путем соединения последовательностей, расположенных на левом и правом концах РНК, а также оставшаяся минус-цепь вирусной ДНК, за исключением левого LTR. На третьем этапе образуется левый LTR на матрице предварительно синтезированной плюс-цепи правого LTR.

Рис.3. Этапы репликации ретровирусного генома от РНК до свободной двухцепочечной линейной ДНК.
Фаза III: интеграция вирусной ДНК. По крайней мере одна копия ДНК оказывается интегрированной с ДНК каждой успешно зараженной клетки, а большинство клеток, продуцирующих вирус, содержит 4-10 копий провирусов. Внедрившись в клеточный геном, провирус в дальнейшем реплицируется и передается дочерним клеткам вместе с остальной ДНК. Первые интегрированные провирусы обнаруживаются через восемь часов после заражения, большинство же копий вирусной ДНК интегрирует в течении трех дней после заражения. Зараженная клетка может вновь заражаться тем же вирусом, пока не приобретет резистентность к заражению в результате образования вирусного гликопротеина. По крайней мере некоторые из провирусов не в состоянии обеспечить продукции вируса, поскольку они не транскрибируются или оказываются повреждены мутациями. Первое вирусное потомство появляется еще до того, как клетка становится устойчивой к суперинфекции (обычно через 1-2 дня после заражения). Поэтому многие зараженные клетки могут вновь инфицироваться вирусами, появившимися в результате первого цикла репликации.
Свободные линейные провирусные ДНК представляют собой предшественники интегрированных провирусов. Для успешного осуществления интеграции необходимы концы LTR, поскольку мутанты, утратившие эти последовательности, не способны к ней. Интеграция требует также неизвестных клеточных факторов.
Анализ последовательностей клонированных провирусов, а также сайта их интеграции с хозяйской ДНК позволил установить как структуру провирусной ДНК, так и те изменения, которые происходят в клеточных последовательностях, прилегающих к месту интеграции, в ходе инфекции. Вирусная ДНК интегрирует с сохранением ДНК: LTR-gag-pol-env-LTR. Однако в клеточном геноме существует много мест, в которые может встроиться провирусной ДНК. Последовательности, в которые он встраивается, обычно не содержат гомологий с вирусной ДНК. Более того, у провирусов нет тенденции включаться в уже существующих в геноме последовательности эндогенных или экзогенных ретровирусов. Эти данные свидетельствуют о том, что провирус может внедриться в любое место хозяйской ДНК.
Фаза IV: экспрессия вирусной ДНК. В хронически инфицированных клетках вирусная РНК считывается с интегрированных провирусов. Свободная ДНК может экспрессироваться, но для сохранения провируса необходима его интеграция. В клетках, содержащих несколько провирусов, обычно бывает трудно разобраться, какой из них транскрибируется. Разные клетки одной популяции могут существенно различаться по уровню экспрессии вируса.
Провирус является транскрипционной единицей с собственными регуляторными последовательностями. Однако экспрессия конкретного провируса зависит как от вирус-специфических, так и от хозяйских факторов, в частности от места интеграции, физиологического состояния клетки и LTR. В отличие от многих других вирусов у ретровирусов продукты экспрессии, а экспрессия провируса зависит только от хозяйских ферментов.
Вирус-специфическая регуляция экспрессии осуществляется с помощью LTR, несущих промоторов, энхансер транскрипции. Транскрипция начинается на левом конце последовательности R левого LTR. Как и большинство эукариотических генов, провирусы транскрибируются с помощью клеточной РНК-полимеразы II.
В состав LTR входят также элементы, усиливающие транскрипцию (энхансеры) и работающие независимо от своего положения и ориентации. Относительная "сила" энхансера варьирует в зависимости от вида животного или стадии дифференцировки клеток.
Первичным продуктом транскрипции провируса является полноразмерная молекула РНК. Вирусная РНК обычно составляет от 0,1 до 1% тотакльной клеточной РНК. У полноценных вирусов эта РНК, как и ее процессированные варианты, выполняют две главные функции: формирует вирионную РНК и служит мРНК для синтеза продуктов генов gag, pol и env. Около половины полноразмерной РНК упаковывается в вирионы, остальная служит мРНК. В клетках обычно содержится несколько больше мРНК для gag, чем для env, причем продукта гена gag синтезируется примерно в 20 раз больше, чем продукта гена pol. Каждый из вирусных генов детерминирует синтез полипротеина-предшественника, который затем разрезается на два зрелых полипептида.
мРНК для продуктов гена env - результат сплайсинга полноразмерной РНК, из которой удалена большая часть последовательностей генов gag и pol. Одна из интересных особенностей этой мРНК состоит в том, что ее акцепторный сайт сплайсинга, а также часть env-кодирующих последовательностей расположены перед терминирующим кодоном гена pol.
До сих пор не выявлено различий между вирионной РНК и РНК, которая служит матрицей для синтеза продуктов gag и pol. Тем не менее времена полужизни различаются, что указывается на различие их путей метоболизма внутри клетки. Продукт гена pol синтезируется в виде длинного слитного полипротеина gag-pol. С большинства же молекул полноразмерной мРНК транслируется лишь продукт гена gag.
Гены v-onc экспрессируются сходно с обычными вирусными генами, поскольку находятся под тем же вирусным и клеточным контролем. Большинство генов v-onc являются слитными с генами gag и кодируют гибридные продукты gag-onc, у которых N-концевая часть кодируется геном gag, а С-концевая - онкогеном. Последовательности онкогенов в этих слитных генах могут замещать большую или меньшую часть гена gag и соответственно их экспрессия контролируется аналогично этому гену.
Фаза V: синтез вирусных белков и сборка вирионов. После завершения синтеза и процессинга РНК необходим синтез вирионных белков, которые собираются в частицы, содержащие вирионную РНК. Оболочка вириона образуется на плазматической мембране клетки, поскольку вирус освобождается из клетки почкованием. Сердцевины вирусов С-типа формируются в непосредственной близости от мембраны, тогда как у ретровирусов В- и D-типов капсиды образуются в цитоплазме.
Синтез белков и сборка вирионов идут сходным образом у разных видов ретровирусов, несмотря на то что молекулярные массы белков, выполняющих одни и те же функции, могут различаться. В качестве примера возьмем вирус, вызывающий мышиные лимфомы и лейкозы - MuLV. У вирусов этой группы нарезание полипротеинов-предшественников происходит в основном уже после сборки вирионов, поскольку свежесобранный вирус несет много неразрезанных предшественников. Следовательно последовательность белков в полипротеине имеет значение для их относительного расположения в составе вириона.
Из продуктов гена gag образуются все белки сердцевины вириона, за исключением ревертазы. Их одни достаточно, чтобы сформировать вирион, правда, неинфекционный. В случае MuLV белок-предшественник, кодируемый геном gag, имеет молекулярную массу 65 кДа (Pr65 gag ). Он нарезается на 4 белка. Неясно какой фермент осуществляет это нарезание - клеточная или вирусная протеаза.
Продукты гена pol синтезируются в виде белка-предшественника - полипротеина Pr180 gag-pol . Он участвует в сборке вирионов.
Продукт гена env Pr90 env гликолизируется и разрезается на два белка - gp70 и p15E - которые остаются связанными друг с другом дисульфидными мостиками. Вероятно, p15E - это трансмембранный белок, С-концевая часть которого находится внутри, а N-концевая - снаружи оболочки вириона. Заметные на электронных фотографиях шипы представляют собой молекулы p15E, а булавы на их вершине - это gp70. Гликозилированный белок gp70 детерминирует спектр хозяев и свойства вируса. Каким образом в состав вириона попадают две молекулы РНК и как формируется димерная структура вирионной РНК, неизвестно.
Читайте также:


