Открытие онкогенного вируса принадлежит
Как вирусы провоцируют раковые опухоли
Среди направлений, которые современная медицина разрабатывает в поиске средств для борьбы с раком, важное место принадлежит вирусологии. С начала XX века известно, что онкозаболевания и инфицирование вирусами могут быть связаны друг с другом, но лишь теперь становится ясно, как именно и в каких случаях проникновение вируса в тело человека приводит к появлению злокачественной опухоли. Редакция N + 1 приготовила для своих читателей рассказ о том, что на сегодняшний день известно об этой теме.
О причинах возникновения опухолей ходили догадки начиная с античных времен, и некоторые из них оказались удивительно проницательными для своего времени. Так еще в 1775 году английский врач Персифаль Пот обнаружил, что у трубочистов подозрительно часто встречается рак мошонки и связал это с канцерогенными свойствами сажи. Позже появились и другие подтверждения того, что некоторые вещества — позже их назовут канцерогенами — способны провоцировать образование опухолей.
Примерно в то же время российский ветеринар Мстислав Новинский продемонстрировал передачу болезни при переносе раковых клеток от больной собаки здоровой, показав тем самым, что рак может возникать и от контакта с живыми клетками. Тем не менее, эти два способа не объясняли всех случаев, и врачи продолжали искать возможные причины. Поэтому неудивительно, что после того, как в начале XX века были открыты вирусы, их тоже кинулись проверять на причастность к этой болезни.
Впервые доказательство их вины удалось получить Фрэнсису Пейтону Роусу (Francis Peyton Rous) и его датским коллегам Вильгельму Эллерману (Vilhelm Ellermann) и Олафу Бангу (Olaf Bang). Они продемонстрировали, что кур можно заразить раком при помощи бесклеточных фильтратов из опухолей больных птиц, но сделали это на разных примерах. Роус обнаружил вирусную природу птичьей саркомы, а датчане открыли вирус лейкоза птиц. Открытие оказалось настолько важным, что спустя полвека Роусу вручили за него Нобелевскую премию по медицине.
Обидно, но его датские коллеги, хоть и выступили со своим открытием на два года раньше, остались без премии, а их статья долгое время оставалась незамеченной. Возможно, причина этого заключалась в том, что раковая природа лейкемии долго оставалась неизвестной. Аналогичным образом остались без внимания работы итальянца Джузеппе Чуффо (Giuseppe Ciuffo), который в 1907 году продемонстрировал вирусную природу бородавок — связь папилломы и рака обнаружили гораздо позже.

Та самая курица с саркомой, с которой начались исследования Роуса
P. Rous / J. Exp. Med., 1911
Идея вирусного происхождения рака оказалась слишком новой для того времени, и должна было пройти еще пара десятков лет, прежде чем у нее появились новые поклонники. В тридцатых годах в аналогичных экспериментах на кроликах и мышах была подтверждена онкогенность других вирусов. На Западе наибольшую известность приобрели эксперименты Джона Биттнера (John Bittner), а в Советском Союзе его идеи были проверены Львом Зильбером — ученым с очень непростой судьбой.
Жизнь кидала Зильбера от Парижа до Печоры, а основные постулаты своей вирусной теории канцерогенеза он сформулировал в тюрьме. Работая в шарашке (НИИ тюремного типа при НКВД), ученый много экспериментировал с вирусом папилломы у кроликов — после заражения и дополнительной стимуляции канцерогенами у животных развивались опухоли.
Зильбер заметил, что к моменту появления внешних признаков опухоли вирус в тканях уже не обнаруживается. Это позволило предположить, что вирус папилломы только провоцирует клетку к злокачественной трансформации, а потом может элиминироваться из-за неспособности жить в условиях опухоли. Догадка насчет папилломы оказалась отчасти верна и получила мощное развитие уже в XXI веке, но попытка Зильбера в целом представить вирусы чуть ли не основными и единственными двигателями канцерогенеза не подтвердилась.
Со временем накопилось немало свидетельств того, что разные вирусы могут провоцировать развитие рака у животных, и начиная с шестидесятых годов аналогичные случаи начали массово описывать у людей.
Ниже представлены основные онкогенные вирусы и соответствующие им опухоли (источник).

Вирус папилломы, или HPV, — самый известный и хорошо изученный пример онкогенного вируса, провоцирующего у людей рак шейки матки и опухоли головы и шеи. Рак шейки матки — это четвертое по распространенности и смертности онкозаболевание среди женщин. Хуже всего с ним в Африке, но и в России его частота выше, чем во многих других странах, — 17 заболевших на 100 тысяч женщин. Фотография из работы первооткрывателя этой связи Гаральда цур Хаузена (Harald zur Hausen), получившего за свои работы Нобелевскую премию.
H. zur Hausen, Current Topics in Microbiology and Immunology 1977

Клетки с необычной цветочной формой ядра — характерный признак лейкемии, вызванной HTLV-1, Т-лимфотропным вирусом. Этот вирус довольно распространен в тропических странах и Японии. Обычно он ведет себя тихо, но в 5-10 процентах случаев может провоцировать опухолеобразование. У HTLV-1 есть много способов это сделать: как и другие ретровирусы, он умеет встраивать (и встаивает) свою ДНК в геном хозяина, а его белки могут взаимодействовать с CTCF — важным клеточным регулятором активности генов и организации хроматина.
American Society of Hematology, Blood Journal 2010

Гепатоцеллюлярная карцинома, по-простому рак печени, в 75 процентах случаев развивается на фоне хронического поражения вирусами гепатита B и С. Несмотря на сходный результат своей деятельности, эти вирусы вообще не родственны друг другу и ведут себя по-разному. HBV сделан на основе ДНК, может встраиваться в человеческий геном и дестабилизировать его. У HCV вместо ДНК РНК, он живет в цитоплазме и провоцирует рак за счет того, что мешает клетке чинить свою ДНК и тем самым увеличивает количество мутаций.
Delaney, Antiviral Research 2013

Среди других онковирусов — относительно редкий вирус герпеса 8 типа (KSHV), провоцирующий саркому Капоши и обычный обитатель нашей кожи вирус клеток Меркеля (MCV). Несмотря на широкое распространение, его открыли лишь в 2008 году благодаря метагеномному анализу кожи пациентов с карциномой клеток Меркеля.
После того как ученые наткнулись в образцах на последовательность ДНК неизвестного им раньше вируса, им удалось найти его самого, а заодно разработать аккуратный метод детекции. К их удивлению, этот вирус обнаружился практически у всех больных.
Действие онколитических вирусов основано на том, что они заражают преимущественно раковые клетки. В этом случае они ведут себя довольно агрессивно и убивают зараженную клетку, кроме того, их присутствие привлекает внимание иммунной системы.
Такими свойствами в отношении разных типов опухолей обладают парвовирусы, вирус везикулярного стоматита и другие, например созданный в лаборатории онколитический вирус герпеса. Последний получается путем удаления у обычного вируса герпеса первого типа гена ICP-34.5. Из-за этой манипуляции тот теряет способность размножаться в нервной ткани и ополчается на клетки опухоли.
Сейчас сразу несколько препаратов, основанных на этом принципе, находятся на разных стадиях клинических испытаний.
Сразу стоит отметить, что связь между заражением вирусом и канцерогенезом не столь однозначна, как можно представить. Сам по себе рак не заразен — известно всего несколько исключений из этого правила, вроде лицевой опухоли у тасманийского дьявола, но все они обнаружены не у людей, а у других животных и не связаны с вирусами. Тем не менее, можно легко заразиться вирусом, деятельность которого в дальнейшем может привести к раку.
Есть несколько типов опухолей, напрямую связанных с вирусами. Так, саркому Капоши находят только у KSHV+ людей, а такие распространенные опухоли, как рак шейки матки или рак печени, в 70-90 процентах случаев спровоцированы соответствующими вирусами.
Аналогичным образом, MCV провоцирует образование опухолей далеко не во всех случаях и становится агрессивным только после приобретения ряда мутаций — и то не у любых людей.
Для некоторых вирусов их онкогенный статус находится под вопросом — бывает, что их обнаруживают в пациентах с определенными видами раков, но такие совпадения находятся недостаточно часто, чтобы однозначно клеймить вирус. Например, вирус SV40 долгое время находился под подозрением, поскольку он вызывает рак у других видов животных. После многочисленных проверок ученые пришли к выводу, что для людей такой ассоциации не существует, и сейчас он полностью оправдан.
Шансы, что малозаметная вирусная инфекция приведет к онкогенезу, зависят от разных факторов. Во-первых, очень большую роль играет штамм вируса. Так, среди множества папиллом есть вирусы высокого и низкого риска, а около 70 процентов случаев опухолей — дело рук всего двух штаммов HPV16 и HPV18.

На текущий момент известно больше сотни штаммов вируса папилломы, освоивших самые разные ткани. На филогенетическом дереве хорошо видно, что онкогенность — как и специализация к отдельным тканям — возникала несколько раз независимо и свойственна лишь отдельным штаммам.
Ma et al., Journal of Virology 2014
Заякоривание вируса в организме может иметь свои причины — ослабленный иммунитет больного или усугубляющее действие канцерогенов вроде курения и других вирусов. Так, коинфекция вирусами гепатита B, C и ВИЧ в любых комбинациях повышает риск развития хронического гепатита и смертность от рака печени.
На молекулярном уровне переход инфекции в хроническую стадию часто сопровождается интеграцией ДНК вируса в человеческий геном. При этом сам вирус может давно покинуть хозяина, но застрявшие в геноме сломанные реплики будут продолжать мешать клетке нормально функционировать. По-видимому, именно это и наблюдал Лев Зильбер, когда видел, что у излечившихся от папилломы животных всё равно возникали опухоли.
Альтернативный путь — научиться манипулировать клеточным жизненным циклом, подталкивая ее к делению и синтезу ДНК. В большинстве случаев вирусы достигают этого, мешая работать белку Rb, который как раз ограничивает переход клетки к делению.
Кроме того, вирусам выгодно увеличивать продолжительность жизни клетки и не допускать ее апоптоза — самоубийства зараженных или просто больных клеток во имя здоровья всего организма. Для этого они давят работу классического онкосупрессора p53. Это регулятор клеточного цикла, который может запретить клетке переходить к делению при обнаружении каких-то патологий.
Та же интеграция вируса это тупиковый варинт развития событий. Из-за появления ошибок в ДНК при вставке вирус теряет способность к размножению и оказывается навсегда похоронен в человеческом геноме. Регуляция генов в них нарушена, и обычно малоактивные вирусные онкогены — например E6 у папилломы — включаются на полную мощность. В итоге плохо становится всем — и вирусу, и клетке.

Несмотря на то, что MVC открыли недавно, довольно быстро в общих чертах стало ясно, как и почему он провоцирует онкогенез. При сравнении MCV+ и MCV- раковых больных со здоровыми носителями MCV выяснилось: в опухоли вирус обычно интегрирован в человеческий геном так, что теряет способность к нормальному размножению (справа). Это приводит к тому, что самого вируса нет, но его белки по-прежнему синтезируются и вмешиваются в клеточные процессы. Второе обязательное изменение, которое должно произойти, это поломка гена LT. Из-за нее синтезируется укороченная версия этого белка, которая умеет влиять на экспрессию других генов и стабилизирует другие онкопротеины. В отсутствие вируса злокачественная трансформация клеток Меркеля достигается за счет множества мутаций из-за воздействия ультрафиолета (слева).
Harms et al., Nature Reviews Clinical Oncology 2018
История открытия онкогенных вирусов, их классификация. Положения вирусогенетической теории канцерогенеза Л.А. Зильбера. Мутации первого и второго типа, классификация протоонкогенов. ДНК- и РНК-геномные вирусы, вызывающие развитие опухолей у человека.
| Рубрика | Медицина |
| Вид | лекция |
| Язык | русский |
| Дата добавления | 01.12.2014 |
| Размер файла | 27,4 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Онкогенные вирусы (от греч. onkos - объемная масса) - это вирусы, способные вызывать развитие опухолей у лабораторных животных, у природных хозяев и трансформировать клетки в культуре тканей.
Рак известен человечеству с древних времен. Злокачественные опухоли были найдены на древнеегипетских и центрально-американских мумиях, имеющих возраст примерно 5 тысяч и 2 тысячи лет, соответственно, а само заболевание описано в папирусах 1600 г. до н.э. (является копией документа, написанного около 3000 г. до н.э.) и 1550 г. до н.э. Кроме людей раком болеют млекопитающие, птицы, рептилии и рыбы.
В начале XX в., вскоре после открытия вирусов, ученых заинтересовало, не могут ли вирусы вызывать рак? Ответ оказался неутешительным.
В 1908 г. французские ученые О. Банг и В. Эллерман показали, что фильтрующиеся агенты вызывают лейкоз (рак крови) у кур. Для доказательства вирусной этиологии заболевания они использовали методику фильтрования материала и многократно повторяемую перевивку его чувствительным животным. Это открытие, как и открытие Ивановского, обнаружевшего первый вирус, осталось почти незамеченным.
В 1911 г. американский ученый Пейтон Раус (1879-1970 гг.) обнаружил, что куриная саркома может перевиваться не только клетками, но субмикроскопическими агентами, экстрагируемыми из клеток. Хотя поначалу другие ученые не приняли открытия Рауса, многочисленные эксперименты в последующие годы доказали его правоту, и в 1966 г. Раус был удостоен Нобелевской премии по физиологии и медицине. Во всем мире теперь эта саркома известна как саркома Рауса. В течение 25 лет после открытия Рауса было описано 18 вирусов, вызывающих саркомы у птиц.
В 1933 г. Р. Шоуп установил фильтруемость возбудителя папилломы и рака кроликов. У диких кроликов вирус обычно вызывает развитие доброкачественной опухоли, а у домашних кроликов вызванные им папилломы практически всегда перерождаются в злокачественные опухоли.
В 1936 г. Д. Биттнер доказал вирусное происхождение рака молочной железы у мышей. Экспериментально было показано, что вирус передается с молоком матери.
В начале 40-50 гг. ХХ в. было окончательно установлено, что все ранее открытые фильтрующиеся агенты являются вирусами.
В 1946 г. выдающийся советский вирусолог Лев Александрович Зильбер сформировал теорию вирусного канцерогенеза.
Впоследствии вирусы, вызывающие разнообразные виды рака у животных стали выделять все чаще и чаще.
В 1951 г. А. Гроссе открыл вирус лейкоза мышей. Вирус мышинного лейкоза сыграл важную роль при исследовании строения и размножения онкогенных вирусов.
В 1957 г. С. Стюарт открыл вирус полиомы мышей. Вирус полиомы широко распространен у диких мышей, у которых он не вызывает видимых заболеваний. Однако при выращивании на культуре тканей и последующем введении в достаточном количестве новорожденным мышам, хомякам, морским свинкам или кроликам может вызывать развитие злокачественных опухолей.
В середине 1950-х гг. американский ученый Ренато Далбекко показал, что вирус полиомы, подобно умеренным фагам, интегрируется в геном клетки, после чего может вызвать ее злокачественную трансформацию.
В 1960 г. из культур клеток почек африканской зеленой мартышки был выделен еще один онкогенный вирус из этого семейства - вирус симиан-40 (SV-40), в клетках которой он быстро размножался и вызывал их гибель.
В начале 60-х г. была доказана возможность онкогенной трансформации клеток in vitro, индуцированных вирусами культур клеток. В настоящее время установлена вирусная природа ряда опухолей млекопитающих и птиц. Многие онкогенные вирусы получены в клеточных культурах, хорошо изучены в морфологическом и биохимическом отношении. В те же годы начинается интенсивное молекулярно-биологическое изучение онкогенных вирусов и механизмов трансформации нормальных клеток в опухолевые. В 70-х г. появились многочисленные сообщения о вирусной контаминации нормальных и опухолевых клеточных культур и возможной роли онкогенных РНК-вирусов.
В настоящее время уже известно более 200 вирусов - возбудителей опухолей животных, входящих в состав разных семейств и 2 вируса, вызывающие Т-лейкозы человека.
В 80-х гг. ХХ в. усиленно изучался вопрос о связи между вирусами и раком у человека. Долгое время ученые не могли доказать, что в клетках раковой опухоли есть вирусы, которые после выделения могут вызывать злокачественную трансформацию (малигнизацию) клеток человека. Однако постепенно такие данные накопились. Было показано, что в мозге больного лейкозом содержится фактор, вызывающий ускорение развития этого заболевания. Затем удалось доказать вирусную этиологию лимфогрануломатоза. В настоящее время установлено, что к вирусам, причастным к раковым заболеваниям человека, относятся ДНК-содержащие вирусы (вирусы Эпштейна-Барра и другие герпес-вирусы, гепатита В и несколько вирусов папиллом) и ретровирусы (вирусы Т-клеточного лейкоза). Вирусная этиология большинства форм рака, сарком, лейкозов человека - остается гипотезой. Сейчас можно считать установленной вирусную этиологию рака шейки матки и некоторых других опухолей урогенитального тракта, носоглоточной карциномы и некоторых видов лейкозов.
Вирусогенетическая теория рака.
В 1946 г. выдающийся советский вирусолог Лев Александрович Зильбер впервые предложил вирусогенетическую теорию рака.
Основные положения вирусогенетической теории рака:
1. Геномы вирусов в виде провируса встраиваются в хромосомный аппарат клетки, вызывая ее трансформацию и создавая опухолевый фенотип.
2. Вирус наследственно превращает нормальную клетку в опухолевую.
3. Опухолевое действие вирусов на клетки принципиально отличается от инфекционного действия: в отличие от других заболеваний вирусного происхождения рак - это патологический процесс, а не инфекционный.
4. Вирус не играет роли в размножении возникших клеток.
Суть этой теории состоит в том, что при онкогенезе ДНК вирусного происхождения внедряется (интегрируется) как фрагмент в ДНК клетки и становится составной частью клеточного генома. Поэтому при электронно-микроскопическом исследовании опухолей далеко не всегда в их клетках можно обнаружить вирус. Эта интеграция - начальное звено в цепи процессов превращения нормальной клетки в раковую.
Вирусные ДНК, интегрированные в клеточный геном, называются провирусами. В геноме одной клетки может содержаться несколько интегрированных провирусных ДНК.
Впервые возможность интеграции вирусных геномов в геном клетки была установлена на умеренных фагах. При заражении бактериальных клеток фагами может либо развиться острая инфекция, заканчивающаяся лизисом бактериальной клетки и выходом из нее новых фаговых частиц, либо произойти интеграция генома фага с геномом бактериальной клетки. В середине 1950-х гг. американский ученый Ренато Далбекко показал, что вирус полиомы, подобно умеренным фагам, либо размножается обычным путем и вызывает острую инфекцию клеток, либо его геном интегрируется в геном клетки, после чего может вызвать ее злокачественную трансформацию.
Таким образом, трансформированные клетки приобретают ряд новых свойств (способность вызывать злокачественные опухоли у лабораторных животных).
Объяснение возникновения рака интеграцией вирусного и клеточного геномов, данное Л.А. Зильбером, было понятно для ДНК-содержащих вирусов. Серьезным возражением против теории Л.А. Зильбера явилось открытие большого числа онкогенных РНК-содержащих вирусов (онкорнавирусов), вызывающих опухоли у птиц и млекопитающих, поскольку вирусная РНК не может встраиваться непосредственно в геном клетки согласно триаде ДНК-РНК-белок. Между ДНК- и РНК-содержащими опухолеродными вирусами существуют кардинальные различия. При заражении клеток ДНК-содержащими вирусами происходит либо репликация, приводящая к инфекции, либо интеграция геномов, приводящая к трансформации клетки. РНК-содержащие вирусы индуцируют только трансформацию нормальной клетки в злокачественную, т.е. при заражении клетки таким вирусом должна происходить интеграция их геномов.
Только в 1970 г. американские ученые Г. Темин и С. Мицутани и независимо от них Д. Балтимор разрешили эту загадку. Они доказали возможность передачи генетической информации от РНК к ДНК. Это открытие перевернуло центральную догму молекулярной биологии о том, что генетическая информация может переноситься только в направлении ДНК-РНК-белок. Пять лет понадобилось Г.Темину для обнаружения фермента, осуществляющего перенос информации от РНК к ДНК, - РНК-зависимой ДНК-полимеразы. Этот фермент получил название обратной транскриптазы. Т.е., была доказана возможность образования на матрице вирусной РНК ее ДНК-копии.
Г. Темину удалось не только получить фрагменты ДНК, комплементарные заданной цепи РНК, но и доказать что ДНК-копии могут встраиваться в геном клеток и передаваться потомству.
Группа РНК-содержащих вирусов, в цикле развития которых по геномной РНК с помощью обратной транскриптазы осуществляется синтез ДНК, встраивающейся затем в геном клетки хозяина, получила название ретровирусов (Retroviridae - от REversed TRanscription).
В семейство ретровирусов входят вирусы саркомы Рауса, миелоцитоматоза, саркомы мышей Харви и Молони, лейкоза птиц, ретикулоэндотелиоза птиц, лейкоза мышей, Т-клеточного лейкоза человека, иммунодефицита человека.
Каждая эукариотическая клетка содержит набор генов, кодирующих синтез веществ, обеспечивающих ее жизнедеятельность, а также ее запрограммированную гибель - апоптоз. Под воздействием различных факторов генетическая программа может изменяться, и клетка преждевременно погибает, либо начинает бесконтрольно делиться, давая начало неопластическому росту. Для таких клеток характерна высокая частота мутаций, вызывающих изменение структуры или локализации одного или нескольких генов.
Классификация протоонкогенов, подвергающихся влиянию онковирусов:
1. Протоонкогены, кодирующие протеинкиназы - представлены протоонкогенами, гомологичными по первичной структуре онкогенам, белковые продукты которых обладают протеинкиназной активностью и локализующиеся на мембранах трансформированных клеток.;
2. Ядерные протоонкогены - представлены генами, кодирующие белки, локализованные в ядре;
3. Протоонкогены, кодирующие факторы роста - представлены генами, продукты которых служат факторами роста;
4. Вставочные (инсерционные) протоонкогены - представлены генами, в месте локализации которых происходит встраивание онкогенных ретровирусов;
5. Протоонкогены транслокации - участки (локусы) клеточного генома, способные вовлекаться в процесс транслокации (перемещения) генов.
Механизмы онкогенной активности вирусов.
Вирусы могут оказывать прямое трансформирующее действие, либо непрямое промоторное действие.
Молекулярно-генетические исследования вируса саркомы Рауса позволили выявить конкретный ген, ответственный за трансформацию клеток (1970 г., Г. Мартин).
В настоящее время выявлено более 20 таких генов. Они получили название онкогенов. Онкоген - это ген вирусного генома, ответственный за трансформацию клеток.
Вирусы, содержащие онкоген в своем геноме обозначают как onc + -вирусы. Однако вирусы часто утрачивают онкоген и соответственно трансформирующую активность; в этом случае их обозначают onc - -вирусы.
В зависимости от особенностей структуры вирусного генома выделяют:
· Независимые онкогены - транслируется в виде отдельного белка;
· Слитные онкогены - транскрибируются в виде РНК, кодирующей опухолевый белок.
В геноме клеток всех организмов существует набор генов, аналогичных вирусным онкогенам по последовательности нуклеотидов - протоонкогены. Протоонкоген - это набор генов клеточного генома, аналогичных вирусным онкогенам по последовательности нуклеотидов.
Доказано, что на определенных этапах эмбриогенеза протоонкогены работают как нормальные гены, обеспечивая процессы дифференцировки зародыша. Затем они находятся в репрессированном состоянии.
Согласно молекулярной теории происхождении опухолей, рак - болезнь регуляции генов и вирус играет в ней роль пускового механизма.
Возможно, онковирусы - нормальные компоненты организма, принимающие участие в процессах клеточного цикла, дифференциации и пролиферации.
Большую роль в развитии рака может играть действие химических и физических канцерогенов, а также старение организма. Например, у кур, зараженных вирусом птичьей оспы, при смазывании кожи метилхолантреном развивается рак кожи. Нанесение дегтя на кожу кролика, зараженного вирусом папилломы Шоупа, сокращает латентный период и увеличивает частоту образования опухолей.
Классификация онкогенных вирусов.
Онкогенные вирусы подразделяют на ДНК- и РНК-содержащие.
ДНК-содержащие вирусы относятся к 6 семействам:
1. Papillomaviridae - более 100 вирусов папилломы человека и множество папилломовирусов животных.
2. Polyomaviridae (от лат. рoly - много, oma - опухоль) - обезьяний вирус SV-40 (вызывает острые вакуолизирующие нефриты у зеленых мартышек), вирус полиомы мышей, вирусы человека ВК и JC.
Раньше семейства Papillomaviridae и Polyomaviridae входили в одно семейство Papovaviridae.
3. Adenoviridae - 37 вирусов человека, множество аденовирусов животных (например, 24 вируса обезьян и 9 вирусов крупного рогатого скота) - обладают онкогенным действием только у животных.
4. Herpesviridae - ВПГ-1 и 2, ЦМВ, вирус Эпштейна-Барр и онкогенные вирусы приматов, лошадей, кур, кроликов, лягушек.
5. Hepadnaviridae - вирус гепатита В человека, гепатита североамериканского сурка, гепатита земляных белок и гепатита уток.
6. Poxviridae - вирус фибромы Шоупа у кроликов, вирус миксомы кролика, вирус Яба и танапоксвирус, вызывающие гистиоцитомы у приматов, вирус контагиозного моллюска.
РНК-содержащие опухолеродные вирусы разделяются на 4 класса.
1. Вирусы типа А - к типу А относят дефектные вирусные частицы или незрелые формы других онковирусов.
2. Вирусы типа В - вирус рака молочных желез мышей, лейкоза морских свинок.
3. Вирусы типа С - возбудители лейкозов и сарком у животных, например, вирус саркомы Рауса вызывают саркомы у птиц, млекопитающих.
4. Вирусы типа D - вирус, выделенный при раке молочных желез обезьян-резус, Т-лимфотропные вирусы человека 1 и 2 типов.
Опухолеродные вирусы, как правило, видоспецифичны, т.е. поражают животных только определенного вида. Но из каждого правила есть исключения. Например, вирусом куриной саркомы можно заразить крыс, кроликов, хомячков, обезьян, ящериц и даже змей.
вирус онкогенный канцерогенез мутация
Вирусы, вызывающие развитие опухолей у человека
Вирус папилломы человека
доброкачественные эпителиальные опухоли: кожные бородавки, остроконечные кондиломы, папилломы гортани
злокачественные опухоли: плоскоклеточная карцинома носоглотки, опухоли мочеполовых путей
Выделен из мочи человека с пересаженной почкой (на фоне иммунодефицита)
Выделен из мозга людей с прогрессирующей многоочаговой лейкоэнцефалопатией (на фоне иммунодефицита)
рак шейки матки, опухоли урогенитального тракта

Инфекция, вызванная онкогенными вирусами, является причиной 15,4% заболеваний раком по всей земле. Первый онкогенный вирус, который был идентифицирован — это куриный вирус саркомы Рауса в 1911 году. Десятилетиями позже были обнаружены серии других онкогенных вирусов, в том числе вирус папилломы Шопа (вирус папилломы кроличьего хвоста), вирус опухоли молочной железы мыши, аденовирус, вирус SV40 (обезьяний вирус sv40). Теория опосредованного вирусом онкогенеза в итоге была экспериментально продемонстрирована в 1976 году Гарольдом Вармусом и Майклом Бишопом путем превращения инфицированных клеток в опухолевые вирусом саркомы (ген v-src вызывает образование опухоли после захвата протоонкогена человеческой клетки в результате трансдукции).
Несмотря на то, что онкогенные вирусы нашли в исследованиях онкогенной активности животных клеток, они были не в состоянии преобразовать человеческие клетки. Теория вирусного онкогенеза в человеческой клетке оставалась спорной до 1965 года, когда вирус Эпштейн-Барр (EBV) был обнаружен в клетках лимфомы Беркитта. В ходе последующих исследований, в том числе выделении Т-лимфотропного вируса человека (HTLV) из клеток Т-клеточной лимфомы и выявлении роли папилломовирусов человека с высокой онкогенной активностью в развитии рака шейки матки, был определен путь для понятия человеческих онкогенных вирусов. Обнаружение связи между герпес-вирусом и саркомой Капоши (KSHV) и лимфомой и между полиомавирусом клеток Меркеля (MCV) и карциномой клеток Меркеля (MCC) подчеркнуло возможность открытия еще большего количества онкогенных вирусов с помощью современных технологий. Далее каждый вирус будет рассмотрен отдельно.
Вирус Эпштейн-Барр
Вирус Эпштейн-Барр (ВЭБ, EBV) — ДНК-содержащий вирус, который преимущественно поражает B-лимфоциты, также является митогеном для них; вызывает лимфопролиферативные болезни (лимфома Беркитта, носоглоточная карцинома, NK-клеточная лейкемия, лимфома Ходжкина и т.д.), а также инфекционный мононуклеоз. Вирионы вируса были обнаружены при электронной микроскопии биоптата лимфомы Беркитта в начале 1964 года Энтони Эпштейном и Ивонной Барр.
Строение. ВЭБ имеет вирусный капсидный антиген (VCA), ядерные антигены-EBNAs 1, 2, 3, 3a, 3b, 3c; латентные мембранные протеины (LMPs) 1, 2 и две маленькие Эпштейна-Барр-кодируемые РНК (EBER) молекулы — EBER1 и EBER2. EBNAs и LMPs являются ДНК-связывающими белками, считающимися необходимыми для развития инфекции и фиксации.
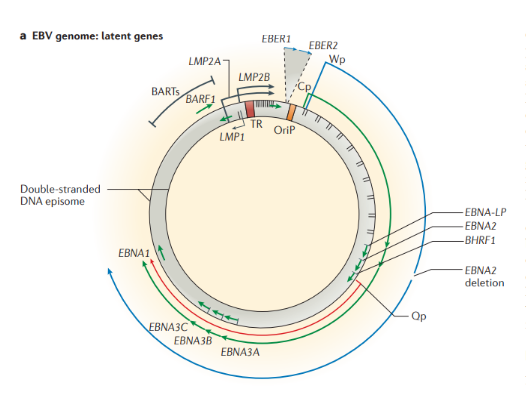
- необходим для трансформации В-лимфоцитов;
- функционирует как конститутивный активатор рецептора ФНО и имеет сходство с CD-40 рецептором;
- активирует сигнальные пути, которые делают вклад в онкогенный эффект.
В зависимости от набора экспрессируемых вирусных генов в пораженных клетках выделяют три типа латентности (I, II и III тип), характерные для различных видов лимфом: I тип подразумевает избирательную экспрессию EBNA-1 при ВЭБ-положительной лимфоме Беркитта; II тип заключается в экспрессии EBNA-1, LMP-1 и LMP-2 и является отличительным признаком ВЭБ-положительной ходжкинской лимфомы, периферических T/NK-клеточных лимфом; латентность III типа, характеризуемая экспрессией всего набора из девяти латентных белков ВЭБ, наблюдается при лимфопролиферативных поражениях, возникающих у пациентов с тяжелым иммунодефицитом (после трансплантации паренхиматозных органов или стволовых клеток, ВИЧ-инфекции). Тип латентности определяет восприимчивость инфицированных клеток к различным иммунотерапевтическим тактикам. Индуцированные ВЭБ злокачественные новообразования связаны с экспрессией латентных генов. У большинства иммунокомпетентных носителей ВЭБ вирус не индуцирует опухолевый процесс. Новообразования развиваются при комплексном взаимодействии ВЭБ, иммуногенетических факторов, факторов внешней среды (паразитарных инфекций — чаще, малярии, недоедании, потреблении пищи, содержащей канцерогены) и иммунодефицита (ВИЧ-инфекция, трансплантация).
Папилломавирусы человека
Описано около 200 папилломавирусов. Вирусы передаются при контактах через микротравмы кожи и слизистых оболочек, а также половым путем. Папилломавирусы человека вызывают доброкачественные кожные, генитальные, оральные и конъюнктивальные папилломы; индуцируют пролиферацию эпителия, обладают онкогенным потенциалом. С папилломавирусом, особенно ПВЧ-5 и ПВЧ-8, тесно связано развитие немеланомных разновидностей рака кожи. Различают низкоонкогенные папилломавирусы, вызывающие бородавки, которые не малигнизируются, и высокоонкогенные, способные вызвать рак шейки матки, — ПВЧ-16, 18, 31, 33, 35, 45, 51, 52, 58.
Строение. Капсид икосаэдрический, состоит из двух капсидных белков (L1-L2), формирующих 72 пентамера. Геном — двунитевая циркулярная ДНК; имеет в зависимости от вируса восемь ранних генов (E1-E8) и два поздних гена (L1-L2). Гены E6-E7 обладают онкогенной активностью.
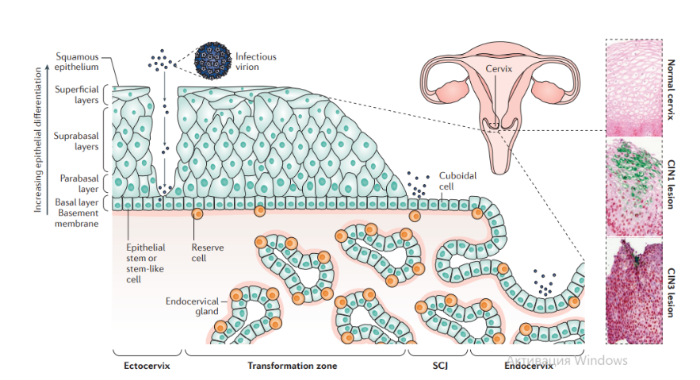
Патогенез. В целом, для развития продуктивного поражения ВПЧ (высокого или низкого риска) требуется, чтобы вирус имел доступ к эпителию базального слоя как только эпителиальный барьер был подвержен риску. Папилломавирусы должны инфицировать делящуюся клетку, чтобы стать признанными как малое количество копий ядерной эписомы, и для развития стойкого поражения первичная инфицированная клетка, вероятно, должна быть похожа на долгоживующую эпителиальную стволовую клетку или похожую на нее. Кроме того, связанные с заживлением ран изменения в местном микроокружении, включая увеличение количества факторов роста, могут играть ключевую роль в создании резервуара инфекции в базальном слое. Способность ВПЧ инфицировать, и реплицироваться, и управлять прогрессированием рака зависит от функции вирусного белка, положении в эпителии, где эти белки экспрессируются. Как только инфицированные базальные клетки поделились и в конечном итоге вошли в парабазальный слой, они начинают проходить программу экспрессии генов, которая связана с дифференциацией. Амплификация вирусного генома обычно происходит в срединно-эпителиальных слоях, тогда как сбор и выход вируса происходит вблизи наружной поверхности эпителия.
Несмотря на то, что эффективная амплификация генома требует комбинированного действия множественных продуктов вирусного гена, включая E6, E7, E2 и кодированную вирусом геликазы E1, поддержание репликации в базальном слое эпителия может зависеть от факторов репликации клетки хозяина. Программа, зависящая от дифференциации, которая происходит в надбазальных слоях эпителиальной клетки, включает как временные изменения в активности промотора, так и изменения в шаблонах сплайсинга мРНК, которые облегчают производство различных продуктов вирусных генов на разных стадиях во время программы дифференциации. Функция вирусного белка далее регулируется посттрансляционной модификацией, включая фосфорилирование и протеолитическое деление клетки.
Герпесвирус, ассоциированный с саркомой Капоши
KSHV, или человеческий герпесвирус 8, был обнаружен в 1994 году как член семейства гамма-герпеса человека, присоединившись к ВЭБ. Инфекция иммунокомпрометированных индивидуумов с KSHV была связана с развитием саркомы Капоши, полученной из эндотелиальных клеток, и по меньшей мере двумя B-лимфоцит лимфопролиферативными заболеваниями: первичная выпотная лимфома и многоцентричная болезнь Кастлмана. Однако изучение патогенеза и онкогенеза KSHV затруднено отсутствием значимой модели животных и восприимчивой клеточной культуры.
Онкогенное действие. Две иммортализованные клеточные линии, KS Y-1 и SLK, когда-то использовались для исследований KS и KSHV, но в KS Y-1 были также обнаружены клетки линии рака мочевого пузыря T 24, что затруднило дальнейшую работу. Первичные эмбриональные метанефрические мезенхимальные клетки-предшественники почек крысы восприимчивы к инфекции и трансформации KSHV, но из них распространяются ограниченное количество инфекционных вирионов. Линии B-клеток, полученные из первичной выпотной лимфомы, обычно заражаются KSHV на латентной стадии и могут быть индуцированы для получения малого количества вирионов KSHV, но первичные B-лимфоциты из периферической крови или тонзиллярной ткани являются устойчивыми к инфекции KSHV, и для их инфицирования может потребоваться совместный рост с KSHV-позитивными клетками.
KSHV кодирует несколько важных белков, которые обладают некоторой онкогенной активностью для индуцирования пролиферации клеток, иммортализации, трансформации и передачи сигналов; производства цитокинов; иммунного контроля; антиапоптозной активности; и ангиогенеза. К ним относятся вирусные латентные белки, латентный ассоциированный ядерный антиген (LANA), vFLIP (FADD (Fas-ассоциированный белок с доменом смерти), подобный ферменту, ингибирующему синтез интерферона или ингибирующему белок каспазы 8 (FLICE)), vCyclin и вирусные литические белки G-белкового рецептора (vGPCR), интерферон-регуляторный фактор 1 (vIRF-1) и K1. Хотя истинную онкогенную природу каждого белка еще предстоит определить, накопление доказательств указывает на то, что каждый из них вносит свой вклад в онкогенез KSHV. Таким образом, полный спектр вызванной KSHV злокачественности может потребовать, чтобы несколько онкогенных продуктов работали вместе в присутствии клеток хозяев и экологических факторов. Например, как LANA, так и vIRF-1 нацелены на клеточный опухолевый супрессор p53. LANA также ингибирует pRB и PP2A.vCyclin, активатор CDK4 6,198, подавляет p27kip1, ингибитор CDK199 и вызывает реакцию на задержку старения G1, результаты от гиперактивации NF-κB. vFLIP и K1 активируют путь сигнала NF-κB для предотвращения апоптоза B-клеток. vGPCR и K1 влияют на сигнальные пути AKT и NF-κB и способствуют ангиопролиферативному и воспалительному поражению саркомой Капоши.
Т-лимфотропный вирус человека (HTLV)
T-лимфотропный вирус человека (HTLV) относится к семейству ретровирусов, является возбудителем T-клеточного лимфолейкоза взрослых. Вирус впервые был изолирован в 1980 году от больного Т-лимфомой.
Геном. Gag, Pol и Env являются вирусными структурными белками, другие — вирусными регуляторными/вспомогательными белками. За исключением гена hbz, который кодируется минус-цепью провирусного генома HTLV из 3'-LTR, все остальные гены кодируются плюсовой нитью по направлению 5'-LTR. Следует отметить, что 5'-LTR часто удаляется или метилируется по мере прогрессирования заболевания. Кроме того, на поздних стадиях лейкемиогенеза в гене tax часто возникают нонсенс- или миссенс-мутации. Хотя белок tax и ген HBZ индуцируют опухоли у трансгенных мышей, а p12 проявляет слабую онкогенную активность, ни один из вирусных белков/генов, кроме tax, не требуется для опосредованного HTLV-1 опухолеобразования. Продукт tax гена действует на терминальные повторы LTR, стимулируя синтез вирусной иРНК, а также образование рецепторов IL-2 на поверхности зараженной клетки.
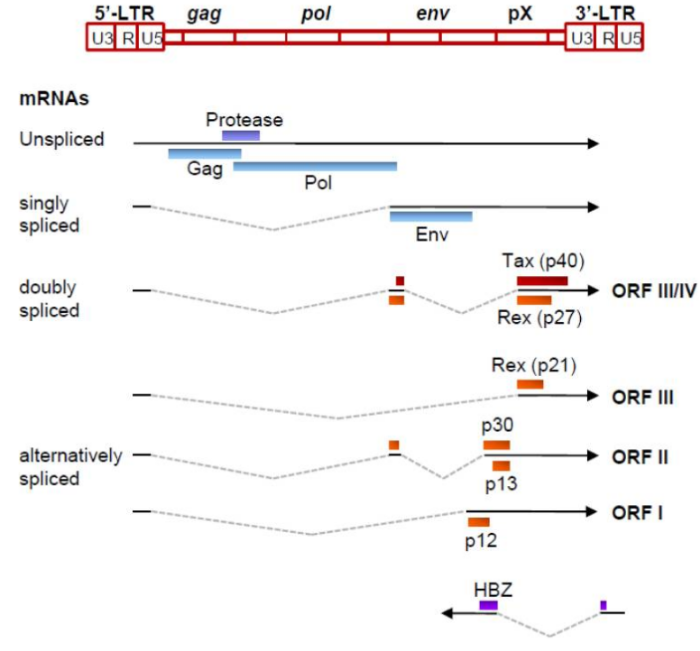
Рисунок 3. Gag, Pol и Env вирусные регуляторные/вспомогательные белки HTLV
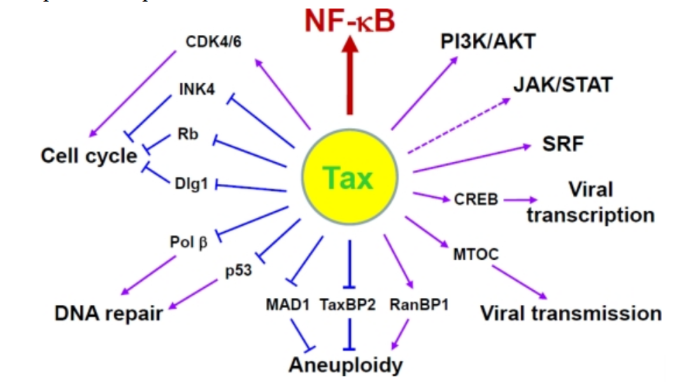
Рисунок 4. К леточные пути вирусного онкобелка tax
Патогенез. Проникновение HTLV-1 в клетку человека охарактеризовывает начало выживания и репликации вируса. HTLV-1 связывается с рецептором клеток, имеющих необходимый антиген, что инициирует процесс инвазии. Рецепторный комплекс состоит из транспортера глюкозы (GLUT1), гепаринсульфат протеогликана (HSPG) и рецептора VEGF-165 нейропилина-1 (NRP-1). HTLV-1 взаимодействует с HSPG. Процесс слияния происходит через комбинацию GLUT1 с HSPG/NRP-1, после чего ядро, содержащее вирусную РНК, доставляется в цитоплазму клеток-мишеней. После обратной транскрипции HTLV-1 встраивает свой геном в генома хозяина, чтобы сформировать провирус, окруженный двумя LTR на 5' и 3' концах. Затем провирус транскрибируется и кодирует структурные, регуляторные и вспомогательные белки. Впоследствии вирусные геномные РНК и Gag, Env и Gag-Pol белки переносятся в плазматическую мембрану, чтобы начать собираться в зрелую вирусную частицу.
Вирусы гепатита
Вирус гепатита В (HBV) и вирус гепатита С (HCV) представляют собой несвязанные вирусы, имеющие тропность к гепатоцитам и реплицирующиеся в них. Около 2 миллиардов человек инфицированы HBV, и более 350 миллионов человек становятся хроническими носителями. Только 5-10% взрослых, которые приобретают инфекцию, становятся хроническими носителями, у 30% развиваются прогрессирующие хронические заболевания печени: гепатит, фиброз, цирроз и, наконец, гепатоцеллюлярная карцинома (HCC).
Патогенез. HCC, индуцированная посредством HBV и HCV, развивается в области воспаления и регенерации, что является результатом хронического повреждения печени, а это в свою очередь указывает на то, что патогенез HCC иммунно-опосредован. Эти вирусы постоянно реплицируются в культуре клеток без явных повреждений и смерти клеток, подразумевая, что они являются не цитопатическими. Постоянная репликация вируса является фактором риска для образования HCC, потому что воспаление часто приводит к длительным хроническим заболеваниям печени CLD без выведения вируса. В этом контексте HBV и HCV генерируют белки, подавляющие иммунитет, который должен контролировать хронические инфекции. HBV- и HCV-кодированные белки изменяют экспрессию гена хозяина и клеточный фенотип, что является признаком рака. Эти изменения способствуют независимой от фактора роста пролиферации, сопротивлению к ингибированию роста, инвазии тканей и метастазированию, ангиогенезу, перепрограммированию энергетического метаболизма и устойчивости к апоптозу. Хроническое воспаление также способствует генетической нестабильности в клетках опухоли. Вклад HBV в развитие HCC включает в себя экспрессию гена гепатита Bx (HBx) и, возможно, усеченные пре-S или S-полипептиды карбоксимицина; основной белок и неструктурные (NS) белки NS3 и NS5A HCV способствуют онкогенной трансформации. Изменения в экспрессии гена хозяина, которые способствуют возникновению опухолевого генеза, также, похоже, поддерживают репликацию вируса и/или защиты вирусных гепатоцитов от иммунного опосредованного повреждения и разрушения.
Читайте также:


