Отек легких при гриппе патогенез
Причины развития
На сегодняшний день выделяют ряд провоцирующих факторов, которые становятся причиной отечности легких при гриппе:
- Нарушение функционирования митрального клапана сердца. Циркуляция крови из левого клапана замедлена, что вызвано патологическими изменениями в левом желудочке. Постепенно развивающаяся сердечная недостаточность вызывает отек легких.
- Ухудшение оттока лимфы из легких. Такое патологическое явление вызывает серьезные осложнения – отечноть дыхательных органов, развитие болезни Ходжкина (врожденная или же приобретенная).
- Избыточное количество крови в венах. Выявляется у пациентов, страдающих варикозом и иными болезнями сосудов.
- Дефицит ряда витаминов и макроэлементов.
- Тяжелые заболевания печени и почек.
- Наличие обширных ожоговых поверхностей.
- Довольно часто при тяжелом протекании вирусных недугов не предпринимаются необходимые меры по лечению, в результате чего страдают легкие. Отечность легких – осложнение течения гриппа. Сильный кашель и быстрое распространение инфекции вызывает отек дыхательных органов. На самых ранних стадиях грипп практически никак себя не проявляет, но в скором времени появляются все характерные признаки.
В случае выявления любой из описанных патологий потребуется пройти комплексное обследование органов дыхания, что поможет диагностировать патологию на ранней стадии.
Симптомы
Очень важно знать признаки отека легких, которые провоцирует грипп, чтобы своевременно обратиться к врачу и начать эффективное лечение. Выделяют целый перечень симптомов, которые характеризуют отечность легочной ткани при гриппе:
- Учащение пульса
- Затрудненность дыхания
- Тахикардия
- Развитие сердечной недостаточности (на фоне сопутствующих патологий сердечно-сосудистой системы)
- Приступы сильного кашля и развитие одышки после продолжительного сна
- Наличие крови в выделяемой мокроте
- Резкие перепады температуры тела
- Бледность кожного покрова
- Изменение показателей АД.
Наблюдаемая симптоматика может отличаться ввиду того, как именно развивается отек: медленно или же стремительно. В случае медленного отека больного мучает сильная одышка с учащенным дыханием, эти признаки никак не связаны с физической нагрузкой. Головокружение также будет сигнализировать о серьезных нарушениях в дыхательной системе. Наряду с этим больной ощущает вялость, сонливость. Описанные признаки говорят о постепенном развитии отечности легочной ткани, их нельзя игнорировать.
Быстрый отек развивается стремительно, зачастую это происходит в ночное время. Внезапное пробуждение связано с приступом удушья. Больной начинает пыхтеть, судорожно кашлять. Во время кашлевого рефлекса выделяется мокрота, которая постепенно разжижается. Проявляются хрипы, ощущается свист во время дыхания. Больной бледнеет, что частично спровоцировано паникой. Такой приступ может длиться около 25 мин. При данном состоянии потребуется незамедлительная госпитализация больного.
Диагностика
При диагностике патологии сопоставляется наблюдаемая симптоматика с общим состоянием больного. Для квалифицированного врача определить отек легких не составит никакого труда. Но при ряде случаев потребуется проведение дополнительных исследований.
Для выявления серьезных нарушений со стороны сердечно-сосудистой системы необходимо осуществить катеризацию легкого. Информативным в этом случае будет и анализ крови, во время развития отека наблюдается гипоксия, которая определяется падением уровня гемоглобина. Проведение кардиограммы поможет исключить или подтвердить болезни сердца, которые могут оказывать определенное влияние при последующем лечении.
Тактика лечения
Лечение болезни дома не принесет позитивных результатов, а скорее может навредить – спровоцировать тяжелые осложнения, которые подвергают опасности жизнь больного. Прием лекарственных средств и проведение определенных процедур назначается лечащим врачом с учетом общей картины заболевания. Наряду с этим существуют некоторые принципы, следование которым во время лечения является обязательным:
Кроме главных принципов лечения стоит взять во внимание ход действий при оказании экстренной медицинской помощи во время приступов, спровоцированных отечностью легочной ткани.
Первоочередно следует обеспечить больному устойчивое сидячее положение при спущенных нижних конечностях. Чтобы снизить давление в малом кругу кровообращения и купировать признаки чрезмерной возбудимости, потребуется внутривенно ввести такие препараты как Морфин, Дроперидол. В случае выраженной тахикардии при гриппе больному необходимо принять Супрастин, дозировку которого определяет лечащий врач. По наблюдаемой клинической картине медработником принимается решение о дальнейшем проведении медицинских мероприятий.
Необходимо помнить, что отечность легочных тканей может провоцировать резкие перепады АД в ту или иную сторону. Поэтому применение препаратов однонаправленного действия во время лечения противопоказано. Перед введением того или иного препарата при гриппе необходимо проводить измерение АД, чтобы исключить побочные действия.
Такое серьезное осложнение при гриппе как отек легких нужно начинать лечить как можно раньше. Это объясняется тем, что вирусная инфекция может усиливать признаки недуга. При оказании своевременной квалифицированной помощи удастся добиться позитивного результата. Не стоит прибегать к самолечению, такое халатное отношение к собственному здоровью может стоить пациенту жизни.
Входными воротами для вирусов гриппа является эпителий дыхательных путей. Однако организм человека в течение столетий совершенствовал механизмы защиты и первой их линией являются неспецифические факторы. К ним относятся вязкие свойства слизи, постоянное движение ресничек цилиндрического эпителия, неспецифические ингибиторы репликации вируса, которые содержатся в секрете дыхательных путей, макрофаги, захватывающие вирус, секреторный IgA. Факторами защиты являются также лектины С-типа (конагглютинин, манозосвязывающий белок, белки А и D сурфактанта), которые связываются с углеводами вируса, вызывают его агрегацию, приводя к опсонизирующему действию. Для того чтобы произошло инфицирование, вирус должен побороть факторы неспецифической резистентности дыхательных путей. Главной мишенью вируса являются клетки цилиндрического реснитчатого эпителия.
Переборов сопротивление ослабленных ресничек, возбудитель попадает в носоглотку и поддается действию высокоактивного секрета клеток. Белки секрета слизистых желез способны неспецифически ингибировать гемагглютинирующую и инфекционную активность вируса гриппа. Это действие обусловлено наличием в секрете гликопротеидов, которые содержат значительное количество N-ацетилнейраминовой кислоты. Существуют сезонные колебания содержания ингибиторов. Наиболее активны они в летне-осенний период, а в период эпидемии гриппа (зима) содержание ингибиторов снижается. Погибшие клетки отрываются и захватываются макрофагами, а также удаляются с секретом дыхательных путей. В подслизистом слое в результате высвобождения биологически активных веществ (гистамин, серотонин, кинины, простагландины) возникает реакция сосудов, форменных элементов крови, образование мелких тромбов и кровоизлияний, диапедез мо-нонуклеаров и нейтрофильных лейкоцитов, отек, местные нарушения метаболизма, изменения рН среды в кислую сторону и тому подобное. При этом патологический воспалительный процесс наиболее выражен в трахее и бронхах.
Наличие токсикоза при гриппе является существенной особенностью патогенеза. Симптомы интоксикации являются следствием резорбции токсичных субстанций вирусов, продуктов нарушенного обмена веществ, что прямо или опосредованно влияет на органы и системы. Вирус обладает токсическим действием на сосудистую систему, значительно повышая проницаемость и ломкость сосудов, что в комплексе с расстройствами микроциркуляции может приводить к развитию геморрагического синдрома. В возникновении циркуляторных расстройств, кроме прямого действия на сосудистую стенку, большое значение имеет нейротропность вируса. Характерны фазовые повреждения вегетативной нервной системы, касающиеся двух ее частей (симпатической и парасимпатической): гипертензия изменяется гипотензией, тахикардия — брадикардией, повышается секреция слизи в дыхательных путях, появляется потливость.
Проникая в более глубокие слои эпителия, вирус встречается со второй линией специфической обороны (интерферон, циркулирующие антитела классов IgM, IgG, IgE, температурная реакция). Механизмы иммунного ответа при гриппе представлены на рис. 3.
Рис. 3. Механизмы иммунного ответа при гриппе
При гриппе в ответ на инфицирование развиваются ранние цитокиновые реакции (РЦР) как наиболее быстрый ответ на вирус. Здесь мы имеем дело с естественным (врожденным) и наиболее распространенным вариантом РЦР на вирус гриппа как на внутриклеточного паразита, когда вирус сам включает систему интерферона, играя роль природного индуктора.
Каскад внутриклеточных событий, который наблюдается после внедрения вируса, обусловлен индукцией образования ИФН и в последующем разрушением вирусных информационных РНК, благодаря действию 2'-5'-олигоаденилсинтетазы и активации эндонуклеазы. Параллельно активированная протеинкиназа фосфорилирует а-субъединицу фактора, который инициирует трансляцию, что приводит к блокировке синтеза вирусных белков. Все это приводит к угнетению репродукции широкого спектра РНК и ДНК-содержащих вирусов за счет прямого внутриклеточного антивирусного эффекта. Эти явления происходят в течение первых часов после проникновения вируса гриппа в организм.
Интерфероны (в первую очередь ИФН-b или так называемые интерфероны I типа) имеют способность к активации естественных киллеров (ЕК) и цитотоксических лимфоцитов. В результате на этом этапе вирусного инфицирования локально осуществляются три взаимосвязанных действия:
- внутриклеточная ингибиция интерферонами репродукции вирусов;
- удаление посредством ЕК и ЦТЛ инфицированного материала;
- защита вновь образованным интерфероном окружающих незараженных клеток от возможного заражения.
Интерферон распределяется по организму, связывается со специфическими рецепторами здоровых неповрежденных клеток и делает их невосприимчивыми к вирусу. С интерферонсвязанных неинфицированных клеток вокруг очага вирусной инфекции образуется заслон для последующего распространения инфекции. Кроме того, интерферон активирует почти все иммунные реакции (модуляция взаимосвязи между эндокринной и иммунной системами, активация макрофагов, повышение цитотоксичности, стимуляция экспрессии антигенов ГКГ I и II классов).
Однако описанные эффекты ИФН нередко являются недостаточными для завершения инфекционного процесса. Подобное имеет место при сниженном сопротивлении организма, дефектности системы ИФН и иммунитета, неблагоприятной экологической ситуации, действии стрессов и др.
В итоге развивается острое заболевание, которое сопровождается продукцией каскада ранних цитокинов (второй этап РЦР), активацией CD4+ и CD8+ Е-клеток с последующим развитием специфического, опосредствованного Т- и В-клеточного иммунитета. В этих случаях кроме ИФН 1-го типа синтезируются такие ранние цитокины, как фактор некроза опухоли, образуются интерлейкины (IL) 1b, 6, 10 и 15, а также трансформирующий фактор роста (TGF). На этом этапе уже отмечается вариабельность РЦР при разных вирусных инфекциях. Продукция ИФН-b считается ключевым доминантным признаком инфицирования вирусом.
ИФН а/b вызывает лейкопению, лимфаденопатию, миграцию клеток из красной пульпы селезенки в белую пульпу, то есть происходит перераспределение клеток для последующих иммунорегуляторных эффектов. ИФН а/b могут усилить специфический иммунный ответ при гриппе в период первичной инфекции за счет притягивания популяции В- и Е-клеток в места воспаления для антигенной презентации.
Первыми на инфекцию начинают реагировать макрофаги, в них происходит расщепление вирусной частицы на отдельные пептиды, которые продвигаются к поверхности клетки, здесь (на мембране макрофага) они контактируют с молекулами ГКГ I и II классов. ИФН, который секретируется ИЛ-1, усиливает экспрессию антигена ГКГ. Выраженное синергичное действие ИЛ-1 и ИЛ-2 способствует пролиферации предшественников Т-клеток в вилочковой железе. В очаг инфекции направляются Т-лимфоциты (хелперы), которым и предоставляются фрагменты антигена в комплексе с молекулами ГКГ. В активации Т-хелперов принимают участие ИЛ-4, ИЛ-6 и ФНО. Возможна ситуация, когда Т-лимфоциты способны непосредственно связывать вирусные антигены при участии антигенов II класса ГКГ. Потом подключаются ЦТЛ и NK-клетки, которые являются основными факторами ликвидации инфицированных вирусом клеток. Но роль CD8+ ЦТЛ двойственна: с одной стороны, они более эффективно по сравнению с другими субпопуляциями элиминируют вирус из отделов нижних дыхательных путей, с другой — усиливают реакции локального воспаления, вызывая в эксперименте синдром респираторного дистресс-синдрома. Результатом этого взаимодействия может стать победа вируса, тогда макроорганизм подключает факторы гуморального иммунитета (местного и общего).
Основу специфического местного иммунитета составляет секреторный IgA. В его синтезе принимают участие клетки реснитчатого эпителия, макрофаги, Т-лимфоциты, клетки секреторного эпителия. Макрофаги, локализованные в пространствах между эпителиальными клетками, захватывают обломки разрушенных вирусом клеток, метаболизируют их. Антигены, подготовленные макрофагами, активизируют Т- и В-лимфоциты, которые превращаются в плазмоциты, продуцируют антитела класса IgA. Выполняя важные эффекторные функции, IgA играет роль молекулы, которая регулирует функции клеток иммунной системы, в частности альвеолярных макрофагов, несущих рецепторы к Fc-фрагменту этого Ig. Так, иммунные комплексы, которые содержат антитела класса А, индуцируют в моноцитах-макрофагах синтез ФНО-а и СЗ-комплемента С. Секреторные IgA связывают вирус и препятствуют его выходу из организма в активной форме, что ограничивает циркуляцию вируса среди людей.
При первой встрече с вирусом через 3-5 дней образуются антитела класса IgM. Повышение их содержания свидетельствует об остроте инфекционного процесса. Высокое содержание Ig в крови является показателем устойчивости организма к инфекции. IgE — единственный тип антител, который вступает во взаимодействие с мембраной тучных клеток (в клинической картине наблюдаются приступы бронхоспазма).
Иммунные механизмы при первичной встрече с вирусом запоминаются организмом в виде информации, заложенной в клетки памяти (иммунологическая память), и при повторной встрече с вирусом той же антигенной разновидности иммунные реакции протекают быстрее и более эффективно. Создание иммунной памяти об антигене является целью применения вакцин. С их помощью создается и поддерживается защитная концентрация противогриппозных антител. Антитела, вступая во взаимосвязь с антигеном, образуют иммунные комплексы. Иногда вместе с защитными функциями они могут стать причиной тяжелых иммунопатологических состояний. Циркулируя по всему организму, они оседают в тканях, вызывая воспалительные реакции в капиллярах клубочков почек и синовиальных оболочек суставов. Частично вирус из организма выделяется почками, что, возможно, и обусловливает тот факт, что в эпителии дистальных канальцев, как и в эндотелии капилляров клубочков, оказывается значительное количество антигена вируса. Почками также выделяются иммунные комплексы, фрагменты клеток, что приводит к сенсибилизации тканей почки и впоследствии, через несколько недель и даже месяцев после перенесенного заболевания, может послужить причиной возникновения гломерулонефрита. Инициатором в этом случае может быть фактор, который имеет антигенную природу (например, переохлаждение).
Находясь в окружении антител, вирус может сохранять свою структуру и при разрушении комплекса опять поражать чувствительные клетки. Длительная циркуляция комплексов приводит к инфицированию все большего количества клеток, к поддержке инфекции и к персистенции. В данное время не исключается возможность длительной персистенции вируса гриппа в ЦНС по типу медленной инфекции с развитием впоследствии такого патологического состояния, как паркинсонизм. Это изменяет представление о гриппе как об острой инфекции. Установлено, что в 50% случаев антиген вируса гриппа сохраняется в периферических лимфоидных клетках и в крови до 120-200 и более дней.
При гриппе роль антигена могут играть не только структура вируса, но и измененные вирусом структуры клеток, и уже к ним синтезируются антитела, с которыми начинают вступать во взаимодействие нормальные клетки, в результате чего возникает угроза развития аутоиммунопатологического состояния.
Изменения во внутренних органах однотипны, обусловлены генерализованной вазодилятациеи. При массивной вирусемии, которая быстро развивается в первые часы болезни, может возникнуть инфекционно-токсический шок с развитием сердечно-сосудистой недостаточности. В его основе лежат несколько факторов: сосудистый (непосредственное действие вируса на сосуды с повышением их проницаемости, вазодилятациеи), геморрагический синдром с повреждением надпочечников и дефицитом гормонов, нарушение функции миокарда. У таких больных смерть может наступить в ближайшие часы от начала заболевания.
В результате токсического повреждения сосудистого аппарата ЦНС наступает гиперсекреция спинномозговой жидкости, нарушается ликвородинамика, что приводит к повышению внутричерепного давления, может наступить отек мозга. Чаще все-таки повреждаются мягкие мозговые оболочки, сосудистое сплетение, где можно выявить антигены вируса гриппа.
Инфекционно-алергический процесс после перенесенной гриппозной инфекции может возникнуть также в эндокарде. Изменения в миокарде, определенные на ЭКГ как миокардиодистрофия, обусловлены токсикозом и циркуляторными расстройствами.
В патогенезе отека легких имеют значение много факторов: нарушения гемодинамики, связанные с токсикозом, воспалительные процессы в бронхах и легких, снижение сократительной функции левого желудочка, что чаще развивается у лиц с сопутствующими заболеваниями сердечно-сосудистой системы. Необходимо подчеркнуть, что начальные стадии отека легких, на которых повреждается интерстициальная ткань, определяются лишь рентгенологически в виде нерезких, расплывчатых теней, которые сливаются и распространяются от корней к периферии легочных полей.
В механизмах устойчивости организма к генетически инородной информации принимают участие два основных феномена: наследственная резистентность и приобретенный иммунитет:
- природная видовая наследственная резистентность, связанная с врожденной стойкостью организма, которая развивается с возрастом, к возбудителям инфекций, основанная на отсутствии чувствительных клеток или повышении их резистентности к репродукции вируса, а также на их биологической инактивации при участии интерферона, фагоцитарных факторов, нормальной температуры тела или неспецифических ингибиторов крови;
- приобретенный иммунитет создается после болезни или искусственной иммунизации вакцинами.
Приобретенный иммунитет опирается на формирование местной секреторной защиты. Секреторный иммунитет предупреждает или смягчает тяжесть заболевания во входных воротах гриппозной инфекции при участии антител класса IgA, которые синтезированы в процессе кооперации между В-лимфоцитами и эпителиальными клетками. Секреторные антитела избирательно адсорбируются на поверхности клеток мерцательного эпителия, эффективно защищая их от инвазии вируса.
Длительность противогриппозного иммунитета ограничена не дву-мя-тремя годами, как это считалось бесспорным до 1977 г. (в этот год особенно тяжело болели молодые люди, рожденные после 1957 г., когда вирус A (H1N1) исчез из циркуляции и появился снова в 1977 г.). В случае возвращения к активной циркуляции уже известного подтипа через 20 и более лет — выявляется сохранение специфической невосприимчивости к возбудителю, который вернулся, у части населения, которая контактировала с ним раньше. Такая длительная иммунологическая память обусловлена, конечно, не антителами (их титры в крови падают ниже защитного порога через 6-12 месяцев, а в секрете дыхательных путей — еще быстрее). Длительный постинфекционный иммунитет обеспечивают клеточные механизмы (Т- и В-лимфоциты), в том числе местные, во входных воротах возбудителя инфекции. Существует четко выраженная корреляция невосприимчивости к гриппу с концентрацией антител в крови (в основном IgG) и в секрете дыхательных путей (IgA). Однако в частных случаях гриппом могут заболеть люди с высоким исходным уровнем гуморального иммунитета и не заболевают инфицированные лица с низким начальным титром антител. Такие примеры подчеркивают сложность и многогранность иммунной защиты организма, где роль отдельных факторов интегрирована в общем результате.
Между специфическими механизмами противогриппозного иммунитета существует распределение защитных функций:
- секреторные антитела, которые подавляют репродукцию вируса во входных воротах инфекции, обеспечивают противоэпидемическую защиту, направленную на ограничение рассеивания и передачи возбудителя от инфицированных лиц здоровому окружению; в связи с широким диапазоном нейтрализующего эффекта секреторные антитела способны подавлять любые антигенные варианты вируса гриппа А в пределах своего подтипа;
- сывороточные антитела нейтрализуют токсичные продукты вируса и регулируют клиническую тяжесть болезни;
- клеточно-обусловленные факторы иммунитета устраняют резервуар вируса в инфицированных клетках, малодоступных влиянию антител.
Напряженность противовирусного иммунитета зависит от уровня циркулирующих антител и образования цитотоксических лимфоцитов. Цитотоксические лимфоциты вызывают лизис инфицированных вирусом клеток.
Повторное заболевание гриппом обусловлено высокой изменчивостью вируса гриппа и формированием иммунитета только к конкретному штамму, что и объясняет необходимость ежегодной вакцинации.
Общие сведения
Отек легких — это клинический синдром, в основе которого избыточная транссудация жидкости из венул/капилляров в интерстициальную легочную ткань, а затем — в альвеолы и сопровождающийся выраженным нарушением газообмена в легких с развитием гипоксии различных тканей, ацидоза, угнетением функций ЦНС. Код отек легких по МКБ-10: J81. Этот клинический синдром может быть осложнением различных кардиологических, пульмонологических урологических, гинекологических, неврологических, гастроэнтерологических заболеваний.
В клинической практике чаще встречается кардиогенный отек легких, являющийся осложнением ОСН. В большинстве случаев кардиогенный отек развивается при ИБС, ХСН, острых нарушений сердечного ритма, патологии клапанов при которых развиваются застойные явления в легких. В пожилом возрасте преобладает ИБС, а в молодом — превалируют пороки сердца, дилатационная кардиомиопатия, миокардиты.
Относится к жизнеугрожающим осложнениям, требующим принятия неотложных мер. Промедление с оказанием врачебной помощи при отеке легких, приводит к летальному исходу.
В основе развития патологического процесса — повышение давления (постепенное/резкое) в малом круге кровообращения. При этом, важнейшее значение имеет непосредственно скорость развития патологического процесса, поскольку вероятность возникновения кардиогенного отека значительно выше при остро возникших нарушениях, так как в таких ситуациях компенсаторные механизмы не срабатывают (не успевают купировать/уменьшить их последствия). В случаях более постепенного развития процесса недостаточности кровообращения и нарастаниях клинических проявлений последствия чаще не столь драматические.
Некардиогенный отек легких развивается как при прямом повреждении легких (ингаляция токсинов/токсичных газов, аспирация содержимого ЖКТ, воды, крови, ожоги, пневмонии), так и при внелегочных заболеваниях (шок, тяжелая политравма, сепсис, массивная кровопотеря, панкреатит/панкреонекроз, гемотрансфузия, уремия) встречается значительно реже. Еще одним синдромом, проявляющимся некардиогенным отеком легких и острой дыхательной недостаточностью является ОРДС — острый первичный/вторичный респираторный дистресс-синдром (синоним мокрое легкое, шоковое легкое). Развитие этого типа отека обусловлено преимущественно нарушением функции/структуры альвеолокапиллярной мембраны.
Согласно современным представлениям о первичном ОРДС повреждающий фактор оказывает влияние непосредственно на альвеолоциты, сурфактант, приводящих к повреждению эпителия альвеол и нарушению целостность альвеолокапиллярной мембраны в результате чего происходит трансфузия жидкой составляющей крови в альвеолярные пространства. При вторичном ОРДС в основе лежит внелегочный фактор, формирующийся на фоне синдрома воспалительной реакции в организме (сепсис, бактериемия). Отек такого типа (шоковое легкое) не подчиняется законам транспорта жидкости и не зависит от уровня гидростатического давления.
Его особенностью является резкое снижение вентиляции/оксигенации организма, вызывающее застой в легких, кислородную недостаточность тканей головного мозга и сердца с быстрым развитием состояний, угрожающих жизни. При неадекватной/несвоевременно оказанной помощи летальность достигает 65-80%.
Патогенез
Патогенез отека легких определяется его типом (кардиогенный/некардиогенный). Соответственно различают гидростатический и мембраногенный механизм развития отека.
Основным этиологическим фактором являются заболевания сердечно-сосудистой системы, при которых происходит повышение внутри капиллярного гидростатического давления. При достижении давления 15 мм рт. ст. происходит трансфузия плазмы крови в интерстиций в объеме, который превышает физиологическую возможность удаления её путем лимфооттока. При росте давления до 20 мм рт. ст. и выше жидкость поступает на поверхность альвеол. Механизм развития отека этого типа основан на законе Франка-Старлинга, описывающего закономерности обмена жидких сред в тканях легких. В рамках статьи нет возможности расшифровки каждого из действующих факторов формулы. Выделим лишь основные последовательно сменяющиеся взаимосвязанные этапы патологического процесса:
- Повышение гидростатического давления в малом круге кровообращения, способствующее повышению давления в легочной артерии и затем внутри капилляров легких.
- Повышение фильтрации жидкости из лёгочных сосудов непосредственно в ткань.
- Образование избыточного отрицательного давления в интерстициальном пространстве легких и развитие интерстициального отека.
- Декомпенсация оттока жидкости через лимфопути.
- Развитие альвеолярного отека (наблюдается развернутая клиника отека легких).
- Сокращение площади газообмена и дезорганизация механизма газообмена между наружной воздушной средой и кровью.
- Состояние гипоксии, которое, в свою очередь, провоцирует продуцирование гормонов стресса, катехоламинов, что приводит к еще большему нарастанию артериального давления и снижению проницаемости сосудов, дополнительно увеличивая нагрузку на левый желудочек сердца, формируя тем самым порочный круг.
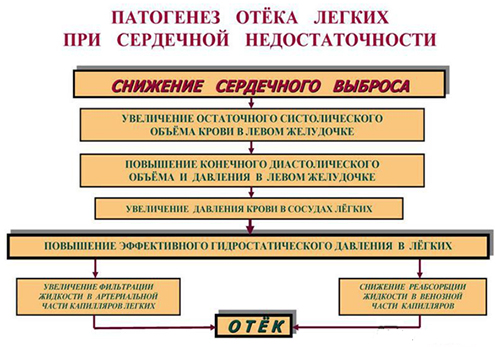
На рисунке схематически представлен патогенез отека легких кардиогенного типа
Его развитие обусловлено первичным повышением проницаемости и нарушением функции альвеолярно-капиллярной мембраны, что вызвано повреждением эпителия альвеол и эндотелия капилляров. Повышение проницательности происходит под воздействием токсичных кислородных радикалов, протеиназ, простагландинов, лейкотриенов, гистамина, образующихся или освобождающихся в ткани под воздействием на нее различного рода раздражителей.
Повышение проницаемости легочных капилляров быстро приводит к появлению большого количества отечной жидкости, в которой содержится много белка. При этом, изменения проницаемости альвеолярной и капиллярной части барьера происходит не одночастно. Вначале повышается проницаемость эндотелиального слоя, что приводит к пропотеванию сосудистой жидкости в интерстиций, где она временно накапливается (интерстициальный отек легких). При этом, интерстициальный отек частично компенсируется за счет ускорения лимфооттока. В большинстве случаев эта приспособительная реакция является недостаточной, и постепенно отечная жидкость проникает через поверхность деструктивно измененных клеток альвеол в их полость, заполняя весь объем.
Развивается альвеолярный отек легких. Выключение из процесса газообмена части альвеол компенсируется растяжением (эмфиземой) еще оставшихся неповрежденных альвеол, что приводит к сдавливанию лимфатических сосудов и капилляров легких. Альвеолярный отек развивается при заполнении альвеол жидкостью и характеризуется появлением выраженных нарушений со стороны дыхательной системы, развитием артериальной гипоксемии/гиперкапнии.
На этом фоне изменяется микроциркуляция/повышается вязкость крови (развитие ДВС-синдрома). Нарушается реактивность сосудов и тонус мышечной ткани бронхов, снижается активность сурфактанта, что приводит к развитию микроателектаз. Нарастает гиповентиляция альвеол, приводящая к несоответствию между перфузией и вентиляцией, изменению диффузии углекислого газа/кислорода и снижению снабжения тканей кислородом с развитием гипоксии и метаболического ацидоза.
Мембраногенный отёк лёгких развивается при воздействии различных типов повреждающих факторов, одним из которых являются токсиканты различного генеза, на примере которых более подробно рассмотрим патогенез токсического отека.
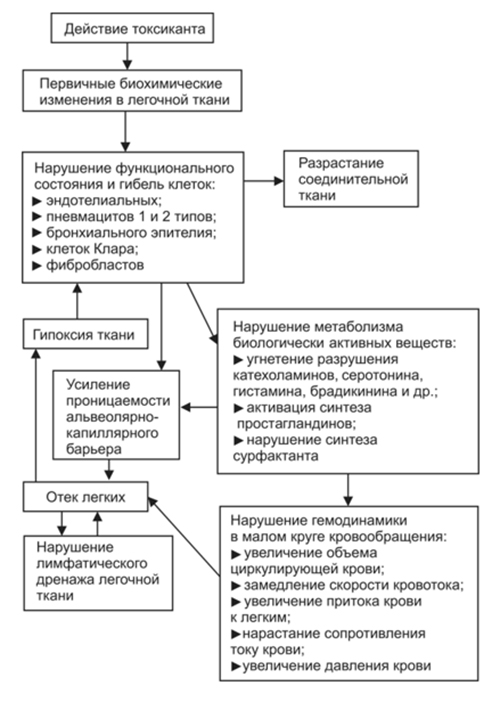
На рисунке схематически представлен патогенез токсического отека легких
Токсический отек легких. Патогенез отека легких такого типа обусловлен воздействием токсикантов непосредственно на клетки альвеолярно-капиллярного барьера с нарушением их функции. Токсический отек имеет различные механизмы повреждения клеток легких, но развивающиеся за этим патологические процессы достаточно схожи. При повреждении/гибели клеток происходит усиление проницаемости барьера и резкому к усилению процессов выработки в легочной ткани биологически активных веществ (гистамина, норадреналина, ангиотензина, ацетилхолина, серотонина, простагландинов) что способствует дальнейшему повышению проницаемости/нарушению функции альвеолярно-капиллярного барьера и развитию нарушений гемодинамики в легких (уменьшается скорость кровотока, растет давление в малом круге кровообращения). По мере прогрессирования отека респираторные и терминальные бронхиолы заполняет жидкость, а под действием турбулентности, возникающей при движении воздуха, образуется пена в дыхательных путях.
Отек легких смешанного типа. В основе развития сочетание механизмов отека обоих типов.
Классификация
Единой общепринятой классификации отека легких нет. Общепризнанным является разделение отека легких на кардиогенный и некардиогенный.
Кардиогенный отек легких в свою очередь разделяют по нескольким признакам.
По наличию/отсутствию в анамнезе ХСН:
- Впервые возникший (без наличия в анамнезе ХСН).
- Декомпенсированный (острая декомпенсация ХСН).
По причине возникновения:
- Левожелудочковая недостаточность (аритмии; острый коронарный синдром; миокардит/перикардит/эндокардит; дисфункции клапанов — митральная недостаточность, аортальный стеноз и др.).
- Увеличение внутрисосудистого объема (почечная недостаточность, объемная перегрузка).
- Легочная венозная обструкция (стеноз митрального клапана).
Некардиогенный отек разделяют на:
- Первичный — связанный с наличием повреждающего фактора непосредственно в легочной ткани.
- Вторичный — развивающегося при наличии внелегочного фактора и выраженном системном воспалении.
По течению выделяют:
- Молниеносный отек – бурное развитие на протяжении нескольких минут, летальный исход.
- Острый отек – быстро нарастает (на протяжении до 4-х часов). Развивается преимущественно при инфаркте миокарда, анафилаксии, черепно-мозговых травмах. Даже при своевременно проведенных реанимационных мероприятиях высокий риск летального исхода.
- Подострый отек – характеризуется волнообразным течением с постепенным нарастанием симптоматики и ее стиханием. Наблюдается чаще при эндогенной интоксикации организма различного генеза (печеночной недостаточности, сепсисе, уремии).
- Затяжной отек – период развития от 12 часов до 1-3 суток. Часто протекает стерто, с невыраженной симптоматикой без характерных клинических признаков. Встречается чаще при хронических заболеваниях легких, ХСН.
Причины отека легкого
Основной причиной отека легкого при болезни сердца (кардиогенного отека) является увеличение гидростатического давления в капиллярной системе легочной артерии. Наиболее частой причиной, от чего бывает отек является застойная сердечная, чаще левожелудочковая недостаточность, обусловленная снижением сократительной возможности миокарда, перегрузкой объемом/давлением или патологией клапанов сердца. Нарастающий дисбаланс артериального/венозного кровенаполнения, развитие в малом кругу кровообращения выраженного венозного застоя является неблагоприятным прогностическим признаком. Венозный застой в легких что это такое? Это нарушение гемодинамики малого круга кровообращения, характеризующийся переполнением венозного участка кровеносного русла кровью, обусловленное расстройствами сердечной деятельности.
Причинами развития некардиогенного отека легких могут быть: ингаляция токсических субстанций, тяжелая травма грудной клетки, острые вирусные заболевания легких (пневмонии), сепсис, аспирационный синдром, радиационное повреждение легких, переливание крови, панкреонекроз, политравма, кровопотеря.
Симптомы отека легких
Относится к той группе состояний, диагностировать которую можно практически уже на расстоянии, поскольку симптомы отека легких у взрослых относятся к весьма характерным: выраженная одышка, преимущественно инспираторная, значительно реже — смешанная; ортопноэ (одышка в положении лежа); кашель с выделением мокроты; число дыханий превышает 30/мин.; холодный обильный пот; цианоз кожных покровов/слизистых; наличие в легких хрипов; тахикардия (ритм галопа), аускультативно — акцент 2 тона над легочной артерией.
Признаки отека легких у человека определяются патогенетическими процессами. Условно клинически выделяют несколько стадий:
- Диспноэтическая. Проявляется сухими хрипами, диспноэ, что связано с началом отека преимущественно интерстициальной легочной ткани, единичные влажные хрипы.
- Стадия ортопноэ. Характерно нарастание влажных хрипов, которых превалируют над сухими хрипами.
- Стадия развернутой клиники. Выраженное ортопноэ, хрипы отчетливо слышны на расстоянии.
- Тяжелая стадия. Множество разнокалиберных хрипов, выделение пены, обильный холодный пот, прогрессирующий диффузный цианоз.
В практике чрезвычайно важно различать интерстициальную и альвеолярную стадию развития отека. Интерстициальному отеку легких соответствует клиническая симптоматика сердечной астмы, что обусловлено резким ухудшением обмена кислородом и углекислотой между кровью и воздухом альвеол, способствующее повышению сосудистого и бронхиального сопротивления.
Приступ сердечной астмы, как правило, развивается в ночной период времени. Больной просыпается от сильного ощущения недостатка воздуха, вынужденно принимает положение сидя, пытается открыть окно, появляется страх смерти, возбуждение, на вопросы не отвечает, сосредоточившись на борьбе за воздух.
Продолжительность приступа сердечной астмы варьирует от 5-10 минут до 1-3 часов. При аускультации— сухие хрипы, в нижних отделах легких ослабленное дыхание. В случаях хронической сердечной недостаточности, митрального стеноза, сопровождаемых гиперволемией малого круга кровообращения для диагностики интерстициального отека большее значение имеет рентгенологическое обследование. На рентгенограмме отмечаются характерные признаки — усиление легочного рисунка, который особенно выражен в прикорневых зонах, что обусловлено наличием лимфатических пространств и отечной инфильтрации перибронхиальной/периваскулярной и межуточной ткани; наличие линии Керли и субплеррального отека.
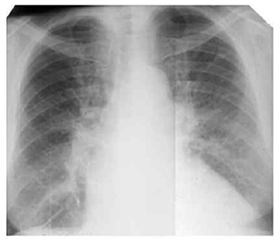
Рентген-снимок. Интерстициальной отек
Далее жидкость из интерстиция поступает в альвеолы, что вызывает альвеолярный отек легких со спаданием альвеол, разрушением сурфактанта, затоплением альвеол транссудатом. На этой стадии может происходить образование стойкой белковой пены, которая перекрывает просвет бронхов/бронхиол, что приводит к гипоксемии и гипоксии.
Острый альвеолярный отек легких относится к более тяжелой форме проявления левожелудочковой недостаточности. Переход интерстициального отека к альвеолярному зачастую происходит достаточно быстро – на протяжении нескольких минут. Бурно протекающий альвеолярный отек чаще развивается в дебюте инфаркта миокарда или на высоте гипертонического криза.
Характерным является громко клокочущее дыхание с выделением белой или из-за примеси эритроцитов розовой пены. На этом фоне резко нарушается оксигенация крови и присутствует высокий риск асфиксии. Как правило, развернутая клиническая симптоматика альвеолярного отека является ярко выраженной и не вызывает затруднений с постановкой диагноза. Дополнительным характерным признаком является появление значительного количества влажных разнокалиберных хрипов, иногда присутствуют и сухие хрипы. Альвеолярный отек, как и сердечная астма, наблюдается преимущественно в ночное время. Приступ может быть как кратковременным, который проходит самостоятельно, так и длительным, продолжающимся несколько часов. В случаях сильного пенообразования может быстро наступить смерть от асфиксии, буквально на протяжении 5-10 минут после появления первых клинических проявлений.
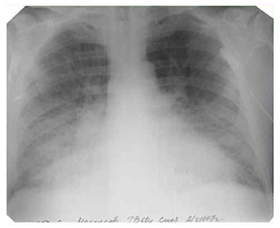
Рентген-снимок. Альвеолярный отек легких.
При альвеолярном отеке легких типичная рентгенологическая картина обусловливается пропитыванием транссудатом симметрично в обоих легких с локализацией отека преимущественно в базальных и прикорневых отделах.
Лабораторные данные клинического значения не имеют и сводятся преимущественно к резким изменениям в газовом составе (гипоксемия) и кислотно-щелочном состоянии крови (метаболический ацидоз). На ЭКГ — тахикардия, повышение/деформация амплитуды зубца Р, снижения сегмента ST.
При застойной сердечной недостаточности, обусловленной снижением сократительной возможности левого желудочка отек чаще развивается при нарушениях сердечного ритма/повышении АД, приводящих к снижению минутного объема крови.
Анализы и диагностика
Диагностическими критериями являются жалобы на резкое ощущение нехватки воздуха, сухой/влажный кашель, позже выделение пенистой мокроты; наличие в анамнезе различных заболеваний сердца (ХСН, ИБС, кардиомиопатии, АГ) или некардинальных причин.
Физикальное обследование: к основным признакам острой левожелудочковой недостаточности относятся пароксизмальная ночная одышка, ортопноэ, двусторонние легочные хрипы, влажные холодные конечности, головокружение, спутанность сознания, олигурия, низкое пульсовое давление.
Вероятные признаки наличия ОСН: тахикардия (ЧСС> 120 уд./мин.)/брадикардия (ЧСС 25/мин. с вовлечением в дыхательный процесс вспомогательных мышц.
Лабораторные критерии постановки диагноза кардиогенного отека легких:
- Низкая сатурация кислорода (при пульсоксиметрии SaO2 45 мм.рт.ст. в артериальной крови).
- Дыхательная недостаточность гиперкапнического типа.
- Метаболический ацидоз.
- Рентгенография легких – признаки легочного застоя.
- ЭКГ – наличие нарушений проводимости, пароксизмальных нарушений ритма и ОКС, признаки структурного поражения сердца.
- Пульсоксиметрия — сатурации кислорода 25 в мин) проводится неинвазивная вентиляция легких специальными аппаратами в режиме CPAP/BiPAP.
Медикаментозное лечение проводится в зависимости от показателей артериального давления. Именно уровень АД у больных с ОСН имеет наибольшее значение в выборе лечебных препаратов при неотложных мероприятиях.
Читайте также:


