Пробирки для крови на вирусную нагрузку
Взятие, доставку и оформление материалов для проведения лабораторных исследований методом ИФА на ВИЧ-инфекцию и СПИД - индикаторные заболевания, для проведения лабораторных исследований методом ПЦР на ВИЧ - инфекцию, вирусные гепатиты В и С, а также для иммунологических исследований в КДЛ ГБУЗ РЦПБ СПИД и ИЗ производить строго в соответствии с правилами (приложение 1, 2, 3).
Наиболее частыми нарушениями указанных правил являются следующие:
1) при оформлении сопроводительной документации не указывается наименование диагностической тест-системы, ее серия, срок годности
2) не полностью указываются паспортные данные обследуемых, а также дата и место взятия материала
3) зачастую в лабораторию ГБУЗ РЦПБ СПИД и ИЗ доставляется материал, уже непригодный для исследования: сыворотки, хранившиеся дольше установленного срока хранения (для разных методов исследования сроки хранения составляют от 3 до 48 часов); проросшие, гемолизированные сыворотки, в недостаточном для исследования количестве (в зависимости от метода минимально необходимый объем материала составляет от 2 до 5 мл);
4) номера, проставленные на флаконах, не соответствуют указанным в направлении; количество проб крови не соответствует количеству, указанному в направлении;
5) неправильно производится взятие материала, в пробах крови, доставляемых для исследований методом ПЦР и для иммунологические исследований, обнаруживаются сгустки,
6) при заборе материала не всегда медицинский персонал ЛПУ обращает внимание на сроки годности пробирок.
Правила взятия и доставки крови для проведения лабораторных исследований методом ИФА на ВИЧ-инфекцию и СПИД-индикаторные заболевания.
Взятие крови производится из локтевой вены в чистую сухую пробирку в количестве 3-5 мл. У новорожденных можно брать пуповинную кровь с указанием об этом в направлении. Полученный материал не рекомендуется хранить более 12 часов при комнатной температуре и более 1 суток в холодильнике при +4-8 0С. Наступающий гемолиз может повлиять на результаты анализа. В случае невозможности доставки материала в течение суток следует сразу после взятия крови отобрать из нее сыворотку. Сыворотка отделяется центрифугированием. Отделенная сыворотка переносится в чистую (лучше стерильную) пробирку, флакон или пластиковый контейнер, и в таком виде она может храниться до 7 дней при температуре +4-8 0С. На пробирке следует указать порядковый номер, фамилию и инициалы пациента, в строгом соответствии с направлением. Для транспортировки в КДЛ диагностики ВИЧ штативы с пробирками помещают в термоконтейнер, легко подвергающийся дезинфекции. Полученный материал в КДЛ диагностики ВИЧ доставляет медицинский персонал, прошедший специальный инструктаж в установленном порядке.
Утв. МЗ СССР от 05.09.1988 г. №690
Направление №__________________
на исследование образца крови в ИФА на ВИЧ-инфекцию
В_________________________________________________________
(наименование учреждения)
Должность лица, направляющего материал___________________________________
Взятие материала для исследования производить только при предъявлении пациентами паспорта или иного документа, удостоверяющего его личность (кроме анонимного обследования).
Коды контингентов
Наименование кода
код
Доноры (крови, биологических жидкостей, органов и тканей)
Медицинский персонал, работающий с ВИЧ - инфицированными лицами и инфицированным материалом
Гомо- и бисексуалисты
Больные заболеваниями, передающимися половым путем
Лица, находящиеся в местах лишения свободы
Обследованные по клиническим показаниям
Беременные (доноры плацентарной и абортной крови)
Обследованные при эпидемиологическом расследовании
Для лабораторий диагностики ВИЧ-инфекции в обменном журнале и направлении обязательно дополнительно указываются результаты исследования (ОП сыворотки, ОП критическое), а также дата постановки, название, серия, срок годности используемой тест-системы.
Правила взятия, хранения и доставки материала для проведения исследований методом полимеразной цепной реакции (ПЦР).
В направлении должны быть четко указаны: учреждение, направившее материал, Ф.И.О. (полностью), год рождения, код контингента, домашний адрес, дата, точное время и место взятия материала, фамилия и подпись ответственного лица с указанием номера контактного телефона.
Правила взятия и доставки материала для проведения иммунологических исследований.
Материал должен быть доставлен в лабораторию сразу после взятия. Недопустимо замораживание биологического материала. Флаконы должны быть четко промаркированы с указанием фамилии пациента, даты и времени взятия. Маркировка флаконов должна строго соответствовать данным, указанным в направлении.
В направлении должны быть четко указаны: учреждение, направившее материал, Ф.И.О. (полностью), год рождения, код контингента, домашний адрес, дата, время и место взятия материала, фамилия и подпись ответственного лица с указанием номера контактного телефона.
Вакуумная пробирка — основной инструмент для забора венозной крови. Она может быть наполнена реагентом, который позволит провести быстрый и точный анализ. В таком случае каждая пробирка имеет колпачок своего цвета. Цветное кодирование соответствует международному стандарту ISO 6710.
Вакуумные пробирки для получения сыворотки (биохимия, серология). Цвет крышечки – коричневый или красный
Сыворотка крови – жидкая часть крови лишенная форменных элементов и некоторых белков (фибрин и др.) в отличие от плазмы, в которой сохраняются все элементы жидкой части крови кроме форменных элементов.
Получение сыворотки крови является результатом двухступенчатого биохимического процесса: свертывания (коагуляции) крови и ретракции (уплотнения) сгустка. Для запуска коагуляционного каскада необходимо наличие внешнего активатора, каковым может служить кремния диоксид, поэтому процесс свертывания крови быстрее происходит в стеклянных пробирках, так как кремния диоксид является базовым материалом стекла или в пластиковых пробирках с активатором свертывания. Активатор свертывания (clot activator) выполнен в виде напыления на внутренней стенке пробирки.
После образования сгустка начинается этап его уплотнения и выделения сыворотки. На практике ретракция сгустка ускоряется центрифугированием пробирок с кровью.
Для получения максимально чистой сыворотки рекомендуется соблюдение трех условий:
1. После забора крови в пробирку в соответствии с инструкцией необходимо осторожно однократно перевернуть пробирку для более полного контакта крови с активатором свертывания;
2. Дождаться завершения процесса свертывания крови в течение 20-30 минут при комнатной температуре и вертикальном положении пробирки;
3. Центрифугировать пробирку со свернувшейся кровью не менее 10 минут с ускорением 1500 G (примерно 3000 об/мин) для максимального выдавливания сыворотки из сгустка. При необходимости допускается центрифугирование с ускорением 4000G c крышечкой и до 12000G без крышечки.
После центрифугирования и полной ретракции сгустка сыворотка располагается над сгустком, но в контакте с ним. Сохраняется опасность загрязнения сыворотки составляющими сгустка при неосторожном обращении с пробиркой (встряхивание, опрокидывание и пр.). Для лучшего очищения сыворотки и более полного разграничения сыворотки и сгустка применяются специальные пробирки, содержащие биологически инертный олефиновый гель. Последний представляет собой тиксотропный кополимер, который тяжелее сыворотки, но легче кровяного сгустка, поэтому после центрифугирования гель в виде тонкой полоски занимает промежуточное положение и служит разделительным барьером. Стабильность такого барьера гарантирована в течение 5-7 дней при хранении пробирки с кровью при комнатной температуре.
Оптимальные сроки сохранности образца крови в данных пробирках составляет при комнатной температуре 6 часов, при хранении в холодильнике (+4ºС) – 24 часа. Повторное центрифугирование пробирок, особенно с гелем, не допускается.
Полученная сыворотка крови применяется для очень широкого спектра лабораторных биохимических, ИФА и иммунологических исследований:
белковый состав, ферменты, гормоны, онкомаркеры, ВИЧ-инфицирование, гепатиты и пр.
Вакуумные пробирки для получения цельной крови или плазмы
Не все анализы в клинике делаются из сыворотки крови. Для многих видов исследований необходима цельная кровь, содержащая форменные элементы, или плазма, освобожденная от клеток крови центрифугированием. С целью получения несвернувшейся крови разработаны пробирки с определенными добавками – антикоагулянтами. На практике используют два вида антикоагулянтов:
ингибиторы (вещества, вызывающие торможение) тромбина. Тромбин является ключевым игроком в коагуляционном каскаде. Он принимает участие в формировании ряда факторов свертывания крови и способствует трансформации фибриногена в фибрин. Добавление биохимических ингибиторов тромбина эффективно активирует антикоагуляционные свойства крови.
связывание (удаление) ионов Ca2+. При прочих равных условиях свертывание крови происходит при активном участии ионов Ca2+. Удаление их является эффективным механизмом сохранения крови в жидком состоянии.
Гепарин. Цвет крышечки – зеленый, светло-зеленый
Гепарин - кислый мукополисахарид с молекулярной массой 4000-40000 – является натуральным антикоагулянтом, присутствующем в любом здоровом организме. Гепарин активирует создание комплексных соединений между антитромбином III и такими факторами свертывания крови, как тромбин, факторы XIIa, XIa, Xa, IXa и VIIa. В таком комплексе факторы свертывания инактивируются необратимо.
Для целей получения плазмы крови в пробирки добавляют литиевую либо натриевую соль гепарина в пропорции к забираемой в пробирку кровью 15-20 МЕ/1 мл, что служит гарантией полной инактивации свертывания крови и не искажает исследуемые параметры. Эритроциты сохраняются в образце крови до 8 часов. Нельзя использовать для проведения анализов образец крови, хранившийся более 48 часов даже в условиях холодильника (+4ºС).
Для получения качественного результата анализа необходимо:
Немедленно после взятия крови осторожно перевернуть пробирку 5-7 раз для лучшего перемешивания крови и гепарина,
Плазма отделяется после центрифугирования. Нормальные скорости центрифугирования – 1000-1500G (2000-3000 об/мин). При необходимости допускается центрифугирование с ускорением 4000G c крышечкой и до 12000G без крышечки.
В клинике пробирки с гепарином применяются, в основном для проведения исследования:
электролитного состава крови,
газового состава крови,
содержания алкоголя в крови.
Не рекомендуется использовать гепарин для: морфологических исследований, так как кислотный характер гепарина способствует обесцвечиванию мазка крови, придавая ему голубоватый оттенок, подсчета лейкоцитов и тромбоцитов, поскольку гепарин стимулирует агрегацию этих клеток крови.
исследований по методике полимеразной цепной реакции (ПЦР).
Для более чистого разграничения плазмы крови и сгустка применяются специальные пробирки, содержащие кроме гепарина инертный олефиновый гель. Последний представляет собой тиксотропный кополимер, который тяжелее плазмы, но легче форменных клеток крови, поэтому после центрифугирования гель в виде тонкой полоски занимает промежуточное положение и служит разделительным барьером.
Фторид натрия/ЭДТА калия. Цвет крышечки – серый
Добавление фторида натрия и ЭДТА калия в пробирку позволяет предотвратить разрушение глюкозы крови (процесс, называемый гликолизом) и сохранить ее уровень во взятом образце крови.
Фторид натрия и оксалат калия выступают в качестве антикоагулянтов, связывая ионы Са2+ и, кроме того, фторид натрия стабилизирует уровень глюкозы.
Глюкоза разрушается до пирувата и лактата при последовательном осуществлении различных энзиматических реакций. Фторид натрия ингибирует некоторые ферментативные реакции, включая превращение фосфоглицерата в фосфоенолпируватацид, и предотвращает гликолиз.
Для получения качественного результата анализа необходимо:
немедленно после взятия крови осторожно перевернуть пробирку 5-7 раз для лучшего перемешивания крови и антикоагулянта
плазма отделяется после центрифугирования. Нормальные скорости центрифугирования – 1000-1500G (2000-3000 об/мин).
Пробирки с добавлением фторида натрия и оксалата калия используют для проведения определения уровня сахара (глюкозы) в крови. Соотношение компонентов 1/1, общее количество добавляемых реагентов – 4,5 мг/1 мл забираемой в пробирку крови.
Замечания: Фторид блокирует активность уреазы и некоторых других ферментов. Образцы крови из данных пробирок нельзя использовать для прямого определения энзимов. Фторид натрия и ЭДТА калия связывают ион Са2+, заменяя в крови 1 ион кальция на 2 иона натрия или калия. Следствием этого является повышение напряжения ионов в межклеточной жидкости и выкачивание воды из внутриклеточного пространства в межклеточное, сморщивание клеток крови с умеренным "выдавливанием" из эритроцитов гемоглобина. Поэтому видимый гемолиз свойственен образцам крови с данной добавкой.
Глюкоза превращается в лактат в результате комплекса реакций, включающего в себя различные этапы. Фторид ингибирует один их последних этапов разрушения глюкозы, начальные этапы с участием гексокиназы и фосфофруктокиназы блокируются менее эффективно, поэтому можно наблюдать снижение содержания глюкозы в образце крови на 6-7% от первоначального.
После первоначального незначительного снижения уровня глюкозы ее количество остается постоянным при хранении крови в пробирке в течение 8-10 часов при температуре до 25ºС и в течение 2-3 дней в холодильнике (+4ºС).
ЭДТА-К2. Цвет крышечки - сиреневый
Этилендиаминтетраацетат (ЭДТА) является предпочтительным антикоагулянтом для гематологических исследований. ЭДТА и его щелочные соли способны создавать хелатные соединения с ионами кальция с образованием растворимых высокостабильных комплексов. Наиболее эффективная концентрация ЭДТА – 1,2 мг/мл крови. Во всем мире используют три варианта солей ЭДТА: ЭДТА-К3, ЭДТА-К2 и ЭДТА-Na2. Наиболее предпочтительной и рекомендуемой Международной Комиссией по Стандартизации в Гематологии является двукалиевая соль ЭДТА:
ЭДТА-К3 показывает меньшую способность поддержания крови в жидком состоянии, также ЭДТА-К3 влияет на подсчет лейкоцитов, занижая их количество.
различия между ЭДТА-К2 и ЭДТА-Na2 в клиническом плане незначительны и ими можно пренебречь, но ЭДТА-Na2 хуже растворим.
Для получения качественного результата анализа необходимо:
немедленно после взятия крови осторожно перевернуть пробирку 5-7 раз для лучшего перемешивания крови и антикоагулянта;
плазма отделяется после центрифугирования. Нормальные скорости центрифугирования – 1000-1500G (2000-3000 об/мин). При необходимости допускается центрифугирование с ускорением 4000G c крышечкой и до 12000G без крышечки.
Наиболее широко используются пробирки, содержащие 1,95 мг ЭДТА/1мл крови. Они нашли свое применение в таких областях лабораторной практики, как:
гематологические исследования – подсчет клеток крови, определение СОЭ и пр.
ПЦР-исследования (качественные и количественные методики).
Пробирки с образцами крови можно хранить до 6-10 часов при 4ºС, хранение свыше 24 часов не рекомендуется из-за снижения числа эритроцитов и лейкоцитов.
Цитрат натрия. Цвет крышечки - голубой
Цитрат натрия является антикоагулянтом для сбора венозной крови с це6лью проведения исследований коагуляционных свойств крови.
Процесс свертывания крови представляет собой последовательность сложных реакций, в которых результатом первых реакций (с участием активных ферментов) является активация следующих, первоначально неактивных энзимов. Последним активным ферментом в этой цепочке присутствует тромбин, который осуществляет превращение фибриногена в фибрин. Нити фибрина опутывают клетки крови и окончательно формируют кровяной сгусток. Крайне важную роль на этом этапе играют ионы Са2+. Антикоагуляционные свойства цитрата проявляются в формировании комплекса с ионами Са2+ и эффективном удалении их из крови.
Общее исследование свертывания крови определяется временем, необходимым для последовательной активации ферментов, участвующих в коагуляционном процессе. Проводится определение времени активации и количественное измерение различных составляющих коагуляционного каскада, для чего создаются так называемые "обходные пути" добавлением некоторых промежуточных продуктов свертывания.
Наиболее часто используются пробирки с 3,8% или 3,2% раствором цитрата натрия (0,129 моль/л), соотношение цитрата к количеству забираемой крови 1/9.
Для максимально качественного проведения коагулологических исследований рекомендуется соблюдение определенных правил:
нельзя использовать пробирку для взятия крови на коагуляционные тесты первой, сразу после венепункции, так как на результаты может повлиять выделяющийся при пункции тканевой тромбопластин;
венозный жгут во время взятия крови в пробирку должен быть снят;
немедленно после взятия крови пробирку аккуратно переворачивают 5-6 раз для лучшего перемешивания крови и антикоагулянта;
сразу после этого надо проверить количество взятой крови: ее верхняя граница должна быть на уровне голубой полоски на этикетке.
Оптимальными условиями хранения пробирки с образцом крови является температура 20-24ºС и исследование коагуляционных свойств и факторов свертывания крови должно быть проведено в течение 2-х часов с момента взятия крови
Что и как отбирают на исследование?[1]
От больных или контактных лиц для проведения лабораторной диагностики отбираются:
1. Респираторный материал:
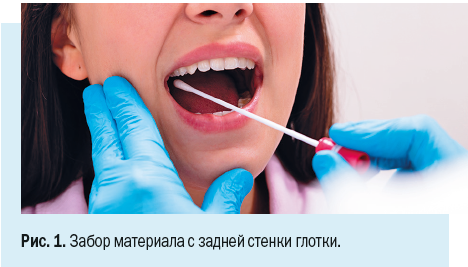
• Мазки из носоглотки и ротоглотки. Мазок из носоглотки и ротоглотки забирают в стерильные пластиковые пробирки Эппендорфа и тампоны для мазков (швабы) (рис. 1).
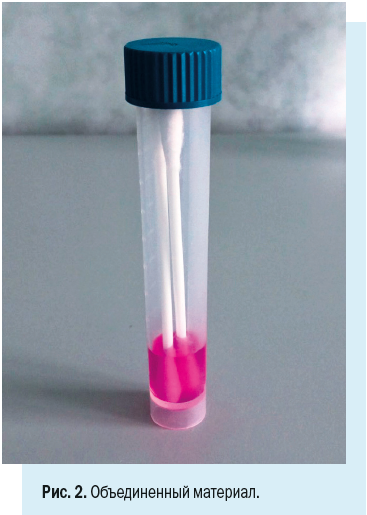
Носоглоточные и орофарингеальные тампоны помещают в одну пробирку для увеличения вирусной нагрузки (рис. 2).
• Мокрота (при наличии). Отбирается в стерильный контейнер, для транспортировки используют транспортную среду, содержащую противогрибковые и антибиотиковые добавки.
Мы рекомендуем
• Эндотрахеальный аспират. Отбирают в стерильный контейнер.
• Бронхоальвеолярный лаваж. Забирается в стерильный контейнер, возможно небольшое разведение образца. Ткани биопсии или аутопсии, включая легкие, забираются в стерильный контейнер с физиологическим раствором и транспортной средой, содержащей противогрибковые и антибиотиковые добавки.
• Биопсия легких. Ткани биопсии или аутопсии, включая легкие, забираются в стерильный контейнер с физиологическим раствором и транспортной средой, содержащей противогрибковые и антибиотиковые добавки. Для посмертной диагностики используют аутоптаты легких, трахей и селезенки.
2. Сыворотка крови. Забираются в пробирки для разделения сыворотки, у взрослых собирают 3–5 мл цельной крови.
Проводят две пробы:
• первую — в острую фазу, в первую неделю болезни;
• вторую — через 2–4 недели после острой фазы.
Анализ образцов сыворотки, отобранных в острый период и в период реконвалесценции, может поддержать идентификацию истинного агента.
3. Цельная кровь. Собирается в пробирку. Цель — обнаружить антиген, особенно в первую неделю болезни.
4. Моча. Собирается в контейнер для сбора мочи.
7 правил при заборе клинического материала
Важно правильно выбрать время забора клинического материала. Предположительно наиболее высокое содержание вируса в дыхательных путях человека может быть в течение первых 4-х дней после появления признаков заболевания.
Например, при тяжелом случае это бронхоальвеолярный лаваж, эндотрахеальный аспират, мокрота или кровь.
Важно!
От каждого пациента забирают 3 вида клинических материалов в двух экземплярах , т.е. минимум 6[2] проб.
Все образцы, собранные для лабораторных исследований, являются потенциально инфекционными. Поэтому медицинский персонал при сборе и транспортировании клинического материала должен соблюдать требования биологической безопасности и использовать средства индивидуальной защиты — шапочку, респиратор, очки, противочумной халат или противочумной костюм (рис. 3, 4).
При выполнении аэрозольных процедур (аспирация или открытое отсасывание образцов дыхательных путей, интубация, сердечно-легочная реанимация, бронхоскопия) необходимо применять:
• очки для защиты глаз или защитный экран (рис. 6);
• противочумной халат и перчатки, водонепроницаемый фартук (при проведении процедур, при которых жидкость может попасть на халат) или специальные защитные комплекты (рис. 7).
Ограничить число лиц, присутствующих в комнате, до минимума, необходимого для сбора образцов, использовать СИЗ.
Все используемые материалы должны быть утилизированы в соответствии как медотходы класса В[3].
А. П. Ситников,
санитарный врач
Общие правила:
Пробирки на исследования выдаются в иммунологической лаборатории.
· Забор крови проводится утром натощак.
- Исключается приема алкоголя не менее, чем за 24 часа до взятия крови.
- Утренний прием лекарственных препаратов, лечебно-диагностических процедур (массаж, ЭКГ, физиотерапевческое лечение и др.) проводится после взятия крови.
· Пациент перед процедурой должен находиться в покое, сидеть или лежать не менее 5 минут.
· Продолжительность пережатия сосудов жгутом должна составлять не более 1 минуты.
· Нельзя просить работать пациента кулаком и массировать предплечье по ходу вен.
4.1. Забор крови на иммунограмму:
- Кровь забирают из локтевой вены в две стеклянные центрифужные пробирки или вакуумные системы:
1) пробирка с антикоагулянтом (гепарин);
2) сухая пробирка.
Пробирки выдаются в иммунологической лаборатории!
4.1.1.На исследование гуморального иммунитета (циркулирующие иммунные комплексы; IgA,M,G):
· Кровь забирают из локтевой вены в пробирку без стабилизатора в количестве не менее 5мл.
4.1.2.На исследования фагоцитарной активности лейкоцитов:
· Кровь забирают из локтевой вены в пробирку с гепарином в количестве 7мл, после заполнения пробирки её следует аккуратно перевернуть 2 раза.
4.1.3.На исследования клеточного иммунитета (популяции и субпопуляции лимфоцитов – CD3; CD4; CD8; CD20):
· Кровь забирают из локтевой вены в пробирку с гепарином в количестве 7мл, после заполнения пробирки её следует аккуратно перевернуть 2-3 раза.
!* кровь на фагоцитарную активность лейкоцитов и исследования клеточного иммунитета можно забирать в одну пробирку с гепарином в количестве 7мл.
4.2. Забор крови на определение криоглобулина:
· Кровь забирают из локтевой вены в отдельную стеклянную центрифужную пробирку без стабилизатора в количестве 4-5мл.
!* необходимо немедленно, после забора доставить пробирку с исследуемым образцом в лабораторию, не дав крови охладится (желательно транспортировать образцы в терма контейнере).
4.3. Забор крови на определение специфических серологических маркеров:
· Кровь забирают из локтевой вены в отдельную стеклянную центрифужную пробирку без стабилизатора в количестве 5мл.
4.3.1. Исследования на маркеры вирусных гепатитов В и С (HBsAg; HBeAg; HBcIgG; HBcIgM; HBeIgG; антиВГС-IgG; антиВГС-IgM):
· Кровь забирают из локтевой вены в отдельную стеклянную центрифужную пробирку без стабилизатора в количестве не менее 5мл.
!* кровь на скрининг гепатитов В и С, а также комплекс маркеров гепатитов можно забирать в одну пробирку не менее 7мл.
4.3.2. Исследования на маркеры TORCH- инфекций (анти-ЦМВ IgG, IgM; анти-ВПГ IgG, авидность IgG; анти-TOXO IgG, IgM):
· Кровь забирают из локтевой вены в отдельную стеклянную центрифужную пробирку без стабилизатора в количестве 5мл.
!* кровь на антитела к ЦМВ, ВПГ, токсоплазме можно забирать в одну пробирку не менее 5-7мл.
4.3.3. Исследования на маркеры возбудителей заболеваний ЖКТ (АТ к Нр; АТ к АГ описторхисов; АТ к АГ лямблий):
· Кровь забирают из локтевой вены в отдельную стеклянную центрифужную пробирку без стабилизатора в количестве 3-5мл.
!* кровь на антитела к Нр, антигенам описторхисов, антигенам лямблий можно забирать в одну пробирку не менее 5мл.
4.3.4. Исследования на маркеры клещевых инфекций (АТ к ВКЭ; АТ к ВКБ):
· Кровь забирают из локтевой вены в отдельную стеклянную центрифужную пробирку без стабилизатора в количестве не менее 5мл.
!* кровь на антитела к вирусу клещевого энцефалита, возбудителю клещевого баррелиоза можно забирать в одну пробирку не менее 5-7мл, с указанием порции.
· На исследования антител к вирусу клещевого энцефалита можно забирать ликвор в отдельную центрифужную стеклянную пробирку без стабилизатора, не менее 1мл, с указанием порции.
!*ликвор недолжен, содержать эритроцитов и других примесей.
4.3.5. Исследования на маркеры аутоиммунных и системных заболеваний (АТ кdsДНК; АТ к ТПО):
· Кровь забирают из локтевой вены в отдельную стеклянную центрифужную пробирку без стабилизатора в количестве 3-5мл.
!* кровь на антитела к тиреоидной пероксидазе, антитела к dsДНК можно забирать в одну пробирку не менее 5мл.
4.3.6. Исследования на специфический IgE:
· Кровь забирают из локтевой вены в отдельную стеклянную центрифужную пробирку без стабилизатора в количестве 5-10мл.
!*объем крови зависит от количества назначенных аллергенов.
4.3.7. Исследования на онкомаркеры (СА-125; ПСАоб; ПСАсв):
· Кровь забирают из локтевой вены в отдельную стеклянную центрифужную пробирку без стабилизатора в количестве 5мл.
4.4.Забор крови для определения тканевой совместимости:
· Кровь забирают из локтевой вены в отдельную стеклянную центрифужную пробирку без стабилизатора либо с анитикоагулянтом, в зависимости от вида исследования, в количестве не менее 5-7мл.
· Забор крови производится до гемодиализа и/или других мроцедур!
Пробирки выдаются в иммунологической лаборатории!
4.4.1. Определение фенотипа по системе HLA:
· Кровь забирают из локтевой вены в отдельную стеклянную центрифужную пробирку с анитикоагулянтом (ЭДТА), в количестве 7мл.
!*возможен забор крови в вакуумную систему.
4.4.2. Определение предсуществующих антител к антигенам лимфоцитов по системе HLA:
· Кровь забирают из локтевой вены в отдельную стеклянную центрифужную пробирку без стабилизатора в количестве не менее 5-7мл.
4.4.3. Проба на тканевую совместимость донора и реципиента:
· Кровь реципиента забирают из локтевой вены в отдельную стеклянную центрифужную пробирку без стабилизатора в количестве не менее 5-7мл.
!* забор крови на данное исследование можно производить в пробирку, предназначенную для определения предсуществующих антител, в количестве не менее 7мл; возможен предварительный забор (сыворотка хранится в течении 3-х месяцев при t -20ͦ C, в течении 6-и месяцев при t -40ºС) .
· Кровь донора забирают из локтевой вены в отдельную стеклянную центрифужную пробирку с анитикоагулянтом (ЭДТА), в количестве 7мл, в день проведения перекрестной пробы на совместимость.
С осени 2011 г. в ТНИИКИП проводятся следующие исследования методом ПЦР:
Забор крови в вакутейнер с ЭДТА (сиреневая пробка)
Хранить не более 6 ч
Ожидание результата 10 дней
Для контроля изменения вирусной нагрузки в процессе лечения
Чувствительность: 300 ГЭ/мл, линейный диапазон измерения:300-3х108 ГЭ/мл
Забор крови в вакутейнер с ЭДТА (сиреневая пробка)
Хранить не более 6 ч
Ожидание результата 10 дней
Забор крови в вакутейнер с ЭДТА (сиреневая пробка)
Хранить не более 6 ч
Ожидание результата 10 дней
Для контроля изменения вирусной нагрузки в процессе лечения
Чувствительность: 500 МЕ /мл, линейный диапазон измерения: 500-5х107 МЕ/мл
Забор крови в вакутейнер с ЭДТА (сиреневая пробка)
Хранить не более 6 ч
Ожидание результата 10 дней
Для подбора оптимальной терапии
Чувствительность: 104 МЕ/мл
Забор крови в вакутейнер с ЭДТА (сиреневая пробка)
Хранить не более 6 ч
Ожидание результата 10 дней
Забор крови в вакутейнер с ЭДТА (сиреневая пробка)
Хранить не более 6 ч
Чувствительность: 400 копий/мл
Ожидание результата 10 дней
Материал для исследования: плазма или лейкоциты крови, слюна, смывы и мазки из ротоглотки, моча (а также амниотическая жидкость, спинномозговая жидкость, бронхоальвеолярный лаваж)
Забор в стерильную посуду:
моча – в стерильный контейнер на 60 мл, сбор первой утренней порции 20-30 мл, доставить в течение 6 ч.
мазки из ротоглотки – стерильным зондом в специальную пробирку с транспортной средой для респираторных мазков,
забор крови в вакутейнер с ЭДТА (сиреневая пробка), хранить не более 6 ч
Чувствительность: 400 копий/мл (безклеточный материал) или 5 копий ДНК CMV на 10 5 клеток (для клеток). Линейный диапазон измерения: 500-10 7 копий/мл.
Ожидание результата 10 дней
Материал для исследования: плазма или лейкоциты крови, слюна, смывы и мазки из ротоглотки, моча (а также амниотическая жидкость, спинномозговая жидкость, бронхоальвеолярный лаваж)
Забор в стерильную посуду:
моча – в стерильный контейнер на 60 мл, сбор первой утренней порции 20-30 мл, доставить в течение 6 ч.
мазки из ротоглотки – стерильным зондом в специальную пробирку с транспортной средой для респираторных мазков,
забор крови в вакутейнер с ЭДТА (сиреневая пробка)
хранить не более 6 ч
Чувствительность: 400 копий/мл, 5 копий ДНК EBV на 10 5 клеток Линейный диапазон измерения: 500 – 10.000.000 копий/мл.
Ожидание результата 10 дней
Материал для исследования: осадок утренней мочи, соскобы и мазки
Забор в стерильную посуду:
моча – в стерильный контейнер на 60 мл, сбор первой утренней порции 20-30 мл, доставить в течение 6 ч.
мазки урогенитальные – в специальную пробирку с транспортной средой, на приеме у гинеколога/уролога провести сбор мазка стерильным зондом или цитощеткой в пробирку с транспортной средой для мазков ТСМ, доставить на исследование в течение 2 суток
Чувствительность: 10 3 ГЭ/мл
Ожидание результата 10 дней
Материал для исследования: смывы с объектов окружающей среды, бронхо-альвеолярный лаваж, моча, кровь,
Забор в стерильную посуду:
смывы – специальным стерильным зондом в специальную пробирку с транспортной средой для респираторных мазков,
моча – в стерильный контейнер на 60 мл, сбор первой утренней порции 20-30 мл,
Доставить в течение 6 ч.
кровь – в вакутейнер с ЭДТА
Чувствительность: 10 2 –10 3 м.т./мл.
Ожидание результата 10 дней
11. Комплексное выявление возбудителей острых кишечных инфекций в одном образце фекалий: одновременное выявление и дифференциация ДНК (РНК) микроорганизмов рода Шигелла (Shigella spp.) и энтероинвазивных E. coli (EIEC), Сальмонелла (Salmonella spp.) и термофильных Кампилобактерий (Campylobacter spp.), аденовирусов группы F (Adenovirus F) и ротавирусов группы А (Rotavirus A), норовирусов 2 генотипа (Norovirus 2 генотип) и астровирусов (Astrovirus))
Материал для исследования – фекалии
Забор: в специальный стерильный контейнер,
собрать кал из продезинфицированного судна одноразовой лопаточкой на крышке контейнера, доставить в течение 6 ч
Ожидание результата 10 дней
Материал для исследования: соскобное отделяемое слизистых оболочек урогенитального тракта, прямой кишки, ротоглотки; отделяемое конъюнктивы глаз; образцы мочи
Забор в стерильную посуду:
моча – в стерильный контейнер на 60 мл, сбор первой утренней порция 20-30 мл, доставить в течение 6 ч.
мазки урогенитальные – в специальную пробирку с транспортной средой, на приеме у гинеколога/уролога провести сбор мазка стерильным зондом или цитощеткой в пробирку с транспортной средой для мазков ТСМ, доставить на исследование в течение 2 суток
Читайте также: