Методы заражения вирусом куриного эмбриона
Сайт СТУДОПЕДИЯ проводит ОПРОС! Прими участие :) - нам важно ваше мнение.
Выделение вирусов на лабораторных животных.
Цель заражения лабораторных животных:
1. Изучить патогенез болезни;
2. Выделить вирус из пат.материала;
3. Наработка иммунных и гипериммунных сывороток;
4. Наработка вакцин;
5. Поддержание вирусов в условиях лаборатории;
6. Титрация, с целью определения количества вируса в единице объема;
7. Биологическая модель для постановки реакции нейтрализации;
Выбор метода заражения лабораторных животных зависит от тропизма вируса. Так, при культивировании нейротропных вирусов животных заражают в мозг; респираторных интранозально, интратрахеально; дерматропных - подкожно и внутрикожно.
Заражение производят с соблюдением правил асептики и антисептики.
Различают много способов введения вируссодержащего материала в организм животных:
- Подкожный; - Интрацеребральный; - Внутрикожный;
- Интраперитониальный; - Внутримышечный; - Интраокулярный;
- Внутривеннвй; - Интранозальный; - Алиментарный;
После заражения животных метят, помещают их в изолированный бокс и ведут наблюдение в течение 10 суток. Гибель животного в первые сутки после заражения считается неспецифичной и в дальнейшем не учитывается.
3 признака указывают на результативность заражения:
- наличие клинических признаков
- патологоанатомические изменения (величины, формы, цвета и консистенции органа).
Куриный эмбрион - это оплодотворенное куриное яйцо, в котором развивается зародыш (эмбрион). Культивирование вирусов на куриных и перепелиных эмбрионах в последнее время получило широкое распространение как один из наиболее простых и надежных методов культивирования и диагностики многих вирусов и некоторых бактерий - бруцеллы, риккетсии, вибрионы.
Многие вирусы человека и животных способны культивироваться в развивающихся куриных эмбрионах. Эмбриональная ткань, особенно оболочки эмбриона, богатые тканями зародышевого эпителия, является благоприятной средой для размножения многих вирусов. Вирусы, имеющие эпителиотропные свойства (оспа, ИЛТ и др.), успешно развиваются на хорионаллантоисной мембране, вызывая макроскопически видимые изменения. Различные представители миксовирусов (грипп, болезнь Ньюкасла, чума плотоядных и др.), вирусы инфекционного бронхита, гепатита утят, арбовирусы и др. хорошо размножаются в эмбрионе при введении материала в аллантоисную полость. Некоторые вирусы успешно культивируются в желточном мешке.
1. Экономически выгодно, кроме того яйца легко доступны;
2. У развивающихся куриных эмбрионов отсутствуют защитные механизмы, т.к. система иммунитета еще не развита;
3. Скорлупа яиц препятствует проникновению через неё бактерий и вирусов из окружающей среды;
Для культивирования и выделения вирусов на куриных эмбрионах требуется очень несложное оборудование - обычный термостат или инкубатор.
1. Яйца получают из хозяйств заведомо благополучных по инфекционным заболеваниям;
2. Куриные эмбрионы лучше получать от белых пород кур (леггорн, русская белая), т. к. они более устойчивы к манипуляциям и не гибнут от маленьких травм. Кроме того, у них скорлупа белая и более прозрачная, чем у других пород, и легче просвечивается, что удобно для просмотра и наблюдения в процессе работы с ними;
3. Для инкубирования отбирают оплодотворенные яйца снесенные не более 10 суток тому назад;
4. Берут незагрязненные яйца, т. к. мыть их перед инкубированием нельзя, а грязные яйца хуже просвечиваются при просмотре (овоскопии) и при работе с ними можно инфицировать эмбрион в процессе манипулирования;
Инкубируют яйца в инкубаторе или в термостате с водяным нагревом и доступом воздуха, причем в процессе инкубации в термостате яйца 2-3 раза в сутки нужно переворачивать и для лучшего газообмена вынимать на 5-10 минут на воздух. Для поддержания определенной влажности в термостат ставят сосуд с водой для испарения, температура в термостате должна быть 38°.
Развитие зародыша происходит уже в первые сутки инкубирования, происходит закладка головного мозга, скелета. Строение куриного эмбриона в возрасте 7-9 дней ( см. тетрадь).
Для заражения наиболее часто используют эмбрионы 7-12 суточного возраста. Работу с куриными эмбрионами проводят в стерильной комнате-боксе со строжайшим соблюдением асептики.
Цель заражения куриных эмбрионов:
1. Выделить вырус из пат.материала;
2. Наработка вакцин;
3. Поддержание вируса в условиях лаборатории;
4. Титрация вирусов;
5. Биологическая модель для постановки реакции нейтрализации;
6. Изучение интерференции вирусов и наработка интерферона; Заражение куриных эмбрионов:
Для заражения нужно отбирать жизнеспособные эмбрионы с хорошо выраженной подвижностью. Перед заражением все эмбрионы тщательно просматривают в затемненной комнате на овоскопе
Во время просвечивания эмбрионов перед заражением на скорлупе простым карандашом обрисовывают пугу (воздушную полость), ход крупных кровеносных сосудов и место предлежания эмбриона, т. е. участок на скорлупе, где ближе всего к ней лежит эмбрион. Отметка пуги, места предлежания эмбрирна и хода крупных кровеносных сосудов затем служат ориентиром при выборе места введения вируссодержащего материала в момент заражения.
Отобранные для заражения куриные эмбрионы переносят в бокс, где и проводят с ними работу. Перед заражением скорлупу по месту введения материала дважды обрабатывают йодированным спиртом и обжигают. Доза заражения составляет 0,1-0,2 см .
В зависимости от вида вируса и цели заражения имеются различные методы введения вируссодержащего материала:
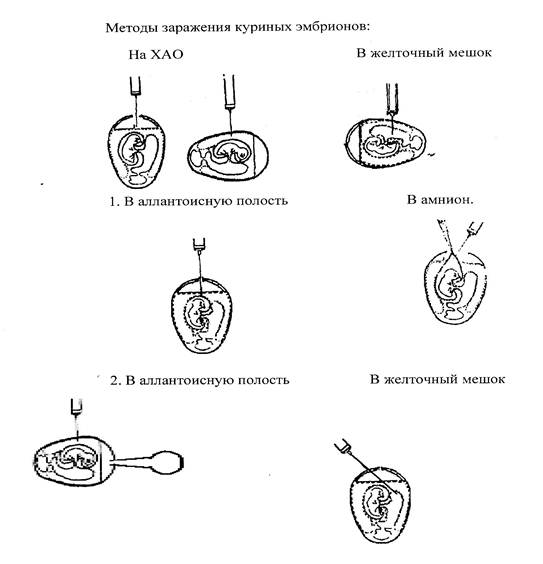
1) Заражение на хорионаллантоисную оболочку, используют эмбрионы 7—12-суточного возраста при выделении и культивировании нейротропных, дерматропных н некоторых пантропных вирусов (оспа, энцефаломиелит, ИЛТ, ящур, бешенство, чума и др.). Существует 3 варианта заражения:
а) вскрывают пугу и срезают ее ножницами, отделяют подскорлупную оболочку и наносят на хорионаллантоисную оболочку (ХАО) материал. Отверстие в яйце затем закрывают стерильным стеклянным колпачком и края колпачка парафинируют;
б) выпиливают надфилем (напильничек) или зазубренным скальпелем в скорлупе треугольник с длиной сторон около 1 см на границе пуги со стороны предлежания эмбриона, пинцетом удаляют участок скорлупы и подскордупной оболочки и вводят материал. Отверстие закрывают покровным стерильным стеклом и края парафинируют, или заклеивают стерильным лейкопластырем.
в) скальпелем удаляют небольшой участок скорлупы площадью около 0,5 см по месту предлежания эмбриона, затем пинцетом или иглой удаляют в этом участке подскорлупную оболочку и вводят материал. Если материал плохо входит в полость яйца, можно с помощью резиновой груши через отверстие в скорлупе на пуге откачать воздух из пуги и в результате по месту введения материала образуется искусственная пуга и тогда материал легко вводится. Отверстие в скорлупе закрывают лейкопластырем или парафинируют.
2) Заражение в аллантоисную полость.Этот метод заражения очень прост и применяется для выделения многих вирусов. Для заражения берут 10-11-дневные эмбрионы. Имеется два варианта заражения:
а) заражение проводят через пугу, не срезая ее. Иглой отмеряют расстояние от верхушки пуги до границы пуги, отмеченной карандашом на скорлупе, и вводят иглу на отмеченную глубину и углубляют еще на 0,5 см, чтобы проколоть хорионаллантоисную оболочку;
б) вводят материал иглой через прокол в скорлупе в месте предлежания эмбриона на глубину 3-5 мм в бессосудистом участке. Отверстие в скорлупе закрывают лейкопластырем или парафинируют.
3) Заражение в желточный мешок. Для заражения используют 5-8-суточные эмбрионы. Существует два варианта заражения:
а) иглу вводят со стороны пуги в желточный мешок под углом 45° к месту предлежания эмбриона под контролем овоскопа;
б) яйцо кладут на подставку также местом предлежания эмбриона вниз и иглу вводят сверху вниз по направлению к эмбриону на глубину около 1 см.
Место введения заклеивают лейкопластырем и парафинируют. 4) Заражение в амниотическую полость. При этом методе заражения вирус может проникнуть в различные клетки, находящиеся в контакте с амниотической жидкостью, и размножаться в них. для удобства заражения рекомендуется за 2-3 дня до проведения заражения эмбрионы инкубировать пугой вверх. Тогда эмбрион и амнион смещаются вверх и удобнее заражать. Имеется два варианта заражения:
а) вскрывают и срезают пугу, пинцетом удаляют подскорлупную оболочку и захватывают амниона подтягивают амнион пинцетом и вводят в амниотическую полость материал в дозе 0,1 мл. Отверстие в скорлупе затем закрывают стерильным стеклянным колпачком и края парафинируют;
б) заражение с помощью длинной иглы через пугу в темной комнате под контролем глаза, У иглы предварительно острие загибают под прямым углом, чтобы получилась маленькая площадка. Иглу вводят под контролем глаза через пугу доэмбриона, под давлением затупленной иглы эмбрион в этом случае будет смещаться, затем легким толчком прокалывают амнион и иглу слегка оттягивают назад. При этом эмбрион должен смещаться за иглой вверх. Затем вводят материал.
5) Заражение в тело эмбриона и заражение в головной мозг. Используются 7-12-дневные эмбрионы, заражение проводят введением материала в различные участки тела или непосредственно в головной мозг. Для заражения вскрывают пугу и подтягивают пинцетом эмбрион. При этих методах заражения может быть гибель эмбрионов от травмы до 30 % и более от числа зараженных.
6) Заражение в крупные кровеносные сосуды хорионаллантоисной оболочки.Этот метод заражения, как и предыдущий, применяется очень редко. Материал вводят тонкой иглой после удаления скорлупы по ходу кровеносного сосуда непосредственно в сосуд по току крови.
После заражения куриные эмбрионы обязательно метят простым карандашом и ставят в термостат. За ними ежедневно наблюдают путем просмотра, наблюдение ведут до 7-8 дней в зависимости от вида вируса. В случае гибели эмбрионов их срочно удаляют из термостата и ставят в холодильник до момента вскрытия. Если эмбрион погиб в течение первых 14-18 часов, это может быть от травмы или токсичности патматериала. Поэтому, так же как и при заражении лабораторных животных, в сомнительных случаях рекомендуется, делать несколько пассажей и в опыт брать на каждый материал по несколько эмбрионов.
Вскрытие погибших зараженных куриных эмбрионов, или изъятых по истечении срока наблюдения производится со всеми правилами асептики в стерильных условиях бокса. При вскрытии скорлупу обрабатывают спиртом и обжигают, затем срезают пугу. У вскрытого эмбриона сначала тщательно отсасывают аллантоисную жидкость (количество ее около 7 мл), затем пинцетом оттягивают амниотическую оболочку, прокалывают пастеровской пипеткой и отсасывают амниотическую жидкость (количество ее 1,0-1,5 мл), затем собирают желток, извлекают оболочки и сам эмбрион. Жидкость, оболочки и сам эмбрион тщательно осматривают на наличие изменений. Амниотическая жидкость в норме совершенно прозрачная, при заражении она может быть мутная, кровянистая. Характерные изменения, вызванные вирусом, бывают наиболее выраженными на хорионаллантоисной оболочке: появляютсявоспалительные очаги, непрозрачные, круглой формы и кровоизлияния. Кровоизлияния могут быть на теле эмбриона. Весь материал собирают в стерильную посуду.
Куриные эмбрионы в вирусологии широко применяются не только для выделения вирусов, но и для накопления и получения антигенов, для приготовления живых и убитых вакцин, титрования вирусов, для постановки реакции нейтрализации вирусов, для аттенуирования (ослабления) вирусов, для изучения интерференции вирусов и получения интерферона.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Использование в вирусологии куриных эмбрионов. Заражение куриных эмбрионов
Цель занятия: ознакомить студентов с методами заражения куриных эмбрионов для культивирования вирусов.
Оборудование и материалы: куриные эмбрионы 9-12 дневного возраста инкубации, овоскоп, спиртовые тампоны, подставки для эмбрионов, пинцеты, ножницы, лейкопластырь, иглы, шприцы, простые карандаши, пробойники, иголочки, таблицы, схемы, мультимедийное оборудование, презентации MS Office Power Point по теме занятия.
Существенно влияет на размножение вирусов в эмбрионах метод заражения. Перед заражением инкубированные яйца просвечивают, погибшие отделяют. На скорлупе яиц с живыми эмбрионами, которые различают по красному цвету кровеносных сосудов и движению эмбриона, карандашом отмечают место заражения.
Заражают эмбрионы в стерильном боксе, имеющем рабочий стол, два табурета, подводку газа, водопровод и вакуум. Заражение в амниотическую полость проводят в затемненной комнате. Рабочее место должно быть хорошо освещено. Перед работой стол дезинфицируют. Для дезинфекции поверхности яиц подготавливают антисептический раствор (70%-ный спирт, 2%-ный раствор йода) и обернутую ватой деревянную палочку, согнутый зубной зонд или бормашину для просверливания яичной скорлупы. Яйца заражают при помощи стерильных шприца для туберкулинизации и специальных игл. Место заражения на яйце заливают парафином. Для этого готовят парафиновые палочки: в пробирку, заполненную расплавленным парафином, вводят стеклянную палочку, следя за тем, чтобы она находилась в центре пробирки до остывания парафина.
Когда парафиновая палочка понадобится, стенки пробирки нагревают на горелке и за стеклянную палочку вытягивают парафин из пробирки. Подержав палочку над пламенем, расплавляют необходимое для закрытия отверстия в яйце количество парафина. Этот способ очень чист, и при нем не образуются пары парафина.
Кроме того, на рабочем столе в боксе размещают стакан со стерильными ватными тампонами, стакан с 3 % раствором едкого натра для использованных инструментов и сосуд с раствором хлорамина для использованных стеклянных предметов. В случае надобности можно приготовить подставку для яиц, небольшую эмалированную чашку и стерильные питательные среды. Подготовленный таким образом рабочий стол в течение 1–2 ч подвергают УФ-облучению.
Учитывая патогенность исследуемых вирусов, работы ведут в маске, резиновых перчатках и защитных очках.
Существует шесть методов заражения эмбрионов. Наиболее часто используют заражение в аллантоисную полость и на хорионаллантоисную оболочку, реже – в амниотическую полость и в желточный мешочек и совсем редко – в тело зародыша и в кровеносные сосуды ХАО. Выбор метода определяется тропизмом вируса, а также целью заражения. При любом методе заражения вводят 0,1–0,2 мл инфекционного материала.
При заражении этим методом хорошо размножаются вирусы гриппа, ньюкаслской болезни, ринопневмонии лошадей, везикулярного стоматита и др. Существует несколько вариантов метода.
Первый вариант. Эмбрион фиксируют вертикально тупым концом вверх. В скорлупе на стороне зародыша, а иногда с противоположной зародышу стороны на 5–6 мм выше границы воздушной камеры делают отверстие диаметром около 1 мм. Иглу вводят параллельно продольной оси на глубину 10–12 мм (рис. 16). После инъекции вируссодержащего материала иглу извлекают, а отверстие в скорлупе закрывают каплей расплавленного стерильного парафина.
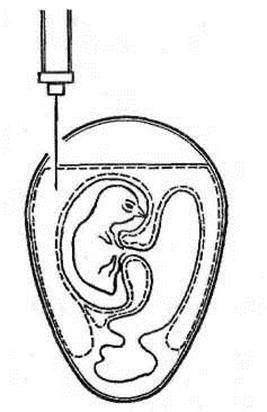
Рисунок 16. Заражение в аллантоисную полость (первый вариант) (по Николау)
Второй вариант. Сделанное в скорлупе над воздушной камерой отверстие используют лишь для выхода части воздуха. Отверстие же для самого заражения делают на участке бессосудистой зоны хорионаллантоисной оболочки (ХАО) со стороны зародыша. Иглу вводят на глубину не более 2–3 мм. Инъецируют инфицирующую жидкость в объеме 0,1–0,2 мл и закрывают отверстие парафином (см. рис. 17).
Этот метод заражения куриных эмбрионов чаще используют для культивирования эпителиотропных и пантропных вирусов оспы, инфекционного ларинготрахеита птиц, чумы плотоядных, болезни Ауески, катаральной лихорадки овец и др.
Такое заражение может быть выполнено через естественную или искусственную воздушную камеру.
Для заражения через естественную воздушную камеру эмбрион помещают в штатив вертикально тупым концом вверх и в скорлупе против центра воздушной камеры вырезают круглое окно диаметром 15–20 мм. Через это окно пинцетом снимают подскорлупную оболочку. На обнажившийся участок ХАО наносят 0,2 мм вируссодержащей суспензии (рис. 18), отверстие закрывают лейкопластырем или реже покровным стеклом, укрепив его расплавленным парафином.
Заражение через искусственную воздушную камеру применяют чаще первого, так как оно обеспечивает контакт вируссодержащего материала с большей поверхностью ХАО и, следовательно, ведет к образованию большего количества вируса.
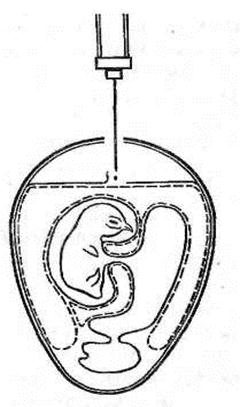
Рисунок 17. Заражение куриного эмбриона в аллантоисную полость (второй вариант) (по Николау)
Рисунок 18. Заражение на ХАО через естественную воздушную камеру (по Николау и др.)
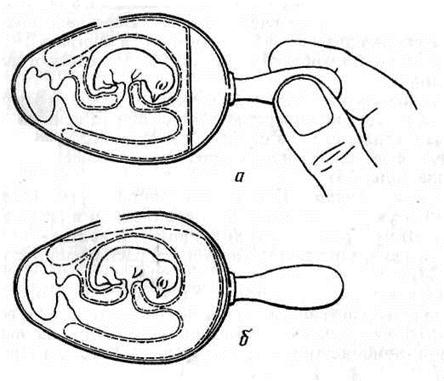
Рисунок 19. Заражение куриного эмбриона на ХАО через искусственную воздушную камеру (по Николау и др.)
Для заражения эмбриона этим методом его помещают в штатив горизонтально зародышем вверх. В скорлупе делают два отверстия: одно небольшое над центром воздушной камеры (предназначено для отсасывания из нее воздуха), а другое диаметром 0,2–0,5 см сбоку, со стороны зародыша. Сложность метода в том, что, делая второе отверстие, необходимо осторожно снять вначале кусочек скорлупы, затем скользящим движением, не повреждая ХАО, сдвинуть подскорлупную оболочку в сторону так, чтобы через образовавшийся дефект мог пройти воздух. После этого резиновой грушей через первое отверстие отсасывают воздух из естественной воздушной камеры (рис. 19, а).В результате через боковое отверстие наружный воздух устремляется внутрь, образуя искусственную воздушную камеру, дном которой является ХАО (рис. 19, б).
Через боковое отверстие на поверхность ХАО наносят инфекционную жидкость и отверстие закрывают кусочком лейкопластыря. Закрывать первое отверстие нет необходимости, так как внутренний листок подскорлупной оболочки при этом методе заражения не нарушается и продолжает выполнять роль барьера для микрофлоры окружающей среды.
Дальнейшую инкубацию эмбрионов, зараженных этим методом, проводят в горизонтальном положении боковым отверстием вверх.
Большей частью им пользуются для размножения хламидий, а также вирусов болезни Марека, ринопневмонии лошадей, катаральной лихорадки овец и др. Заражают эмбрионы 5–7-дневного, а иногда и 2–3-дневного возраста (вирус лихорадки долины РИФ). Используют два варианта заражения.
Первый вариант. Эмбрионы помещают в штатив в вертикальном положении. Делают отверстие в скорлупе над центром воздушной камеры и вводят иглу на глубину 3,5–4 см под углом 45° к вертикальной оси в направлении, противоположном месту нахождения зародыша (рис. 20).
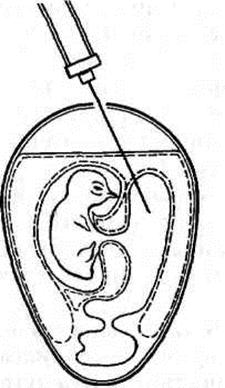
Рисунок 20. Заражение куриного эмбриона в желточный мешок (по Николау и др.)
Второй вариант. Иногда аналогичный путь заражения осуществляется на горизонтально укрепленном в штативе эмбрионе; при этом зародыш находится внизу, а желток над ним. Отверстие в скорлупе закрывают каплей расплавленного парафина.
Для этой цели используют эмбрионы 6 - 10-дневного возраста. Метод используется при культивировании вирусов гриппа, ньюкаслской болезни, ринопневмонии лошадей и др. Есть два способа заражения.
Закрытый способ. Заражение проводят в затемненном боксе. Яйцо помещают на овоскопе в горизонтальном положении зародышем вверх. Через отверстие в скорлупе над воздушной камерой вводят иглу с затупленным концом по направлению к зародышу. Доказательством того, что игла проникла в амнион, служит движение тела зародыша в направлении передвижения.
Открытый способ. Скорлупу над воздушной камерой срезают так, чтобы образовалось окно диаметром 1,5–2,5 см. Через него пинцетом под контролем глаза снимают подскорлупную оболочку. Затем анатомический (14 см) пинцет с сомкнутыми браншами ведут, продавливая хорионаллантоисную оболочку по направлению к зародышу. Когда пинцет достигнет его, бранши размыкают, захватывают амниотическую оболочку вместе с ХАО и подтягивают к окну. Удерживая левой рукой пинцет с фиксированной в нем оболочкой амниона, вводят вируссодержащий материал (рис. 21). Далее все оболочки опускают, окно закрывают лейкопластырем и эмбрион инкубируют в вертикальном положении.
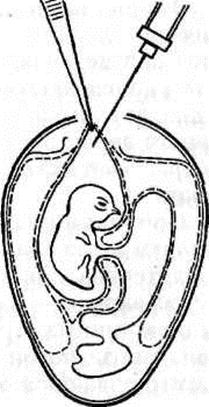
Рисунок 21. Заражение куриного эмбриона в амнион открытым способом (по Николау и др.)
При овоскопировании 11– 13-дневных эмбрионов отмечают крупный кровеносный сосуд. По его ходу удаляют участок скорлупы, наносят 1–2 капли спирта, что делает на некоторое время подскорлупную оболочку прозрачной. Под контролем глаза на овоскопе иглу вводят в сосуд, что подтверждается его подвижностью при небольших боковых движениях иглы. Обнаженный участок подскорлупной оболочки закрывают кусочком лейкопластыря.
Можно материал в сосуды ввести и несколько отличающимся способом: срезают скорлупу над воздушной камерой, подскорлупную оболочку смачивают спиртом и в ставшие видными сосуды ХАО вводят материал. Отверстие закрывают кусочком стерильного лейкопластыря.
Описанные технические приемы экспериментального заражения куриных эмбрионов не единственные, а имеют различные варианты.
Для заражения используют эмбрионы 7–12-дневного возраста. Известно два варианта метода.
Первый вариант. Заражают так же, как в амнион закрытым способом, с той лишь разницей, что берут острую иглу и на овоскопе показателем попадания иглы в тело считают подчинение зародыша движениям иглы.
Второй вариант. Заражают так же, как в амнион открытым способом: через окно в скорлупе подтягивают пинцетом тело зародыша. Материал вводят в головной мозг или определенные участки тела. При таких методах заражения бывает значительный процент неспецифической гибели эмбрионов.
Перед дальнейшей инкубацией на скорлупе зараженных любым методом куриных эмбрионов простым (графитным) карандашом пишут, чем заражен эмбрион и когда, а если нужно, то и другие сведения. Зараженные куриные эмбрионы помещают в термостат для дальнейшей инкубации, в процессе которой происходят репродукция внесенных вирусов и их накопление в соответствующих структурах. Температура инкубации эмбрионов варьирует от 33 до 38 °С в зависимости от свойств вируса, которым проведено заражение. За эмбрионами ведут постоянное наблюдение, просматривают на овоскопе, отбирая павшие.
Гибель эмбрионов в первые 24 ч после заражения чаще всего обусловлена размножением грибов, бактериальной микрофлоры, внесенных в эмбрион вместе с инокулятом, или травмированием при заражении. Эта гибель считается неспецифической. В более поздние сроки эмбрионы гибнут в результате, как правило, размножения в эмбрионах вируса. Обнаружив погибшие эмбрионы, их сразу же переносят в холодильник с температурой 4 °С. Такие условия, с одной стороны, способствуют сохранению активности накопившегося в эмбрионе вируса, с другой – уплотнению тканей и запустению сосудов, что значительно облегчает последующее вскрытие.
Эмбрионы инкубируют до момента максимального накопления вируса. Для каждого вируса и даже штамма этот срок является определенным и варьирует в пределах от 2 до 7-8 сут. Так, для вируса ньюкаслской болезни штамма Н он составляет 2-3 дня, для того же вируса штамма В,– 5 дней, для вируса инфекционного ларинготрахеита птиц – 5 дней и т. д. Затем все эмбрионы умерщвляют охлаждением при 4 °С в течение не менее 3–4 ч и вскрывают.
В основе метода лежит удаление эмбриона из яйца в период, когда к его скорлупе изнутри полностью прилегает хорионаллантоисная оболочка. Если внутрь такого яйца добавить питательную среду, то образуется своеобразная культура ткани, в которой может размножаться вирус. Метод обладает рядом преимуществ: он позволяет получить более чистый вирус, чем в аллантоисно-амниотической жидкости, что важно для снижения аллергизирующих свойств вакцин, приготовленных из этого материала; отсутствие желточного мешка и, следовательно, содержащихся в нем специфических антител позволяет лучше размножаться некоторым вирусам. В некоторых случаях этот метод дает хорошие результаты в диагностических работах, так как при нем можно вводить большие количества исследуемого материала, что увеличивает возможность выделения вируса.
Метод предложил Бернкопф еще в 1949 г., но из-за трудностей применения широко не используется. Трудности эти связаны со свойством хорионаллантоисной оболочки в процессе инкубации отделяться от скорлупы, что снижает ценность культуры и затрудняет манипуляции получения вируса и замены питательной среды.
Е. Гройель (1963) ввел ряд модификаций, которые позволили устранить эти трудности. Он предложил использовать 15-дневные и даже более старые яйца, которые в процессе инкубации следует часто переворачивать для равномерного развития оболочки на скорлупе яйца. При просвечивании обозначают границы воздушной камеры. Скорлупу отпиливают на 0,5 см выше этой линии, на край скорлупной оболочки наливают расплавленный парафин (56-58 С°), который застывая, фиксирует край яйца. Затем вырезают круглое отверстие в оболочке над зародышем, оставляя вокруг узкий ободок. Следующий этап – осторожное удаление зародыша из яйца. При этом яйцо следует удерживать в горизонтальном положении и медленно поворачивать. Таким путем находят сосуды, связывающие эмбрион с ХАО, и перерезают их ножницами. Если яйцо держать вертикально, то зародыш своей массой оттягивает оболочку, отрывая ее обычно в области острого конца яйца. Попадание даже небольшого количества жидкости между ХАО и скорлупой вызывает полную отслойку оболочки в течение 1–2 дней.
После удаления зародыша оболочку, выстилающую яйцо, несколько раз промывают физиологическим раствором, охлажденным до 4–0°С, до тех пор, пока жидкость не станет прозрачной. Затем в полость яйца вводят 20 мл питательной среды, подогретой до 37 °С, и яйцо закрывают стерильным резиновым колпачком, предварительно погрузив его в парафин. Трубка с резиновой пробкой, вмонтированная в яйцо, обеспечивает как взятие, так и введение жидкости без опасности бактериального заражения. Такой биологический объект сохраняет жизнеспособность в течение нескольких дней.
По методике Йошино и других, полость деэмбринированных яиц заполняют раствором агара в растворе Хенкса. Заражают деэмбринированные яйца через трубку в колпачке.
Контрольные вопросы:
1. Строение куриного эмбриона.
2. Для чего используют куриные эмбрионы в вирусологии?
3. Каково строение развивающегося куриного эмбриона?
Основные методы культивирования вирусов:
1) биологический – заражение лабораторных животных. При заражении вирусом животное заболевает. Если болезнь не развивается, то патологические изменения можно обнаружить при вскрытии. У животных наблюдаются иммунологические сдвиги. Однако далеко не все вирусы можно культивировать в организме животных;
Выбор экспериментальных животных определяется целью работы и видовой чувствительностью к изучаемому вирусу. Для заражения используют обезьян, кроликов, морских свинок, хомячков, белых крыс и мышей.
Лабораторных животных заражают различными способами в зависимости от тропизма вируса к определенным тканям. Так, например, для культивирования нейротропных вирусов заражение производят преимущественно в мозг (вирусы бешенства, клещевого энцефалита и др.), культивирование респираторных вирусов осуществляется при интраназальном инфицировании животных (вирусы гриппа), дерматотропных (вирус оспы) – путем накожного и внутрикожного заражения. Наиболее часто используются накожное, внутрикожное, внутримышечное, внутрибрюшинное и внутримозговое заражение.
Индикацию, т.е. обнаружение факта размножения вируса, устанавливают на основании развития типичных признаков заболевания, патоморфологических изменений органов и тканей животных или положительной реакции гемагглютинации (РГА). РГА основана на способности некоторых вирусов вызывать агглютинацию (склеивание) эритроцитов различных видов животных, птиц и человека за счет поверхностного вирусного белка – гемагглютинина.
В настоящее время использование животных для культивирования вирусов ограничено.
2) культивирование вирусов в развивающихся куриных эмбрионах. Большинство известных вирусов обладают способностью размножаться в курином эмбрионе (рис.56). Используют эмбрионы в возрасте от 8 до 14 дней в зависимости от вида вируса, способа заражения и задач исследования. Вирусы гриппа культивируются в 9–10-, осповакцины – в 12-, паротита – в 7-дневных куриных эмбрионах. Размножение вируса в куриных эмбрионах происходит в разных частях зародыша, что связано с особенностями тропизма вируса. Методику выращивания вируса в курином эмбрионе широко используют при промышленном культивировании.
Существует несколько способов заражения развивающегося куриного эмбриона: на хорионаллантоисную оболочку, в аллантоисную и амниотическую полости, желточный мешок, тело эмбриона.
Заражение на хорионаллантоисную оболочку применяется для выделения и культивирования вирусов, образующих на оболочках бляшки (вирусы вакцины, натуральной оспы, простого герпеса). Перед заражением яйца просвечивают с помощью овоскопа, карандашом очерчивают границу воздушного пространства и хорионаллантоисной оболочки. Поверхность яйца над воздушным пространством и в месте заражения протирают спиртом, прожигают, обрабатывают йодом и делают отверстие в полости воздушного мешка. На месте заражения скорлупу удаляют так, чтобы не повредить подскорлупную оболочку, которую затем прокалывают короткой стерильной иглой, чтобы не повредить хорионаллантоисную оболочку. Воздух из полости воздушного мешка отсасывают. Вирусный материал (0,05–0,2 мл) наносят на хорионаллантоисную оболочку туберкулиновым шприцем с короткой иглой или пастеровской пипеткой. Отверстие в скорлупе закрывают стерильным покровным стеклом или тем же выпиленным кусочком скорлупы и по краям заливают расплавленным парафином. Зараженные эмбрионы располагают на подставке горизонтально и инкубируют в термостате. Вскрытие эмбрионов производится не раньше 48 ч инкубации. На зараженной оболочке обнаруживаются беловатые непрозрачные пятна разной формы (бляшки).
Заражение в аллантоисную полость. Вирус, введенный в аллантоис, размножается в эндодермальных клетках, переходя затем в аллантоисную жидкость. Заражение осуществляют следующим способом: в скорлупе над воздушной камерой острием скальпеля или ножниц производят прокол, после чего через отверстие в вертикальном направлении вводят иглу со шприцем, которая проходит через хорионаллантоисную оболочку и попадает в аллантоисную полость, материал вводится в объеме 0,1 мл и отверстие заливают парафином.
Заражение в желточный мешок. С этой целью используют эмбрионы 5–10-дневного возраста. Наиболее употребительны два метода заражения. По первому материал вводится через воздушное пространство. В центре яйца делают отверстие, помещают его на подставку тупым концом вправо и через отверстие в вертикальном направлении вводят иглу, надетую на шприц, игла проходит через хорионаллантоисную оболочку, аллантоисную полость в желток. В желточный мешок можно ввести от 0,1 до 0,5 мл вируссодержащего материала. После заражения отверстие в скорлупе заливают парафином, и эмбрион помещают в термостат. По второму методу на границе воздушного пространства с той стороны, где лежит желток (стороны, противоположной от эмбриона), делают прокол скорлупы, через который вводят инфекционный материал. Направление иглы должно быть к центру яйца.
Индикацию вирусов в курином эмбрионе осуществляют на основании специфических поражений оболочек и тела эмбриона (оспины, кровоизлияния), а также в РГА.
В результате заражения могут происходить и появляться:
1) гибель эмбриона;
2) дефекты развития: на поверхности оболочек появляются образования – бляшки, представляющие собой скопления погибших клеток, содержащих вирионы;
3) накопление вирусов в аллантоисной жидкости (обнаруживают путем титрования);
4) размножение в культуре ткани (это основной метод культивирования вирусов).
Читайте также:


