Методы обнаружения и идентификации вируса
Методы индикации вирусов в к/к
1) Выявление ЦПД (цитопатического действия) – видимых морфологических дегенеративных изменений к/к: симпластобразование (симпласты – гигантские многоядерные клетки), образование в/к включений, трансформация клеток(безудержный рост).
2) Постановка РГА (реакции гемадсорбции) – к/к, зараженная вирусами, имеющими гемагглютинины (вирус гриппа и др.), приобретает способность адсорбировать Эр на своей поверхности.
4) Постановка цветной пробы.
(индикация вирусов после культивирования на курином эмбрионе и животныхпроводится с помощью РГА).
Идентификация вирусов в к/к
Проводится РН (реакция нейтрализации) с диагностическими сыворотками. Результат реакции оценивается по наличию ЦПД, методом бляшек, постановкой РТГА, цветной пробы.
(идентификация вирусов после культивирования на курином эмбрионе и животных проводится с помощью РН).
Методы диагностики вирусных инфекций
I. Вирусологический метод диагностики.
Конечной целью метода является идентификация вирусов до вида или серологического варианта. Вирусологический метод включает несколько этапов:
Отбор материала для исследования.
В зависимости от характера заболевания, материалом для исследования могут быть: 1) смывы с носовой части глотки и мазок из глотки; 2) спинномозговая жидкость; 3) кал и ректальные мазки; 4) кровь; 5) моча; 6) жидкость из серозных полостей; 7) мазок с конъюнктивы; 8) содержимое везикул; 8) секционный материал.
• материал берут непосредственно из очага инфекции или исследуют соответствующее отделяемое (гной, мочу, желчь и т.п.);
• количество материала должно быть достаточным для проведения исследования и его повторения в случае необходимости;
• материал берут по возможности в начальном периоде болезни, так как именно в этот период возбудители выделяются чаще, их больше, они имеют более типичную локализацию;
• материал берут до начала антимикробной химиотерапии или через определенный промежуток времени после приема антибактериального препарата, необходимый для его выведения из организма;
• следует предупредить возможность попадания в материал антимикробных препаратов (дезинфектанты, антисептики, антибиотики);
2. Обработка вируссодержащего материала. Проводится с целью освобождения материала от сопутствующей бактериальной микрофлоры. Для этого используются физические и химические методы. Физические методы: 1) фильтрование через различные бактериальные фильтры; 2) центрифугирование. Химические методы: 1) обработка материала эфиром в случаях выделения вирусов, не имеющих суперкапсида; 2) добавление к материалу смеси гептана и фреона; 3) внесение антибиотиков
3. Заражение материалом чувствительных живых систем. Поскольку вирусы являются облигатными внутриклеточными паразитами, для их размножения используют следующие живые системы: 1) лабораторные животные; 2) куриные эмбрионы; 3) культуры органов; 4) культуры тканей.
Индикация вирусов в живых системах.
Индикация вирусов – это обнаружение вирусов в исследуемом материале без установления их принадлежности к семейству, роду, виду или сероварианту.
5. Титрование выделенных вирусов -это обязательный этап вирусологического метода диагностики, целью которого является количественное определение содержания вирусных частиц в единице объема исследуемого материала.
6. Идентификация вирусов в иммунных реакциях. Идентификация, или титрование вирусов – это установление их вариантной, видовой, родовой и семейственной принадлежности. Идентификация вирусов проводится по принципу: определение неизвестного по известному. Известным компонентом при идентификации вирусов являются специфические противовирусные сыворотки (противогриппозные, противокоревые и др.), которые используют в серологических реакциях нейтрализации (РН), торможения гемадсорбции (РТГадс), торможения гемагглютинации (РТГА), РПГА, РСК, а также при ИФА и РИА. Эти сыворотки содержат специфические противовирусные антитела и называются диагностическими.
II. Вирусоскопический метод
1) Электронная микроскопия
Цель: детальное изучение строения вируса.
2) Световая микроскопия
Цель: а) обнаружения вирионов размером от 200 нм (серебрение по Морозову –
выявление телец Пашена – вирус натуральной оспы).
б) обнаружение включений:
- в цитоплазме (тельца Бабеша-Негри при бешенстве (окраска по Муромцеву), тельца Гварниери при натуральной оспе);

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Определение типа вируса (его идентификация) основано на нейтрализации биологической активности вируса с помощью типоспецифических сывороток. Конечный результат ее может быть установлен на основании следующих признаков:
нейтрализация цитопатического действия: в культуральную среду, содержащую изучаемый вирус, вносят коммерческую сыворотку (например, к вирусу краснухи при подозрении на неё), инкубируют и заражают вторую культуру; через 1-2 дня в неё вносят известный цитопатогенный вирус. При наличии цитопатогенного эффекта делают вывод о том, что первая культура была заражена вирусом, соответствовавшим антителам примененной сыворотки;
нейтрализация реакции гемадсорбции;
изменение проявления цветной пробы;
задержка (торможение) реакции гемагглютинации: смешивают культуральную среду, содержащую возбудитель, с известной коммерческой антисывороткой и вносят в культуру клеток. После инкубации определяют способность культуры к гемагглютинации и при её отсутствии делают заключение о несоответствии вируса антисыворотке.
нейтрализация в опытах на животных.
Таким образом РН (реакция нейтрализации) основана на подавлении соответствующей реакции, феномена, развития инфекционного процесса после внесения в культуру или введения в организм животного смеси вируса со специфичными AT, содержащимися в диагностической сыворотке.
Метод полимеразной цепной реакции (ПЦР, PCR) - позволяет определить наличия инфекционного агента в присланном материале, в кратчайшие сроки. Материалом для исследования методом ПЦР служит ДНК возбудителя.
ПЦР - это метод ферментативного получения большого количества копий (амплификации) исследуемых фрагментов ДНК путем повторных циклов репликации и денатурации (разделения цепи ДНК на отдельные нити). При этом происходит копирование только исследуемого участка ДНК, поскольку только этот участок соответствует заданным условиям. И только в том случае, если он присутствует в исследуемом образце.
Для протекания этой реакции необходимы три ключевых компонента:
- — служащая матрицей молекула ДНК, содержащая исследуемый фрагмент;
- — ДНК-полимераза (фермент для производства копий ДНК) и нуклеотиды, используемые ДНК-полимеразой для синтеза ДНК.
- — два праймера ПЦР - два коротких сегмента однонитевой нуклеиновой кислоты, комплементарных началу исследуемого фрагмента ДНК (обычно это последовательности из 15-20 оснований). Присоединяясь к этому фрагменту, праймеры позволяют запустить синтез ДНК, поскольку ДНК-полимераза способна только добавлять звенья. Праймеры можно заказать в биохимической компании или синтезировать с помощью автоматизированного аппарата, задав программу требуемой последовательности нуклеотидов.
Метод ПЦР имитирует в пробирке естественную репликацию ДНК, повторяющуюся много раз и столько, сколько это необходимо для исследования.
Иммуноферментный метод (ИФА). В иммуноферметных методах антиген вируса взаимодействует с антителом диагностической сыворотки, при этом один из реагентов связан с энзимом. Для выявления этой энзимной метки необходимый соответствующий субстрат (хромоген), который реагирует с адсорбированным, например на молекуле антитела, ферментом, изменяя окраску реагирующей смеси.
Для такой метки широко используется фермент - пероксидаза хрена, которая в зависимости от субстрата дает разноцветные продукты реакции.
Иммуноблотинг [от англ. blot, пятно] - метод идентификации антигенов Аг (или антител AT - иммуноглобулины) с помощью соответствующих известных сывороток (или Аг). На практике применяют для идентификации антигенов ВИЧ. Первоначально электрофорезом в полиакриловом геле выделяют Аг вируса (на практике эту процедуру не проводят, а используют коммерческий реагент). Затем на полосы преципитата накладывают носитель (нитроцеллюлозную плёнку или активированную бумагу) и продолжают электрофорез. После чего на плёнку наносят сыворотку пациента и инкубируют (рисунок 19).
После отмывания несвязавшихся AT (при их наличии) проводят ИФА - на плёнку наносят антисыворотку к иммуноглобулинам (Ig) человека, меченную ферментом, и хромогенный субстрат, изменяющий окраску при взаимодействии с ферментом. При наличии комплексов Аг-АТ-антисыворотка к Ig на носителе появляются окрашенные пятна (рисунок 20).

Рисунок 19 - Схема иммуноблотинга

Рисунок 20 - Результат иммуноблотинга
Вопросы для самоконтроля
- 1 Назовите основные принципы классификации вирусов.
- 2 Какие этапы включают в себя лабораторные исследования при идентификации вирусов и диагностике вирусных инфекций?
- 3 Какие биологические модели используются для выделения и культивирования вирусов человека и животных?
- 4 Как происходит заражение куриных эмбрионов в лабораторных условиях?
- 5 Какие методы получения культуры клеток вы знаете?
- 6 Как проводят идикацию вирусов в курином эмбрионе и на лабораторных животных?
- 7 Какие существуют методы индикации вирусов на культуре клеток?
- 8 Как внешне может проявиться патология клеток в результате инфицирования вирусом?
- 9 В чем заключается назначение и сущность реакций нейтрализации вирусов?
- 10 Назовите способы постановки реакций нейтрализации вирусов.
- 11 В чем заключается суть ИФА и иммуноблотинга?
- 12 В чем заключается принцип полимеразной цепной реакции?
Лабораторное занятие 2 Специальные методы выделения и изучения вирусов
Цель занятия: изучить принципы и методы выделения, культивирования и идентификации вирусов.
Материалы и оборудование: 1) световой микроскоп; 2) препараты для микроскопии (или фотографии препаратов) культур клеток неинфицированных вирусами и инфицированных вирусами а) с крупноклеточной дегенерацией клеток, б) с мелкоклеточной дегенерацией клеток, в) с образованием симпластов, г) с развитием очагов клеточной пролиферации, д) с внутриклеточными включениями; 4) демонстрационная планшетка с положительной реакцией гемагглютинации; 5) фотография препарата или препарат для микроскопии с положительной реакцией гемадсорбции; 6) демонстрационный препарат инфицированной вирусами культуры клеток с феноменом бляшкообразования; 7) штатив с пробирки, демонстрирующими цветную реакцию Солка; 8) демонстрационные варианты постановки реакции нейтрализации вирусов.
Задание 1: проведите индикацию вирусов в культурах клеток по цитопатическому действию.
- 1) Рассмотрите фотографии или промикроскопируйте в световой микроскоп при большом увеличении препараты неинфицированных и инфицированных вирусами культур клеток с разными типами цитопатического действия: а) с крупноклеточной дегенерацией клеток, б) с мелкоклеточной дегенерацией клеток, в) с образованием симпластов; г) с развитием очагов клеточной пролиферации.
- 2) Определите какой тип цитопатического действия вы обнаружили на препаратах культур клеток инфицированных вирусами.
- 3) В протоколе занятия назовите и нарисуйте типы цитопатического действия вирусов.
Задание 2: проведите индикацию вирусов в культурах клеток по наличию внутриклеточных включений.
- 1) Рассмотрите фотографии или промикроскопируйте в световой микроскоп при большом увеличении препараты инфицированных вирусами культур клеток с внутриклеточными включениями. Обратите внимание на расположение включений в клетке (в цитоплазме или в ядре) и их размеры и форму.
- 2) В протоколе занятий сделайте рисунки рассмотренных препаратов и укажите на них внутриклеточные включения.
Задание 3: проведите индикацию вирусов в культурах клеток с использованием реакции гемагглютинации и гемадсорбции.
- 1) Изучите механизм реакции гемагглютинации и гемадсорбции. В протоколе занятия опишите сущность этих реакций.
- 2) Рассмотрите демонстрационный материал (планшетка с положительной реакцией агглютинации и препарат для микроскопии с реакцией гемадсорбции).
- 3) В протоколе занятия сделайте рисунки рассматриваемых реакций.
Задание 4: проведите индикацию вирусов в культурах клеток с использованием феномена бляшкообразования.
- 1) Изучите метод бляшек. В протоколе занятия опишите сущность феномена бляшкообразования.
- 2) Рассмотрите демонстрационный материал с феноменом бляшкообразования. Обратите внимание на цвет питательной среды и наличие в ней бляшек (негативных колоний).
- 3) В протоколе занятия сделайте рисунок культуры клеток с феноменом бляшкообразования.
Задание 5: проведите индикацию вирусов в культуре клеток с использованием цветной реакции Солка.
- 1) Изучите методику постановки цветной реакции Солка. В протоколе занятия кратко опишите сущность этой реакции.
- 2) Рассмотрите демонстрацию результатов цветной реакции Солка.
- 3) В протоколе занятия отразите результаты реакции на рисунке и сделайте вывод о наличии вируса в культуре клеток.
Задание 6: проведите идентификацию вируса с использование реакции нейтрализации.
1) Изучите методику постановки реакций нейтрализации вирусов. В протоколе занятия кратко опишите сущность этой реакции.
2) Рассмотрите демонстрационный материал с постановкой одного из вариантов реакции нейтрализации.
3) В протоколе занятия укажите продемонстрированный вам вариант реакции нейтрализации и нарисуйте схему постановки этого варианта реакции.
Перед выявлением вируса в клетках его обычно отделяют от клеток хозяина путем их разрушения с помощью многократного замораживания и оттаивания или растирания со стерильным песком. Полученный вирусосодержащий материал центрифугируют или пропускают через бактериальный фильтр, обрабатывают антибиотиками для деконтаминации и предотвращения бактериального загрязнения.
Индикация вирусов
Для выявления (индикации) вирусов применяются следующие методы.
Индикация вирусов в культуре клетокосуществляется, прежде всего, по цитопатическому действию (ЦПД) вирусов, сроки и характер которого зависят от свойств вируса, проявляясь дегенеративными изменениями клеток с последующей их гибелью и отслаиванием от стекла (рис. 29).
Полная дегенерация клеток сопровождается значительными изменениями в виде пикноза ядра и цитоплазмы, отслаиванием клеточного монослоя от стекла. Частичная дегенерация культур клеток может протекать по следующим типам:
гроздеобразования (округление, увеличение и слияние клеток с образованием гроздевидных скоплений, типично для аденовирусов),
очаговой деструкции (очаги пораженных клеток на фоне в целом сохранившегося монослоя), характерной для вирусов гриппа;
симпластообразования (слияние клеток с образованием гигантских многоядерных клеток в виде симпластов или синцитиев, характерных для вирусов кори, паротита, парагриппа, респираторно-синцитиального, герпеса, иммунодефицита человека).
Пролиферативный тип ЦПД с трансформацией клеток в злокачественные, обладающие неограниченными потенциями к росту, способны вызывать онкогенные вирусы.
Сроки, в течение которых наступает ЦПД, вариабельны (например, 1-2 дня у полиовирусов, 7-14 суток у аденовирусов).


А б
Рис. 29. Культура клеток почек обезьян (а – незараженная, б – цитопатическое действие вируса) х200
Индикация вирусов с помощью реакции гемадсорбции (РГад).Сущность этой реакции заключается в способности эритроцитов человека или животных адсорбироваться на поверхности клеток, инфицированных рядом вирусов (например, орто и парамиксовирусов и др.) в ранние сроки их репродукции (до развития ЦПД) в результате действия гемагглютининов – гликопротеидов, входящих в состав суперкапсида вируса. Для постановки РГад в культуру клеток добавляют 0,2 мл 0,5%-й взвеси эритроцитов, выдерживают 15-20 мин при температуре 4 0 , 20 0 или 37 0 С в зависимости от свойств вируса, после чего взвесь эритроцитов удаляют и производят учет реакции под малым увеличением микроскопа по скоплению эритроцитов на отдельных клетках или на всем монослое.
Индикация вирусов по цветной пробе.Принцип метода основан на определении кислых продуктов метаболизма, накаливающихся в клетке в процессе ее жизнедеятельности с помощью индикатора фенолового красного, меняющего свой цвет с красного в щелочной среде на оранжево-желтый в кислой среде. При заражении культуры клеток вирусами, вызывающими ЦПД (например, аденовирусы, энтеровирусы и др.), метаболизм клеток подавляется, рН среды не меняется и она остается окрашенной в красный цвет.
Индикация вирусов по внутриклеточным включениям.Репродукция некоторых вирусов (оспы, герпеса, бешенства) приводит к образованию внутриклеточных включений, локализующихся в цитоплазме или в ядре клеток и представляющих собой скопления вируса (или его антигенов). Включения выявляют путем световой микроскопии культур клеток, окрашенных по Романовскому- Гимзе или другими методами, а также с помощью прямого флюорохромирования (например акридиновым оранжевым) с последующей микроскопией препаратов в люминесцентном микроскопе.
Индикация вирусов с помощью прямой РИФ –выявлениевирусных антигенов, находящихся в инфицированной клетке культуры ткани, с помощью антител диагностической иммунной сыворотки, специфических иммуноглобулинов или моноклональных антител, меченых флюорохромом, обычно флюоресцеином (рис. 30).
Индикация вирусов с помощью электронно-микроскопического метода (ЭММ)применяется, в основном, в научных исследованиях. Материал для ЭММ концентрируют различными методами (ультрацентрифугирование, хроматография на колонках, адсорбцией с помощью специальных сорбентов или антител – для метода иммунной электронной микроскопии). ЭММ позволяет обнаружить в ядре или цитоплазме клеток отдельные вирионы, а также их скопления. В практических целях ЭММ может быть полезен для индикации и идентификации вирусов с типичной морфологией (оспенные вирусы, ротавирусы, коронавирусы, ВИЧ и т.д.).

Рис. 30. Реакция иммунофлюоресценции (РИФ) – выявление вирус-специфических антигенов. х900
Индикация вирусов по образованию бляшек - очагов разрушенных вирусом монослоя культуры клеток под агаровым покрытием. Количество бляшек отражает инфекционную активность вируса.
Для постановки этой пробы вирусную суспензию в разных разведениях вносят в культуры ткани, находящиеся в плоских сосудах, после чего монослой клеток заливают гелем (слой агара или бентонита с индикатором нейтральным красным). Время бляшкообразования для большинства вирусов, обладающих ЦПД, варьирует от 36 до 48 ч. Бляшки выглядят в виде неокрашенных светлых пятен на розово-красном фоне окрашенного монослоя. В бентонитовом методе монослой клеток молочного цвета, бляшки прозрачные.
Индикация вирусов в куриных эмбрионах.Зараженные РКЭ инкубируют в термостате при 35- 37 0 С в течение 48 -72 ч., после чего производят их вскрытие, амниотическую и аллантоисную жидкость отсасывают шприцем, а оболочки и эмбрион извлекают и помещают в стерильные чашки Петри.
При репродукции некоторых вирусов (натуральной оспы, осповакцины, простого герпеса) на ХАО куриных эмбрионах появляются характерные бляшки - беловатые пятна диаметром 1-2 мм, количество которых соответствует числу инфекционных частиц.
В аллантоисной и амниотической жидкости зараженных эмбрионов ряд вирусов (например, ортомиксовирусы, парамиксовирусы, аденовирусы и т.д.) может быть выявлен с помощью реакция гемагглютинации (РГА). Принцип реакции состоит в способности гемагглютининов -поверхностных вирусных структур гликопротеидной природы этих вирусов склеивать (агглютинировать) эритроциты определенных видов животных, птиц или человека. РГА не относится к иммунологическим реакциям, поскольку в ее основе отсутствует взаимодействие АГ и AT.
Определение титра вирусов можно проводить также на хорионаллантоисной оболочке.Для этого в лунки стерильных полистироловых пластин помещают кусочки скорлупы 11-12-дневного куриного эмбриона с неповрежденной ХАО, добавляют вирусосодержащую жидкость в десятикратных разведениях на буфере, накрывают пластины фольгой и инкубируют при 35-37 0 С в течение 24-72 часов. После этого скорлупу удаляют, добавляют 0,5% взвесь куриных эритроцитов и производят учет реакции по эффекту гемагглютинации, который свидетельствует о репродукции вируса.

Рис. 31. Реакция гемагглютинации для выявления вируса гриппа в хорион-аллантоисной жидкости куриного эмбриона.
Индикация вирусов в организме лабораторных животныхнаходится в зависимости от вируса и вида чувствительного лабораторного животного, будет описана в лабораторной диагностике конкретных вирусных инфекций.
Проводится с помощью следующих методов.
Учет вирусиндуцированных патологических изменений в чувствительных живых системах.
Изучение антигенных свойств вирусов в серологических реакциях с противовирусными сыворотками является основным методом идентификации вирусов. Для этого используют ряд иммунологических реакций.
Реакция нейтрализации основана на способности антител нейтрализовать инфекционную активность вирусов в культурах ткани, РКЭ, чувствительных лабораторных животных. Из вирус-содержащего материала готовят десятикратные разведения и добавляют к ним специфическую сыворотку в разведении в соответствии с титром, указанным на этикетке ампулы. Смеси вирус-сыворотка инкубируют 30 — 60 мин при 37 °С для обеспечения связывания антигенов с антителами, после чего смесью заражают культуру ткани, куриные эмбрионы или лабораторных животных. Контролем является чувствительная биосистема, зараженная вирусом без сыворотки.
Реакция считается положительной в случае нейтрализации ЦПД в культуре клеток, а также при отсутствии патологических изменений в куриных эмбрионах или в организме животных. По результатам РН высчитывается индекс нейтрализации (ИН - отношение титра вируса в контроле к титру вируса в опыте). При ИН менее 10 реакция расценивается как отрицательная, от 11 до 49 — сомнительная, от 50 и выше — положительная.
РН может быть поставлена в наиболее чувствительном варианте - подавления вирусного бляшкообразования под действием вирусспецифической антисыворотки. Для этого к вирус-содержащему материалу добавляют соответствующую искомому вирусу антисыворотку и после инкубации в термостате при 37 0 С течение 30-60 мин смесь вносят в культуру чувствительных клеток. Бляшкообразование выявляют в слое агара или бентонита. Идентичность вируса антителам сыворотки проявляется подавлением бляшкообразования.
Другим вариантом РН является цветная проба. Положительный результат пробы в случае соответствия вируса противовирусным антителам проявляется блокадой репродукции вируса, клетка при этом остается жизнеспособной, вырабатывая кислые продукты метаболизма, под влиянием которых цвет индикатора (фенолового красного) меняется с красного на желтый. Для постановки пробы в пробирки вносят по 0,25 мл рабочего разведения вируса и соответствующую антисыворотку. Смесь выдерживают при комнатной температуре 30-60 мин, добавляют в каждую пробирку по 0,25 мл клеточной суспензии и закрывают их резиновыми пробками. Пробирки инкубируют в термостате при 37 0 С 6-8 дней, результаты реакции учитывают по изменению цвета индикатора (красный цвет индикатора соответствует щелочному характеру рН - 7,4 указывая на репродукцию вируса и подавление метаболизма клеток; желтый цвет свидетельствует о кислом рН - ниже 7,2 в результате нейтрализации вируса антителами и активном метаболизме клеток с выработкой кислых продуктов обмена).
Реакция торможения гемадсорбции (РТГадс) основана на нейтрализации эффекта адсорбции эритроцитов на поверхности клеток, инфицированных вирусами, способными вызывать гемадсорбцию. Для постановки реакции по 0,2 мл специфической сыворотки, разведенной 1:5, вносят в пробирки, инкубируют 30-60 мин в термостате при оптимальной для данного вируса температуре, затем добавляют по 0,2 мл 0,5% взвеси эритроцитов. Контрольные пробы содержат неиммунную сыворотку и эритроциты. Пробирки снова инкубируют 20-30 мин, после чего производят учет реакции. Идентификация вируса основывается на признаке отсутствия адсорбции эритроцитов на клетках в присутствии иммунной сыворотки при наличии гемадсорбции в контрольных пробирках.
Для антигенной идентификации вирусов в клетках культур тканей используются также РПГ, РСК, РИФ, РОПГА ИФА, РИА со специфическими иммунными противовирусными сыворотками или моноклональными AT.
выявление вирусной НК методами генодиагностики с помощью метода молекулярной гибридизации и ПЦР;
электронно-микроскопическое изучение вирусов (см. выше).
Лабораторные исследованияпри проведении идентификации вирусов и диагностике вирусных инфекций включают следующие этапы: выделение, культивирование, индикация (выявление) и идентификация вирусов.
2.3.1 Культивирование вирусов
Вирусы не растут на искусственных питательных средах, а размножаются только внутриклеточно. Крупным достижением было предложение Р. Гудпасчура в 1932 г. использовать для культивирования вирусов куриные эмбрионы. Окончательное решение проблемы культивирования вирусов оказалось возможным лишь после того, как были разработаны основные способы культивирования клеток вне организма.
Использование куриных эмбрионов. Куриные эмбрионы – практически идеальные модели для культивирования некоторых вирусов (например, гриппа и кори). Замкнутая полость эмбриона препятствует проникновению микроорганизмов извне, а также развитию спонтанных вирусных инфекций. Эмбрионы применяют для первичного выделения вирусов из патологического материала; для пассирования и сохранения их, а также для получения необходимых количеств вируса. Некоторые возбудители (например, герпесвирусы) вызывают характерные изменения (по ним можно распознавать заболевание).
Для заражения обычно используют куриные эмбрионы 7–12-дневного возраста. Перед заражением определяют жизнеспособность эмбриона путем овоскопирования (просматривают в проходящем свете). Живые эмбрионы при овоскопировании проявляют двигательную активность, хорошо виден сосудистый рисунок. Простым карандашом очерчивают границы воздушной камеры.
Куриные эмбрионы заражают вируссодержащим материалом в асептических условиях стерильными инструментами, предварительно обработав скорлупу над воздушным пространством йодом и спиртом. Заражение проводят на хорион-аллантоисную оболочку, в амниотическую или аллантоисную полость, либо в желточный мешок (рисунок 29). Выбор метода заражения зависит от биологических свойств вируса.
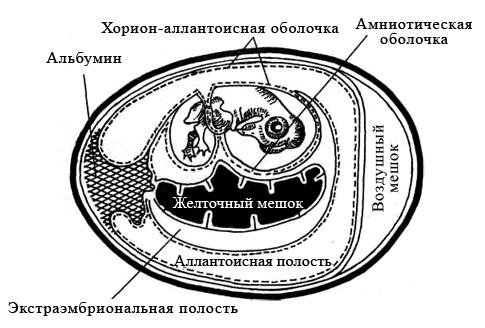
Рисунок 29 – Схематическое изображение развивающегося куриного эмбриона
Культура клеток. Вначале был использован метод переживающих тканей. Он заключался в том, что в колбу, содержащую питательную среду, вносили кусочек ткани. Клетки некоторых тканей в таких условиях могут переживать (но не размножаться) до 30 дней, а в них могут размножаться вирусы. Однако этот способ давал очень небольшой выход вирусов. Необходимо было разработать условия, при которых клетки ткани могли бы свободно размножаться.
Для получения культур клеток необходимо было решить четыре главных задачи:
– получить в необходимом количестве свободные (т. е. изолированные друг от друга) клетки;
– создать такие питательные среды и условия, в которых клетки могли бы активно размножаться;
– обеспечить условия, при которых в культурах клеток не могли бы размножаться бактерии;
– определить методы, с помощью которых можно было бы распознавать рост вируса в культуре клеток и идентифицировать его.
Для выделения изолированных (разобщенных), но жизнеспособных клеток из разрушенных тканей, стали использовать обработку их слабым раствором трипсина, разрушающего межклеточные мостики. Для культивирования клеток были предложены различные среды, содержащие все необходимые для размножения клеток питательные вещества (аминокислоты, основания, витамины и другие), минеральные соли, имеющие оптимальную рН и т. д. К питательным средам добавляли индикатор, по изменению цвета которого можно было судить о метаболизме клеток и их размножении. Было установлено, что в качестве основы, на которой клетки размножаются и образуют монослой, может быть использовано хорошо обработанное стекло пробирок и колб. Для подавления возможного роста бактерий вируссодержащий материал перед посевом его в культуры клеток стали обрабатывать антибиотиками.
В 1949 г. Дж. Эндерс, Т. Веллер и Ф. Роббинс показали, что вирус полиомиелита хорошо размножается в первично-трипсинизированных культурах клеток, полученных из почек обезьян. Основной недостаток первично-трипсинизированных клеток заключается в том, что после нескольких пересевов они перестают размножаться. Поэтому предпочтением стали пользоваться культуры таких клеток, которые способны размножаться in vitro бесконечно долго. Такие перевиваемые культуры клеток (клеточные линии характеризуются бессмертием и гетероплоидным кариотипом) получают из опухолевых тканей (HeLa получена из карциномы шейки матки, НЕр-2 – из карциномы гортани; Детройт-6 – из метастаза рака легкого в костный мозг; RН – из опухоли почки человека) или из мутантных клеток с полиплоидным набором хромосом. Однако опухолевые клетки нельзя применять для получения вакцин. Для этих целей используют только культуры таких клеток, которые не содержат никаких контаминантных вирусов и не обладают злокачественностью. Лучше всего этим требованиям отвечают культуры диплоидных клеток.
Полуперевиваемые (диплоидные) культуры клеток – клетки одного генотипа, способные in vitro выдерживать 50–100 пассажей, сохраняя при этом свой исходный диплоидный набор хромосом. Диплоидные линии фибробластов эмбриона человека используются как для диагностики вирусных инфекций, так и при производстве вирусных вакцин. Как оказалось, вирусы могут размножаться не только в культурах клеток, образующих монослой на стекле пробирок, но и в суспензиях живых клеток.
Для обеспечения жизнедеятельности культивируемых клеток необходимы питательные среды. По назначению они делятся на ростовые и поддерживающие. В ростовых питательных средах должно содержаться больше питательных веществ, обеспечивающих активное размножение клеток и формирование монослоя. Поддерживающие среды обеспечивают переживание клеток в уже сформированном монослое в период размножения в них вирусов.
2.3.2 Выделение вирусов
Выделение вирусов в культурах клеток. При выделении вирусов из различных инфекционных материалов (кровь, моча, слизистые отделяемые, смывы из органов) применяют культуры клеток, обладающих наибольшей чувствительностью к предполагаемому вирусу. Для заражения используют культуры в пробирках с хорошо развитым монослоем клеток. Перед заражением клеток питательную среду удаляют и в каждую пробирку вносят по 0,1–0,2 мл взвеси исследуемого материала, предварительно обработанного антибиотиками для уничтожения бактерий и грибов. После 30-60 мин контакта вируса с монослоем клеток удаляют избыток материала, в культуру вносят поддерживающую среду и пробы оставляют в термостате до выявления признаков размножения вируса.
Выделение вирусов на лабораторных животных. При невозможности выделить и идентифицировать вирус стандартными методами in vitro инфекционный материал вводят чувствительным к возбудителю животным, и после развития типичного инфекционного процесса проводят повторное заражение чувствительных клеточных культур. Наиболее часто используют мышей, кроликов и обезьян; для выделения некоторых вирусов (например, вирусов Коксаки) заражают мышат-сосунков. Вследствие дороговизны и сложности содержания лабораторных животных, практически повсеместно их вытеснили клеточные культуры. Тем не менее животные модели активно используют для изучения особенностей патогенеза и формирования иммунных реакций при вирусных инфекциях.
Таким образом, для выделения чистых культур вирусов в лабораторных условиях в настоящее время используются следующие живые объекты (биологические модели): 1) культура клеток (тканей, органов); 2) куриные эмбрионы; 3) лабораторные животные.
2.3.3 Индикация вирусов
Индикация вирусов в культурах клеток. Индикатором наличия вируса в зараженных культурах клеток может служить:
1) развитие специфической дегенерации клеток – цитопатическое действие вируса (ЦПД), имеющее три основных типа: крупно- или мелкоклеточная дегенерация; образование многоядерных гигантских клеток (симпластов); развитие очагов клеточной пролиферации, состоящих из нескольких слоев клеток (гроздевидная дегенерация клеток).
Различают два механизма гибели клеток, вызываемой вирусами, – некроз и апоптоз. Некроз происходит из-за необратимых нарушений целостности клеточных мембран, апоптоз – вследствие фрагментации ядерной ДНК под действием клеточной эндонуклеазы.
Цитопатические эффектыоценивают при микроскопии клеточных культур. По степени поражения клеток выделяют вирусы с высокой или умеренной цитопатогенностью:
2) обнаружение внутриклеточных включений, располагающихся в цитоплазме и/или в ядрах пораженных клеток;
3) положительная реакция гемагглютинации (РГА) или гемадсорбции (РГАдс). Некоторые вирусы, в частности, вирус гриппа, обладают особыми рецепторами (гемагглютининами), с помощью которых они адсорбируются на эритроцитах и вызывают их склеивание (гемагглютинацию). Такие вирусы легко обнаруживаются с помощью реакции гемагглютинации или гемадсорбции (эритроциты адсорбируются на инфицированных вирусами клетках культуры тканей);
4) феномен бляшкообразования. Широкое распространение получил предложенный в 1952 г. Р. Дюльбекко метод бляшек (негативных колоний), позволяющий производить количественное определение вирусов. Для выделения вирусов монослой клеток после удаления питательной среды заражают вируссодержащим материалом и покрывают слоем агара, содержащего индикатор нейтральный красный. Чашки (флаконы) инкубируют при 37 °С. Через 48–96 ч выявляются пятна – бляшки. Они имеют диаметр 1–3 мм и выглядят неокрашенными на розовом фоне. Пятна возникают за счет цитопатического действия вируса;
5) цветная реакция Солка. О росте вирусов в клетках можно судить с помощью индикатора, добавляемого к питательной среде. Если клетки активно осуществляют метаболизм, рН среды сдвигается в кислую сторону, и среда окрашивается в желтый цвет. В случае размножения вируса клетки погибают, рН среды мало меняется, и она сохраняет первоначальный (малиновый) цвет или (при нейтральной рН) приобретает оранжевый;
6) реакция интерференции (используется при отсутствии ЦПД, гемагглютинации и гемадсорбции): исследуемая культура повторно заражается вирусом, вызывающим ЦПД. В положительном случае ЦПД будет отсутствовать (реакция интерференции положительна). Если в исследуемом материале вируса не было, наблюдается ЦПД.
Кроме того, для обнаружения вируса в культурах клеток могут быть использованы различные серологические реакции.
Индикация вирусов на лабораторных животных. Индикация вируса основана на обнаружении у животных признаков инфекционного заболевания, регистрации их гибели, изучении характера патоморфологических и патогистологических изменений в тканях и органах, выявлении положительной реакции гемагглютинации.
2.3.4 Методы идентификации вирусов
Определение типа вируса (его идентификация) основано на нейтрализации биологической активности вируса с помощью типоспецифических сывороток. Конечный результат ее может быть установлен на основании следующих признаков:
1) нейтрализация цитопатического действия: в культуральную среду, содержащую изучаемый вирус, вносят коммерческую сыворотку (например, к вирусу краснухи при подозрении на неё), инкубируют и заражают вторую культуру; через 1–2 дня в неё вносят известный цитопатогенный вирус. При наличии цитопатогенного эффекта делают вывод о том, что первая культура была заражена вирусом, соответствовавшим антителам примененной сыворотки;
2) нейтрализация реакции гемадсорбции;
3) изменение проявления цветной пробы;
4) задержка (торможение) реакции гемагглютинации: смешивают культуральную среду, содержащую возбудитель, с известной коммерческой антисывороткой и вносят в культуру клеток. После инкубации определяют способность культуры к гемагглютинации и при её отсутствии делают заключение о несоответствии вируса антисыворотке.
5) нейтрализация в опытах на животных.
Таким образом РН (реакция нейтрализации) основана на подавлении соответствующей реакции, феномена, развития инфекционного процесса после внесения в культуру или введения в организм животного смеси вируса со специфичными AT, содержащимися в диагностической сыворотке.
Вопросы для самоконтроля
1 Назовите основные принципы классификации вирусов.
2 Приведите русские и латинские названия основных семейств вирусов человека и животных.
3 Назовите типовых представителей основных семейств вирусов и заболевания, вызываемые ими.
4 Каковы особенности морфологии и ультраструктуры вирусов человека и животных (основных семейств)?
5 Назовите РНК-геномные и ДНК-геномные фитовирусы.
6 Какие этапы включают в себя лабораторные исследования при идентификации вирусов и диагностике вирусных инфекций?
7 Какие биологические модели используются для выделения и культивирования вирусов человека и животных?
8 Как происходит заражение куриных эмбрионов в лабораторных условиях?
9 Какие методы получения культуры клеток вы знаете?
10 Как проводят идентификацию вирусов в курином эмбрионе и на лабораторных животных?
11 Какие существуют методы индикации вирусов на культуре клеток?
12 В чем заключается назначение и сущность реакций нейтрализации вирусов?
13 Назовите способы постановки реакций нейтрализации вирусов.
Читайте также:


