Контрольные точки и вирусы
Сдвиг виден и в активности крупных фармацевтических корпораций. В феврале компания Merck выделила 394 миллиона долларов на покупку австралийской компании, работающей с вирусами, которые убивают опухолевые клетки. Тогда это казалось огромной суммой. Но уже 2 мая рекорд был перекрыт другим фармацевтическим гигантом. Компания Johnson & Johnson объявила, что потратит на приобретение фирмы, разрабатывающей онколитические вирусы, до одного миллиарда долларов.
Одним из немногочисленных методов виротерапии опухолей, получившим одобрение для клинического применения, стал препарат RIGVIR (ECHO-7), созданный под руководством Айны Муциниеце в Латвии. В своих исследованиях 1960-х – 1970-х годов в Институте микробиологии имени А. Кирхинштейна Латвийской академии наук Айна Муциниеце выделила разновидность эховирусов, которые не вызывали опасной инфекции, но оказывали онколитическое действие. В 2004 году Государственное агентство лекарственных средств Латвии официально зарегистрировало препарат RIGVIR для лечения меланомы. Но многие онкологи указывают, что до сих пор в ходе клинических испытаний не было получено достаточно убедительных подтверждений его эффективности. Более того, производителей препарата обвиняют в неэтичной рекламе, а американский онколог Дэвид Горски прямо называет производство RIGVIR шарлатанством. В начале 2017 года Ассоциация онкологов, Ассоциация химиотерапевтов и Ассоциация редких болезней Латвии, а также фармацевтический факультет Рижского университета имени Страдыня обратились в министерство здравоохранения Латвии и агентство лекарственных средств с просьбой исключить препарат RIGVIR из списка лекарств, компенсируемых государством, так как его эффективность не доказана. Но министерство здравоохранения ответило, что RIGVIR останется в списке лекарственных средств и что соотношение риска и пользы при его применении оно оценивает как приемлемое.
В наши дни возможность модифицировать вирусный геном дала специалистам по виротерапии опухолей принципиально новые возможности. Хотя по-прежнему использовать химиотерапию намного дешевле, уже сейчас есть области онкологии, где виротерапия потенциально имеет преимущества. В первую очередь это лечение опухолей головного мозга. Как известно, в организме имеется гемато-энцефалический барьер – систему, которая препятствует проникновению из крови в мозг различных патогенов. Но этот барьер не пускает к клеткам мозга и препараты, направленные на лечение опухолей, а среди вирусов есть такие, кому гемато-энцефалический барьер не страшен. Поэтому именно лечение опухолей мозга сейчас самое перспективное направление в разработке онколитических вирусов.
Правда, в самом большом клиническом испытании Imlygic не показал статистически значимого увеличения выживаемости пациентов по сравнению с другими средствами, но показанных им результатов хватило для положительного решения FDA. К тому же испытания доказало, что Imlygic борется не только с той опухолью, куда была сделана инъекция препарата, но и с опухолями в других частях организма.
На подходе еще несколько методов вирусной терапии. В Университете Дьюка уже прошли первые испытания на пациентах модифицированного вируса полиомиелита в качестве средства борьбы с опухолью мозга – глиобластомой (подробнее об этом также рассказано в отдельном очерке). Вирус бешенства, который распространяется по нервной системе, также пытаются приспособить для прохождения гемато-энцефалического барьера и лечение опухолей мозга. Но тут пока опыты проводятся на лабораторных мышах.
Важным достижением стали свидетельства, полученные преимущественно в исследованиях на животных, что онколитические вирусы особенно эффективны в сочетании с другим методом терапии – применением ингибиторов контрольных точек, которые стимулируют иммунный ответ протии опухоли. Контрольными точками иммунного ответа (immune checkpoint inhibitors) называют особые молекулы, выделяемые опухолями, чтобы защититься от иммунной системы. Ингибируя их, то есть останавливая их действие, ученые активизируют защиту организма.
В клиническом исследовании 2017 года с участием 21 пациента с меланомой поздней стадии препарат Imlygic вместе с ингибитором контрольной точки, который называется pembrolizumab, вызвал значительное сокращение опухолей у 13 участников и полностью уничтожил их у семерых.
Жан-Симон Диалло именно с ингибиторами контрольных точек связывает новый этап развития вирусной терапии рака. Правда, когда ученые пытались совмещать ингибиторы контрольных точек с другими видами терапии, они не всегда добивались успеха. Некоторые комбинации, от которых теоретически ожидалась высокая эффективность, во время клинических испытаний не показывали обнадеживающих результатов. Подобное может происходить и в сочетании ингибиторов контрольных точек с онколитическими вирусами. Но пока большинство исследователей разделяет осторожный оптимизм относительно перспектив такого метода.

В настоящее время нет закона, обязывающего применять ККТАИО во всех заведениях службы питания. Ho внедрение такой системы может оказаться выгодным на нескольких уровнях. Если вы решите начать вводить ККТАИО в своем ресторане, имейте в виду, что для этого потребуются затраты времени и людских ресурсов. Однако использование этой системы сэкономит деньги и время, а также повысит качество блюд, которыми вы угощаете своих клиентов.
В основе ККТАИО лежат семь принципов, которым соответствуют семь шагов.
- Оцените опасность. Первый шаг в программе ККТАИО начинается с анализа опасности, кроющейся в какой-то позиции меню или в рецепте. Требуется внимательно изучить процесс приготовления блюда, соответствующего этому пункту меню, начиная с доставки исходных продуктов. Необходимо продумать каждый шаг процесса, разработать схему переработки продукта в ресторане, охватывающую весь процесс — от приема ингредиентов до готового блюда. Кроме того, очень полезно, чтобы все сотрудники, участвующие в цепочке работ, присутствовали при внедрении программы ККТАИО, так как даже приемщик продуктов может сообщить нечто важное для разработки программы.
Проблемы, с которыми вам предстоит столкнуться, — это биологические, химические или физические условия, способную сделать пищу небезопасной для потребления. В типичном случае это будут микробиологические угрозы, хотя и к ядовитости (например, несъедобных грибов) надо быть готовым. Микробиологические источники опасности — это бактерии, вирусы и паразиты.
Совет для начала: приготовление еды — это, как правило, критическая контрольная точка. Другие KKT обычно связывают с температурно-временными условиями (размораживанием, горячим и холодным хранением, охлаждением и разогревом). При назначении KKT следует подумать над такими вопросами: может ли пища быть заражена на этом этапе? Может ли загрязнение увеличиваться? Можно ли устранить эту опасность тем или иным вмешательством (так называемым корректирующим воздействием)? Можно ли предотвратить или уменьшить опасность заражения с помощью шагов, предпринятых на более ранних или более поздних стадиях переработки? Можете ли вы постоянно отслеживать, измерять и документировать ККТ?
3. Установите критические нормы и меры контроля. Критические нормы — это, говоря в общем, эталонные показатели контрольных измерений в каждой точке контроля. Многие из них уже установлены местными органами здравоохранения, но вы, возможно, захотите ввести собственные критические нормы, более жесткие, чем официальные стандарты, или новые стандарты, которые будут одобрены органами здравоохранения. Рассмотрим пример. Установленная критическая норма для этапа жаренья в процессе приготовления блюда из курицы — конечная внутренняя температура 74°С. Эта критическая норма предотвращает возможность заболевания клиента сальмонеллезом. Если вам приходится ждать какое-то время перед подачей этой курицы на стол, необходимо поддерживать температуру не ниже 6о°С, чтобы не допустить размножения болезнетворных микробов. Это один из шагов, которые будут считаться критическими контрольными точками.
Меры контроля — это то, что можно делать загодя для соблюдения критических норм. Например, чтобы жарить курицу при температуре до 74°C, вы должны убедиться в том, что оборудование хорошо работает. Прежде чем жарить, включите духовку и нагрейте ее. Если вы собираетесь следить за внутренней температурой с помощью термометра, надо проверить, правильно ли он калиброван. Вы также должны знать, как жарить курицу и как измерять внутреннюю температуру. Так что обучение тоже может быть мерой контроля.
4. Установите процедуры мониторинга ККТ. Критические нормы для каждой критической контрольной точки как раз и определяют, что именно надо отслеживать. Следует также определить, как будут отслеживаться KKT и кто будет это делать. Мониторинг помогает обнаружить проблемы или недостатки той или иной стадии процесса. Это позволяет совершенствовать контроль и систему, так как открывает возможности применения корректирующих воздействий, когда параметры не укладываются в критические нормы.
5. Составьте план корректирующих воздействий. Необходимо иметь план действий на тот случай, если на каком-то этапе процесса произойдет отклонение от стандартов или их несоблюдение. Например, если жареная курица слишком долго лежала на мармите при температуре ниже 60°С, то корректирующее воздействие сведется к тому, чтобы просто ее выбросить. Если поставщик привез мороженую рыбу с наростами льда, указывающими на то, что она была разморожена и заморожена снова, ее не надо принимать. Для каждой KKT следует выработать специфические корректирующие воздействия, потому что различия между кухнями по продуктам и способам их приготовления могут быть огромны.
6. Создайте систему ведения записей. Держите документацию под рукой, чтобы видеть, работает ли система. Запись событий в критических контрольных точках докажет, что нормы соблюдены и профилактический мониторинг проводится. Обычно документация состоит из журналов фиксации температурно-временных режимов, контрольных перечней и бланков отчетов.
7. Разработайте систему проверок. Система проверок — это, в сущности, внедрение процедур, гарантирующих, что система ККТАИО функционирует правильно. Поручите контролеру, шефу-администратору или кому-то со стороны проверять, работает ли система. Если какие-то процедуры не выполняются, постарайтесь внести поправки для улучшения работы системы.
- 3035
- 2,5
- 0
- 6
Более полувека назад двое ученых — Льюис Томас и Фрэнк Макфарлейн Бёрнет — выдвинули гипотезу о роли иммунной системы в контроле развития новообразований [1–3]. Ее суть Бёрнет сформулировал следующим образом:
У гипотезы было немало противников, но в последние десятилетия она получила многочисленные подтверждения. Иммунитет защищает человека от рака, и в этих защитных механизмах принимают участие T- и B-лимфоциты, макрофаги и натуральные киллеры (NK-клетки).
В процессе развития иммунологической толерантности по отношению к опухолевым клеткам участвуют разные механизмы [4], [5]. Они не до конца изучены, и все же в последние десятилетия, во многом благодаря достижениям молекулярной биологии и молекулярной генетики, многое стало известно. Полученные знания легли в основу относительного нового направления в лечении онкологических заболеваний — иммунотерапии. Сегодня многие ученые и врачи-онкологи возлагают на нее большие надежды [6].
Существует несколько направлений современной иммунотерапии [7–9]. Для борьбы с раком используют моноклональные антитела [10], цитокины (интерфероны, интерлейкины), противораковые вакцины, онколитические вирусы, перепрограммированные T-клетки (здесь большие перспективы открывает технология редактирования генов CRISPR-Cas9 [11–14]) и даже микобактерии туберкулеза [15–17].
Контрольные точки и их ингибиторы
Важную роль в противоопухолевом иммунитете играет клеточно-опосредованный иммунный ответ. Опухолевые клетки производят антигены, которые могут быть переработаны и представлены примитивным (наивным) T-лимфоцитам антигенпредставляющими клетками (APC) в виде соединений с молекулами главного комплекса гистосовместимости (MHC). В результате наивный T-лимфоцит превращается в эффекторный и запускает цепочку событий, которая в конечном счете приводит к уничтожению опухолевой клетки (рис. 1) [6], [18].
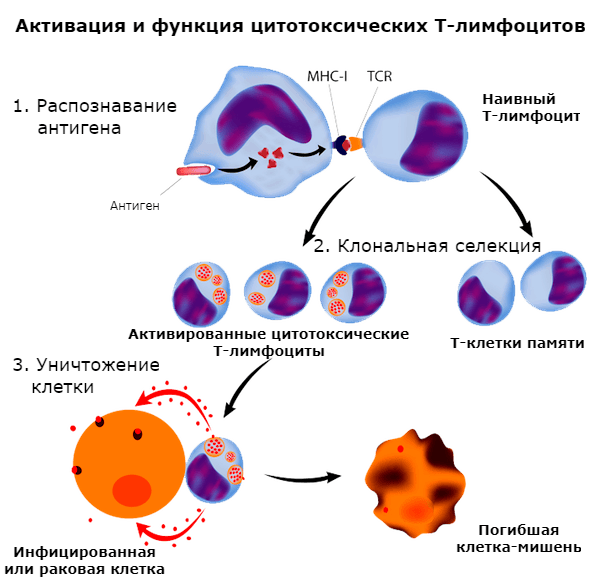
Рисунок 1. Активация T-лимфоцита с участием MHC-I. Наибольшее значение в качестве антигенпрезентирующих клеток имеют специализированные именно на этом дендритные клетки (но также эту функцию могут выполнять и макрофаги и B-клетки). После представления опухолевого антигена наивный T-лимфоцит трансформируется в цитотоксический CD8+ и вызывает гибель опухолевой клетки за счет продукции перфоринов, фрагментинов и индукции апоптоза через Fas-лиганды.
Некоторые опухолевые клетки защищаются от иммунной агрессии еще на стадии этого первичного иммунного ответа. Так, мутационные изменения структуры человеческих лейкоцитарных антигенов (молекул на поверхности клеток, которые извлекают из цитоплазмы куски неправильных или чужеродных, например, вирусных, белков и привлекают ими к себе Т-киллеров) приводят к нарушению их функций и мешает процессу активации иммунных клеток [6], [19].
Помимо механизма распознавания и представления антигенов с участием MHC, в противоопухолевом клеточно-опосредованном иммунном ответе важную роль играют дополнительные мембранные корецепторы. Они обеспечивают положительную и отрицательную модуляции иммунного ответа. В онкологических процессах особое значение имеют два таких корецептора: цитотоксический T-лимфоцитарный антиген-4 (CTLA-4, также известный как CD152) и мембранный белок PD-1 (а также его лиганд PD-L1, или CD274). [6]
CTLA-4 — белок, который в основном экспрессируют CD4+ и CD8+ T-лимфоциты (но также его экспрессия обнаружена и в B-лимфоцитах). В экспериментах in vitro и in vivo доказано его ингибирующее воздействие на первичный иммунный ответ [20]. Для начала пролиферации T-лимфоцитов необходимо, чтобы молекула B7-1 (CD80) или B7-2 (CD86) на поверхности APC связалась с CD28 на Т-клетке. При этом происходит передача сигнала. CTLA-4 — гомолог CD28, обладающий более высокой афинностью по отношению к B7. Однако при связывании CTLA-4 с B7 передачи сигнала не происходит. От соотношения количества связей CD28:B7 и CTLA-4:B7 зависит, будет ли T-клетка находиться в состоянии активации или анергии (рис. 2). Кроме того, CTLA-4, по-видимому, оказывает прямое ингибирующее влияние на иммунный синапс TCR, ингибирует CD28 и его сигнальный путь, а также повышает подвижность T-клеток, что снижает их способность к взаимодействию с APC [21].
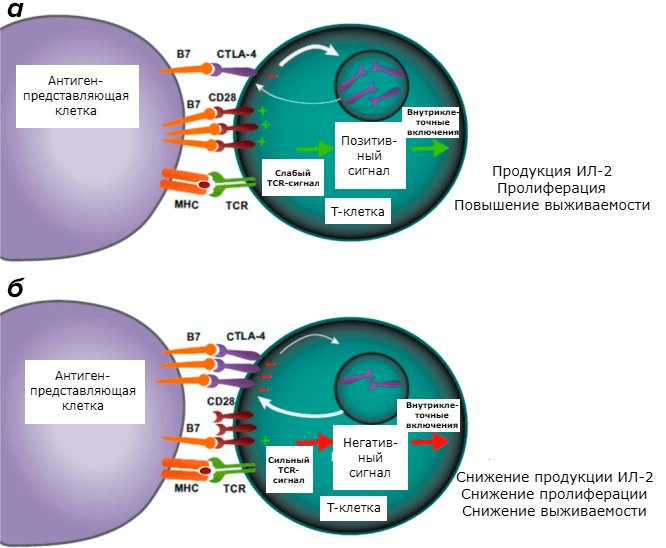
Рисунок 2. CTLA-4-опосредованное ингибирование T-клеток. а — Благодаря связыванию MHC:TCR и CD28:B7 T-лимфоциты продуцируют интерлейкин-2 (ИЛ-2), активируется их пролиферация, повышается выживаемость. б — CTLA-4 конкурирует с CD28 за связывание с B7. Клетка получает негативный сигнал, снижается продукция ИЛ-2, ингибируется пролиферация Т-лимфоцитов и их выживаемость.
В норме в иммунной системе работает обратная связь. Поначалу молекулы CTLA-4 находятся в везикулах внутри клетки в неактивном состоянии. Сигналом к выходу на поверхность служит возникновение связей MHC:TCR и CD28:B7. Кроме того, CTLA-4 содержатся на поверхности регуляторных Т-клеток (Tregs) (рис. 3) [21].
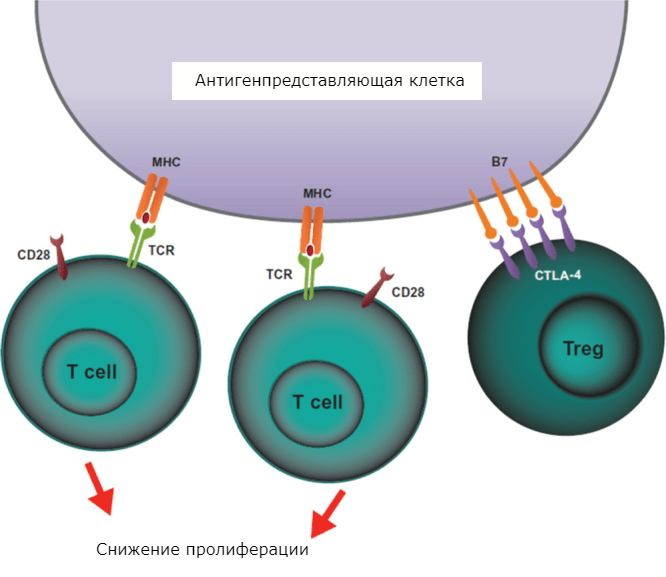
Рисунок 3. CTLA-4-опосредованное ингибирование T-клеток с участием Tregs. Согласно гипотезе, CTLA-4 на поверхности Tregs вступают в связь с B7 на поверхности APC. В итоге CD28 на поверхности T-лимфоцитов не могут вступить в связь с B7, что нарушает активацию клеток.
CTLA-4, PD-1 и подобные им корецепторы, эффекты которых имеют большое значение при онкологических заболеваниях, были названы контрольными точками . Так как они мешают активации T-лимфоцитов и тем самым подавляют противоопухолевый иммунитет, однажды появилась идея создать препараты, которые могли бы ингибировать их. И в настоящее время такие иммунопрепараты созданы, прошли испытания и даже применяются в клинической практике. Называются они ингибиторами контрольных точек [22]. Механизмы действия этих препаратов показаны на рисунках 4 и 5.
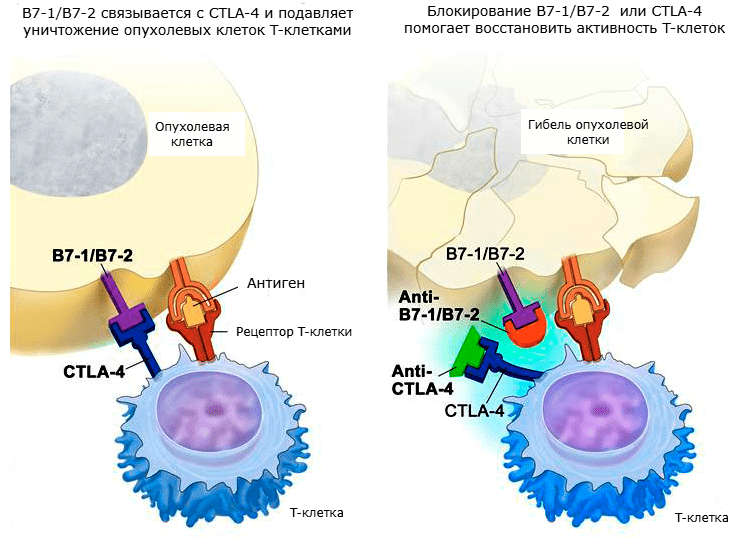
Рисунок 4. Механизм действия ингибиторов CTLA-4 и B7-1/B7-2.
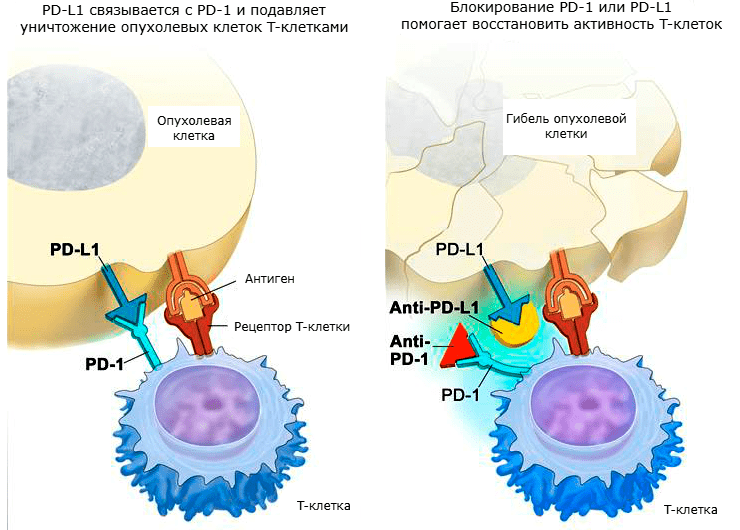
Рисунок 5. Механизм действия ингибиторов PD-1 и PD-L1.
По природе ингибиторы контрольных точек являются человеческими моноклональными антителами. Одновременно их можно отнести к группе таргетных препаратов, так как они прицельно связываются с определенными молекулами-мишенями.
Ингибиторы контрольных точек показали высокую эффективность у многих онкологических пациентов, но не обошлось и без проблем. Главная из них состоит в том, что не все пациенты одинаково хорошо отвечают на лечение.
Полезные бактерии, вредные бактерии
Считается, что резистентность к иммунотерапии при онкологических заболеваниях возникает главным образом из-за слабой инфильтрации опухолевой ткани иммунными клетками и иммуносупрессивных эффектов микроокружения опухоли [23], [24]. На иммунный ответ оказывают влияние в том числе и микроорганизмы, населяющие кишечник [25].
Накоплено немало данных, подтверждающих влияние кишечной микрофлоры на обменные процессы и иммунные реакции. Так, известно, что нарушение взаимодействия между хозяином и микробиотой связано с такими патологиями, как сахарный диабет, цирроз печени, воспалительные заболевания кишечника, колоректальный рак [25], [26].
У животных, которые получают антибиотики или искусственно лишены кишечной микробиоты, развивается резистентность к препаратам платины: снижается цитотоксичность, образование активных форм кислорода [29]. Состав кишечной микрофлоры оказывает влияние на фармакологические эффекты таких препаратов, как 5-фторурацил, иринотекан, оксалиплатин, гемцитабин, метотрексат [30].
Модуляция ответа на химиопрепараты и иммунопрепараты микробиотой кишечника сводится к одному из трех клинических эффектов:
- повышение эффективности препарата;
- ослабление противоопухолевого эффекта;
- повышение токсичности.
Представители микрофлоры используют разные механизмы ответа на препараты. Известные на данный момент объединяет аббревиатура TIMER (табл. 1) [30].
| Механизм ответа | Препараты, активирующие механизм | Бактерии, изпользующие механизм | Эффект взаимодействия бактерий с препаратом |
|---|---|---|---|
| Транслокация (Translocation) | Циклофосфамид Доксорубицин | Грамположительные микроорганизмы (Lactobacillus johnsonii, L. murinus, Enterococcus hirae) | Бактерии пересекают кишечный барьер и мигрируют во вторичные лимфоидные органы. |
| Иммуномодуляция (Immunomodulation) | Циклофосфамид | Lactobacillus | Грамположительные бактерии стимулируют иммунный ответ с участием клеток Th17 и Th1. |
| Метотрексат | Неизвестно | Бактерии регулируют повреждение кишечника химиопрепаратом через сигнализацию TLR2 и белок множественной лекарственной устойчивости. | |
| Блокаторы CTLA-4 | Bacteroidales | Подавление активации селезеночных эффекторных CD4+ Т-клеток и опухоль-инфильтрирующих лимфоцитов. | |
| Блокаторы PD-L1 | Bifidobacterium | Стимуляция опухолеспецифических Т-клеток и увеличение количества Т-лимфоцитов в микроокружении опухоли. | |
| Метаболизм (Metabolism) | Иринотекан | Неизвестно | Точная роль бактерий не известна, но лечение стрептомицином ингибирует поглощение иринотекана и снижает активность эпителиальной карбоксилэстеразы. |
| Ипилимумаб | Bacteroidetes | Бактериально опосредованная продукция витамина B и дефицит транспорта полиамина, связанные с повышенным рискоминдуцированного блоком CTLA-4 колита. | |
| Ферментная деградация (Enzymatic degradation) | Гемцитабин | Mycoplasma | Микоплазменные нуклеозидные фосфорилазы ограничивают цитостатическую активность. |
| Иринотекан | β-глюкуронидаза-экспрессирующая кишечная бактерия | Бактериальная β-глюкуронидаза расщепляет глюкуронид неактивного иринотекана (SN-38G), высвобождая активный метаболит (SN-38) в кишечнике. | |
| Сокращение разнообразия и функций экологической сети (Reduced diversity and ecological network function) | Комбинации кармустина, этопозида, цитарабина и мелфалана | Firmicutes Actinobacteria Proteobacteria | Уменьшается количество бактерий, которые подавляют воспаление, и увеличивается число бактерий, которые приводят к колиту. |
| Метотрексат | Анаэробы Стрептококки Bacteroides | Уменьшается разнообразие микроорганизмов, и сдвиги в составе кишечной микробиоты приводят к диарее. |
Свежие данные
Начало 2018 года ознаменовалось сразу тремя научными работами, посвященными влиянию микрофлоры кишечника на эффективность ингибиторов контрольных точек.
Работа Виары Мэтсон с соавторами посвящена метастатической меланоме. Ученые отобрали 42 пациента, страдавших этим заболеванием, и провели анализ их стула тремя различными методами. В дальнейшем бóльшая часть пациентов (38 человек) получала блокаторы PD-1 (ниволумаб, пембролизумаб), а четверо — блокатор CTLA-4 (ипилимумаб) [31].
Оказалось, что в составе кишечной микрофлоры пациентов, которые хорошо отвечали на терапию ингибиторами контрольных точек, было повышено количество восьми видов бактерий: Enterococcus faecium, Collinsella aerofaciens, Bifidobacterium adolescentis, Klebsiella pneumoniae, Veillonella parvula, Parabacteroides merdae, Lactobacillus sp. и Bifidobacterium longum. В кишечной микробиоте испытуемых, не ответивших на терапию, были многочисленны два микроорганизма: Ruminococcus obeum и Roseburia intestinalis.
Затем представителей кишечной микрофлоры пациентов с помощью метода трансплантации фекальной микробиоты (fecal microbiota transplantation, FMT) пересадили в кишечник стерильных (безмикробных) мышей [32]. Спустя некоторое время животным имплантировали клетки меланомы. Опухоли в теле мышей, которым пересадили бактерий от людей, ответивших на иммунотерапию, в целом росли медленнее. У них оказались более эффективны блокаторы PD-1 [31], [33].
Ванчесваран Гопалакришнан с коллегами также изучил микрофлору пациентов, страдающих распространенной меланомой, причем, не только в кишечнике, но и в полости рта [34]. Участники исследования получали лечение ингибиторами PD-1. Наилучший ответ наблюдался среди людей, у которых в стуле преобладали микроорганизмы рода Faecalibacterium. Преобладание группы Bacteroidales, напротив, оказалось связано с более низкой активностью препаратов. Ученые не обнаружили корреляции между составом микрофлоры полости рта и ответом пациентов на иммунотерапию.
Затем провели фекотрансплантацию микрофлоры пациентов стерильным мышам, после чего животным имплантировали опухолевые клетки и начали вводить блокаторы PD-1 (рис. 6). У мышей, получивших микробиоту людей, хорошо ответивших на терапию, отмечалось более существенное сокращение роста опухолей. В их стуле также преобладали бактерии рода Faecalibacterium [33], [34].
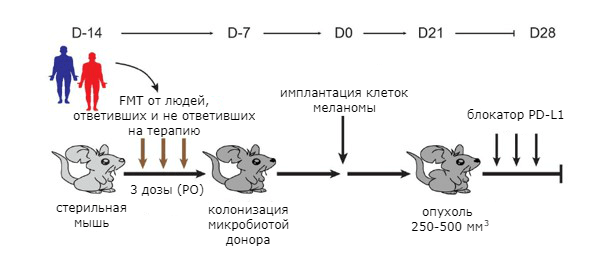
Рисунок 6. Эксперимент с трансплантацией фекальной микробиоты мышам от пациентов, по-разному ответивших на лечение блокаторами PD-1.
Работа Бертрана Роути с соавторами посвящена взаимосвязи состава кишечной микрофлоры и эффективности блокаторов PD-1 при немелкоклеточном раке легких, карциноме почек и уротелиальной карциноме [35]. Исследователи отметили, что прием антибактериальных препаратов для лечения инфекции во время онкологического заболевания ухудшает ответ на введение ингибиторов контрольных точек. Причем, в стуле у людей, хорошо отвечавших на терапию, авторы обнаружили повышенное количество микроорганизмов Akkermansia muciniphila.
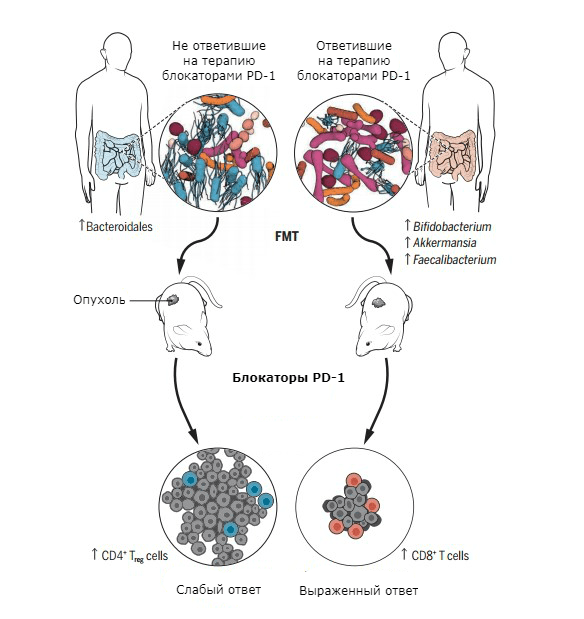
Рисунок 7. FMT и имплантация опухолевых клеток в тело лабораторных мышей. Слева — пациент, не ответивший на лечение блокаторами PD-1. Справа — пациент, хорошо ответивший на иммунотерапию.
Проблемы
Авторы всех трех исследований сходятся на том, что кишечная микрофлора — важный фактор, влияющий на эффективность ингибиторов контрольных точек, и с ним однозначно нужно считаться. Тем не менее результаты расходятся: в качестве предикторов названы разные группы микроорганизмов. Возможно, это зависит от типа злокачественной опухоли или индивидуальных особенностей пациентов. Вероятно, в этом загадочном треугольнике — микрофлора—хозяин—иммунопрепарат — существуют общие механизмы и закономерности, но ученым они пока неизвестны. Главная проблема состоит в том, что знания в этой сфере пока немногочисленны и фрагментарны [33].
Перспективы
Есть надежда, что дальнейшее изучение влияния микрофлоры на эффективность противоопухолевых препаратов поможет решить две проблемы:
Эти подходы могут открыть новые возможности для персонализированной терапии онкологических заболеваний.
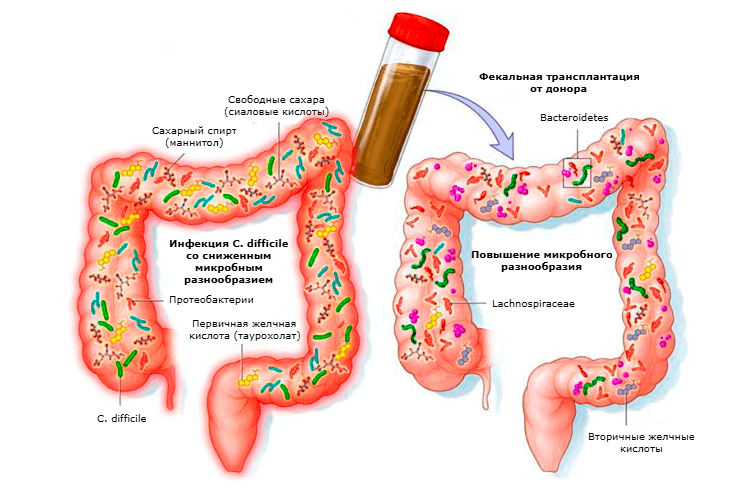
Рисунок 8. Схема FMT-терапии при рецидивирующей инфекции Clostridium difficile.
Методы и технологии борьбы с компьютерными вирусами
Массовое распространение вирусов, серьезность последствий их воздействия на ресурсы КС вызвали необходимость разработки и использования специальных антивирусных средств и методов их применения. Антивирусные средства применяются для решения следующих задач:
* обнаружение вирусов в КС;
* блокирование работы программ-вирусов;
* устранение последствий воздействия вирусов.
Обнаружение вирусов желательно осуществлять на стадии их внедрения или, по крайней мере, до начала осуществления деструктивных функций вирусов. Не существует антивирусных средств, гарантирующих обнаружение всех возможных вирусов.
При обнаружении вируса необходимо сразу же прекратить работу программы-вируса, чтобы минимизировать ущерб от его воздействия на систему.
Устранение последствий воздействия вирусов ведется в двух направлениях:
* восстановление (при необходимости) файлов, областей памяти.
Технология восстановления системы зависит от типа вируса, а также от момента времени обнаружения вируса по отношению к началу вредительских действий. Восстановление информации без использования дублирующей информации может быть невыполнимым, если вирусы при внедрении не сохраняют информацию, на место которой они помещаются в память, а также, если деструктивные действия уже начались, и они предусматривают изменения информации.
Для борьбы с вирусами используются программные и аппаратно-программные средства, которые применяются в определенной последовательности и комбинации, образуя методы борьбы с вирусами: методы обнаружения вирусов и методы удаления вирусов.
Известны следующие методы обнаружения вирусов:
1. Сканирование - один из самых простых методов обнаружения вирусов. Сканирование осуществляется программой-сканером, которая просматривает файлы в поисках опознавательной части вируса - сигнатуры. Программа фиксирует наличие уже известных вирусов, за исключением полиморфных вирусов, которые применяют шифрование тела вируса, изменяя при этом каждый раз и сигнатуру. Программы-сканеры могут хранить не сигнатуры известных вирусов, а их контрольные суммы. Программы-сканеры часто могут удалять обнаруженные вирусы. Такие программы называются полифагами.
Метод сканирования применим для обнаружения вирусов, сигнатуры которых уже выделены и являются постоянными. Для эффективного использования метода необходимо регулярное обновление сведений о новых вирусах.
Метод обнаружения изменений базируется на использовании программ-ревизоров. Эти программы определяют и запоминают характеристики всех областей на дисках, в которых обычно размещаются вирусы. При периодическом выполнении программ-ревизоров сравниваются хранящиеся характеристики и характеристики, получаемые при контроле областей дисков. По результатам ревизии программа выдает сведения о предположительном наличии вирусов.
Обычно программы-ревизоры запоминают в специальных файлах образы главной загрузочной записи, загрузочных секторов логических дисков, характеристики всех контролируемых файлов, каталогов и номера дефектных кластеров. Могут контролироваться также объем установленной оперативной памяти, количество подключенных к компьютеру дисков и их параметры.
Имеются у этого метода и недостатки. С помощью программ-ревизоров невозможно определить вирус в файлах, которые поступают в систему уже зараженными. Вирусы будут обнаружены только после размножения в системе. Программы-ревизоры непригодны для обнаружения заражения макровирусами, так как документы и таблицы очень часто изменяются.
2. Эвристический анализ сравнительно недавно начал использоваться для обнаружения вирусов. Как и метод обнаружения изменений, данный метод позволяет определять неизвестные вирусы, но не требует предварительного сбора, обработки и хранения информации о файловой системе.
3. Метод использования резидентных сторожей основан на применении программ, которые постоянно находятся в ОП ЭВМ и отслеживают все действия остальных программ.
Существенным недостатком данного метода является значительный процент ложных тревог, что мешает работе пользователя, вызывает раздражение и желание отказаться от использования резидентных сторожей.
5. Самым надежным методом защиты от вирусов является использование аппаратно-программных антивирусных средств. В настоящее время для защиты ПЭВМ используются специальные контроллеры и их программное обеспечение. Контроллер устанавливается в разъем расширения и имеет доступ к общей шине. Это позволяет ему контролировать все обращения к дисковой системе.
В программном обеспечении контроллера запоминаются области на дисках, изменение которых в обычных режимах работы не допускается. Таким образом, можно установить защиту на изменение главной загрузочной записи, загрузочных секторов, файлов конфигурации, исполняемых файлов и др.
При выполнении запретных действий любой программой контроллер выдает соответствующее сообщение пользователю и блокирует работу ПЭВМ.
Аппаратно-программные антивирусные средства обладают рядом достоинств перед программными:
* обнаруживают все вирусы, независимо от механизма их действия;
* блокируют неразрешенные действия, являющиеся результатом работы вируса или неквалифицированного пользователя.
Недостаток у этих средств один - зависимость от аппаратных средств ПЭВМ. Изменение последних ведет к необходимости замены контроллера.
Читайте также:


