Этиология опухолей онкогенные вирусы
Опухолевый рост - типовая форма нарушения тканевого роста, возникающая под действием канцерогена. Характерезуется атипизмом роста, обмена веществ, структуры и функции.
Опухолевый рост проявляется патологическим разрастанием ткани с атипичными свойствами.
Согласно цитологической и гистологической структуре опухолевых клеток и тканей выделяют доброкачественные и злокачественные опухоли. Доброкачественные опухоли. Клетки их морфологически похожи на нормальные и формируют характерные для данной ткани, высокодифференцированные структуры. Такие опухоли растут медленно и, как правило, не метастазируют.
Злокачественные опухоли. Клетки их морфологически отличаются от нормальных и образуютнизкодифференцированные тканевые структуры. Эти опухоли растут быстро, инвазируют в соседние ткани, формируют метастазы. Выделяют следующие разновидности злокачественных опухолей:
♦ Карциномы - злокачественные опухоли, происходящие из эпителия.
♦ Саркомы - злокачественные опухоли, возникающие из тканей мезенхимального происхождения (соединительных, костной, хрящевой).
Инициальным звеном опухолевого роста является образование опухолевых клеток под воздействием канцерогенов.
Опухолевая трансформация - процесс превращения нормальных клеток в опухолевые вследствие трансформации нормальной генетической программы в программу формирования опухолевого атипизма.
Факторы химической, физической и биологической природы, способные вызвать опухолевую трансформацию, называютканцерогенами.
• Химические канцерогены. Более 75% случаев злокачественных опухолей человека вызвано воздействием химических факторов внешней среды. К возникновению опухолей приводят преимущественно продукты сгорания табака, некоторые компоненты пищи и промышленные соединения. Известно более 1500 химических соединений, обладающих канцерогенным эффектом. Из них не менее 20 опре- делённо являются причиной опухолей у человека. Например, к ним отнесены 2-нафтиламин, бензидин, 2-аминотиофенил, вызывающие рак мочевого пузыря у работников анилинокрасочной и резиновой промышленности; бис-(хлорметил)-эфир, приводящий к возникновению рака бронхов и лёгких.
• Физические канцерогены: ионизирующее излучение (α-, β- и γ-излучение), рентгеновские и ультрафиолетовые лучи, поток нейтронов. Так, врачи-рентгенологи заболевают лейкозами в 8-9 раз чаще, чем врачи других специальностей.
♦ ДНК-вирусы, вызывающие опухолевую трансформацию, называют онковирусами. Гены ДНК-онковирусов способны непосредственно внедряться в геном клетки-мишени. Участок ДНК-вируса (собственно онкоген), интегрированный с клеточным геномом, может осуществить опухолевую трансформацию клетки. Не исключают также, что один из генов онковируса может играть роль промотора клеточного протоонкогена. К ДНК-содержащим онковирусам относят некоторые аденовирусы, паповавирусы и герпесвирусы (так, вирус Эпстайна-Барр вызывает развитие лимфом, а вирус гепатита B способен инициировать рак печени).
♦ РНК-содержащие вирусы, относящиеся к ретровирусам. Интеграция РНК-генов ретровирусов в клеточный геном происходит не непосредственно, а после образования их ДНК-копий.
ОБЩИЕ ЭТАПЫ КАНЦЕРОГЕНЕЗА
Вне зависимости от конкретной причины опухолевой трансформации клетки, гистологической структуры и локализации новообразования, в процессе канцерогенеза можно выделить несколько общих этапов
• На первом этапе происходит взаимодействие канцерогенов химической, физической или биологической природы с протоонкогенами и антионкогенами (онкосупрессорами) генома нормальной клетки.
• На втором этапе канцерогенеза (в результате воздействия канцерогена на геном) подавляется активность антионкогенов и происходит трансформация протоонкогенов в онкогены. Последующая экспрессия онкогена - необходимое и достаточное условие для опухолевой трансформации.
• На третьем этапе канцерогенеза, в связи с экспрессией онкогенов, синтезируются и реализуют свои эффекты (непосредственно или

с участием клеточных факторов роста и рецепторов к ним) онкобелки. С этого момента генотипически изменённая клетка приобретает опухолевый фенотип.
• Четвёртый этап канцерогенеза характеризуется пролиферацией и увеличением числа опухолевых клеток, что ведёт к формированию новообразования (опухолевого узла).
Этапы химического канцерогенеза
Сами по себе потенциально канцерогенные вещества не вызывают опухолевого роста. В связи с этим их называют проканцерогенами, или преканцерогенами. В организме они подвергаются физико-химическим превращениям, в результате которых становятся истинными, конечными канцерогенами. Считают, что конечными канцерогенами являются алкилирующие соединения, эпоксиды, диолэпоксиды, свободнорадикальные формы ряда веществ.
Выделяют два взаимосвязанных этапа химического канцерогенеза: инициации и промоции.
• На этапе промоции осуществляется экспрессия онкогена, происходит неограниченная пролиферация клетки, ставшей генотипически и фенотипически опухолевой, формируется новообразование.
Этапы физического канцерогенеза
Мишенью канцерогенных агентов физической природы также является ДНК. Допускается либо их прямое действие на геном, либо через посредники - медиаторы канцерогенеза. К последним относят свободные радикалы кислорода, липидов и других органических и неорганических веществ.
• Этап инициации заключается в прямом или опосредованном воздействии агентов физической природы на ДНК. Это вызывает либо повреждение её структуры (генные мутации, хромосомные аберрации), либо эпигеномные изменения. Как первое, так и второе может привести к активации протоонкогенов и последующей опухолевой трансформации клетки.
• На этапе промоции канцерогенеза осуществляется экспрессия онкогена и формирование фенотипа опухолевой клетки. В результате последовательных циклов пролиферации формируется опухоль.
Этапы вирусного канцерогенеза включают пять последовательных событий: проникновение онкогенного вируса в клетку, включение вирусного онкогена в геном клетки, экспрессию онкогена, превращение клетки в опухолевую, образование опухолевого узла.

Инфекция, вызванная онкогенными вирусами, является причиной 15,4% заболеваний раком по всей земле. Первый онкогенный вирус, который был идентифицирован — это куриный вирус саркомы Рауса в 1911 году. Десятилетиями позже были обнаружены серии других онкогенных вирусов, в том числе вирус папилломы Шопа (вирус папилломы кроличьего хвоста), вирус опухоли молочной железы мыши, аденовирус, вирус SV40 (обезьяний вирус sv40). Теория опосредованного вирусом онкогенеза в итоге была экспериментально продемонстрирована в 1976 году Гарольдом Вармусом и Майклом Бишопом путем превращения инфицированных клеток в опухолевые вирусом саркомы (ген v-src вызывает образование опухоли после захвата протоонкогена человеческой клетки в результате трансдукции).
Несмотря на то, что онкогенные вирусы нашли в исследованиях онкогенной активности животных клеток, они были не в состоянии преобразовать человеческие клетки. Теория вирусного онкогенеза в человеческой клетке оставалась спорной до 1965 года, когда вирус Эпштейн-Барр (EBV) был обнаружен в клетках лимфомы Беркитта. В ходе последующих исследований, в том числе выделении Т-лимфотропного вируса человека (HTLV) из клеток Т-клеточной лимфомы и выявлении роли папилломовирусов человека с высокой онкогенной активностью в развитии рака шейки матки, был определен путь для понятия человеческих онкогенных вирусов. Обнаружение связи между герпес-вирусом и саркомой Капоши (KSHV) и лимфомой и между полиомавирусом клеток Меркеля (MCV) и карциномой клеток Меркеля (MCC) подчеркнуло возможность открытия еще большего количества онкогенных вирусов с помощью современных технологий. Далее каждый вирус будет рассмотрен отдельно.
Вирус Эпштейн-Барр
Вирус Эпштейн-Барр (ВЭБ, EBV) — ДНК-содержащий вирус, который преимущественно поражает B-лимфоциты, также является митогеном для них; вызывает лимфопролиферативные болезни (лимфома Беркитта, носоглоточная карцинома, NK-клеточная лейкемия, лимфома Ходжкина и т.д.), а также инфекционный мононуклеоз. Вирионы вируса были обнаружены при электронной микроскопии биоптата лимфомы Беркитта в начале 1964 года Энтони Эпштейном и Ивонной Барр.
Строение. ВЭБ имеет вирусный капсидный антиген (VCA), ядерные антигены-EBNAs 1, 2, 3, 3a, 3b, 3c; латентные мембранные протеины (LMPs) 1, 2 и две маленькие Эпштейна-Барр-кодируемые РНК (EBER) молекулы — EBER1 и EBER2. EBNAs и LMPs являются ДНК-связывающими белками, считающимися необходимыми для развития инфекции и фиксации.
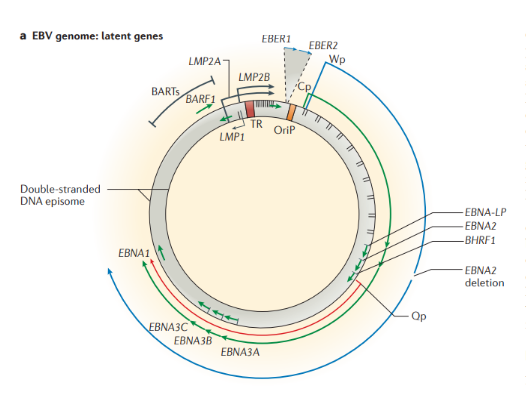
- необходим для трансформации В-лимфоцитов;
- функционирует как конститутивный активатор рецептора ФНО и имеет сходство с CD-40 рецептором;
- активирует сигнальные пути, которые делают вклад в онкогенный эффект.
В зависимости от набора экспрессируемых вирусных генов в пораженных клетках выделяют три типа латентности (I, II и III тип), характерные для различных видов лимфом: I тип подразумевает избирательную экспрессию EBNA-1 при ВЭБ-положительной лимфоме Беркитта; II тип заключается в экспрессии EBNA-1, LMP-1 и LMP-2 и является отличительным признаком ВЭБ-положительной ходжкинской лимфомы, периферических T/NK-клеточных лимфом; латентность III типа, характеризуемая экспрессией всего набора из девяти латентных белков ВЭБ, наблюдается при лимфопролиферативных поражениях, возникающих у пациентов с тяжелым иммунодефицитом (после трансплантации паренхиматозных органов или стволовых клеток, ВИЧ-инфекции). Тип латентности определяет восприимчивость инфицированных клеток к различным иммунотерапевтическим тактикам. Индуцированные ВЭБ злокачественные новообразования связаны с экспрессией латентных генов. У большинства иммунокомпетентных носителей ВЭБ вирус не индуцирует опухолевый процесс. Новообразования развиваются при комплексном взаимодействии ВЭБ, иммуногенетических факторов, факторов внешней среды (паразитарных инфекций — чаще, малярии, недоедании, потреблении пищи, содержащей канцерогены) и иммунодефицита (ВИЧ-инфекция, трансплантация).
Папилломавирусы человека
Описано около 200 папилломавирусов. Вирусы передаются при контактах через микротравмы кожи и слизистых оболочек, а также половым путем. Папилломавирусы человека вызывают доброкачественные кожные, генитальные, оральные и конъюнктивальные папилломы; индуцируют пролиферацию эпителия, обладают онкогенным потенциалом. С папилломавирусом, особенно ПВЧ-5 и ПВЧ-8, тесно связано развитие немеланомных разновидностей рака кожи. Различают низкоонкогенные папилломавирусы, вызывающие бородавки, которые не малигнизируются, и высокоонкогенные, способные вызвать рак шейки матки, — ПВЧ-16, 18, 31, 33, 35, 45, 51, 52, 58.
Строение. Капсид икосаэдрический, состоит из двух капсидных белков (L1-L2), формирующих 72 пентамера. Геном — двунитевая циркулярная ДНК; имеет в зависимости от вируса восемь ранних генов (E1-E8) и два поздних гена (L1-L2). Гены E6-E7 обладают онкогенной активностью.
Патогенез. В целом, для развития продуктивного поражения ВПЧ (высокого или низкого риска) требуется, чтобы вирус имел доступ к эпителию базального слоя как только эпителиальный барьер был подвержен риску. Папилломавирусы должны инфицировать делящуюся клетку, чтобы стать признанными как малое количество копий ядерной эписомы, и для развития стойкого поражения первичная инфицированная клетка, вероятно, должна быть похожа на долгоживующую эпителиальную стволовую клетку или похожую на нее. Кроме того, связанные с заживлением ран изменения в местном микроокружении, включая увеличение количества факторов роста, могут играть ключевую роль в создании резервуара инфекции в базальном слое. Способность ВПЧ инфицировать, и реплицироваться, и управлять прогрессированием рака зависит от функции вирусного белка, положении в эпителии, где эти белки экспрессируются. Как только инфицированные базальные клетки поделились и в конечном итоге вошли в парабазальный слой, они начинают проходить программу экспрессии генов, которая связана с дифференциацией. Амплификация вирусного генома обычно происходит в срединно-эпителиальных слоях, тогда как сбор и выход вируса происходит вблизи наружной поверхности эпителия.
Несмотря на то, что эффективная амплификация генома требует комбинированного действия множественных продуктов вирусного гена, включая E6, E7, E2 и кодированную вирусом геликазы E1, поддержание репликации в базальном слое эпителия может зависеть от факторов репликации клетки хозяина. Программа, зависящая от дифференциации, которая происходит в надбазальных слоях эпителиальной клетки, включает как временные изменения в активности промотора, так и изменения в шаблонах сплайсинга мРНК, которые облегчают производство различных продуктов вирусных генов на разных стадиях во время программы дифференциации. Функция вирусного белка далее регулируется посттрансляционной модификацией, включая фосфорилирование и протеолитическое деление клетки.
Герпесвирус, ассоциированный с саркомой Капоши
KSHV, или человеческий герпесвирус 8, был обнаружен в 1994 году как член семейства гамма-герпеса человека, присоединившись к ВЭБ. Инфекция иммунокомпрометированных индивидуумов с KSHV была связана с развитием саркомы Капоши, полученной из эндотелиальных клеток, и по меньшей мере двумя B-лимфоцит лимфопролиферативными заболеваниями: первичная выпотная лимфома и многоцентричная болезнь Кастлмана. Однако изучение патогенеза и онкогенеза KSHV затруднено отсутствием значимой модели животных и восприимчивой клеточной культуры.
Онкогенное действие. Две иммортализованные клеточные линии, KS Y-1 и SLK, когда-то использовались для исследований KS и KSHV, но в KS Y-1 были также обнаружены клетки линии рака мочевого пузыря T 24, что затруднило дальнейшую работу. Первичные эмбриональные метанефрические мезенхимальные клетки-предшественники почек крысы восприимчивы к инфекции и трансформации KSHV, но из них распространяются ограниченное количество инфекционных вирионов. Линии B-клеток, полученные из первичной выпотной лимфомы, обычно заражаются KSHV на латентной стадии и могут быть индуцированы для получения малого количества вирионов KSHV, но первичные B-лимфоциты из периферической крови или тонзиллярной ткани являются устойчивыми к инфекции KSHV, и для их инфицирования может потребоваться совместный рост с KSHV-позитивными клетками.
KSHV кодирует несколько важных белков, которые обладают некоторой онкогенной активностью для индуцирования пролиферации клеток, иммортализации, трансформации и передачи сигналов; производства цитокинов; иммунного контроля; антиапоптозной активности; и ангиогенеза. К ним относятся вирусные латентные белки, латентный ассоциированный ядерный антиген (LANA), vFLIP (FADD (Fas-ассоциированный белок с доменом смерти), подобный ферменту, ингибирующему синтез интерферона или ингибирующему белок каспазы 8 (FLICE)), vCyclin и вирусные литические белки G-белкового рецептора (vGPCR), интерферон-регуляторный фактор 1 (vIRF-1) и K1. Хотя истинную онкогенную природу каждого белка еще предстоит определить, накопление доказательств указывает на то, что каждый из них вносит свой вклад в онкогенез KSHV. Таким образом, полный спектр вызванной KSHV злокачественности может потребовать, чтобы несколько онкогенных продуктов работали вместе в присутствии клеток хозяев и экологических факторов. Например, как LANA, так и vIRF-1 нацелены на клеточный опухолевый супрессор p53. LANA также ингибирует pRB и PP2A.vCyclin, активатор CDK4 6,198, подавляет p27kip1, ингибитор CDK199 и вызывает реакцию на задержку старения G1, результаты от гиперактивации NF-κB. vFLIP и K1 активируют путь сигнала NF-κB для предотвращения апоптоза B-клеток. vGPCR и K1 влияют на сигнальные пути AKT и NF-κB и способствуют ангиопролиферативному и воспалительному поражению саркомой Капоши.
Т-лимфотропный вирус человека (HTLV)
T-лимфотропный вирус человека (HTLV) относится к семейству ретровирусов, является возбудителем T-клеточного лимфолейкоза взрослых. Вирус впервые был изолирован в 1980 году от больного Т-лимфомой.
Геном. Gag, Pol и Env являются вирусными структурными белками, другие — вирусными регуляторными/вспомогательными белками. За исключением гена hbz, который кодируется минус-цепью провирусного генома HTLV из 3'-LTR, все остальные гены кодируются плюсовой нитью по направлению 5'-LTR. Следует отметить, что 5'-LTR часто удаляется или метилируется по мере прогрессирования заболевания. Кроме того, на поздних стадиях лейкемиогенеза в гене tax часто возникают нонсенс- или миссенс-мутации. Хотя белок tax и ген HBZ индуцируют опухоли у трансгенных мышей, а p12 проявляет слабую онкогенную активность, ни один из вирусных белков/генов, кроме tax, не требуется для опосредованного HTLV-1 опухолеобразования. Продукт tax гена действует на терминальные повторы LTR, стимулируя синтез вирусной иРНК, а также образование рецепторов IL-2 на поверхности зараженной клетки.
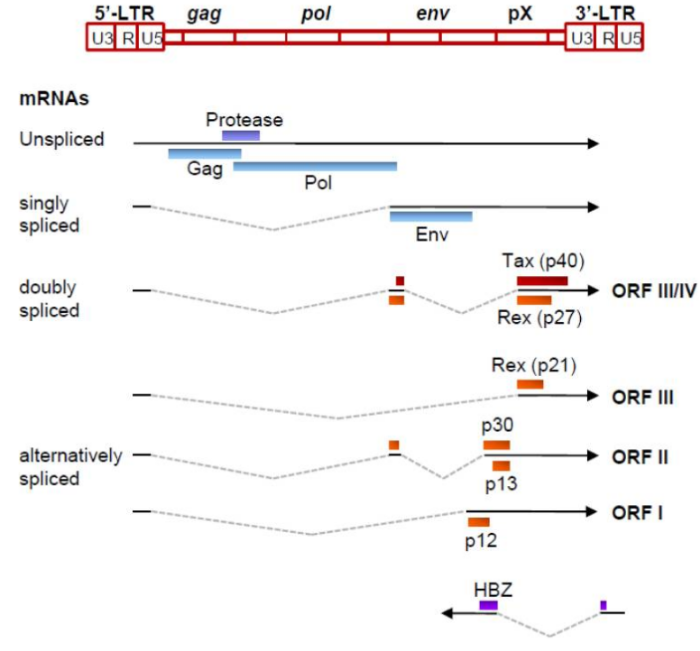
Рисунок 3. Gag, Pol и Env вирусные регуляторные/вспомогательные белки HTLV
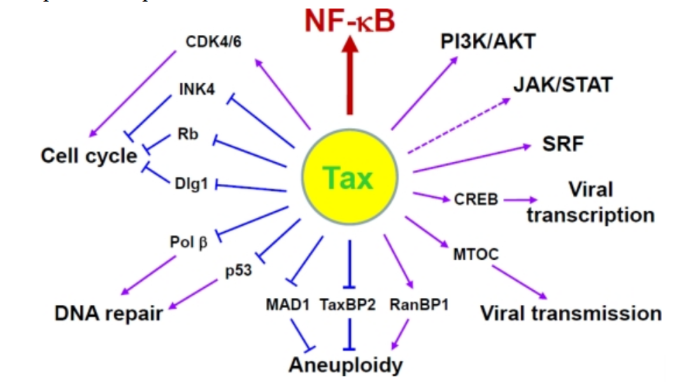
Рисунок 4. К леточные пути вирусного онкобелка tax
Патогенез. Проникновение HTLV-1 в клетку человека охарактеризовывает начало выживания и репликации вируса. HTLV-1 связывается с рецептором клеток, имеющих необходимый антиген, что инициирует процесс инвазии. Рецепторный комплекс состоит из транспортера глюкозы (GLUT1), гепаринсульфат протеогликана (HSPG) и рецептора VEGF-165 нейропилина-1 (NRP-1). HTLV-1 взаимодействует с HSPG. Процесс слияния происходит через комбинацию GLUT1 с HSPG/NRP-1, после чего ядро, содержащее вирусную РНК, доставляется в цитоплазму клеток-мишеней. После обратной транскрипции HTLV-1 встраивает свой геном в генома хозяина, чтобы сформировать провирус, окруженный двумя LTR на 5' и 3' концах. Затем провирус транскрибируется и кодирует структурные, регуляторные и вспомогательные белки. Впоследствии вирусные геномные РНК и Gag, Env и Gag-Pol белки переносятся в плазматическую мембрану, чтобы начать собираться в зрелую вирусную частицу.
Вирусы гепатита
Вирус гепатита В (HBV) и вирус гепатита С (HCV) представляют собой несвязанные вирусы, имеющие тропность к гепатоцитам и реплицирующиеся в них. Около 2 миллиардов человек инфицированы HBV, и более 350 миллионов человек становятся хроническими носителями. Только 5-10% взрослых, которые приобретают инфекцию, становятся хроническими носителями, у 30% развиваются прогрессирующие хронические заболевания печени: гепатит, фиброз, цирроз и, наконец, гепатоцеллюлярная карцинома (HCC).
Патогенез. HCC, индуцированная посредством HBV и HCV, развивается в области воспаления и регенерации, что является результатом хронического повреждения печени, а это в свою очередь указывает на то, что патогенез HCC иммунно-опосредован. Эти вирусы постоянно реплицируются в культуре клеток без явных повреждений и смерти клеток, подразумевая, что они являются не цитопатическими. Постоянная репликация вируса является фактором риска для образования HCC, потому что воспаление часто приводит к длительным хроническим заболеваниям печени CLD без выведения вируса. В этом контексте HBV и HCV генерируют белки, подавляющие иммунитет, который должен контролировать хронические инфекции. HBV- и HCV-кодированные белки изменяют экспрессию гена хозяина и клеточный фенотип, что является признаком рака. Эти изменения способствуют независимой от фактора роста пролиферации, сопротивлению к ингибированию роста, инвазии тканей и метастазированию, ангиогенезу, перепрограммированию энергетического метаболизма и устойчивости к апоптозу. Хроническое воспаление также способствует генетической нестабильности в клетках опухоли. Вклад HBV в развитие HCC включает в себя экспрессию гена гепатита Bx (HBx) и, возможно, усеченные пре-S или S-полипептиды карбоксимицина; основной белок и неструктурные (NS) белки NS3 и NS5A HCV способствуют онкогенной трансформации. Изменения в экспрессии гена хозяина, которые способствуют возникновению опухолевого генеза, также, похоже, поддерживают репликацию вируса и/или защиты вирусных гепатоцитов от иммунного опосредованного повреждения и разрушения.
Все многообразие взглядов на этиологию может быть сведено к четырем основным теориям:
Дисгормональный канцерогенез - дисбаланс тропных гормонов, особенно эстрогенов.
- 3. Дисонтогенетическая теория - создана Конгеймом (1839 - 1884). Опухоли возникают из эмбриональных клеточно-тканевых смещений и порочно развитых тканей при действии ряда провоцирующих факторов.
- 4. Полиэтиологическая теория подчеркивает значение разнообразных факторов (химических, физических, вирусных, паразитарных, дисгормональных и др.), комплекс которых приводит к глубокому нарушению обмена. Вероятно, опухолевая клетка возникает при воздействии разнообразных факторов в результате мутации - внезапной трансформации генома, приводящей к появлению клона опухолевых клеток.
- 2. Строение опухоли, свойства опухолевой клетки
Внешний вид опухоли разнообразен. Может иметь форму узла, шляпки гриба, цветной капусты. Поверхность может быть гладкой, шероховатой, бугристой, сосочковой. Опухоль может быть расположена в толще органа, на его поверхности, диффузно пронизывать весь орган. Опухоль, расположенная на поверхности органа или слизистой (полип), бывает связана с ними ножкой. Опухоль может аррозировать сосуды, вызывая внутреннее кровотечение, часто изъязвляется. На разрезе - бело-серая или серо-розовая пестрая ткань, в связи с наличием в ней кровоизлияний, очагов некроза.
Размеры опухоли различны, консистенция твердая (больше стромы) или мягкая (больше паренхимы).
Вторичные изменения - воспаление, некроз, ослизнение, отложение извести.
Макроскопическое строение. Опухолей отличается большим разнообразием, но имеются общие черты. Состоят из паренхимы и стромы, соотношения которых могут сильно варьировать. В одних преобладает паренхима, в других - строма, в третьих - равномерное распределение.
Паренхиму образуют клетки, которые характеризуют данный вид опухоли, ими определяется морфологическая ее специфика. Строма опухоли образована соединительной тканью органа, в котором она развилась. Она содержит сосуды и нервные волокна.
Большинство опухолей по строению напоминают орган - органоидные опухоли. В некоторых, особенно недифференцированных опухолях, строма развита слабо и состоит лишь из тонкостенных сосудов и капилляров - гистоидные опухоли. Они быстро растут и рано подвергаются некрозу.
Опухоль, строение которой соответствует органу (ткани) в котором она развивается, называется гомологичной, если же строение опухоли отличается, то она гетерологична. Гомологичные опухоли - зрелые, дифференцированные, гетерологичные незрелые, малодифференцированны.
Опухоли, возникающие в результате эмбриональных смещений называются гетеротопическими.
Тканевый - нарушение тканевых взаимоотношений, свойственных данному органу - нарушение органотипической и гистотипической дифференцировки - нарушение формы и величины эпителиальных структур, соотношения паренхимы и стромы, различная толщина волокнистых структур, хаотичное их расположение. Тканевый атипизм характерен для зрелых, доброкачественных опухолей.
Клеточный атипизм - это нарушения цитотипической дифференцировки. Выражается в полиморфизме, или, наоборот, мономорфизме клеток, ядер и ядрышек, в гиперфхромии ядер, полиплоидии, изменениях ядерно-цитоплазматического индекса в пользу ядер в связи с их укрупнением, появлении множества митозов. Иногда атипизм так значителен, что клетки опухоли совершенно не похожи на клетки исходной ткани. Когда морфологическая катаплазия достигает крайней степени, строение опухоли упрощается и она становится монотонной по клеточному составу. По этому анапластические опухоли различных органов очень похожи друг на друга. Важным проявлением атипизма является патология митоза. Она подтверждает то, что канцерогенные факторы воздействуют на генетический аппарат клетки, что и определяет нерегулируемый рост.
Клеточный атипизм характерен для незрелых, злокачественных опухолей.
Атипизм ультраструктур выражается в увеличении числа рибосом, связанных не только с мембранами ЭПС, но и лежащих свободно. Изменяется их форма, расположение и величина, появляются аномалии. Функциональная гетерогенность митохондрий в значительной степени нивелируется за счет митохондрий с низкой или отрицательной активностью цитохромоксидазы. Цитоплазма скудная, но ядро крупное с диффузным или маргинальным расположением хроматина. Появляются многочисленные мембранные контакты ядра, митохондрий и ЭПС, которые в норме редки. Появляются клетки-гибриды. Атипизм ультраструктур встречается в недифференцированных клетках, среди которых могут быть как стволовые клетки, так и клетки-предшественники.
Специфическая дифференцировка опухолевых клеток может быть выражена в различной степени - высокой, умеренной и низкой.
Группа дифференцированных опухолевых клеток неоднородна и по степени выраженности специфических ультраструктурных признаков - признаков дифференцировки: одни клетки опухоли ничем не отличаются от нормальных элементов того же типа, другие -- имеют лишь некоторые специфические признаки, позволяющие говорить о принадлежности опухолевой клетки к определенному типу.
Установление степени дифференцировки опухолевой клетки при электронно-микроскопическом исследовании имеет важное значение для дифференциальной диагностики опухолей. Ультраструктурный анализ опухолевых клеток свидетельствует о том, что в незрелой опухоли с высокой степенью злокачественности преобладают недифференцированные клетки типа стволовых и клеток-предшественников. Увеличение в опухоли содержания дифференцированных клеток, как и степени их дифференцировки, свидетельствует о нарастании зрелости опухоли и снижении степени ее злокачественности.
В практическом отношении важен вопрос о том, существуют ли какие-либо специфические морфологические особенности опухолевой клетки. Результаты многочисленных исследований показали, что ряд описанных выше признаков опухолевой клетки может наблюдаться при воспалении, регенерации тканей, заживлении ран, поэтому иногда трудно провести дифференциальный морфологический диагноз между опухолью, регенерацией и воспалением. Известный американский цитолог Каудри утверждает. что раковая клетка не обладает какими-либо специфическими признаками. Хотя морфологическая диагностика опухоли по одной взятой клетке и трудна, но все же возможна. Наиболее достоверна цитологическая диагностика опухоли при исследовании комплекса ее клеток, когда учитываются размеры клеток. степень морфологической анаплазии, расположение клеток по отношению друг к другу. Диагноз опухоли ставится по совокупности морфологических признаков, при этом методы цитологического и гистологическою исследований должны дополнять друг друга.
Биохимический атипизм опухолевой ткани выражается рядом особенностей обмена, отличающих их от нормальных. Выяснено, что спектр биохимических характеристик каждой из опухолей неповторим и включаем разные комбинации отклонений от нормы. Такая вариабельность злокачественной опухоли является закономерной.
Ткань опухоли богата холестерином, гликогеном и нуклеиновыми кислотами. В опухолевой ткани гликолитические процессы преобладают над окислительными, содержится мало аэробных ферментных систем, т.е. цитохромоксидазы, каталазы. Выраженный гликолиз сопровождается накоплением в тканях молочной кислоты. Это своеобразие обмена опухоли усиливает ее сходство с эмбриональной тканью, в которой также преобладают явления анаэробного гликолиза.
Гистохимическое исследование имеет большое значение не только для диагностики опухоли, но и для изучения ее гистогенеза.
Антигенный атипизм опухоли проявляется в том, что она содержит ряд свойственных только ей антигенов. Среди опухолевых антигенов различают:
- 1. антигены вирусных опухолей;
- 2. антигены опухолей, вызванных канцерогенами;
- 3. изоантигены трансплантационного типа;
- 4. эмбриональные антигены;
- 5. гетероорганные антигены.
В недифференцированных злокачественных опухолях происходит антигенное упрощение, которое, как и появление эмбриональных антигенов, является отражением катаплазии опухолевой клетки.
Выявление типичных и атипичных антигенов в опухоли с помощью иммуногистохимических методов служит дифференциальной диагностике и установлению гистогенеза опухоли.
Функциональные свойства опухолевой клетки, отражающие тканевую и органную специфику, зависят от степени морфологической и биохимической катаплазии. Более дифференцированные опухоли сохраняют функциональные особенности клеток исходной ткани. Например, опухоли, исходящие из клеток островков поджелудочной железы, выделяют инсулин; опухоли надпочечников, передней доли гипофиза выделяют большое количество соответствующих гормонов и дают характерные клинические симптомы, позволяющие высказывать предположение об опухолевом поражении эндокринных желез. Удаление опухолей ликвидирует эти симптомы. Опухоли из печеночных клеток выделяют билирубин и бывают нередко окрашены и зеленый цвет. Клетки раковой опухоли превратника желудка выделяют слизь, раковые клетки кожи образуют роговое вещество и т.д.
Малодифференцированные и недифференцированные клетки опухоли могут потерять способность выполнять функцию исходной ткани. В то же время слизеобразные иногда сохраняется в резко анаплазированных раковых клетках, например, желудка.
Читайте также:


