Электронная микроскопия в диагностике вирусных болезней
Методы лабораторной диагностики вирусных инфекций подразделяются на несколько больших групп.
- Прямые методы, состоящие в выявлении непосредственно в биологическом материале самого вируса или антител к нему.
- Непрямые методы-заключаются в искусственной наработке вируса в значительных количествах, и его дальнейшем анализе.
К наиболее актуальным в повседневной практике методам диагностики относятся:
Серологические методы диагностики - выявление в сыворотке крови пациента определенных антител или антигенов в результате реакции антиген-антитело(АГ-АТ). То есть, при поиске у пациента определенного антигена используется соответствующее искусственно синтезированное антитело, и, соответственно, наоборот-при выявлении антител используют синтезированные антигены.
Реакция иммунофлуоресценции (РИФ)

Основана на использовании меченых красителями антител. При наличии вирусного антигена он связывается с мечеными антителами, и под микроскопом наблюдается специфическая окраска, которая говорит о положительном результате. При этом методе, к сожалению, невозможна количественная интерпретация результата, а только лишь качественная.
Возможность количественного определения дает иммуноферментный анализ(ИФА). Он похож на РИФ, однако в качестве маркеров используют не красители, а ферменты, превращающие бесцветные субстраты в окрашенные продукты, что и дает возможность количественной оценки содержания как антигенов, так и антител.

- Отмывают не связавшиеся антитела и антигены.
- Добавляют бесцветный субстрат, и в лунках с антигеном, который мы определяем, произойдет окрашивание, т.к. там будет связанный с антигеном фермент, после чего на специальном приборе оценивают интенсивность свечения окрашенного продукта.
По похожей схеме происходит и выявление антител.

Реакция непрямой(пассивной) гемаглютинации (РПГА).
Метод основан на способности вирусов связывать эритроциты. В норме эритроциты падают на дно планшета, образуя так называемую пуговку. Однако если в исследуемом биологическом материале находится вирус, он свяжет эритроциты в так называемый зонтик, который не упадет на дно лунки.


Теперь остановимся на методах диагностики непосредственно нуклеиновых кислот исследуемых вирусов, и прежде всего о ПЦР ( Полимеразная Цепная Реакция) .
Суть этого метода заключается в обнаружении специфического фрагмента ДНК или РНК вируса путём его многократного копирования в искусственных условиях. ПЦР можно проводить только с ДНК, то есть для РНК-вирусов предварительно необходимо произвести реакцию обратной транскрипции.
Непосредственно ПЦР проводят в специальном приборе, под названием амплификатор, или термоциклер, который поддерживает необходимый температурный режим. ПЦР-смесь состоит из добавленной ДНК, которая содержит интересующий нас фрагмент, праймеров (короткий фрагмент нуклеиновой кислоты, комплиментарный ДНК-мишени, служит затравкой для синтеза комплиментарной цепи), ДНК-полимеразы и нуклеотидов.
Стадии цикла ПЦР:
- Деннатурация-первая стадия. Температура повышается до 95 градусов, цепочки ДНК расходятся друг относительно друга.
- Отжиг праймеров. Температуру понижают до 50-60 градусов. Праймеры находят комплиментарный участок цепи и связываются с ним.
- Синтез. Температуру вновь повышают до 72, это рабочая температура для ДНК-полимеразы, которая, отталкиваясь от праймеров, строит дочерние цепи.

Цикл многократно повторяется. Через 40 циклов из одной молекулы ДНК получается 10*12 степени копий копий искомого фрагмента.

При проведении ПЦР в режиме реального времени синтезируемые копии фрагмента ДНК метятся красителем. Прибор регистрирует интенсивность свечения и по ходу реакции строит графики накопления искомого фрагмента.
Современные методы лабораторной диагностики с высокой достоверностью позволяют выявить присутствие вируса - возбудителя в организме, нередко, задолго до появления первых симптомов заболевания.
В основе диагностики вирусного заболевания лежат в первую очередь внешние симптомы. Но диагноз заболевания только по внешним признакам не всегда точен. Внешними признаками при определении вирусного заболевания можно ограничиться в тех случаях, когда они очень четки и характерны только для данного вида заболевания.
В практике очень часто приходится сталкиваться с такими явлениями, когда одни и те же или очень сходные признаки поражения вызываются совершенно различными причинами (явление фитопатологической конвергенции). Пример такой конвергенции -- хлороз плодовых деревьев или ягодных культур.
Поэтому при определении заболевания наряду с внешним осмотром необходимы дополнительные методы, уточняющие (или опровергающие) предварительный диагноз.
Применяют следующие методы диагностики вирусных заболеваний и вызывающих их вирусов:
1) установление инфекционности заболевания;
2) серологический метод;
3) метод растений-индикаторов;
4) электронная микроскопия;
5) метод внутриклеточных включений;
6) метод люминесцентного анализа;
7) анатомический метод;
8) химический метод.
Основными из них являются первые четыре метода.
Для всех вирусов, которые удается передать соком на травянистые индикаторы, очень важными показателями при диагностике вирусов являются определение таких физических свойств вируса, как температура инактивации вируса (предельно высокая температура, при которой вирус инактивируется in vitro в течение 10 мин); границы разведения (степень предельного разведения сока больного растения, при которой еще сохраняется его инфекционность); длительность сохранения инфекционности сока при 20 °С.
Так, для огуречного вируса 2 (Cucumis virus 2) температура инактивации 90 °С, предельное разведение сока 1: 1 000 000, длительность сохранения инфекционности сока при комнатной температуре более года, а для огуречного вируса 1 (Cucumis virus 1) температура инактивации 60--73 °С, граница разведения сока 1: 1000, длительность сохранения инфекционности сока 3--6 дней.
Электронно-микроскопическая диагностика применяется главным образом в научно-исследовательской работе. В последние годы этот метод используется для проверки зараженности растений, полученных из верхушечной меристемы с целью оздоровления сорта от вирусных инфекций.
Принцип метода заключается в том, что капельку очищенного от грубых примесей сока или экстракта из тканей исследуемого растения помещают на объектоноситель -- сетку с пленкой и высушивают. Вирусные частицы вместе с другими коллоидными компонентами сока остаются на пленке, однако они прозрачны для электронного луча и, для того чтобы их увидеть на экране электронного микроскопа, препарат необходимо контрастировать, то есть обработать веществами с высокой электронной плотностью. Применявшийся ранее метод контрастирования препаратов путем напыления в вакууме инертных металлов (золота, платины, иридия) сейчас почти полностью заменен негативным контрастированием -- обработкой растворами фосфорно-вольфрамовой кислоты, четырехокиси осмия или уранилицетата натрия. При этом способе повышается электронная плотность объекта вокруг частиц, которые остаются прозрачными и хорошо видны на экране. Иногда бывают, различимы детали строения вирионов -- расположение белковых субъединиц и внутренний канал (у палочковидных и нитевидных частиц). С помощью электронной микроскопии можно определить относительную концентрацию вирусных частиц в соке или препарате, а также вид вируса. Вирусные частицы различаются по форме, размерам (длине и диаметру), шагу спирали (у частиц с осевой симметрией), жесткости.
Форма и размеры частиц далеко не всегда могут обеспечить точное определение вида вируса, особенно при смешанной инфекции. Поэтому электронно-микроскопическую диагностику обычно сочетают с другими методами (серологическим и индикаторным).
Преимущество электронной микроскопии, как метода диагностики, состоит в том, что для анализа достаточно очень небольшого количества ткани или сока, чувствительность его приближается к индикаторному методу; недостатки -- сложность и высокая стоимость оборудования, необходимость высококвалифицированного технического обслуживания, вероятность ошибок в диагностике из-за неравномерного распределения вирусных частиц в тканях и наличия свободных от них участков тканей. Не обнаруживается этим методом вирус в форме нуклеиновой кислоты (лишенной белковой оболочки).
Инфекционные болезни — это заболевания, вызванные проникновением в организм бактерий, грибков или вирусов. Самая важная часть диагностики инфекций — это определение возбудителя и его концентрации. Для этих целей используются разнообразные лабораторные методы, которые позволяют выяснить, чем именно и как давно атакован организм, а в некоторых случаях — спрогнозировать эффективность лечения тем или иным препаратом.
Особенности диагностики инфекционных заболеваний
В клинической практике данный тип заболеваний встречается очень часто. Именно они, по данным Всемирной организации здравоохранения, становятся причиной 26% всех смертей. В список самых распространенных инфекционных заболеваний входят инфекционная пневмония и другие воспалительные заболевания дыхательных путей, гепатит, ВИЧ, туберкулез, малярия, воспаления органов половой системы и мочевыводящих путей, гистоплазмоз, ротавирусные инфекционные заболевания, ветряная оспа, герпес, вирус папилломы человека и еще несколько десятков болезней. Хотя бы раз в жизни каждый из нас сталкивается с инфекционными заболеваниями и необходимостью быстрой постановки диагноза.
Все инфекционные болезни делятся на пять типов — прионные, вирусные, бактериальные, протозойные и грибковые поражения. Далее будут рассмотрены последние четыре типа как наиболее распространенные. Разные возбудители иногда могут вызывать одно и то же заболевание. В частности, пневмония может быть результатом как вирусной, так и бактериальной инфекции. Лечение зависит не от проявлений, а от возбудителя болезни. Противовирусные препараты бесполезны в борьбе с бактериями и грибками, антибиотики не действуют на вирусы. Поэтому основная задача лабораторной диагностики инфекционных заболеваний — выявление типа возбудителя.
Способы лабораторной диагностики инфекционных болезней можно разделить на два типа: неспецифические и специфические методы.
К неспецифическим относятся общий анализ крови и исследование соотношения ее белковых фракций, печеночные пробы, общий анализ мочи и кала. Эти методы не дают информации о виде возбудителя, но позволяют узнать, в какой мере болезнь затронула органы и системы организма, что именно в их работе нарушено и насколько далеко зашел процесс.
Специфические — вирусологический и бактериологический методы, микроскопическое исследование возбудителей, анализы на антигены и антитела — направлены непосредственно на обнаружение возбудителя.
Современная медицина располагает множеством методов выделения возбудителей бактериальной инфекции:
Бактериоскопический . Исследуется окрашенный специальным образом мазок.
Бактериологический . Биоматериал высеивается в питательную среду, и через некоторое время специалист исследует колонию бактерий, выросшую в ней.
Биологический . Направлен на определение патогенности микроорганизмов.
Серологический . Выявляет антитела и антигены в сыворотке крови — особые вещества, которые вырабатываются организмом при контакте с возбудителем определенной болезни.
Чаще всего для исследований используют кровь или сыворотку крови, реже — слюну, мочу, кал, клетки эпителия (мазок и соскоб) и другой биоматериал.
В лабораторной диагностике вирусных заболеваний используются:
Вирусологическое исследование . Световая и электронная микроскопия дает возможность выявить наличие вирусных включений и сами вирусы и идентифицировать их.
Серологическое исследование для обнаружения антител и антигенов. Этот метод дает возможность быстро выявить агрессора, как и в случае с бактериальными инфекциями. Для диагностики используются разнообразные способы исследования материала — реакции гемадсорбции, гемагглютинации или метод непрямой иммунофлюоресценции. Имунноблоттинг, в частности, позволяет выявлять антитела сразу к нескольким инфекциям и считается современным и точным диагностическим методом.
Молекулярно-генетические методы . Последнее слово в лабораторной диагностике. Позволяют обнаружить вирус даже тогда, когда его концентрация ничтожно мала — то есть на самых ранних стадиях. Самым известным из этих методов является ПЦР, при которой фрагмент вируса многократно копируется до тех пор, пока специалист не получит достаточно материала для определения типа вируса и его изначальной концентрации.
Для выявления вирусов обычно требуется сделать анализ крови.
Так называют инфекции, вызванные простейшими паразитами, например, амебами. Малярия, амёбиаз, токсоплазмоз, лямблиоз, трихомониаз, сонная болезнь — вот неполный список самых распространенных протозойных инфекций. Лабораторная диагностика таких заболеваний включает в себя следующие методы:
Микроскопический . Простейшие паразиты выявляются путем исследования под микроскопом окрашенных образцов биоматериала. Самый простой и надежный метод для многих возбудителей.
Культуральный . Посев биоматериала в питательную следу для дальнейшего исследования размножившихся простейших. У этого метода есть существенный недостаток: результатов нужно ждать долго, сам процесс может занять не менее 5-6-ти дней.
Серологический . Используют редко ввиду малой информативности.
Аллергический . Также не является распространенным. Кожные аллергопробы делают для того, чтобы подтвердить лейшманиоз и токсоплазмоз. Это вспомогательный диагностический метод.
В качестве биоматериала для исследований в основном используется кровь, иногда — – кал или моча.
Микроскопическое исследование . Препарат окрашивается и рассматривается под мощным микроскопом. Посредством иммунофлюоресцентной микроскопии исследуется проба, помеченная флюоресцеинами — специальным красителем. Наиболее быстрый способ выявления грибка по сравнению с другими методами.
Культуральный . Происходит посев пробы на питательную среду и дальнейшее исследование полученной в результате колонии грибков.
Серологический . Используется для выявления грибковых поражений, однако для микозов он считается не особенно точным.
Гибридизация нуклеиновых кислот . Самый современный способ выявления грибковых инфекций, его применяют для идентификации основных возбудителей системных микозов. Из культуры извлекается РНК и вносится особым способом помеченная молекула ДНК. Если в пробе наличествует один из основных патогенных грибков, ДНК объединится с его РНК, создав легко различимую структуру. Несомненным преимуществом метода является возможность определить инфекцию на самых ранних стадиях.
Биоматериалом для исследований являются клетки кожи, волос и ногтей, клетки слизистых оболочек (мазок или соскоб), мокрота, моча, секрет простаты, сперма, грудное молоко.
Современные методики диагностики инфекций позволяет выявить их на начальном этапе, Чем раньше болезнь будет обнаружена, тем проще ее вылечить. Поэтому сдавать анализы на инфекции желательно регулярно, даже если вы ни на что не жалуетесь и не замечаете никаких перемен в самочувствии.

Перед сдачей биоматериала для исследований иногда требуется определенная подготовка. Так, кровь обычно сдают с утра, натощак, а перед забором мазка не рекомендуется принимать душ. Эти требования очень важны: они обеспечивают точность результата, поэтому узнайте у врача заранее о подготовительных мерах и точно следуйте всем его рекомендациям.
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ
Студент должен знать:
-морфологию, экологию, физиологию вирусов, методы их изучения;
-основы эпидемиологии вирусных инфекций (типы инфекций);
-основы химиотерапии и химиопрофилактики вирусной инфекции;
-факторы иммунитета при вирусных инфекциях.
Студент должен уметь:
-проводить профилактику вирусных инфекций;
-составлять алгоритмы действия в условиях эпидемии.
Вопросы для фронтального обсуждения:
1.Дайте понятие вирусам. Охарактеризуйте особенности строения и жизни вирусной частицы.
2.Какими факторами осуществляется защита организма человека от вируса.
3.Назовите группу и механизм действия препаратов на вирусы. Приведите примеры препаратов.
4.Назовите типы инфекции, вызываемые вирусами.
5. Назовите представителей кишечных, кровяных, респираторных вирусных инфекций, инфекций кожных покровов и слизистых.
7.Назовите, как называются мероприятия, ликвидирующие эпидемический процесс.
Самостоятельная работа студентов:
Запишите определения методов исследования вирусных инфекций.
Зарисйте в атлас внутриклеточные включения при натуральной оспе (тельца Гварниери), при бешенстве (тельца Бабеша-Негри).
3.Составьте план противоэпидемических мероприятий на вирусную инфекцию (инфекцию определяет преподаватель).
Краткие теоретические положения
Введение
Расширение возможностей в лечении и профилактике вирусных болезней с использованием противовирусных препаратов, иммуномодуляторов и вакцин с различным механизмом действия нуждается в быстрой и точной лабораторной диагностике. Узкая специфичность некоторых противовирусных препаратов также требует быстрой и высокоспецифичной диагностики инфицирующего агента. Появилась необходимость в количественных методах определения вирусов для мониторинга противовирусной терапии. Помимо установления этиологии заболевания лабораторная диагностика имеет важное значение в организации противоэпидемических мероприятий.
Ранняя диагностика первых случаев эпидемических инфекций позволяет своевременно провести противоэпидемические мероприятия – карантин, госпитализацию, вакцинацию и пр. Реализация программ по ликвидации инфекционных заболеваний, например натуральной оспы, показала, что по мере их выполнения возрастает роль лабораторной диагностики. Существенную роль играет лабораторная диагностика в службе крови и акушерской практике, например, выявление доноров, инфицированных вирусом иммунодефицита человека (ВИЧ), вирусом гепатита В (HBV), диагностика краснухи и цитомегаловирусной инфекции у беременных.
Методы диагностики вирусных инфекций
Для успешного выделения вирусов клинический материал должен быть взят в соответствии с патогенезом предполагаемого заболевания и в наиболее ранние сроки.
Как правило, берутся:
– при респираторных инфекциях – носоглоточный смыв;
– при энтеровирусных инфекциях – смыв и фекалии (рео-, энтеровирусы);
– при поражениях кожи и слизистых оболочек – соскобы, содержимое пузырьков (герпес, ветряная оспа);
– при экзантемных инфекциях – смывы (корь, краснуха);
– при арбовирусных инфекциях – кровь, спинномозговая жидкость.
1.Быстрые (экспресс-методы) — прямое обнаружение вируса или его компонентов (антигенов, НК), включений непосредственно в клиническом материале.
А. Вирусоскопический метод заключается в обнаружении вируса в исследуемом материале под микроскопом. Чаще всего используют электронный микроскоп. Световая микроскопия из-за ничтожно малых размеров вирусов практически не применяется. При данном методе можно определить тип НК, размеры вириона, форму вириона, а также выявить внутриклеточные включения, которые образуются в пораженных клетках при некоторых инфекциях.


II. Вирусологический метод основан на:
культивировании вирусов в чувствительных биологических системах (клеточных культурах, курином эмбрионе, организмах лабораторных животных),их индикации по цитопатогенному действию на биологическую систему (рис.1), идентификации по ингибиции действия вирусов соответствующими противовирусными антителами (рис.2).

Рис. 1. Цитопатическое действие вирусов на клетку: А-нормальный рост, Б-ЦПД вирусов на клетку

Рис.2 Ингибиция вируса антителами
Вирусологическое исследование - это "золотой стандарт" вирусологии и должно проводится в специализированной вирусологической лаборатории. В настоящее время оно используется практически только в условиях возникновения эпидемической вспышки того или иного вирусного инфекционного заболевания.
III. Серологический метод — определение противовирусных антител (оптимально — IgM) и/или определение динамики нарастания их титров за определенный период заболевания в парных сыворотках. Диагностически значимым считают нарастание титра антител в 4 и более раз.
Метод парных сывороток:осуществляем сбор венозной крови в количестве 10 мл в начале болезни и в конце, приготавливаем сыворотку, определяем количество антител в первой и второй сыворотке.
При этом четырехкратное нарастание титра антител во второй сыворотке в большинстве случаев служит показателем протекающей или свежеперенесенной инфекции. При исследовании одной сыворотки, взятой в острой стадии болезни, диагностическое значение имеет обнаружение антител класса Ig М, свидетельствующее об острой инфекции.
Современные методы диагностики:
1.ПЦР-выявляют персистирующие вирусы по НК, находящиеся в клиническом материале, с трудом обнаруживаемые или не обнаруживаемые другими методами.
2.Радиоизотопный иммунный анализ (РИА)-метод основан на метке антител радиоизотопами, что обеспечивало высокую чувствительность в определении вирусного антигена. Широкое распространение метод получил в 80-е годы, особенно для определения маркеров HBV и других некультивируемых вирусов. К недостаткам метода относится необходимость работать с радиоактивными веществами и использования дорогостоящего оборудования (гамма-счетчиков).
3.Иммуноферментный анализ (ИФА) – Иммуноферментные методы определения вирусных антигенов в принципе сходны с РИФ, но основываются на мечении антител ферментами, а не красителями. Наиболее широко используется пероксидаза хрена и щелочная фосфатаза, применяют также b-галактозидазу и b-лактамазы. Меченые антитела связываются с антигеном, и такой комплекс обнаруживается при добавлении субстрата для фермента, с которым конъюгированы антитела. Конечный продукт реакции может быть в виде нерастворимого осадка, и тогда учет проводится с помощью обычного светового микроскопа, или в виде растворимого продукта, который обычно окрашен (или может флюоресцировать или люминесцировать) и регистрируется инструментально.
Поскольку с помощью ИФА можно измерять растворимые антигены, то не требуется наличия интактных клеток в образце и таким образом могут использоваться различные виды клинического материала.
Другое важное преимущество метода ИФА – возможность количественного определения антигенов, что позволяет применять его для оценки клинического течения болезни и эффективности химиотерапии. ИФА, как и РИФ, может применяться как в прямом, так и в непрямом варианте.
Твердофазный ИФА, дающий растворимый окрашеный продукт реакции, нашел наибольшее распространение. ИФА может быть использован как для определения антигена (тогда на твердую фазу – дно лунки полистиролового планшета – наносятся антитела), так и для определения антител (тогда на твердую фазу наносятся антигены).
4.Реакция иммунофлюоресценции (РИФ) – Метод основан на использовании антител, связанных с красителем, например флюоресцеинизотиоцианатом. РИФ широко применяется для выявления вирусных антигенов в материале больных и для быстрой диагностики.
В практике применяются два варианта РИФ: прямой и непрямой. В первом случае применяются меченные красителем антитела к вирусам, которые наносятся на инфицированные клетки (мазок, культура клеток). Таким образом, реакция протекает одноэтапно. Неудобством метода является необходимость иметь большой набор конъюгированных специфических сывороток ко многим вирусам.
При непрямом варианте РИФ на исследуемый материал наносится специфическая сыворотка, антитела которой связываются с вирусным антигеном, находящимся в материале, а затем наслаивается антивидовая сыворотка к гамма-глобулинам животного, в котором готовилась специфическая иммунная сыворотка, например антикроличья, антилошадиная и т. п. Преимущество непрямого варианта РИФ состоит в потребности лишь одного вида меченых антител.
Метод РИФ широко применяется для быстрой расшифровки этиологии острых респираторных вирусных инфекций при анализе мазков-отпечатков со слизистой оболочки верхних дыхательных путей. Успешное применение РИФ для прямой детекции вируса в клиническом материале возможно лишь в случае содержания в нем достаточно большого числа инфицированных клеток и незначительной контаминации микроорганизмами, которые могут давать неспецифическое свечение.
5.Другие методы диагностики –
РТГА используется для диагностики заболеваний, вызванных гемагглютинирующими вирусами. Она основана на связывании антителами сыворотки больного добавленного стандартного вируса. Индикатором реакции являются эритроциты, агглютинирующиеся вирусом (формирование характерного "зонтика") при отсутствии специфических антител и оседающие на дно неагглютинированными при их наличии.
РСК является одной из традиционных серологических реакций и используется для диагностики многих вирусных инфекций. В реакции принимают участие две системы: антитела сыворотки больного + стандартный вирус и эритроциты барана + антитела к ним, а также оттитрованный комплемент. При соответствии антител и вируса этот комплекс связывает комплемент и лизиса бараньих эритроцитов не происходит (положительная реакция). При отрицательной РСК комплемент способствует лизису эритроцитов. Недостатком метода является его недостаточно высокая чувствительность и трудность стандартизации реагентов.
Для учета значимости РСК также, как и РТГА, необходимо титрование парных сывороток, то есть взятых в начале заболевания и в период реконвалесценции.
РПГА – агглютинация сенсибилизированных вирусными антигенами эритроцитов (или полистироловых шариков) в присутствии антител. На эритроцитах могут быть сорбированы любые вирусы, независимо от наличия или отсутствия у них гемагглютинирующей активности. В связи с наличием неспецифических реакций сыворотки исследуются в разведении 1:10 и более.
РНГА – агглютинация эритроцитов, сенсибилизированных специфическими антителами в присутствии вирусных антигенов. Наибольшее распространение РОПГА получила при выявлении HBs-антигена как у больных, так и у доноров крови.
Относящийся к данному классу атомно-силовой микроскоп оказался инструментом, подходящим для исследования биологических объектов и позволил не только визуализировать наноразмерные структуры, но и манипулировать ими. В частности, принципиально возможной оказалась манипуляция одиночными вирионами и прямое измерение сил, возникающих при их контакте с поверхностью клетки. Такие эксперименты позволяют получать подробные данные о самом первом и во многих случаях еще недостаточно исследованном этапе заражения клетки – адгезии вируса к ее поверхности. Данные исследования представляют и значительный практический интерес, т.к. могут дать ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
Вирусы являются чрезвычайно малыми объектами – их размеры лежат в диапазоне от нескольких десятков до нескольких сотен нанометров. Первым и на долгое время единственным методом прямой визуализации наноразмерных частиц стала электронная микроскопия (ЭМ), которая начала развиваться в 1930-е гг. Метод, оказавшийся очень информативным, позволил не только детально охарактеризовать структуру различных вирусов, но и исследовать процессы, происходящие в зараженной клетке.
Оказалось, что форма вирусных частиц отличается большим разнообразием: от правильных сфер до сложных структур, напоминающих кирпичи, обклеенные трубочками (вирус натуральной оспы), или щетинистых червей (вирус геморрагической лихорадки Эбола).
Вне клетки любой вирус является всего лишь молекулярным контейнером с генетическим материалом (ДНК или РНК) и вряд ли может считаться полноценным живым организмом, хотя по этому вопросу в научной среде до сих пор нет окончательной терминологической определенности.
Так, исследование репликации вируса методом просвечивающей электронной микроскопии на ультратонких срезах выглядит следующим образом: зараженные клетки обрабатывают фиксирующим раствором, обезвоживают спиртом и заливают специальной смолой. После отвердевания смолы с помощью специального прибора – ультратома – делают ультратонкие (≈ 50 нм) срезы, которые затем наносят на специальную сетку и обрабатывают растворами солей тяжелых металлов. Во время самого микроскопического исследования образец находится в вакуумной камере и подвергается действию пучка электронов с энергией в несколько десятков кэВ. Очевидно, что прижизненная визуализация в данном случае принципиально невозможна.
В течение почти полувека электронная микроскопия оставалась единственным методом визуализации наноразмерных объектов. Однако в начале 1980-х гг. эта монополия была нарушена появлением сканирующей зондовой микроскопии (СЗМ). Основным принципом СЗМ является сканирование – прецизионное (с высокой точностью) перемещение зонда вблизи исследуемой поверхности, сопряженное с отслеживанием определенного параметра, характеризующего взаимодействие между зондом и образцом. Результатом такого сканирования является топографическая карта рельефа поверхности образца.
Первым прибором СЗМ стал сканирующий туннельный микроскоп (СТМ), который мог лишь весьма ограниченно использоваться для визуализации биологических объектов, так как для его работы требовалась высокая электрическая проводимость исследуемой поверхности.
В 1986 г. швейцарский физик Г. Бинниг и его коллеги создали новый прибор семейства СЗМ – атомно-силовой микроскоп (АСМ). В основе его работы лежит силовое (Ван-дер-Ваальсово) взаимодействие атомов зонда и поверхности. АСМ не требуется электрическая проводимость поверхности образца, и он может осуществлять съемку в жидкой среде. Поэтому этот прибор оказался удобным инструментом для исследования биологических объектов.

С момента появления атомно-силового микроскопа было опубликовано огромное число работ, посвященных АСМ-визуализации самых разнообразных биологических образцов. Следует все же признать, что в большинстве случаев в плане визуализации АСМ не дает ничего принципиально нового в сравнении с обычной электронной микроскопией, поэтому зачастую данный метод воспринимается биологами как техническая экзотика, а не как полноценный исследовательский инструмент.
Однако важнейшим, пусть и почти единственным преимуществом визуализации биологических объектов при помощи АСМ по сравнению с электронной микроскопией является возможность выполнения исследований нативных, природных образцов без какой-либо фиксации и специальной пробоподготовки, при физиологических параметрах среды.
Помимо визуализации рельефа поверхности с субнанометровым разрешением АСМ позволяет осуществлять прямое измерение сил, возникающих при взаимо¬действии одиночных наноразмерных объектов.
Проводятся такие измерения следующим образом: один объект закрепляется на острие зонда АСМ, а второй фиксируется на подложке, после чего зонд подводится к поверхности подложки до достижения механического контакта, а затем возвращается обратно. В ходе этого перемещения отслеживается деформация упругой консоли (кантилевера). Зависимость этого параметра от расстояния между зондом и подложкой называется силовой кривой. С ее помощью можно определить величину силы, действующей между исследуемыми объектами. Этот метод, названный атомно-силовой спектроскопией (АСС), может использоваться для исследования силовых характеристик взаимодействия самых разнообразных малых объектов: от неорганических наночастиц до вирусов и живых клеток.
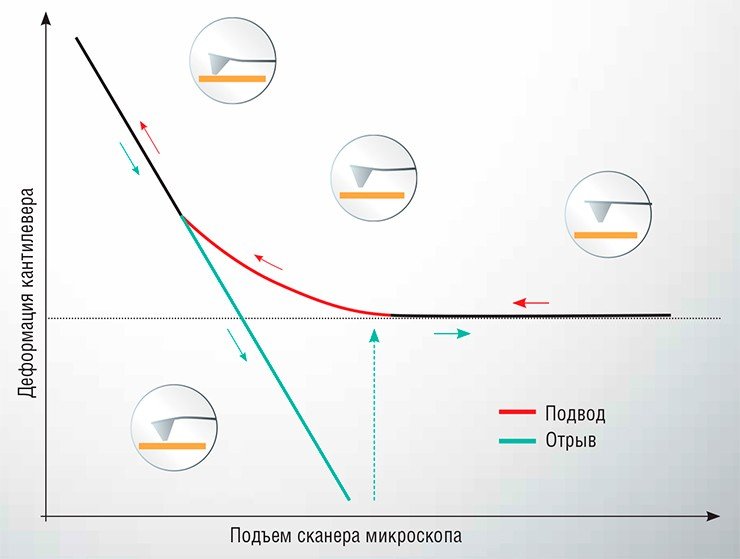
Начальным этапом заражения клетки вирусом является адгезия (прилипание) вирусной частицы (вириона) к клеточной поверхности с последующим проникновением генетического материала вируса внутрь клетки. Этот процесс, определяемый взаимодействием белковых рецепторов, расположенных на поверхности клетки, с поверхностными белками вириона, является критически важным для размножения вируса. И, надо отметить, в большинстве случаев изучен недостаточно.

Однако фиксация одиночной вирусной частицы на острие зонда атомно-силового микроскопа является весьма непростой задачей. Для успешного проведения эксперимента требуется большая подготовительная работа:
- получить как можно более чистый и концентрированный препарат вируса;
- подготовить на острие зонда площадку подходящего размера для посадки вириона;
- химически активировать поверхность зонда для образования ковалентных связей при контакте с белками вируса;
- убедиться в том, что на зонде закрепился действительно вирион, а не молекулы свободного белка или мелкие фрагменты клеток, всегда присутствующие в препаратах вирусов.
Оценка концентрации и степени чистоты препарата вируса обычно проводится методом просвечивающей электронной микроскопии. Площадку на острие АСМ-зонда, которое обычно изготавливают из кремния или его нитрида, формируют путем длительного сканирования кремниевой или сапфировой подложки при больших значениях развертки и силы прижатия зонда к поверхности. Наиболее наглядной иллюстрацией для этого процесса служит изменение формы острия карандаша в ходе интенсивного рисования.
По меркам микроскопии, клетка высших организмов является относительно крупным (≈ 10 мкм) объектом, поэтому хорошо видна в световом микроскопе, при помощи которого на нее наводится кантилевер атомно-силового микроскопа. Но как быть с самим зондом, на острие которого предполагается наличие вириона? Строго говоря, вместо вириона там может оказаться все, что угодно: монослой белковых молекул, фрагмент клетки или вириона, агрегат из нескольких вирионов, случайное загрязнение и т. д. Кроме того, в процессе измерения вирион может разрушиться или оторваться от зонда. Визуализация же зонда с вирусной частицей методом электронной микроскопии до силовых измерений недопустима, так как под воздействием высушивания, вакуума и пучка электронов вирион приобретет необратимые изменения.
Наиболее эффективным методом решения данной проблемы оказалась визуализация острия зонда АСМ с помощью электронной микроскопии, осуществляемая непосредственно после силовых измерений. Если на острие будет обнаружена вирусная частица, уцелевшая в ходе эксперимента, то все сомнения развеются.
В течение последних пятидесяти лет в результате поистине титанической работы, проделанной электронными микроскопистами всего мира, накоплен огромный багаж знаний в области ультраструктурных аспектов репликации различных вирусов. Создание атомно-силового микроскопа и техники силовой спектроскопии позволило вплотную приблизиться к произвольной механической манипуляции одиночными вирусными частицами. Это выводит изучение взаимодействия вируса с клеткой на принципиально другой уровень – от структурных исследований к функциональным.
При этом атомно-силовая спектроскопия не является конкурентом для электронной микроскопии, а открывает новое самостоятельное направление исследований – наномеханику взаимодействия вирусной частицы с поверхностью клетки. Весьма вероятно, что в самом ближайшем будущем в данном направлении будут совершены фундаментальные открытия, соизмеримые по значимости с достижениями электронной микроскопии в середине прошлого века.
Изучение механизмов связывания вирусных частиц с поверхностью клетки вызывает значительный интерес не только с позиции фундаментальной науки, но и в контексте практических приложений. Более детальное понимание этих механизмов на молекулярном уровне может дать человечеству ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
*Просвечивающая электронная микроскопия с использованием специальной жидкостной ячейки и сканирующая электронная микроскопия при атмосферном давлении позволяют исследовать биологические объекты без фиксации, но из-за ряда технических трудностей и относительно низкого пространственного разрешения эти методы не получили широкого распространения
Корнеев Д. В., Бессуднова Е. В., Зайцев Б. Н. Изучение взаимодействия наночастиц TiO2 и поверхности эритроцитов человека методом атомно-силовой спектроскопии // УНЖ. 2012. № 4. С. 73—77.
Миронов В. Л. Основы сканирующей зондовой микроскопии. Нижний Новгород: ИФМ РАН, 2004. 182 с.
Alsteens D., Pesavent E., Cheuvart G. et al. Controlled manipulation of bacteriophages using single-virus force spectroscopy // ACSNANO. 2009. V. 3(10). P. 3063—3068.
Alsteens D., Trabelsi H., Soumillion P., Dufrene Y. F., Multiparametric atomic force microscopy imaging of single bacteriophages extruding from living bacteria // Nature Communications. V. 4. Article number: 2926.
Binnig G., Quate C. F., Gerber Ch. Atomic force microscope // Phys. Rev. Lett. 1986. V. 56(9). P. 930—933.
Cappella B., Dietler G. Force-distance curves by atomic force microscopy // Surf. Sci. Rep. 1999. V. 34. P. 1—104.
Malkin A.J., Plomp M., McPherson A. Unraveling the architecture of viruses by high-resolution atomic force microscopy // Methods Mol. Biol. 2005. V. 292. P. 85—108.
В публикации использованы фото автора
Читайте также:


