Что такое рекомбинантная вакцина против гриппа
Рекомбинантная вакцина стала новым шагом в медицине и вакцинации. В настоящее время наиболее широко применяется такой тип прививок, эффективно предупреждающий гепатит В. Рассмотрим общие особенности препаратов такого класса, их ключевые отличия. Обратим внимание на самые известные продукты.
Общая информация
Изготовление рекомбинантной вакцины предполагает сначала клонирование генетического материала для генерирования антигена, затем введение полученного сырья в вектор, введение вектора в продуценты. Следующий шаг – лабораторная культивация, после чего выделяют и очищают антиген. Альтернативный вариант – использование продуцентов как элемента вакцины.
Подготовленный продукт необходимо для начала изучить. Для этого используют референс-препарат, успешно прошедший проверки доклинического уровня и на клиническом шаге. Отличия разных серий говорят о нестабильных векторах и утере клеточным материалом такового в процессе работы. На заключительном этапе работы нужно проверить, насколько велик процент включающих вектор клеток. К вектору вируса формулируют строгие требования. Должна быть высока аттенуация, при этом недопустима онкогенная активность. Недопустимо использовать материал, провоцирующий дополнительные нежелательные эффекты.

Препараты будущего?
Как заверяют ученые, рекомбинантные вакцины совершенно безопасны. Такие средства показывают высокую степень эффективности. Процесс производства подобного фармацевтического продукта предполагает применение наиболее эффективных и современных методов и технологий. Готовые продукты используются для создания комплексных препаратов для вакцинации населения. Их применение позволяет сформировать у людей иммунитет против нескольких возбудителей одновременно.
Особенности применения
Повторную вакцинацию проводят введением АКДС один раз в 18-месячном возрасте. Если стандартные сроки нарушены, повторную инъекцию назначают через 12-13 месяцев после первого курса. Если к четырехлетнему возрасту все еще не получена повторная вакцина, для введения используют анатоксин АДС для детей до шестилетнего возраста или АДС-М для лиц постарше.
Особенности активности
Использование такого препарата сопровождается определенными рисками. Рекомбинантная прививка может стать причиной кратковременных системных, локальных реакций. Может повыситься температура, общее состояние ребенка слабое, область введения отзывается болью и горячая на ощупь. Есть вероятность локального отека. Обычно такое появляется в два первых дня после введения. Редко укол приводит к судорогам, аллергии и эпизодам крика.
Особенности применения
Введение дрожжевой вакцины может спровоцировать рост общей температуры тела. У некоторых болит голова. Ребенка может тошнить. Место введения иногда беспокоит болью, становится несколько плотнее. Средство предназначено для детей и взрослых. При введении нужно руководствоваться национальным прививочным календарем и инструкцией к препарату.
Фармакология
Медикаментом пользуются при необходимости введения инъекций вакцины по национальному календарю. Препарат показан тем, кто контактирует с зараженным гепатитом В материалом, а также всем сотрудникам сферы здоровья, работающим с кровью. Необходимо ставить вакцину лицам, работающим в области изготовления иммунобиологической продукции из человеческой крови.
Случаи и практика
Вакцинация рекомендована студентам, обучающимся в медицинском учебном заведении среднего, высшего уровня. Это особенно актуально для выпускающихся. Вакцинирование положено тем, кто инъекционным путем вводит себе наркотические средства.
Особенности применения

В условиях пандемии многие государства приступили к созданию лекарств и вакцин от нового коронавируса. Сообщается, что в России разработка прошла первую фазу — так ли это? Значит ли, что скоро можно ждать появления препарата? Чтобы разработать новое лекарство от неизвестного заболевания по всем правилам научного поиска нужно от 5 до 15 лет. Разобрали весь процесс на примере COVID-19 вместе с Равилем Ниязовым, специалистом по регуляторным вопросам и разработке лекарств Центра научного консультирования.
COVID-19 — инфекционное заболевание, вызываемое коронавирусом SARS-CoV-2. В тяжелых формах оно поражает легкие, иногда — сердце и другие органы. Особенно тяжело заболевание протекает, если у больного есть другие нарушения со стороны дыхательной или сердечно-сосудистой систем. Молниеносно возникшая пандемия COVID-19 поставила вопрос разработки лекарств и вакцин от новой инфекции. Это долгий процесс с множеством стадий, на каждой из которых исключают вещества-кандидатов. Только одно или небольшая группа таких веществ в итоге сможет стать безопасным и эффективным лекарством.
Шаг 1: понять, как развивается новое заболевание
Любая болезнь нарушает естественные физиологические и биохимические процессы в организме. Причины заболеваний могут быть разными, в том числе — инфекционными. Инфекционный агент (в случае COVID-19 это коронавирус SARS-CoV-2) заимствует и эксплуатирует биохимический аппарат клеток, перехватывая управление им, в результате чего клетки перестают выполнять свою физиологическую функцию. Для вируса SARS-CoV-2 основной мишенью являются клетки дыхательного эпителия, отвечающие за газообмен, то есть за дыхание.
Лекарством для лечения COVID-19 будет считаться любое вещество или комбинация веществ, которое будет способно (1) инактивировать вирус еще до того, как он успеет поразить клетку, или (2) нарушать жизненный цикл вируса внутри зараженной клетки, или (3) защищать новые непораженные здоровые клетки от инфицирования.
Чтобы создать лекарство от SARS-CoV-2, нужно хорошо знать, каков жизненный цикл вируса в организме человека:
- с какими клетками человека и через какие рецепторы на поверхности клеток он связывается, какой собственный вирусный аппарат для этого он использует;
- как вирус проникает в клетку;
- как вирус эксплуатирует биохимический аппарат клетки, чтобы воспроизводить собственный генетический материал и белки, нужные для сборки новых вирусных частиц;
- как вирус покидает инфицированную клетку, чтобы инфицировать новые клетки;
- как формируется иммунитет против вируса и какой вклад иммунитет вносит в тяжесть заболевания (чрезмерная иммунная реакция может вызывать тяжелое поражение внутренних органов).

Всё перечисленное — это совокупность фундаментальных знаний, необходимых для перехода к следующему этапу разработки лекарства — синтезу или биосинтезу веществ, которые могут нарушать свойства вирусных частиц, убивая вирус и при этом не вредя человеку. Например, так работают лекарства от ВИЧ-инфекции или гепатита C. Но при этих заболеваниях важно применять сразу несколько веществ из разных классов, чтобы вирус не становился устойчивым к терапии. Об этом нужно будет помнить и при разработке лекарств против SARS-CoV-2.
Для лечения вирусных заболеваний также могут использоваться иммуносыворотки, содержащие антитела, способные инактивировать вирус. Такие сыворотки можно получать от животных, например, лошадей или кроликов, но также и от человека, уже переболевшего заболеванием.
Однако самый эффективный подход — профилактика заболевания. Для этого используют вакцины — естественные или генетически модифицированные белки вируса, а иногда и живой, но ослабленный вирус. Вакцина имитирует инфекционное заболевание и стимулирует организм к формированию иммунитета. В последнее время также разрабатываются РНК- и ДНК-вакцины, но пока одобренных препаратов нет.
В отличие от традиционных вакцин, РНК-/ДНК-вакцины содержат не вирусные белки, а гены, кодирующие основные вирусные белки. Введение такой вакцины приводит к синтезу клетками белков вируса, на которые должна реагировать иммунная система и вырабатывать иммунитет против этих белков вируса. Гипотетически это должно препятствовать началу инфекционного процесса при заражении настоящим патогенным вирусом. Важно отметить, такие РНК- и ДНК-вакцины не должны кодировать те белки вируса, которые способны были бы привести к настоящей вирусной инфекции.
Шаг 2: поиск хитов
На ранней стадии разработки синтезируют и тестируют множество веществ — библиотеку. Основная цель этого этапа — найти группу хитов (hit — попадание в цель), которые бы связывались с нужной вирусной мишенью. Обычно это один из белков вируса. Иногда отбор идет из библиотек, состоящих из миллиардов низкомолекулярных веществ. Сейчас активно используют компьютерные алгоритмы — машинное и глубокое обучение — чтобы искать новые потенциально активные молекулы. Одна из компаний, успешно работающая в этом направлении, — InSilico Medicine, создана российскими математиками.
Другой источник потенциальных лекарств — выздоровевшие люди: в их крови содержатся антитела, часть из которых способны связываться с вирусом и, возможно, нейтрализовать его.
Шаг 3: поиск и тестирование лидов
Когда находят группу хитов, способную связываться с вирусным белком, переходят к следующему этапу скрининга. На этом шаге исключаются вещества, которые:
- нестабильны и быстро разлагаются;
- тяжелы/затратны в синтезе;
- токсичны для различных клеток человека в условиях лабораторных экспериментов на культуре клеток. Вещества не должны быть токсичны сами, токсичностью также не должны обладать продукты их метаболизма в организме, продукты их разложения и примеси, возникающие в процессе производства; вместе с тем если процесс производства способен с помощью очистки удалять продукты разложения или примеси, то такой хит может и не будет выведен из разработки;
- плохо растворимы в воде — лекарство должно в достаточном количестве растворяться в биологических жидкостях, чтобы распределиться по организму;
- быстро разлагаются в живом организме;
- плохо проникают через слизистые оболочки, клеточные мембраны или внутрь клетки, в зависимости от пути введения лекарства и расположения вирусной мишени.
Хиты, которые выдерживают эти испытания и проходят все фильтры, переводят в категорию лидов (lead — ведущий).
Лиды тестируют в еще более широкой серии экспериментов для принятия так называемых решений Go/No-Go о продолжении или остановке разработки. На этой стадии инициируются испытания на животных. Такая схема отбора нужна чтобы как можно раньше вывести из разработки бесперспективные молекулы, потратив на них минимальные время и ресурсы, поскольку каждый последующий этап является еще более затратным.
Те несколько лидов, которые успешно проходят очередные испытания, становятся кандидатами. К этому моменту разработка может длиться уже от трех до семи лет.
Шаг 4: испытания кандидатов и клинические исследования

Прежде чем перейти к испытаниям на людях, нужно выполнить исследования на животных и подтвердить отсутствие неприемлемой для человека токсичности, подобрать первоначальную безопасную дозу. На этом этапе кандидаты тоже могут отсеиваться — например, из-за генотоксичности (токсичности для генетического аппарата клетки) или канцерогенности (способности вызывать рак). Еще они могут оказаться небезопасными для беременных женщин или женщин детородного возраста, вызывать поражение головного мозга, печени, почек, сердца или легких. В зависимости от природы молекулы исследования проводят на грызунах, собаках, обезьянах, минипигах, кроликах и т.д.
В зависимости от природы заболевания, особенностей его терапии и свойств лекарства, какие-то исследования могут не проводиться или быть не значимы. Например, оценка канцерогенности лекарства не потребуется, если оно будет применяться в лечении краткосрочных заболеваний, как в случае COVID-19. Генотоксичность не оценивают для биопрепаратов или если лекарство предназначено для лечения метастатического рака и т. д. Суммарно доклинические исследования могут занимать 3–5 лет. Часть из них проводится параллельно с клиническими исследованиями.
Если доклинические исследования успешны, начинается клиническая разработка, которая условно делится на фазы. Это нужно, чтобы постепенно и контролируемо тестировать лекарство на все большем количестве людей. И снова стадийность процесса позволяет прекратить разработку на любом этапе, не подвергая риску многих людей.
- Первая фаза: здесь подтверждают первичную безопасность для людей в принципе, изучают поведение лекарства в организме человека, его биодоступность (способность достигать места действия в достаточных концентрациях), его взаимодействие с другими лекарствами, влияние пищи, половых и возрастных различий на свойства лекарства, а также безопасность для людей с сопутствующими заболеваниями (особенно важны заболевания печени и почек — эти органы отвечают за метаболизм и выведение лекарств), проверяют, не вызывает ли лекарство нарушение ритма сердца. Кроме того, на I фазе оценивают безопасный диапазон доз: эффективные дозы не должны быть неприемлемо токсичными.
- Вторая фаза: здесь начинают проверять эффективность лекарства на пациентах с заболеванием. На ранней II фазе оценивают, работает ли кандидатная молекула на людях с изучаемым заболеванием в принципе, а на поздней II фазе подбирают режим дозирования, если кандидатное лекарство было эффективным. При этом вещество, эффективное в лабораторных экспериментах, на животных моделях заболевания и даже в ранних клинических исследованиях на людях, вполне может не быть таким же рабочим в реальной медицинской практике. Поэтому и нужен длительный процесс поэтапной исключающей разработки, чтобы на выходе получить эффективное и безопасное лекарство.
- Третья фаза: здесь подтверждают эффективность и безопасность лекарства, а также доказывают, что его польза компенсирует те нежелательные реакции, которые неминуемо будет вызывать лекарство. Иными словами, в исследованиях третьей фазы надо понять, что баланс пользы и рисков положителен. Это всегда индивидуально. Например, у людей с ВИЧ в целом допустимо, если противовирусные лекарства вызывают некоторые нежелательные реакции, а в случае онкологических заболеваний приемлемы и более выраженные токсические реакции.
В случае вакцин, которые рассчитаны на здоровых людей, и особенно детей, приемлемы лишь легкие нежелательные реакции. Поэтому найти баланс трудно: вакцина должна быть высоко эффективной, и при этом вызывать минимальное число тяжелых реакций, например реже, чем 1 случай на 1000, 10 000 или даже 100 000 вакцинированных людей. Клиническая разработка может длиться до 5–7 лет, однако низкомолекулярные противовирусные лекарства для краткосрочного применения, как в случае COVID-19, можно протестировать быстрее — за 1–2 года.
Разработка многих отечественных противовирусных и иммуномодулирующих препаратов не соответствует такому научно выверенному процессу разработки.
Шаг 5: производство
Важный этап — наладить производство лекарства. Разработка процессов синтеза начинается в самом начале отбора лидов и постепенно дорабатывается, оптимизируется и доводится до промышленного масштаба.
В настоящее время против SARS-CoV-2 разрабатывается много разных методов лечения:
- низкомолекулярные соединения, которые нарушают жизненный цикл вируса. Трудность в том, что может быть нужно применять сразу несколько противовирусных лекарств. Сейчас надежды возлагают на ремдесивир. Есть данные, что может быть эффективен давно известный гидроксихлорохин, действующий не на сам вирус, а влияющий на иммунитет. Информацию, что комбинация лопинавира и ритонавира оказалась неэффективной у тяжелобольных пациентов, стоит интерпретировать с осторожностью: она может быть эффективна при более легких формах, или для профилактики, или у каких-то определенных подгрупп;
- противовирусные, в том числе моноклональные, антитела, которые связываются с ним на поверхности и блокируют его проникновение в клетку, а также помечают вирус для клеток иммунной системы. Антитела можно получать как биотехнологически, так и выделять из крови переболевших людей. Сейчас тестируются препараты, получаемые с помощью обоих методов;
- вакцины. Они могут представлять собой естественные или модифицированные белки вируса (модификации вводят для усиления выработки иммунитета), живой ослабленный вирус, вирусоподобные наночастицы, синтетический генетический материал вируса (РНК-вакцины) для того, чтобы сам организм человека синтезировал некоторые белки вируса и смог выработать антитела к нему. Одна из проблем в случае вакцин — простое введение белков вируса, пусть и модифицированных, не всегда позволяет сформировать иммунитет, способный защитить от реального заболевания — так называемый стерильный иммунитет. Даже образование антител в ответ на введение вакцины не гарантирует защиты: хорошим примером являются те же ВИЧ и гепатит C, хотя вакцина против гепатита B достаточно проста и при этом высокоэффективна. Хочется надеяться, что отечественные разработчики следуют рекомендациям Всемирной организации здравоохранения по проведению доклинических и клинических исследований вакцин, включая исследования провокации и изучение адъювантов;
- препараты для РНК-интерференции. Так называемые малые интерферирующие рибонуклеиновые кислоты (РНК) — это небольшие отрезки синтетически получаемой РНК, которые способны связываться с генетическим аппаратом вируса и блокировать его считывание, мешая синтезу вирусных белков или воспроизведению генетического материала вируса.
Процесс разработки лекарства — это научный поиск с неизвестным исходом. Он занимает много времени и требует участия большой команды профессионалов разных специальностей. Однако только реальный клинический опыт позволит оценить, удалось ли получить не только эффективное, но и безопасное лекарство, поэтому любое точное определение сроков получения лекарства — спекуляция. Получить эффективную и безопасную вакцину к концу года, если следовать всем правилам научного поиска, вряд ли удастся.
Детальные обсуждения процессов разработки новых лекарств и возникающих в связи с этим проблем — на YouTube-канале PhED.
- 923
- 0,0
- 0
- 0
Есть шанс, что вакцина от коронавируса будет доступна уже в начале 2021 года
Итак, давайте поговорим о разработке вакцин, ведь для реализации таких планов все должно сработать идеально. Вот ссылка на хороший обзор вакцин против коронавируса, опубликованный в Nature Reviews Drug Discovery [1]. На сайте ВОЗ размещен официальный список вакцин, а BioCentury постоянно обновляет в открытом доступе сводки о вакцинах и других методах лечения, которые находятся в клинических или доклинических исследованиях. Только что они опубликовали превосходный обзор о вакцинах, который я рекомендую прочитать после моего поста.
Обзор в Nature Reviews Drug Discovery упоминает 115 (!) программ вакцинации, из которых по 37 нет никакой дополнительной информации, а 78, безусловно, реальны. Из этих 78 пять уже вошли в клинические исследования, и число их будет быстро расти. Это вакцина mRNA1273 от компании Moderna, которая, как следует из названия, является мРНК-вакциной, и INO4800 от компании Inovio, представляющая собой ДНК-плазмиду. Также есть две клеточные вакцины из Шэньчжэньского геноиммунного медицинского института: LV-SMENP-DC, вакцина из дендритных клеток, модифицированных лентивирусными векторами для экспрессии вирусных белков, и вакцина из искусственных антигенпрезентирующих клеток (aАРС). И, наконец, есть более традиционная рекомбинантная белковая вакцина Ad5-nCoV от компании CanSino.
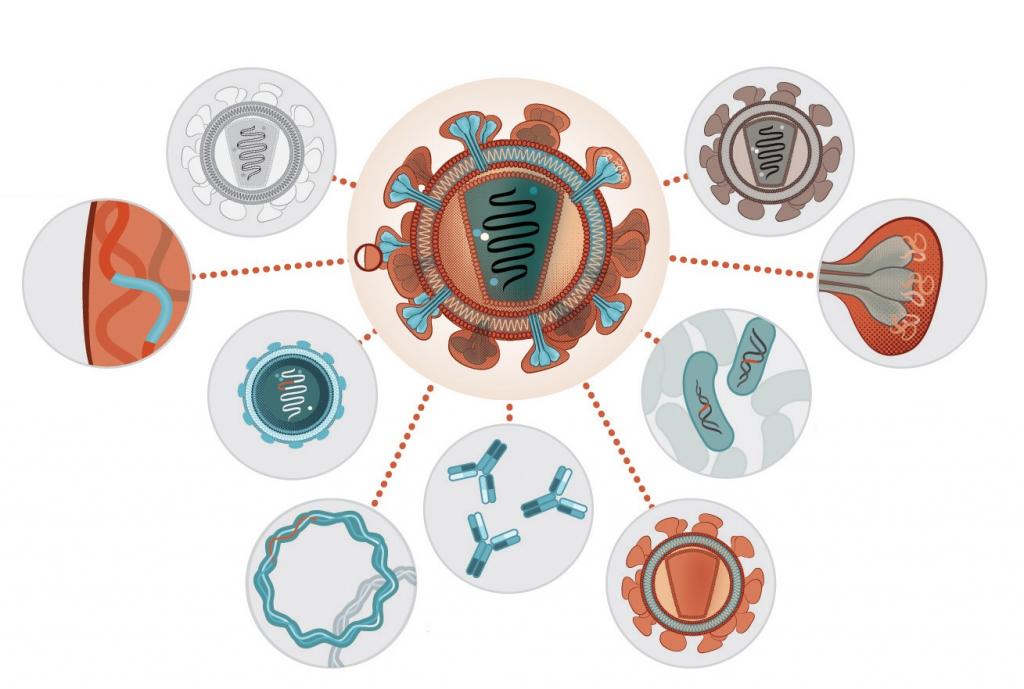
Давайте рассмотрим, что всё это значит. Как видно из приведенного перечня, подходы к созданию вакцины весьма разнообразны, и это еще не весь спектр. Если обратиться к доклиническим кандидатам, мы увидим также вирусоподобные частицы, вирусные векторы (как реплицирующиеся, так и не реплицирующиеся), живые аттенуированные вирусы, инактивированные вирусы и многое другое. Мы видим, что существует множество способов вызвать иммунный ответ. Каковы же различия между ними?
Типы вакцин
Следующий класс — вакцины на основе инактивированных вирусов. В этом случае вирусы, даже если вы считаете их живыми существами (я — нет), мертвы. Раньше вирусный препарат для этого нагревали, теперь же это чаще всего делается при помощи дезинфицирующих средств, вызывающих денатурацию вируса, таких как формалин или бета-пропиолактон. Эти вещества изменяют белки вируса так, что вирус уже не может заражать клетки, но не настолько сильно, чтобы они не вызывали иммунный ответ. Это сродни искусству; такую инактивацию необходимо провести и испытать несколько раз, чтобы получить воспроизводимый иммунный ответ и воспроизводимый способ производства неактивного вируса. Как вы понимаете, введение такого инактивированного вируса часто не столь эффективно, как описанный выше подход с живыми ослабленными вирусами, которые заставляют клетки человека самостоятельно производить вирусные белки. Приходится прибегать к старой доброй схеме повторной вакцинации (праймирование и дальнейшее бустирование). К этому типу относятся, например, вакцины против гепатита А и сезонного гриппа.
Еще один распространенный вид вакцины — субъединичная — это отдельный белок, фрагмент белка или субъединицы патогена (при некоторых бактериальных заболеваниях это может быть также токсин, вырабатываемый бактерией). Идея заключается в том, чтобы выбрать белок, который вызывает сильный иммунный ответ. Таким образом, существует множество потенциальных кандидатов на эту роль, и проработка каждого — самостоятельный процесс. Плюсом такого подхода является то, что выбранный белок можно производить рекомбинантно в больших количествах. Конечно, вместо белка можно взять гликопротеин или даже кусочек полисахарида из наружной оболочки патогена, поскольку они могут быть весьма характерными для конкретной бактерии. Самое сложное здесь — получить достаточный иммунный ответ, ведь такие фрагменты могут быть не столь эффективны для запуска выработки антител, как полноценный патоген. Поэтому, как правило, для успешной работы таких вакцин необходимы адъюванты (о них — ниже). Вакцины такого типа применяются против опоясывающего лишая, гепатита В, вируса папилломы человека, менингококка, сезонного гриппа и многих других патогенов.
Более новый подход — ДНК-вакцина. Это кольцевая ДНК-плазмида, кодирующая определенный белок-антиген, ген которого скомбинирован с сильными промоторными сигналами и стоп-сигналами на концах нуклеотидной последовательности. Идея в том, что такая плазмида может быть поглощена клетками, в которых она далее начинает транскрибироваться в РНК, а затем транслироваться в белок, запускающий иммунный ответ. Как и в случае с аттенуированным вирусом, антигенные белки производятся клеткой, поэтому они правильно свернуты и обладают необходимыми посттрансляционными модификациями, которые могут быть критичны для формирования против них иммунного ответа. Можно также взять известный вирус (далекий от патогена, против которого проводится вакцинация) и реорганизовать его ДНК, вставив в нее ген для производства нужного белка-антигена. В этом случае мы как бы возвращаемся к методике живого ослабленного вируса, но путем составления этого вируса из разных частей. Это очень похоже на генную терапию, которая также обычно использует вирусные векторы. На сегодняшний момент не существует человеческой вакцины, в которой используется какой-либо из вышеописанных методов получения ДНК-вакцины, однако для лошадей, например, такая вакцина против вируса Зика уже зарегистрирована. Некоторые препараты исследовались, однако получить достаточный иммунный ответ на них не удалось. Другой сложный момент в разработке такого типа вакцин — стабильность ДНК-плазмиды как при хранении, так и после инъекции. На решение этой проблемы были потрачены значительные деньги при разработке методов генной терапии, и с годами ситуация улучшилась. В целом, однако, я бы сказал, что ДНК-вакцина против SARS-CoV-2 стала бы настоящим прорывом в этой области.
Аналогично дела обстоят и с мРНК-вакцинами [7]. Концептуально они похожи на ДНК-вакцины, однако вы сразу перескакиваете к этапу мРНК. Я немного писал об этом в посте про CureVac — иммуногенность такого рода препаратов была отмечена как неожиданный побочный эффект в экспериментах, где животным вводили мРНК, и исследователям пришло в голову использовать это свойство для создания вакцин. Как и в случае ДНК-вакцин, на мРНК-вакцину можно получить два вида иммунного ответа: клетки врожденного иммунитета могут распознать последовательность чужеродных нуклеиновых кислот, плавающих вокруг, как признак инфекции, а клетки адаптивного иммунитета выработать к полученным после трансляции мРНК белкам антитела. Одна из задач при таком подходе — ослабить врожденный иммунный ответ и усилить адаптивный, обеспечивающий длительную защиту, которую мы хотим получить при вакцинации. На днях появилась информация о выздоравливающем от COVID-19 молодом пациенте, который в ходе болезни, по-видимому, не выработал антитела против вируса. Это пример подобного рода проблемы: сильный врожденный иммунный ответ может победить вирус, но не дать пациенту выработать долговременный иммунитет против него.
мРНК-вакцины имеют несколько потенциальных преимуществ перед ДНК-вакцинами, а, возможно, и перед всеми описанными типами вакцин. мРНК — это самая простая конструкция из тех, которую можно себе представить, так что при ее использовании нет проблем с иммунным ответом на вектор, который часто препятствует повторному введению других вакцин. Кроме того, мРНК не может интегрироваться в геном клетки организма. На протяжении многих лет большой проблемой с мРНК-вакцинами была стабильность мРНК: ей нужно не деградировать после введения, а эффективно проникать в клетки и транслироваться в белок. На данный момент многие из этих вопросов практически решены путем внесения изменений в саму последовательность РНК и в формуляцию (рецептуру) раствора, в виде которого она находится перед введением. Правда, ДНК-вакцины существуют дольше мРНК-вакцин, но, как уже говорилось, всё еще не дошли до применения у человека. Превзойдут ли их мРНК-вакцины или нас ждет разочарование? В условиях пандемии коронавируса мы выясним это быстрее, чем планировали.
Адъюванты
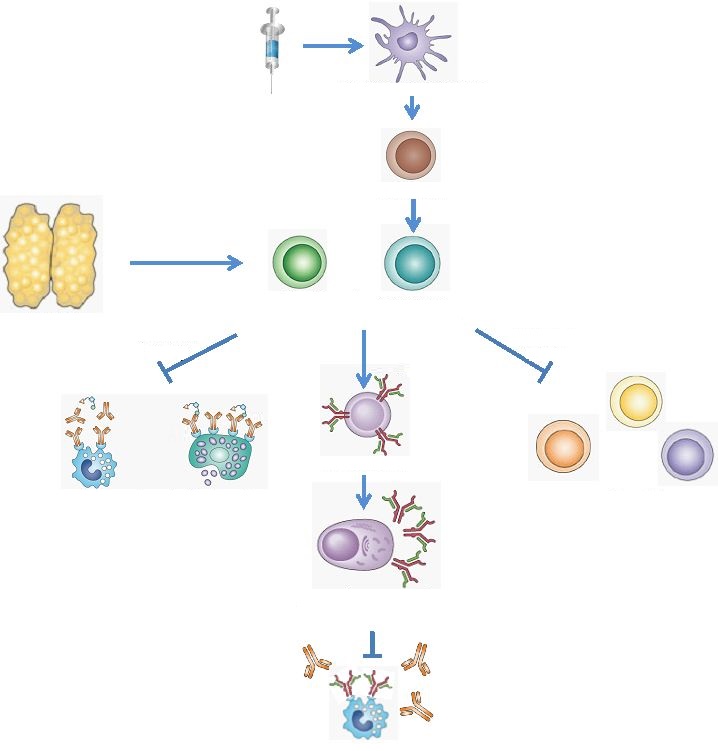
Есть еще одна ключевая методика вакцинации, которая применима ко всем вышеописанным методам, — использование адъювантов [8]. Очевидно, что основная вещь, которую мы хотим получить при вакцинации, — это устойчивый длительный иммунный ответ, и оказалось, что различные добавки могут способствовать его появлению, играя на равновесии между врожденным и адаптивным иммунными ответами, упомянутыми выше. Идея состоит в том, чтобы получить оптимальный переход от врожденных механизмов иммунитета к адаптивным, а именно к выработке антител. Для быстрого ознакомления с принципами работы иммунной системы можно прочитать этот пост, хотя, конечно, существует много материалов по этому вопросу . Ключевой процесс в данном случае — взаимодействие антигенпрезентирующих клеток и хелперных Т-клеток.
Изучение адъювантов началось с того, что в 20-х годах прошлого века французский ветеринар Гастон Рамон заметил, что при инъекциях лошадям и дальнейшем заборе от них плазмы крови выход антител был выше у животных с развившейся сильной воспалительной реакцией в месте инъекции. Он начал экспериментировать с добавками, вызывающими местную реакцию, включая такое вещество, как тапиока (крахмал из клубней маниока). В то же время британский иммунолог Александр Гленни разрабатывал вакцины против дифтерии и заметил, что те, которые содержали соли алюминия, были гораздо более эффективными. Никто не знал подробностей этих процессов, но и почти столетие спустя соли алюминия всё еще чрезвычайно распространены в производстве вакцин. Чуть больше мы узнали в 90-х годах XX века, когда впервые за многие десятилетия появились новые адъюванты. Так, вакцина GSK против опоясывающего лишая содержит липопротеины, выделенные из бактерий сальмонелл, а также терпеновые гликозиды из чилийского мыльного дерева — такое сочетание оказалось наиболее мощным. Я могу вам сказать, что реакция на них в месте инъекции, особенно после второго введения, выглядит впечатляюще! Опыт GSK в этой области — это то, что они привносят в сотрудничество с Sanofi, упомянутое в начале статьи.
Разработка вакцин против COVID-19: эффективность
Теперь вернемся к общей картине разработки вакцины против коронавируса. Основной вопрос в том, какой из возможных методов наиболее эффективен и безопасен. Это мы узнаем только после тестирования каждого из вариантов на людях. На множестве людей. С терапиями, нацеленными на иммунную систему, нет другого способа это узнать из-за сложности иммунного ответа человека и его широкой вариации в человеческой популяции. Чтобы ускорить процесс, потребуется огромное количество усилий, и некоторые из шагов должны быть выполнены в таком масштабе, который никогда прежде не предпринимался. Еще один момент, который нельзя игнорировать: если мы хотим, чтобы это было сделано так быстро, как хотелось бы, то должны быть предприняты попытки сокращения пути разработки и тестирования.
В связи с этим, одна из причин такого быстрого старта вакцины Moderna заключается не только в том, что разработка мРНК-вакцины может быть по своей природе более быстрой, но и в том, что шаг тестирования ее на животных был полностью пропущен. Отчасти это сделали из-за того, что до сих пор неясно, какая модель животного была бы наиболее информативной. В более раннем посте мы говорили о том, что вирусы SARS и nCoV-19 действительно показывают различия в лабораторных тестах, и мы можем ожидать, что эти различия распространятся и на животные модели. Один из подходов в тестировании на животных заключается в том, чтобы разводить линию лабораторных животных (например, мышей или хомяков) с человеческой формой белка ACE2, который, по-видимому, имеет решающее значение для проникновения вируса. Это может быть полезно, однако будет ли такая животная модель создана действительно вовремя, чтобы помочь при разработке вакцин? Я думаю, некоторые другие кандидатные вакцины пойдут тем же путем, что и Moderna, и полностью пропустят стадию тестирования эффективности на животных. Поверьте мне, это (и не только это) существенно сократит путь тестирования.
К счастью, тестирование эффективности вакцины может быть довольно простым, и оно включает в себя многие вопросы, возникающие и при тестировании антител, такие как:
- Развивается ли у вакцинированного пациента антительный иммунный ответ?
- Насколько много антител образуется?
- Правильного ли они типа, чтобы нейтрализовать вирус?
- Как долго продолжается этот иммунный ответ?
Ответы на первые три вопроса требуют проведения огромной работы прямо сейчас, но я не сомневаюсь, что они будут найдены. Необходимо понять, по каким конечным точкам мы будем измерять эффективность, чтобы быть уверенными, что они удовлетворят регулирующие органы.
Существует обзор 2016 года о процессе разработки стандартной новой профилактической вакцины [10]. Взгляните на длинную, детальную, перекрывающуюся и взаимосвязанную систему клинических испытаний , которые такие вакцины проходили в прошлом, и подумайте, что мы не сможем сделать всё это, если хотим получить вакцину в сроки, указанные в начале поста. В идеале, хотелось бы изучить вопросы эффективности в исследованиях второй фазы у разных групп (возраст, пол, сопутствующее состояние здоровья и набор принимаемых лекарств) с различными графиками дозирования, и тщательно подобрать эти параметры для запуска третьей фазы испытаний. Запустив множество одновременных испытаний вместо последовательных, мы сможем охватить какую-то часть этих проблем, но отнюдь не все. Сейчас разрабатывают по меньшей мере 78 таких препаратов; с каждым шагом их будет все меньше (до поздних стадий доберутся единицы), но организовать подобные исследования будет все еще очень непросто.
Некоторые же вещи не могут быть ускорены никакими способами, известными человечеству. Вопрос о длительности иммунитета является важным как для людей, естественно инфицированных SARS-CoV-2, так и для тех, кто получит вакцину. К сожалению, нет другого способа ответить на этот вопрос, кроме времени, которого в эти дни так не хватает. Существует множество примеров вакцин, защита после которых не держалась так долго, как ожидалось. Я предполагаю, что для начала мы можем получить вакцину первого раунда, защита которой будет длиться не так долго, как хотелось бы, но обеспечит достаточный иммунитет и, соответственно, время для сбора дополнительных данных об оптимизированной версии вакцины.
Разработка вакцин против COVID-19: безопасность
Все вышеописанное подводит нас ко второму вопросу, возникающему для любой новой терапии: безопасность и ее баланс с эффективностью. Это особенно сложный вопрос для любой терапии, нацеленной на иммунный ответ, поскольку сильная иммунная реакция может стоить пациенту жизни. Так, описан синдром Гийена—Барре: организм реагирует на антиген, появляющийся при вирусной инфекции или вакцинации, принимая миелиновые оболочки вокруг нервов также за враждебные белки и начиная их разрушать. При этом большинство людей выздоравливают, однако некоторые умирают. По приблизительным оценкам, даже вакцина против сезонного гриппа может убить примерно 1 на 10 миллионов человек, хотя понятно, что в случае отсутствия вакцинации умрет гораздо больше людей. Эпидемия свиного гриппа 1976 года показывает, что может произойти, если баланс будет рассчитан неправильно. Данной проблемы нельзя избежать полностью: огромные индивидуальные особенности иммунной системы каждого человека означают, что подобные серьезные события никогда не могут быть исключены, если вакцинировать много людей.
Разработка вакцин нацелена на то, чтобы ввести их миллионам, даже миллиардам людей, которые в настоящее время не больны, чтобы защитить их от болезней, не причиняя при этом больше вреда, чем сама болезнь. Я не сомневаюсь, что вовлеченные компании и регулирующие органы будут делать все возможное для решения вопросов безопасности, но вакцина, получающая EUA в начале следующего года, хм.
Разработка вакцин против COVID-19: логистика
Еще одна большая проблема — производство и распространение вакцины. Многие читатели слышали о трудностях, которые иногда возникают в процессе производства вакцины против гриппа, что приводит к ее дефициту. В зависимости от того, какая технология получения вакцин выходит на первое место, производство достаточного количества доз воспроизводимым способом может быть довольно сложной задачей. Кроме того, многие вакцины нуждаются в перевозке и хранении в холодных условиях, что также бывает трудно обеспечить. А что делать, если возможная вакцина требует более одной инъекции, что справедливо, например, для многих вакцин с адъювантами? Отслеживать это — еще одна проблема.
Я думаю, что масштабирование и производство вполне могут стать ахиллесовой пятой для срыва упомянутых ранее сроков обеспечения готовности вакцин, поэтому будут предприняты огромные усилия, чтобы сразу начать работу над этими проблемами. Вот почему, например, Билл Гейтс уже заранее заявил о готовности финансировать фабрики для производства до семи типов вакцин. Производство вакцин с живым, аттенуированным вирусом, рекомбинантным белком и нуклеиновыми кислотами обеспечивается совершенно разными методиками и формуляциями и, поскольку мы не знаем, какой вариант в итоге будет выбран, готовность к реализации производства любого из них может оказаться единственным способом решения этой проблемы. Компания Pfizer и другие уже заявили, что будут работать над налаживанием производства еще до того, как появятся данные об эффективности, что, разумеется, не является обычной практикой. Я думаю, что мы так или иначе получим эффективную вакцину против коронавируса, хотя она, конечно, не будет охарактеризована так тщательно, как обычно. Думаю также, что мы уже согласны пойти на компромисс в вопросах безопасности. Однако масштабирование производства вакцины может стать еще более серьезной проблемой, и по мере развития событий мы будем следить за неприятными сюрпризами в этом процессе.
То, чему мы сейчас свидетели — это беспрецедентный вызов, и, будем надеяться, мы никогда больше не увидим ничего подобного.
Читайте также:


