Бактериофаги от гепатита в
Первые клинические эксперименты с бактериофагами начались сто лет назад, и казалось, что этот новый метод терапии обречен на успех: с научной точки зрения он выглядел безупречным, и результаты применения выглядели многообещающими.
Почему же в последующие десятилетия интерес к терапевтическому применению бактериофагов в мире упал? Почему он возник вновь, и почему эта замечательная идея до сих пор не реализована в полной мере? И практические врачи, и их пациенты сегодня должны четко представлять не только суть, но и все сильные и слабые стороны этого перспективного вида терапии
Бактериофаги – это не обычные лекарства. Они не являются простыми химическими веществами, как антибиотики и большинство других препаратов, но их вряд ли можно считать и полноценными живыми организмами, так как они, как и все остальные вирусы, могут размножаться только в клетке-хозяине. По сути, это нанороботы с генетической программой, способные проникнуть внутрь бактериальной клетки и там размножиться, разрушив ее.
Поэтому к бактериофагам не всегда применимы стандартные для фармакологии нормы и подходы. И хотя фаговые препараты сегодня производятся и используются в медицине, наши знания о многообразии этих вирусов, механизмах их взаимодействия с бактериями и конкуренции с себе подобными пока недостаточны, чтобы в полной мере использовать их мощный терапевтический потенциал.
Безопасно и эффективно
Фаготерапия родилась едва ли не сразу после открытия самих бактериофагов, однако широкие испытания этих противобактериальных средств начали проводиться в СССР только в конце 1930-х гг. В результате была доказана эффективность препаратов бактериофагов как профилактического средства при борьбе с эпидемиями дизентерии и холеры, а использование их при лечении ран и гнойно-воспалительных процессов показало их потенциал как альтернативы антибиотикам.
Однако результаты исследований тех времен были зачастую противоречивы: иногда фаги сразу подавляли развитие инфекционных процессов, но иногда оказывались бесполезными. Специалисты сразу поняли, в чем причина: лечение было успешным лишь тогда, когда использовались фаги, способные инфицировать именно тот бактериальный штамм, который и вызвал заболевание. Поэтому при возникновении эпидемии требовалось выделить инфекционный агент, проверить на нем имеющиеся фаговые препараты и запустить в производство в качестве препарата наиболее эффективный бактериофаг.
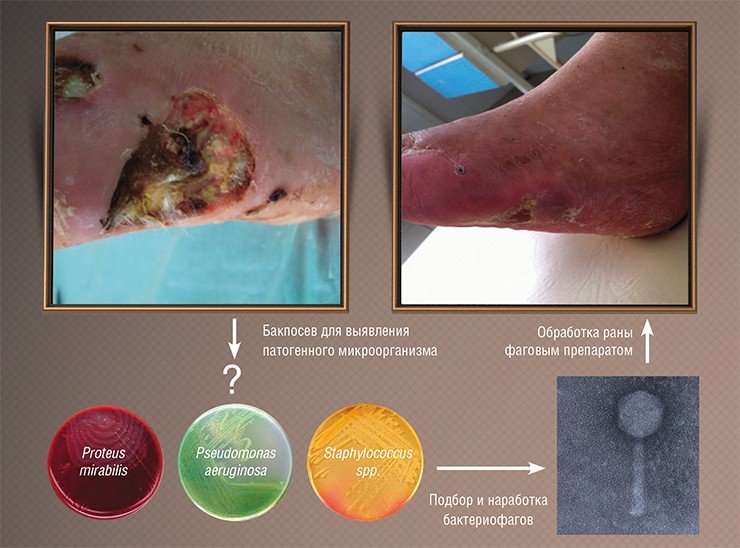
К сожалению, результаты подобных исследований, проводившихся в СССР, не были должным образом документированы и описаны в научной литературе, к тому же они проводились по схемам, не соответствующим принятым на сегодня протоколам клинических испытаний. Тем не менее главные результаты этой работы были бесспорны: фаги доказали свою безопасность и высокую эффективность в реальных условиях и с тех пор используются в нашей стране в клинической практике наряду с обычными лекарственными средствами.

С появлением антибиотиков интерес к фагам на Западе был утрачен, но после появления антибиотикоустойчивых штаммов бактерий в разных странах начали разрабатывать фаговые препараты и проводить испытания, которые, по сути, повторяли исследования, уже проведенные в СССР. Результаты этих работ вновь подтвердили безопасность препаратов бактериофагов, что, в частности, отметило и Управление по контролю за качеством пищевых продуктов и лекарственных препаратов США (FDA).
В Великобритании успешно проведены эксперименты по лечению бактериофагами хронического отита, вызванного нечувствительной к антибиотикам синегнойной палочкой Pseudomonas aeruginosa, а в рамках проекта Phagoburn семь медицинских центров Франции, Бельгии и Швейцарии проводят клинические испытания коктейля фагов для предотвращения инфекций при ожогах. Об испытаниях собственных оригинальных коктейлей фагов для лечения широкого спектра заболеваний сообщает и ряд американских фирм (Intralytix, Enbiotix, AmpliPhi). Правда ни одно из этих масштабных клинических испытаний пока не доведено до конца.
В России препараты бактериофагов можно приобрести в обычной аптеке. Но при этом нужно понимать, что в отличие от других лекарств с точной химической формулой и концентрацией действующих компонентов препарат бактериофага представляет собой нестандартный раствор, содержащий живые вирусные частицы. Даже препарат с одним и тем же названием, но произведенный на разных предприятиях или в разное время, может содержать отличающиеся комбинации и (или) пропорции фагов.
Поэтому покупать препарат бактериофага, чтобы лечиться самостоятельно, не стоит. Назначить лечение и выбрать лекарство должен специалист. Спектр заболеваний, которые можно лечить бактериофагами широк: трофические язвы, ожоговые и раневые инфекции, инфекции органов дыхания, мочеполовой системы и желудочно-кишечного тракта, остеомиелит и т. п. Возбудителями болезней во всех этих случаях служат такие печально известные бактерии, как золотистый стафилококк, включая лекарственно устойчивые штаммы, синегнойная палочка, патогенные формы кишечной палочки, сальмонеллы, протеи, стрептококки и др. В принципе в природе можно найти бактериофаг против любой бактерии, включая возбудителей чумы и сибирской язвы. Можно применять бактериофаги и для профилактики бактериальных инфекционных болезней, например, они были успешно использованы в детских садах и школах для предотвращения эпидемии дизентерии.

Основная же и главная причина неудач – неумелый подбор фагов для лечения конкретных пациентов. Каждый конкретный фаг эффективен против одного или максимум нескольких штаммов бактерий, а у разных пациентов схожая по внешнему проявлению инфекция, например, ангина может быть вызвана разными штаммами стрептококка. Чтобы вылечить больного, необходимо выделить культуру патогена и протестировать ее на чувствительность к конкретным фагам. То есть терапия бактериофагами должна проводиться с использованием принципов персонализированной медицины, к чему современная медицина практически не готова.

На пути к персонализированной Фаготерапии
Опыт СССР, Грузии и Польши показал, что для успешного применения бактериофагов нужны не только клиника, но и производственно-лабораторный участок, располагающий коллекцией фагов и специалистами, способными идентифицировать бактерии, подбирать и выделять бактериофаги для конкретного пациента.
Но в таком случае имеет ли смысл масштабное производство фаговых препаратов? Ответ – да, потому что проблема узкой специфичности фагов частично решается производством фаговых коктейлей из нескольких (иногда десятков) разных фагов, поражающих разные штаммы целевого возбудителя. Ведь подобрать для больного нужный фаговый коктейль быстрее и проще, чем тестировать отдельные фаги из большой коллекции.
И все же не надо думать, что бактериофаги полностью заменят антибиотики – эти препараты дополняют друг друга, и применяться они должны в разных ситуациях. Когда больной находится в тяжелом состоянии, и есть уверенность, что причиной служит бактериальная инфекция, времени на эксперименты и подбор препаратов нет. Единственно правильное решение в этой ситуации – антибиотик широкого спектра действия.
Но в ситуации хронической инфекции или инфекции, вызванной бактериями со множественной устойчивостью к антибиотикам, предпочтение следует отдавать бактериофагу. В случае таких затяжных болезней, как отит, у врача есть время, чтобы использовать фаговый коктейль или специально подобрать фаг. Или же, когда после операции больной поражается антибиотикоустойчивым бактериальным штаммом, и его состояние быстро ухудшается, фаготерапия может стать единственным спасением.
Богатый опыт применения бактериофагов в клинической практике, накопленный за последние сто лет, свидетельствует о перспективности фаговых медицинских технологий. Дальнейшая работа специалистов из множества компаний, работающих сегодня в этой области, и применение методов синтетической биологии обязательно приведут к созданию препаратов с несравненно большей эффективностью по сравнению с современными фаговыми коктейлями.
Тем не менее, биотехнологи, также как ученые и медики, надеются, что безвредные и эффективные препараты все же займут свое законное место в арсенале терапии инфекционных заболеваний.
Алешкин А. В. Бактериофаги в инфекционной патологии: прошлое, настоящее и будущее // Лекции по исследованию и применению бактериофагов. 2016. Ульяновск. С. 11—51.
Козлова Ю. Н., Репин В.Е., Анищенко В.В., Власов В.В. и др. Штамм бактериофага Pseudomonas aeruginosa, используемый в качестве основы для приготовления асептического средства против синегнойной палочки. // Патент РФ №2455355. 2012.
Козлова Ю. Н., Морозова В. В., Тикунова Н. В. и др. Штамм бактериофага Staphylococcus aureus SA20, обеспечивающий разрушение биопленок, образуемых бактериями рода Staphylococcus // Патент РФ № 2565824. 2015.
Морозова В. В., Козлова Ю. Н., Тикунова Н. В. и др. Штамм бактериофага Citrobacter freundii CF17, способный лизировать патогенные штаммы Citrobacter freundii // Патент РФ № 2565559. 2015.
Тикунова Н. В., Морозова В. В. Фаговый дисплей на основе нитчатых бактериофагов: применение для отбора рекомбинантных антител // Аcta Naturae. 2009. № 3. С. 6—15.
Тикунова Н. В. и Власов В. В. Бактериофаги – враги наших врагов // Наука из первых рук. 2013. № 2(50). С. 58—69.
Покровская М. П. Каганова Л. С., Морозенко М. А. и др. Лечение ран бактериофагом. М.: НАРКОМЗДРАВ СССР, МЕДГИЗ. 1941. 57 с
Górski A. et al. Phages targeting infected tissues: novel approach to phage therapy. // Future Microbiol. 2015. V. 10. P. 199—204.
Międzybrodzki R. et al. Clinical aspects of phage therapy // Adv. Virus. Res. 2012. V. 83. P. 73—121.
В публикации использованы иллюстрации из книги Лечение ран бактериофагом. М.: НАРКОМЗДРАВ СССР, МЕДГИЗ. 1941. 57 с.
Владелец регистрационного удостоверения:
ГлаксоСмитКляйн Трейдинг, ЗАО (Россия)
Код ATX: J07BC01 (Hepatitis B, purified antigen)
Активное вещество: вакцина против гепатита В рекомбинантная (hepatitis B vaccine (rDNA))
Ph.Eur. Европейская Фармакопея
сусп. д/в/м введения 20 мкг/доза: фл. 1 мл (1 доза) 1, 25 или 100 шт.
Суспензия для внутримышечного введения
1 мл (1 доза)
HBS-протеин, являющийся основным поверхностным антигеном вируса гепатита B (HBsAg)
0.5 мл (0.5 дозы) — флаконы (1) — пачки картонные.
0.5 мл (0.5 дозы) — флаконы (25) — пачки картонные.
0.5 мл (0.5 дозы) — флаконы (100) — пачки картонные.
1 мл (1 доза) — флаконы (1) — пачки картонные.
1 мл (1 доза) — флаконы (25) — пачки картонные.
1 мл (1 доза) — флаконы (100) — пачки картонные.
Клинико-фармакологическая группа: Вакцина для профилактики гепатита В
Фармако-терапевтическая группа: МИБП-вакцина
Приведенная научная информация является обобщающей и не может быть использована для принятия решения о возможности применения конкретного лекарственного препарата.
Вакцина против гепатита B. Способствует выработке иммунитета против вируса гепатита В. Представляет собой очищенный основной поверхностный антиген вируса гепатита B (HBsAg), полученный с помощью технологии рекомбинантной ДНК и адсорбированный на алюминия гидроксиде. Антиген продуцируется культурой дрожжевых клеток (Saccharomyces cerevisiae), полученных методом генной инженерии и имеющих ген, кодирующий основной поверхностный антиген вируса гепатита В. От дрожжевых клеток HBsAg очищен с помощью нескольких последовательно применяемых физико-химических методов.
HBsAg спонтанно трансформируется в сферические частицы диаметром 20 нм, содержащие негликозилированные HBsAg полипептиды и липидную матрицу, состоящую, главным образом, из фосфолипидов. Исследования показали наличие у этих частиц свойств, характерных для природного HBsAg.
Вызывает образование специфических HBs-антител, которые в титре 10 МЕ/л предупреждают заболевание гепатитом В.
Проведение активной иммунизации детей и взрослых против гепатита В, в первую очередь лиц, подверженных риску заражения вирусом гепатита В.
Проведение активной иммунизации против гепатита В в областях с низкой заболеваемостью рекомендуется для новорожденных детей и подростков, а также лиц с повышенным риском инфицирования, к которым относятся:
- дети, рожденные матерями-носителями вируса гепатита В;
- персонал медицинских и стоматологических учреждений, включая сотрудников клинических и серологических лабораторий;
- пациенты, которым проводится или планируются переливание крови и ее компонентов, плановые хирургические вмешательства, инвазивные лечебные и диагностические процедуры;
- лица, у которых повышенный риск заболевания связан с их сексуальным поведением;
- наркоманы;
- лица, направляющиеся в регионы с широким распространением гепатита В;
- дети в регионах с широким распространением гепатита В;
- пациенты с хроническим гепатитом С и носители вируса гепатита С;
- больные серповидно-клеточной анемией;
- пациенты, у которых планируется трансплантация органов;
- лица, злоупотребляющие алкоголем;
- лица, имеющие тесный контакт с больными или носителями вируса, и все лица, которые в связи с работой или по каким-либо другим причинам могут быть инфицированы вирусом гепатита В.
Проведение активной иммунизации против гепатита В в областях со средней или высокой частотой заболеваемости гепатитом В, где существует риск инфицирования для всей популяции, вакцинация необходима (помимо всех перечисленных выше групп) для всех детей и новорожденных, а также подростков и лиц молодого возраста.
Коды МКБ-10
Вакцина применяется в соответствии с принятой в стране схемой иммунизации.
Доза вакцины зависит от возраста пациента.
Местные реакции: незначительная болезненность, эритема и уплотнение в месте введения препарата.
Со стороны организма в целом: редко — слабость, лихорадка, недомогание, гриппоподобные симптомы; в отдельных случаях — лимфаденопатия.
Со стороны ЦНС и периферической нервной системы: редко — головная боль, головокружение, парестезии; в отдельных случаях — невропатия, паралич, неврит (включая синдром Гийена-Барре, неврит зрительного нерва и рассеянный склероз), энцефалит, энцефалопатия, менингит, судороги, хотя причинно-следственная связь этих осложнений с прививкой не установлена.
Со стороны пищеварительной системы: редко — тошнота, рвота, диарея, боль в животе, изменения показателей функции печени.
Со стороны костно-мышечной системы: редко — артралгия, миалгия; в отдельных случаях — артрит.
Аллергические реакции: редко — сыпь, зуд, крапивница; в отдельных случаях — анафилаксия, сывороточная болезнь, ангионевротический отек, многоформная эритема.
Со стороны сердечно-сосудистой системы: в отдельных случаях — синкопальные состояния, артериальная гипотензия, васкулит.
Прочие: в отдельных случаях — тромбоцитопения, бронхоспазм.
Побочные реакции имеют слабовыраженный и преходящий характер. Во многих случаях причинно-следственная связь побочных явлений с введением вакцины не установлена.
Острые и тяжелые заболевания, а также тяжелые инфекционные заболевания, сопровождающиеся лихорадкой; проявление реакции гиперчувствительности на предыдущее введение вакцин против гепатита В.
Препарат используется для проведения активной иммунизации детей и взрослых против гепатита В. Вакцина не предотвращает инфекции, вызванной другими возбудителями, например гепатита А, гепатита С и гепатита Е, а также возбудителями, вызывающими другие заболевания печени.
Обычно у людей старше 40 лет гуморальный иммунный ответ менее выражен, поэтому таким пациентам может потребоваться введение дополнительных доз вакцины.
В связи с длительным инкубационным периодом гепатита В возможно наличие скрытой инфекции вируса гепатита В во время проведения курса вакцинации. В таких случаях применение вакцины не может предотвратить заболевание гепатитом В.
Вакцина не предотвращает инфекции, вызванной другими возбудителями, например гепатита А, гепатита С и гепатита Е, а также возбудителями, вызывающими другие заболевания печени.
Иммунный ответ на вакцинацию связан с разными факторами, в т.ч. возраст, пол, ожирение, курение и способ введения вакцины. Обычно у людей старше 40 лет гуморальный иммунный ответ менее выражен, поэтому таким пациентам может потребоваться введение дополнительных доз вакцины.
У пациентов, находящихся на гемодиализе, у ВИЧ-инфицированных пациентов и у лиц с другими нарушениями иммунитета, адекватный титр HBs-антител может быть не достигнут после проведения основного курса иммунизации, поэтому может потребоваться дополнительное введение вакцины.
При введении вакцины необходимо иметь в наличии средства, которые могут потребоваться при возникновении анафилактических реакций. Аллергические реакции могут развиться непосредственно после введения вакцины, в связи с чем привитые пациенты должны находиться в течение 30 мин под медицинским наблюдением.
При наличии инфекционного заболевания в легкой форме вакцинация может быть проведена сразу после нормализации температуры.
Бактериофаги – это специфические вирусы, разрушающие патогенные и условно-патогенные для человеческого организма бактерии. Эти микроорганизмы безопасны для человека, то есть не могут вызвать развитие заболеваний.
Бактериофаги могут применяться как для лечения, так и для профилактики кишечной патологии.
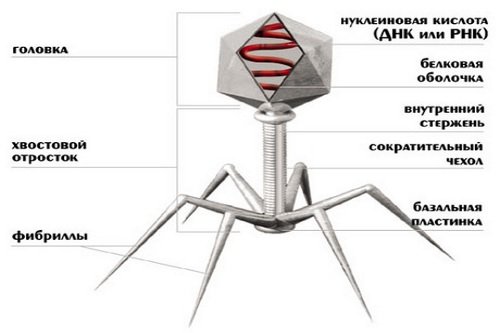
Виды бактериофагов
Классифицируют бактериофаги в зависимости от свойств вируса, входящих в его состав, а также в зависимости от бактерии, которую этот фаг может уничтожить.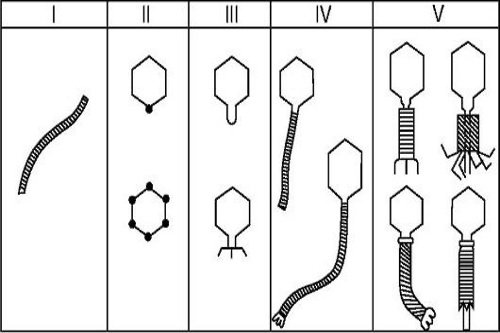
Бактериофаги специфичны в своем воздействии, то есть эффективны по отношению к какой-то одной (реже нескольким) патогенным бактериям. В зависимости от возбудителя, в отношении которого действует бактериофаг, выделяют такие его виды:
- брюшнотифозный (против Salmonella typhi);
- дизентерийный (против Shigella);
- клебсиеллезный (против Klebsiella);
- колифаг (против Escherichia coli);
- протейный (против Proteus);
- синегнойный (против Pseudomonas aeruginosa);
- стафилококковый (против Staphylococcus);
- интести (поливалентный фаг против сальмонелл, шигелл, стафилококков, синегнойной палочки и эшерихий);
- пиобактериофаг (комбинированный и моновалентный).
Разделяют также бактериофаги по количеству компонентов: моновалентный (против одного вида патогенных бактерий) и поливалентный (комплексного действия, против нескольких видов бактерий).
Для чего применяются?
Бактериофаги применяются в комплексном лечении и профилактике кишечных инфекций. Их использование целесообразно при:
- повторяющихся эпизодах кишечных инфекций;
- резистентности к антибиотикам;
- аллергических реакциях на антимикробные препараты;
- возможном риске тяжелых системных реакций;
- тяжелой сопутствующей хронической патологии;
- маленьком возрасте пациента (до 1 года).
Целесообразность применения того или иного бактериофага определяет врач-инфекционист или гастроэнтеролог. Для начала такого специфического лечения необходимо специфическое подтверждение диагноза кишечной инфекции, то есть обнаружение патогенной бактерии в биологической жидкости пациента.
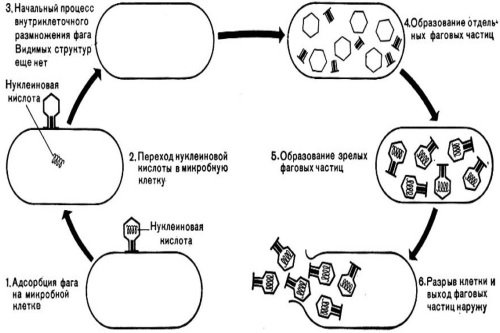
Механизм действия бактериофагов
По механизму действия различают такие виды:
- Умеренные бактериофаги. Внедряются в бактериальную клетку, изменяют некоторые процессы ее метаболизма, но не оказывают прямого цитопатического эффекта. Клетка патогенной бактерии погибает в результате прекращения важнейших биохимических реакций.
- Вирулентные (патогенные) бактериофаги. Разрушают клетку патогенной бактерии, то есть вызывают ее лизис, поэтому называются фаголизатами. После разрушения патогенной бактериальной клетки наружу выходят фаговые клетки, которые могут заражать и разрушать новые бактериальные клетки.

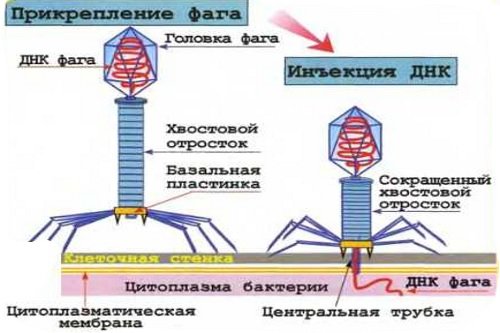
Бактериофаги, даже поливалентные не оказывают какого-либо воздействия на собственную нормальную микрофлору кишечника. Все виды фаголизатов действуют только в просвете кишечника, то есть не всасываются и не попадают в системный кровоток. Именно поэтому вероятность побочных эффектов у пациентов любого возраста практически нулевая.
Преимущества и недостатки бактериофагов
| Преимущество бактериофагов | Недостатки бактериофагов |
|
|
Некоторые преимущества бактериофагов можно рассматривать как оборотную сторону медали, то есть определенное достоинство рассматривается как недостаток.
Препараты бактериофагов
Бактериофаги классифицируют в зависимости от возможности уничтожить определенный вид бактерии. В настоящее время наиболее часто используются:
Многие бактериофаги используются перорально и в клизмах, допускается сочетанное применение. В любом случае исключаются внутримышечные и внутривенные инъекции. Бактериофаг имеет нейтральный вкус, поэтому не вызывает отвращения при употреблении.
Сравнение бактериофагов и антибиотиков
Сравнивать бактериофаги и антибиотики не совсем правильно, так как это разные фармацевтические группы. Следует отметить несколько наиболее важных моментов:
- антибиотики обладают широким спектром действия (против многих бактерий), а бактериофаги узкоспецифичны;
- для назначения бактериофага нужно знать вид микроба, а при антибиотикотерапии это не всегда важно;
- длительность применения бактериофагов больше, чем антибиотиков;
- к бактериофагам не развивается устойчивость, а к антибиотикам развивается;
- бактериофаги не вызывают системных побочных эффектов в отличие от антибиотиков;
- бактериофаги можно применять пациентам любого возраста, а антибиотики имеют возрастные ограничения.
Решающее слово в выборе антибиотика или бактериофага принадлежит врачу.
Можно ли принимать препараты бактериофагов для профилактики?
Бактериофаги – это лекарственные средства для лечения и профилактики кишечных инфекций. Следует отметить, что профилактический эффект бактериофага сохраняется недолго – не более суток. Для предотвращения заражения тем или иным возбудителем кишечной инфекции необходимо постоянно пить бактериофаг, что технически невозможно.
Целесообразно использовать это лекарственное средство при высоком риске инфицирования, например, при непосредственном контакте с больным кишечной инфекцией.
Место бактериофагов в терапии инфекционных заболеваний желудочно-кишечного тракта
Наиболее дискутабельным остается вопрос о целесообразности использования антимикробных препаратов (АМП) в лечении бактериальных ОКИ у детей. Назначая АМП в этих случаях, врач ожидает: уменьшения выраженности клинических симптомов, сокращения продолжительности заболевания, снижения частоты развития осложнений, прекращения выделения возбудителя, предупреждения дальнейшего распространения инфекции [4, 5].
В то же время доказано, что использование антибиотиков далеко не всегда является эффективным и безопасным при бактериальной диарее. Так, при энтерогеморрагическом эшерихиозе применение АМП приводит к массивному высвобождению шигаподобного токсина, следовательно, увеличивает риск развития гемолитико-уремического синдрома [6].
Назначение АМП при бактериальных диареях в значительном проценте случаев не только не приводит к санации макроорганизма от возбудителя, а, наоборот, способствует продолжительной персистенции бактериального агента в желудочно-кишечном тракте (ЖКТ) вследствие не только подавляющего влияния на аутохтонную микробиоту кишечника, но и прямого иммуносупрессивного действия [7, 8]. По данным отечественных и зарубежных исследователей, затяжное реконвалесцентное бактериовыделение сальмонелл формируется у значительного числа пациентов, получавших антибиотики в острую фазу инфекции, по сравнению с лицами, использующими исключительно
патогенетическую терапию [9, 10].
Экономический ущерб, наносимый возникновением антибиотикорезистентных форм бактерий, исчисляется десятками и сотнями миллионов долларов. Например, в странах Евросоюза он составляет как минимум 1,5 млрд. евро в год [11]. В сложившейся ситуации альтернативу АМП в терапии бактериальных диарей могут составить бактериофаги [12, 13].
Необходимо отметить, что в медицинском сообществе в настоящее время присутствует две полярные точки зрения на роль и место бактериофагов в терапии инфекционных заболеваний. Часть специалистов, ориентируясь на зарубежные протоколы и гадлайны, считают использование бактериофагов архаичным и небезопасным наследием прошлых десятилетий советской медицины; другие – широко применяют препараты фагов в своей клинической практике без каких-либо сомнений и при этом не опираются на исследования чувствительности и эффективности терапии.
Автору пришлось неоднократно беседовать с представителями обеих групп специалистов, и оказалось, что в большинстве случаев мало кто из них мог правильно ответить на вопрос, что представляют собой бактериофаги и каков их механизм действия. Бактериофаги – это вирусы, избирательно поражающие бактериальные клетки. В первую очередь необходимо понимать, что бактериофаги – это древние обитатели планеты и каждый грамм почвы, каждый кубический сантиметр воды и воздуха, продукты питания,
растения, животные содержат миллионы фаговых частиц (от 10 до 100 млн). Фаговые частицы в огромном количестве содержатся на кожных покровах, слизистых оболочках и в открытых полостях организма человека. Бактериофаги – самые вездесущие и наиболее распространенные существа на Земле, их насчитывают 1030–1032. Доказано, что бактериофаги играют важную роль в эволюции бактерий и реализации их патогенных свойств. Фаги способствуют формированию генетического разнообразия бактерий [14–16].
Выделяют вирулентные и умеренные бактериофаги. Вирулентные фаги: заражение бактерий ими всегда заканчивается разрушением бактерий и высвобождением зрелых фаговых частиц, готовых к поражению новых бактериальных клеток, – литический эффект. Умеренные бактериофаги: генетический материал фагов включается в хромосомы бактерий, такие фаги называются профагами и вызывают лизогенный эффект (лизогенную конверсию). Умеренные фаги интегрируются в бактериальную хромосому и размножаются синхронно с клеткой хозяина, не вызывая лизиса долгое время. Умеренные фаги могут переносить хозяйские гены (гены бактериальной клетки) от одной
бактериальной клетки к другой (фаговая трансдукция).
В настоящее время доказано, что множество факторов вирулентности у патогенных и условно-патогенных бактерий закодировано с помощью профаговых генов.
Так у Vibrio cholerae, Clostridium botulinum продукция токсинов обусловлена профагами [15, 16].
Бактериофаги – это высокоэффективные иммунобиологические препараты антимикробного действия, применяются для лечения и профилактики бактериальных инфекций, в том числе инфекций, связанных с оказанием медицинской помощи. Антимикробный эффект бактериофагов обусловлен внедрением фага в бактериальную клетку с последующим его размножением и лизисом инфицированной клетки. Вышедшие во внешнюю среду в результате лизиса бактериофаги повторно инфицируют и лизируют другие бактериальные клетки, действуя до полного уничтожения патогенных бактерий в очаге воспаления [14–17]. В настоящее время описано 13 семейств бактериофагов,
подразделенных более чем на 140 родов, содержащих более 5300 видов.
Бактериофаги широко применялись для лечения разных заболеваний с 1920-х годов как в СССР, так и зарубежных странах. Символично, что в 1930–1932 гг. Моррисон впервые применил массовую фаготерапию во время эпидемии холеры в Индии, затем долгие годы ученые считали, что с помощью бактериофагов можно управлять эпидемическим процессом при холере, однако эти мировоззрения оказались ошибочными [18].
Однако с 1940–1950-х годов производство и применение фагов на Западе практически прекратились. Препараты бактериофагов на сегодняшний день производятся лишь в России, Грузии и Польше. Однако в настоящее время интерес к бактериофагам возрождается во всем мире. Так, в 2006 г. Управление по контролю за продуктами и лекарствами Соединенных Штатов разрешило использование бактериофагов Listeria monocytogenes в качестве антимикробного компонента в сырах, а в 2007 г. – во всех готовых к употреблению продуктах. Препарат выпускается компанией Intralytix Inc. (США) и представляет собой смесь из шести фагов, активных в отношении L. monocytogenes. По инициативе этой же компании в 2008 г. была завершена I фаза клинических исследований препарата бактериофагов, содержащего восемь фагов, специфически лизирующих Pseudomonas aeruginosa, S. aureus и E. coli. Показана безопасность этого препарата при лечении венозных язв [18]. В августе 2009 г. корпорацией Nestlé Nutrition (Швейцария) в Бангладеш были инициированы клинические исследования по изучению безопасности и эффективности применения бактериофага E. coli в терапии ОКИ у детей в возрасте от 6 до 60 мес [19].
В настоящее время бактериофаги используются в качестве АМП при разных бактериальных инфекциях: желудочно-кишечного тракта (ЖКТ), ЛОР-органов, органа зрения, дыхательных путей, урогенитального тракта, генерализованных септических заболеваний, ожоговых ранах, хирургических инфекциях; для профилактики инфекций, связанных с оказанием медицинской помощи [20].
Фаги проникают через эпителиальные барьеры слизистых оболочек с помощью рецепторзависимого транспорта, активно осуществляемого специализированными клетками иммунной системы (М-клетками, бокаловидными) и, возможно, клетками эпителия кишечника и других отделов ЖКТ. Бактериофаг, введенный любым способом, поступает в общий ток крови, в крови не задерживается и адсорбируется тканями, оседая в первую очередь в лимфатических узлах, печени и селезенке. Выводится фаг из организма через кишечник и почки. После перорального приема фаговые частицы обнаруживаются через 1 ч в образцах крови, через 1–1,5 ч – на поверхности ожоговых ран и в бронхиальном содержимом, через 2 ч – в ликворе и моче. После однократного приема больными пациентами фаги выделялись с мочой в течение 5–6 сут с постепенным уменьшением титра. Гематоэнцефалический барьер не является барьером для проникновения фагов в центральную нервную систему. Необходимо отметить, что
скорость транслокации фагов, так же как и бактерий из ЖКТ в кровь, может существенно меняться в разных физиологических состояниях. При воспалительном ответе транслокация бактерий и, вероятно, фагов из кишечника значительно увеличивается [18].
Бактериофаги, используемые в составе лечебно-профилактических препаратов, должны иметь литический цикл развития (т.е. быть вирулентными), вследствие которого происходит гибель бактериальной клетки-мишени. По определенным участкам генов, кодирующим белок капсида бактериофага, можно быстро и с известной долей вероятности определить его принадлежность к семействам литических фагов.
В 1920–1940 гг. в Канаде и США бактериофаги широко использовались для лечения дизентерии, брюшного тифа и сальмонеллеза. Причем большинство исследователей показали их хорошую клиническую эффективность, в первую очередь снижение смертности на 30% и более по сравнению с группой сравнения [18].
Традиционной формой выпуска бактериофагов является жидкий препарат (кроме таблетированных форм кишечных фагов), поэтому фаги используют для приема через рот, в виде клизм, аппликаций, орошений, введения в полости ран, вагины, носа, а также путем введения в дренированные полости – брюшную, плевральную, мочевого пузыря, почечной лоханки [18, 20].
Препараты бактериофагов при энтеральном и ректальном пути введения безопасны и нетоксичны для человека. Они не имеют противопоказаний к применению, кроме аллергических реакций, и могут быть использованы в сочетании с любыми другими лекарственными средствами. Препараты бактериофагов можно назначать беременным, кормящим матерям и детям, начиная с раннего возраста [17, 18, 20, 21]; они эффективны в монотерапии, но могут быть также использованы и в комбинации с антибиотиками [22]. Необходимо отметить, что в раннем детском возрасте (до 3–4 мес) использовать бактериофаги можно только по строгим показаниям, учитывая значимую частоту аллергических и диарейных побочных реакций у детей данной возрастной группы. Следует отметить, что побочные реакции в результате употребления фагов обычно связаны с массивным распадом бактериальных клеток с выделением эндотоксина под действием бактериофага. Нивелировать данные нежелательные явления можно при помощи включения в комплекс терапии энтеросорбентов. При использовании фагов в сочетании с терапевтическими дозами АМП отсутствует негативное воздействие
этих препаратов на развитие бактериофагов, но отмечается взаимное потенцирование их терапевтического эффекта. Установлено, что воздействие фагов на антибиотикоустойчивые штаммы бактерий может быть более активным по сравнению с воздействием на антибиотикочувствительные штаммы того же вида [18, 23].
Следовательно, показания к использованию бактериофагов при ОКИ можно сформулировать следующим образом:
• в качестве монотерапии – при стертых и легких формах инвазивных ОКИ;
• в сочетании с антибактериальной терапией или последовательно – при среднетяжелых и тяжелых формах ОКИ в период обратного развития симптомов;
• при бактериовыделении (у реконвалесцентных или транзиторных бактерионосителей);
• в комплексе терапии энтероколитов условно-патогенной и стафилококковой этиологии у детей раннего возраста;
• для коррекции нарушений микробиоценоза кишечника.
Дозы бактериофагов в зависимости от возраста приведены в табл. 1, 2. Бактериофаги назначаются 2–3 раза в сутки. Поскольку при приеме жидких препаратов бактериофагов перорально происходит частичная инактивация бактериофагов кислой средой желудка, целесообразно производить препараты бактериофагов в таблетках с кислотоустойчивыми капсулами и суппозиториях. В табл. 3 представлены бактериофаги, используемые в Российской Федерации для терапии и профилактики инфекционных диарей.
Очень актуальным является исследование В.Г.Акимкина, посвященное купированию продолжительной нозокомиальной вспышки сальмонеллеза в Главном военном клиническом госпитале им. Н.Н.Бурденко, с использованием адаптированного сальмонеллезного бактериофага как в виде монотерапии, так и в комплексе с АМП фторхинолонового ряда [13, 26]. Таким образом, практика использования лечебнопрофилактических бактериофагов показала необходимость осуществления бактериологического мониторинга за возможными изменениями фаголизабильности по отношению к выделяемым культурам сальмонелл в стационаре. Доказано, что регулярная передача на производство свежевыделенных штаммов возбудителей ОКИ способствует повышению литической активности и расширению диапазона действия препаратов бактериофагов [26–28].
Применение бактериофагов по эпидемиологическим показаниям при ОКИ
Бактериофаги находят свое применение и с профилактической целью при чрезвычайных ситуациях природного характера (наводнения и т.д.), в очагах бактериальной инфекции, в первую очередь шигеллеза, сальмонеллеза и брюшного тифа, заболеваний, вызванных условно-патогенными возбудителями (протеем, синегнойной палочкой) [20].
В эпидемических очагах (шигеллеза, сальмонеллеза) бактериофаги применяют для фагирования детей, посещающих детские дошкольные учреждения, и работников пищевых предприятий, водопроводных и коммунальных сооружений и др. Фагирование всех общавшихся с источником ОКИ проводят при неблагоприятных санитарных условиях в очаге, а также при оставлении больного на дому. В качестве профилактики препараты фагов принимают ежедневно в виде разовой возрастной дозы: детям в возрасте от 1 года до 3-х лет – по 1 таблетке; от 3–8 лет – по 2 таблетки; взрослым – по 3 таблетки. Продолжительность приема как правило определяется
условиями эпидситуации.
Читайте также:


