Аттестационные тесты лабораторная диагностика бешенства животных
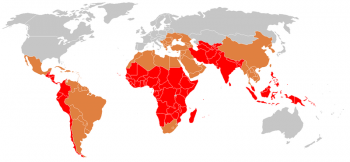
Мировая распространённость брюшного тифа
Итоговая государственная аттестация (ИГА)
Смотрите также тесты для фельдшеров по инфекционным болезням и первую часть вопросов данного теста по инфекционным болезням
№ 51
* 1 -один правильный ответ
Спинно-мозговая пункция производится при подозрении на
1) грипп
2) менингококковую инфекцию
3) сыпной тиф
4) брюшной тиф
! 2
№ 52
* 1 -один правильный ответ
Люмбальную пункцию проводят в положении больного
1) лежа на боку
2) лежа на животе
3) сидя
4) стоя
! 1
№ 53
* 1 -один правильный ответ
Признак отека мозга при менингите
1) температура 39 град. С
2) судороги
3) рвота, приносящая облегчение
4) бледность кожных покровов
! 2
№ 54
* 1 -один правильный ответ
Назофарингит — это форма менингококковой инфекции
1) локализованной
2) генерализованной
3) смешанной
! 1
№ 55
* 1 -один правильный ответ
Отсутствующий признак при менингококовом назофарингите:
1) насморк
2) сухой кашель
3) нормальная температура тела
4) незначительная гиперемия миндалин и небных дужек
! 3
№ 56
* 1 -один правильный ответ
Критерий выписки из стационара больных менингитом — отсутствие
1) головной боли
2) менингиальных знаков
3) слабости
4) тошноты
! 2
№ 57
* 1 -один правильный ответ
Препарат для лечения менингита
1) пенициллин внутримышечно
2) фуразолидон
3) анальгин
4) противосудорожные препараты
! 1
№ 58
* 1 -один правильный ответ
Клинический признак менингита:
1) кашель
2) менингиальные знаки
3) слезотечени
4) сыпь на коже
! 2
№ 59
* 1 -один правильный ответ
Источник инфекции при менингококковой инфекции
1) больное животное
2) менигококконоситель
3) больной человек и менигококконоситель
4) больной человек
! 3
№ 60
* 1 -один правильный ответ
Признак менингококкцемии
1) головная боль
2) насморк
3) геморрагическая сыпь
4) повышение АД
! 3
№ 61
* 1 -один правильный ответ
При подозрении на менингит необходимо провести посев
1) слизи из носоглотки
2) слизи из зева
3) мокроты
4) испражнений
! 1
№ 62
* 1 -один правильный ответ
При подозрении на менингококковую инфекцию используется метод лабораторного исследования
1) бактериологический
2) биологический
3) серологический
4) кожно — аллергический
! 1
№ 63
* 1 -один правильный ответ
Люмбальную пункцию проводят с целью
1) диагностической и лечебной
2) лечебной
3) диагностической
4) профилактической
! 1
№ 64
* 1 -один правильный ответ
При люмбальной пункции точка укола между
1) 4-5 поясничными позвонками
2) 12 грудным и 1 поясничным позвонком
3) 10-11 грудными позвонкам
4) 2-3 поясничными позвонками
! 1
№ 65
* 1 -один правильный ответ
Признаки токсикоинфекционного шока при менингококковой инфекции
1) высокая температура
2) падение АД, отсутствие пульса
3) полиурия
4) гиперемия кожи
! 2
№ 66
* 1 -один правильный ответ
При подозрении на дифтерию необходимо
1) введение противодифтерийной сыворотки
2) осуществление экстренной госпитализации и подача экстренного извещения
3) введение антибиотиков
4) установление карантина на контактных
! 2
№ 67
* 1 -один правильный ответ
Отек подкожной клетчатки при дифтерии зева токсической форме III степени
1) вокруг тонзилярных лимфатических узлов
2) доходит до середины шеи
3) доходит до ключицы
4) спускается ниже ключицы
! 4
№ 68
* 1 -один правильный ответ
Толстая капля крови берется при подозрении на
1) малярию
2) грипп
3) брюшной тиф
4) дизентерию
! 1
№ 69
* 1 -один правильный ответ
Клинический симптом, характерный для малярии
1) резко выраженный катаральный симптом
2) периодические лихорадочные приступы
3) частый жидкий стул
4) резкие боли в животе
! 2
№ 70
* 1 -один правильный ответ
Путь передачи малярии
1) трансмиссивный
2) пищевой
3) воздушно — капельный
4) контактно — бытовой
! 1
№ 71
* 1 -один правильный ответ
Исход ГЛПС (геморрагической лихорадки с почечным синдромом)
1) панкреатит
2) пневмония
3) уремическая кома
4) печеночная кома
! 3
№ 72
* 1 -один правильный ответ
При геморрагической лихорадке с почечным синдромом количество мочи уменьшается в периоде
1) лихорадочном
2) олигурическом
3) полиурическом
4) реконвалесцеции
! 2
№ 73
* 1 -один правильный ответ
Источник инфекции при геморрагической лихорадке с почечным синдромом
1) полевые мыши
2) сельскохозяйственные животные
3) больной человек
4) дикие животные
! 1
№ 74
* 1 -один правильный ответ
Длительность лихорадочного периода при геморрагической лихорадке с почечным синдромом:
1) 1-2 дня
2) 5-8 дней
3) более двух недель
4) более одного месяца
! 2
№ 75
* 1 -один правильный ответ
Характерный болевой синдром при геморрагической лихорадке с почечным синдромом — боль в
1) пояснице
2) мышцах
3) глазах
4) в суставах
! 1
№ 76
* 1 -один правильный ответ
Клинический признак при геморрагической лихорадке с почечным синдромом в олигурическом периоде:
1) боль в пояснице
2) кашель
3) озноб
4) диарея
! 1
№ 77
* 1 -один правильный ответ
Количество суточной мочи при олигурии
1) 200-500 мл
2) 1,5 литра
3) 3-4 литра
4) 5 — 6 литров
! 1
№ 78
* 1 -один правильный ответ
Показания к переводу больного при геморрагической лихорадке с почечным синдромом на искусственную почку
1) сахар в моче
2) лейкоцитоз
3) высокое содержание мочевины в крови + анурия
4) боль в пояснице
! 3
№ 79
* 1 -один правильный ответ
Путь передачи бубонной формы чумы
1) трансмиссивный
2) воздушно — капельный
3) пищевой
4) водный
! 1
№ 80
* 1 -один правильный ответ
При бубонной форме чумы — бубон
1) резко болезненный
2) малоболезненный
3) безболезненный
4) периодически болезненный
! 1
№ 81
* 1 -один правильный ответ
Материал для лабораторного исследования при подозрении на бубонную форму чумы
1) содержимое лимфатического узла
2) кал
3) мокрот
4) рвотные массы
! 1
№ 82
* 1 -один правильный ответ
Признак бубонной формы чумы
1) увеличение лимфатических узлов
2) катаральный синдром
3) диспептический синдром
4) боли в животе
! 1
№ 83
* 1 -один правильный ответ
При укусе блох разовьется клиническая форма чумы
1) кишечная
2) легочная
3) бубонная
4) септическая
! 3
№ 84
* 1 -один правильный ответ
При сыпном тифе сыпь на коже появляется
1)на 8–10 день болезни
2) не раньше 4 и не позднее 6 дня болезни
3) с первого дня болезни
4) 2–3 день болезни
! 2
№ 85
* 1 -один правильный ответ
Болезнь Брилля встречается после перенесенного
1) сыпного тифа
2) брюшного тифа
3) возвратного тифа.
4) после вирусного гепатита
! 1
№ 86
* 1 -один правильный ответ
Профилактика в очаге сыпного тифа
1) дезинсекция, дезинфекция
2) дезинфекция
3) дератизация
! 1
№ 87
* 1 -один правильный ответ
Длительное отсутствие сознания характерно для формы клещевого энцефалита:
1) лихорадочной
2) менингиальной
3) менингоэнцефалитической
4) полирадикулоневрической
! 3
№ 88
* 1 -один правильный ответ
Ведущий клинический симптом бешенства
1) водобоязнь
2) головные боли
3) лихорадка
4) судороги жевательных мышц
! 1
№ 89
* 1 -один правильный ответ
Основной путь передачи при сибирской язве
1) контактный
2) крово — контактный
3) воздушно — капельный
4) алиментарный
! 1
№ 90
* 1 -один правильный ответ
Лечение столбняка
1) антибиотики
2) противостолбнячная антитоксическая сыворотка
3) противосудорожные средства
4) антигистаминные препараты
! 2
№ 91
* 1 -один правильный ответ
Cтолбняк передается через
1) поврежденную кожу
2) неповрежденную кожу
3) верхние дыхательные пути
4) ротовую полость
! 1
№ 92
* 1 -один правильный ответ
При столбняке судороги начинаются с мышц
1) жевательных
2) шеи
3) живота
4) конечностей
! 1
№ 93
* 1 -один правильный ответ
В профилактике столбняка используют
1) анатоксин
2) противостолбнячную сыворотку
3) антибиотики
4) гамма — глобулин
! 1
№ 94
* 1 -один правильный ответ
Для профилактики бешенства применяют
1) антирабическую вакцину + антирабический гамма-глобулин
2) антибиотики
3) антитоксическую сыворотку
4) антирабическую вакцину
! 1
№ 95
* 1 -один правильный ответ
Лечение при бешенстве
1) полный покой + индивидуальный пост
2) первичная хирургическая обработка раны
3) антирабическая вакцина
4) антибиотики
! 1
№ 96
* 1 -один правильный ответ
Признаки особо опасной инфекции:
1) длительная инкубация
2) легкое течение
3) среднетяжелое течение
4) тяжелое течение + высокая летальность
! 4
№ 97
* 1 -один правильный ответ
Профилактика сибирской язвы
1) введение противосибиреязвенного гамма-глобулина, дезинфекция выделений больного
2) уничтожение грызунов
3) дезинфекция выделений больного
4) дезинсекция
! 1
№ 98
* 1 -один правильный ответ
Источник инфекции при роже
1) больной человек и бактерионоситель
2) больные сельскохозяйственные животные
3) грызуны
4) больной человек
! 1
№ 99
* 1 -один правильный ответ
Входные ворота при роже
1) поврежденные кожа и слизистые оболочки
2) неповрежденная кожа
3) ротовая полость
4) верхние дыхательные пути
! 1
№ 100
* 1 -один правильный ответ
Основной возбудитель, вызывающий рожу
1) cальмонелла
2) cтрептококк
3) менингококк
4) стафилококк
! 2
Методы выявления антигенов. При бешенстве для экспресс-диагностики можно использовать методы флуоресцирующих антител (МФА), реакции преципитации (РП) в агаровом геле, методы иммуноферментного анализа (ИФА), полимеразной цепной реакции (ПЦР). Для прижизненной диагностики бешенства у человека требуется несколько тестов.
Определение антител к антигенам вируса бешенства. Выявление антител в сыворотке крови или в цереброспинальной жидкости — важный метод диагностики. Серологическое исследование рабиес-специфических антител проводится в сыворотке крови для определения пред- и постэкспозиционной вакцинации и определения времени бустерной иммунизации с целью повышения иммунного ответа.
Выделение вируса. Для выделения и идентификации вируса используют метод биопробы на белых мышах. Исследуемый материал суспендируют в физиологическом растворе, содержащем антибиотики и эмбриональную сыворотку крупного рогатого скота. Суспензия вводится интрацеребрально белым мышам массой 5–6 г. Для доказательства развития инфекции за мышами ежедневно наблюдают до 30-го дня после инокуляции. Мыши, у которых за этот период развивается заболевание, немедленно подвергаются эвтаназии, и ткани мозга исследуются методом прямой МФА.
Преимущество данного подхода состоит в возможности определить малые количества вируса бешенства в материале. Недостаток метода — необходимость многодневного (7–18 суток) ожидания между инокуляцией и проявлением первых признаков заболевания. Для сокращения инкубационного периода применяют мышей-сосунков. Для экспресс-диагностики можно использовать мышей в возрасте менее 3 дней: у мышей, забитых через 3 дня, уже выявляется антиген вируса в мозге, который можно выявить методом МФА.
Такой метод выделения вируса практикуется в качестве подтверждающего диагностического теста при отрицательных результатах по выявлению антигена и телец Бабеша – Негри и в случае укуса человека подозрительным на бешенство животным. Он обеспечивает надлежащую чувствительность и специфичность, т. е. расценивается на уровне диагностической значимости метода прямой иммунофлуоресценции. Кроме того, этот метод является основным для идентификации вариантов вируса и перспективен для разработки диагностических реагентов.
Выделение и идентификация вируса на культуре клеток. Основным недостатком выделения вируса при инфицировании лабораторных животных является длительность метода. Избежать этого можно при использовании культур клеток. Обычно для этих целей используют культуру клеток нейробластомы мышей, если нужно исследовать ткани головного мозга. Мозг суспендируют в культуральной питательной среде, суспензию наносят на монослой культуры клеток и инкубируют от одного до нескольких дней.
Чувствительность данной культуры к вирусу можно повысить обработкой ее ДЕАЕ декстраном. Монослой клеток затем отмывают, фиксируют на холоде ацетоном или смесью формалина с метанолом и исследуют методом иммунофлюоресценции. Если животное было инфицировано вирусом бешенства, то в монослое культуры клеток выявляются цитоплазматические включения антигена вируса бешенства.
Показано, что на клетках мышиной нейробластомы линии Na C1 300 в сочетании с МФА антиген вируса бешенства можно выявить через 2 дня. Чувствительность метода сравнима с методом изоляции вируса на мышах.
Хотя вирус бешенства обладает облигатной нейропатогенностью in vivo, он способен инфицировать широкий круг клеток-хозяев in vitro, что можно использовать для исследования других тканей и органов на наличие вируса бешенства. Установлено, что вирус бешенства размножается в клетках ВНК-21 и Vero, в первичных клетках куриных эмбрионов или почек хомяка. Показано, что адсорбция вируса и внедрение его в клетку происходят в течение 7 часов. Через 24–48 часов внутри клетки образуются новые вирусные частицы, через 72 часов происходит почкование их из клеточной оболочки в межклеточное пространство.
Для экспресс-диагностики бешенства могут быть использованы:
а) метод МФА — для выявления антигена вируса бешенства в отпечатках роговицы или заднего отдела шеи больного, содержащего луковицы волос;
б) метод ПЦР — для выявления РНК вируса в биоптатах тканей, слюне, спинномозговой или слезной жидкости;
в) метод ИФА — для выявления специфических антител (антигена) у больных с типичным или атипичным течением.
г) метод биопробы — для выделения вируса на ранних этапах заболевания или для выявления антител в крови или спинномозговой жидкости на поздних стадиях заболевания. Для экспресс-диагностики используется комплексный метод (биопроба + МФА), заключающийся в заражении исследуемым материалом 2-дневных новорожденных мышей и исследования их мозга на 3–4-е сутки в МФА.
Выбор методов прижизненной диагностики в значительной мере зависит от стадии болезни: метод, основанный на выявлении антигенов, как правило, обладает высокой чувствительностью в конце инкубационного периода, в течение первых нескольких дней заболевания, в то время как вируснейтрализующие антитела обычно появляются в спинномозговой жидкости и сыворотке крови после 7-10 дней от начала болезни.
Реакция иммунофлюоресценции. Метод основан на использовании антител, связанных с красителем, например, флюоресцеинизотиоцианатом. РИФ широко применяется для выявления вирусных антигенов в материале больных и для быстрой диагностики.
Метод обладает наиболее высокой степенью чувствительности, он положен в основу экспресс-диагностики и позволяет обнаруживать вирусные антигены в течение нескольких часов
Основные достоинство МФА: быстрота выполнения, высокая специфичность (100%). Затрачиваемое время на диагностику заболевания с его помощью — менее одного дня. Применяются прямой и непрямой варианты МФА.
Прямая иммунофлуоресценция остается наиболее предпочитаемым методом диагностики бешенства. Предметные стекла, содержащие мазки-отпечатки тканей мозга, или стекла с монослоем культуры тканей фиксируют в ацетоне в течение 1–4 часов. Затем препараты высушивают и обрабатывают флуоресцирующими поликлональными антинуклеокапсидными антителами (иммунофлуоресцентный реагент).
Этот реагент представляет собой конъюгат, приготовленный из специфических поликлональных антител IgG класса к нуклеокапсидному антигену вируса и флуоресцеина изоцианата (ФИТЦ). Специфические антитела получают путем гипериммунизации животных (кроликов, хомяков или лошадей) смесью эпитопов нуклеокапсида вируса.
В настоящее время для этих целей все шире используют мышиные моноклональные антитела к нуклеокапсиду вируса бешенства. После 30-минутной инкубации при 37° С диагностические препараты многократно отмывают физиологическим раствором и дистиллированной водой.
Антитела, меченные ФИТЦ, фиксируются только в местах локализации вирусных нуклеопротеидных антигенов. Затем препараты высушивают на воздухе и исследуют методом световой микроскопии, используя в качестве источника света ксеноновую лампу и соответствующий фильтр.
При непрямом варианте антиген сначала соединяют с неокрашенной специфической иммунной сывороткой. Затем на образовавшиеся нефлуоресцирующие комплексы антиген-антитело воздействуют меченой флуорохромом иммунной сывороткой, содержащей антитела к белкам специфической сыворотки. Непрямой вариант МФА наряду с выявлением антигена позволяет количественно определять антитела в исследуемой сыворотке путем соответствующего ее разведения.
Меченые ФИТЦ образования в клетках разных тканей выявляются в виде желто-зеленого флуоресцентного окрашивания на темном фоне (в виде округлой или овальной формы внутрицитоплазматических включений).
Иммуноферментный анализ. Метод основан на принципе сорбции белков на твердой фазе с последующим образованием комплексов антиген-антитело, выявляемых субстрат-индикаторным раствором. Добавляемый в лунки антиген специфически связывается с антителами. На слой антигена наносят исследуемые сыворотки в нужных разведениях. При наличии в них специфических антител последние связываются с антигеном. Для выявления связывания на слой антител наносят иммуноглобулин против глобулинов сыворотки людей, коньюгированный с пероксидазой хрена. Количество сорбирующего коньюгата пропорционально количеству связавшихся с антигеном антител сывороток людей. Это можно определить, используя индикаторный раствор (ортофенилилендиамин + перекись водорода), компоненты которого в результате действия пероксидазы коньюгата окрашивают жидкость в коричнево-желтый цвет. При обследовании неясных случаев применение ИФА дополнительно к методам РП или РСК позволяет увеличить достоверность лабораторной диагностики бешенства, благодаря большой чувствительности этого метода. Метод позволяет обнаруживать инфекционные и дефектные частицы.
Для определения антирабических антител в процессе вакцинации можно применять непрямой метод ИФА, используя в качестве антигена очищенный вирус, а для определения антител класса IgG в человеческой сыворотке — А-белок стафилококка, связанный с пероксидазой хрена. Результаты ИФА сравнимы с полученными в тестах вирусной нейтрализации на мышах. Метод позволяет выявлять присутствие IgМ в начале процесса иммунизации.
Иммуноферментные методы — весьма перспективны для выявления нуклеокапсидного антигена вируса при посмертной диагностике в тканях головного мозга. В их числе, например, быстрый иммуноферментный метод диагностики бешенства, основанный на приготовлении плашек сенсибилизированных антителами IgG изотипа к нуклеокапсиду первого серотипа, разведенных в карбонатном буфере.
Материал для исследования гомогенезируют в буфере или культуральной среде, осветляют центрифугированием, вносят в лунки и инкубируют в плашках. Фиксированный специфическими антителами нуклеокапсидный антиген идентифицируют добавлением пероксидазного конъюгата с антинуклеокапсидными противорабическими антителами иной видоспецифичности и хромогенного субстрата. Чувствительность метода составляет 0,8–1,0 нг/мл.
Этим методом можно выявлять антигены вирусов различных серотипов. Применение конъюгатов нуклеокапсидспецифичных антител, меченых биотином, повышает чувствительность метода до 0,1–0,2 нг/мл.
Методом ИФА успешно выявляется антиген нуклеокапсида [139], но материал, даже разложившийся, не должен фиксироваться формалином.
Метод полимеразной цепной реакции. Для экспресс-диагностики вируса бешенства и идентификации лиссавирусов наиболее удобен метод полимеразной цепной реакции (ПЦР). Метод ПЦР — самый надежный и быстрый для выделения вирионной РНК из любых проб, содержащих вирус в низкой концентрации. С его помощью можно создать много копий РНК вируса. Этот метод используется для подтверждения результатов МФА и для определения вируса в слюне, луковицах волос заднего отдела шеи и головы.
ПЦР основана на принципе естественной репликации ДНК. Суть метода заключается в многократном повторении циклов синтеза (амплификации) вирусоспецифической последовательности ДНК с помощью термостабильной Taq ДНК-полимеразы и двух специфических затравок, так называемых праймеров.
Каждый цикл состоит из трех стадий с различным температурным режимом. В каждом цикле удваивается число копий синтезируемого участка. Вновь синтезированные фрагменты ДНК служат в качестве матрицы для синтеза новых нитей в следующем цикле амплификации, что позволяет за 25–35 циклов наработать достаточное число копий выбранного участка ДНК для ее определения, как правило, с помощью электрофореза в агарозном геле.
Особенно высокая чувствительность ПЦР при использовании праймеров, комплементарных N-гену, когда удается выявлять РНК вируса в пробах, содержащих вирус в титре 10 МЛД50. Методом ПЦР можно выявлять РНК вируса даже в разложившемся патологическом материале.
В настоящее время разработаны и широко используются на практике подтверждающие (конфирматорные) тесты, такие как ПЦР в обратно-транскриптазном исполнении (ОТ-ПЦР). Метод ОТ-ПЦР — высокочувствительный и наиболее эффективный. РНК экстрагируется из тканей инфицированного вирусом органа, транскрибируется в кДНК, которая затем амплифицируется методом ПЦР. Для постановки ОТ-ПЦР необходимы праймеры, полученные к консервативным областям генома вируса бешенства. Обычно используются гены, кодирующие нуклеопротеин или N-белок.
Метод ПЦР высокоспецифичен и очень чувствителен. Является одним из наиболее точных тестов детекции рабического антигена, позволяет диагностировать бешенство даже при наличии в материале хотя бы одного вириона. В основе теста лежит комплементарное достраивание РНК-матрицы, осуществляемое in vitro с помощью фермента РНК-полимеразы. В последние годы ПЦР находит все более широкое применение для диагностики и мониторинга вирусных инфекций. Однако методика проведения сложна, дорогостояща и пока недостаточно унифицирована для рутинного применения.
Цитологические методы в настоящее время имеют ограниченное диагностическое значение, но при ряде инфекций по-прежнему должны применяться. Исследуются материалы аутопсии, биопсии, мазки, которые после соответствующей обработки окрашиваются и анализируются под микроскопом. При бешенстве — это выявление включений в цитоплазме клеток (тельца Бабеша – Негри).
Результативность методов диагностики бешенства может варьировать в зависимости от ряда факторов (стадии болезни, сроков забора материала, качества полученных проб, условий их хранения, опытности персонала, качества реактивов и др.). Если положительный результат подтверждает бешенство, то отрицательный не всегда свидетельствует об отсутствии болезни. Поэтому при бешенстве эксперты ВОЗ рекомендуют использовать несколько тестов, особенно МФА в сочетании с биопробой на новорожденных (2–3 дневных) белых мышах.
Меры личной профилактики
Все работы с материалом, предположительно содержащим вирус бешенства, равно как и с животными, подозрительными на бешенство, должны проводиться с соблюдением мер личной безопасности. Медицинские работники и ветеринарные врачи должны работать в халатах, перчатках, масках.
По окончанию работы боксы обрабатывают 3% раствором перекиси водорода.
Средства индивидуальной защиты обеззараживают кипячением или автоклавированием. Рабочую поверхность стола и руки обеззараживают дезраствором (0,5% раствор хлорамина).
Бешенство — острая инфекционная болезнь, протекающая с тяжелым поражением нервной системы, как правило, с летальным исходом. Восприимчивы человек и все млекопитающие животные.
Бешенство распространено повсеместно. Возбудителя инфекции передают собаки, кошки, дикие грызуны и хищники, а также кровососущие летучие мыши-вампиры.
Продолжительность инкубационного периода зависит от места и силы укуса, количества и вирулентности попавшего в рану вируса, резистентности покусанного животного. Инкубационный период длится от 1—3 нед до года и даже более.
Болезнь протекает остро. Клинические признаки ее в основном одинаковы у всех животных, но наиболее типичны они у собак, у которых может наблюдаться как буйное, так и тихое (паралитическое) течение болезни. У крупного рогатого скота бешенство может протекать атипично (потеря аппетита, атония рубца, паралич глотки, слюнотечение). Стадии возбуждения может не быть.
Патологоанатомические изменения неспецифичны. У мясоедных (в основном у собак) в желудке можно обнаружить инородные предметы.
Вирус бешенства обладает выраженной нейропробазией. Проникая с периферии (место укуса) по нервным стволам в центральную нервную систему центростремительно, он распространяется в организме центробежно по периферическим нервам и попадает в разные органы, включая слюнные железы.
Вирус относится к семейству Rhabdoviridae,родуLyssavirus. Вирионы имеют форму стержня с обрубленным концом. Вирион вируса — РНК-содержащий со спиральным типом симметрии, имеет липопротеидную оболочку. Низкие температуры консервируют вирус. Температура 60 °С убивает его через 5—10 мин, солнечный свет — за 5—7 дней. Растворы формалина, фенола, соляной кислоты (5%-ные) инактивируют вирус за 5—10 мин.
Вирион вируса бешенства содержит гликопротеидный (наружный) и нуклеокапсидный (внутренний) антигены. Гликопротеидный антиген индуцирует образование вируснейтрализующих антител, а нуклеокапсидный — комплементсвязывающих и преципитирующих антител.
В организме вирус локализуется главным образом в центральной нервной системе, а также в слюнных железах и слюне.
Культивируется на мышах, кроликах, морских свинках и других животных, а также в первичных культурах клеток (почки хомячка, эмбриона овец, телят и др.) и перевиваемых клетках. Размножение вируса в культурах клеток не всегда проявляется ЦПД. К вирусу бешенства после предварительной адаптации восприимчивы и куриные эмбрионы. Вирус индуцирует образование цитоплазматических телец-включений, которые чаще всего обнаруживают в клетках аммонова рога, мозжечка, коры головного мозга.
Источником инфекции являются больные животные. Они передают вирус во время укуса. Плотоядные животные могут заражаться при поедании головного и спинного мозга погибших от бешенства животных. Доказана возможность заражения бешенством аэрогенным путем (в местах, где имеются летучие мыши). До 60-х годов основным источником распространения бешенства были собаки и кошки, позднее лисицы, волки, корсаки и другие дикие животные.
Диагноз на бешенство ставят на основании эпизоотологических, клинических данных и результатов лабораторных исследований, имеющих решающее значение.
При работе с больными животными и инфекционным материалом необходимо строго соблюдать меры личной безопасности: надевать резиновые перчатки, халаты с нарукавниками, резиновый или полиэтиленовый фартук, резиновые сапоги, защитные очки, защитную маску на лицо.
Вскрывать подозрительных на заболевание бешенством животных в полевых условиях запрещено.
Получение пат.материала. Для исследования на бешенство направляют в лабораторию свежие трупы мелких животных целиком, а от крупных и средних животных — голову с двумя первыми шейными позвонками. Трупы мелких животных перед отправкой на исследование обрабатывают инсектицидами.
Патологический материал упаковывают в пластмассовые мешки, вкладывают в плотно закрывающиеся ящики с влагопоглощающей прокладкой, пропитанной дезинфектантом. Материал и сопроводительное письмо, в котором указаны отправитель и его адрес, вид животного, анамнестические данные и обоснование подозрений в заболевании животного бешенством, дата и подпись врача.
Лабораторная диагностика. Она включает: обнаружение вирусного антигена в РИФ и РДП, телец Бабеша-Негри и биопробы на белых мышах.
РИФ. Для данной реакции биопромышленность выпускает флуоресцирующий антирабический гамма-глобулин.
Методика постановки РИФ. На обезжиренных предметных стеклах готовят тонкие отпечатки или мазки из различных отделов головного мозга левой и правой стороны (аммонов рог, кора полушарий, мозжечок, продолговатый мозг). Готовят не менее двух препаратов каждого отдела мозга. Можно также исследовать спинной мозг, подчелюстные, слюнные железы. Для контроля делают препараты из мозга здорового животного (обычно белой мыши).
Препараты высушивают на воздухе, фиксируют в охлажденном ацетоне (минус 20 °С от 4 до 12 ч), высушивают на воздухе наносят Флуоресцирующий гамма-глобулин, помещают во влажную камеру при 37 °С на 25—30 мин, затем тщательно промывают физиологическим раствором или фосфатным буфером с рН 7,4, споласкивают дистиллированной водой, высушивают на воздухе, наносят нефлуоресцирующее иммерсионное масло и просматривают под люминесцентным микроскопом.
В препаратах, содержащих антиген вируса бешенства наблюдаются разной величины и формы флуоресцирующий желто-зеленым цветом гранулы в нейронах, но чаще вне клеток.
В контроле подобного свечения не должно быть, нервная ткань обычно светится тусклым сероватым или зеленоватым цветом. Интенсивность свечения оценивают в крестах.
Отрицательным считают результат при отсутствии специфической флуоресценции.
Материал от животных, вакцинированных против бешенства, нельзя исследовать в РИФ в течение 3 мес. после прививки, так как может быть флуоресценция антигена вакцинного вируса.
В РИФ не подлежат исследованию ткани, консервированные глицерином, формалином, спиртом и
т. д., а также материал, имеющий признаки даже незначительного загнивания.
РДП в агаровом геле. Метод основан на свойстве антител и антигенов диффундировать в агаровом геле и при встрече образовывать видимые визуально линии преципитации (комплекс антиген +антитело). Применяют для обнаружения антигена в мозге животных, павших от уличного вируса бешенства, или при экспериментальной инфекции (биопроба).

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Читайте также:


