Антигенов таких бактерии вирусы антитела работают вместе
Антитела - специфические белки гамма- глобулиновой природы, образующиеся в организме в ответ на антигенную стимуляцию и способные специфически взаимодействовать с антигеном (in vivo, in vitro). В соответствии с международной классификацией совокупность сывороточных белков, обладающих свойствами антител, называют иммуноглобулинами.
Уникальность антител заключается в том, что они способны специфически взаимодействовать только с тем антигеном, который вызвал их образование.
Иммуноглобулины ( Ig ) разделены в зависимости от локализации на три группы:
- сывороточные (в крови);
- секреторные ( в секретах- содержимом желудочно- кишечного тракта, слезном секрете, слюне, особенно- в грудном молоке) обеспечивают местный иммунитет (иммунитет слизистых);
- поверхностные ( на поверхности иммунокомпетентных клеток, особенно В- лимфоцитов).
Любая молекула антител имеет сходное строение ( Y- образную форму) и состоит из двух тяжелых ( Н ) и двух легких ( L ) цепей, связанных дисульфидными мостиками. Каждая молекула антител имеет два одинаковых антигенсвязывающих фрагмента Fab ( fragment antigen binding ), определяющих антительную специфичность, и один Fc ( fragment constant ) фрагмент, который не связывает антиген, но обладает эффекторными биологическими функциями. Он взаимодействует со “своим” рецептором в мембране различных типов клеток ( макрофаг, тучная клетка, нейтрофил).
Концевые участки легких и тяжелых цепей молекулы иммуноглобулина вариабельны по составу ( аминокислотным последовательностям ) и обозначаются как VL и VH области. В их составе выделяют гипервариабельные участки, которые определяют структуру активного центра антител (антигенсвязывающий центр или паратоп). Именно с ним взаимодействует антигенная детерминанта (эпитоп) антигена. Антигенсвязывающий центр антител комплементарен эпитопу антигена по принципу “ключ - замок” и образован гипервариабельными областями L- и Н- цепей. Антитело свяжется антигеном (ключ попадет в замок) только в том случае, если детерминантная группа антигена полностью вместится в щель активного центра антител.
Легкие и тяжелые цепи состоят из отдельных блоков- доменов. В легких ( L ) цепях - два домена- один вариабельный ( V ) и один константный ( C ), в тяжелых ( H ) цепях- один V и 3 или 4 ( в зависимости от класса иммуноглобулина ) C домена.
Существуют легкие цепи двух типов- каппа и лямбда, они встречаются в различных пропорциях в составе различных (всех) классов иммуноглобулинов.
Выявлено пять классов тяжелых цепей- альфа ( с двумя подклассами), гамма ( с четырьмя подклассами), эксилон, мю и дельта. Соответственно обозначению тяжелой цепи обозначается и класс молекул иммуноглобулинов- А, G, E, M и D.
Именно константные области тяжелых цепей, различаясь по аминокислотному составу у различных классов иммуноглобулинов, в конечном результате и определяют специфические свойства иммуноглобулинов каждого класса.
Известно пять классов иммуноглобулинов, отличающихся по строению тяжелых цепей, молекулярной массе, физико- химическим и биологическим характеристикам: IgG, IgM, IgA, IgE, IgD. В составе IgG выделяют 4 подкласса ( IgG1, IgG2, IgG3, IgG4 ), в составе IgA- два подкласса (IgA1, IgA2 ).
Структурной единицей антител является мономер, состоящий из двух легких и двух тяжелых цепей. Мономерами являются IgG, IgA ( сывороточный), IgD и IgE. IgM- пентамер (полимерный Ig). У полимерных иммуноглобулинов имеется дополнительная j ( joint) полипептидная цепь, которая объединяет ( полимеризует) отдельные субъединицы (в составе пентамера IgM, ди- и тримера секреторного IgA).
Основные биологические характеристики антител.
1. Специфичность - способность взаимодействия с определенным (своим) антигеном (соответствие эпитопа антигена и активного центра антител).
2. Валентность- количество способных реагировать с антигеном активных центров ( это связано с молекулярной организацией- моно- или полимер). Иммуноглобулины могут быть двухвалентными ( IgG ) или поливалентными (пентамер IgM имеет 10 активных центров). Двух- и более валентные антитела навывают полными антителами. Неполные антитела имеют только один участвующий во взаимодействии с антигеном активный центр ( блокирующий эффект на иммунологические реакции, например, на агглютинационные тесты). Их выявляют в антиглобулиновой пробе Кумбса, реакции угнетения связывания комплемента.
3. Афинность - прочность связи между эпитопом антигена и активным центром антител, зависит от их пространственного соответствия.
4. Авидность - интегральная характеристика силы связи между антигеном и антителами, с учетом взаимодействия всех активных центров антител с эпитопами. Поскольку антигены часто поливалентны, связь между отдельными молекулами антигена осуществляется с помощью нескольких антител.
5. Гетерогенность - обусловлена антигенными свойствами антител, наличием у них трех видов антигенных детерминант:
- изотипические - принадлежность антител к определенному классу иммуноглобулинов;
- аллотипические- обусловлены аллельными различиями иммуноглобулинов, кодируемых соответствующими аллелями Ig гена;
- идиотипические- отражают индивидуальные особенности иммуноглобулина, определяемые характеристиками активных центров молекул антител. Даже тогда, когда антитела к конкретному антигену относятся к одному классу, субклассу и даже аллотипу, они характеризуются специфическими отличиями друг от друга (идиотипом). Это зависит от особенностей строения V- участков H- и L- цепей, множества различных вариантов их аминокислотных последовательностей.
Понятие о поликлональных и моноклональных антителах будет дано в следующих разделах.
Характеристика основных классов иммуноглобулинов.
Ig G. Мономеры, включают четыре субкласса. Концентрация в крови- от 8 до 17 г/л, период полураспада- около 3- 4 недель. Это основной класс иммуноглобулинов, защищающих организм от бактерий, токсинов и вирусов. В наибольшем количестве IgG- антитела вырабатываются на стадии выздоровления после инфекционного заболевания (поздние или 7S антитела), при вторичном иммунном ответе. IgG1 и IgG4 специфически (через Fab- фрагменты) связывают возбудителей (опсонизация), благодаря Fc- фрагментам IgG взаимодействуют с Fc- рецепторам фагоцитов, способствуя фагоцитозу и лизису микроорганизмов. IgG способны нейтрализовать бактериальные экзотоксины, связывать комплемент. Только IgG способны транспортироваться через плаценту от матери к плоду (проходить через плацентарный барьер) и обеспечивать защиту материнскими антителами плода и новорожденного. В отличие от IgM- антител, IgG- антитела относятся к категории поздних- появляются позже и более длительно выявляются в крови.
IgM.Молекула этого иммуноглобулина представляет собой полимерный Ig из пяти субъединиц, соединенных дисульфидными связями и дополнительной J- цепью, имеет 10 антиген- связывающих центров. Филогенетически это наиболее древний иммуноглобулин. IgM- наиболее ранний класс антител, образующихся при первичном попадании антигена в организм. Наличие IgM- антител к соответствующему возбудителю свидетельствует о свежем инфицировании (текущем инфекционном процессе). Антитела к антигенам грамотрицательных бактерий, жгутиковым антигенам- преимущественно IgM- антитела. IgM- основной класс иммуноглобулинов, синтезируемых у новорожденных и младенцев. IgM у новорожденных- это показатель внутриутробного заражения (краснуха, ЦМВ, токсоплазмоз и другие внутриутробные инфекции), поскольку материнские IgM через плаценту не проходят. Концентрация IgM в крови ниже, чем IgG- 0,5- 2,0 г/л, период полураспада- около недели. IgM способны агглютинировать бактерии, нейтрализовать вирусы, активировать комплемент, активизировать фагоцитоз, связывать эндотоксины грамотрицательных бактерий. IgM обладают большей, чем IgG авидностью (10 активных центров), аффинность (сродство к антигену) меньше, чем у IgG.
IgA. Выделяют сывороточные IgA (мономер) и секреторные IgA (IgAs). Сывороточные IgA составляют 1,4- 4,2 г/л. Секреторные IgAs находятся в слюне, пищеварительных соках, секрете слизистой носа, в молозиве. Они являются первой линией защиты слизистых, обеспечивая их местный иммунитет. IgAs состоят из Ig мономера, J-цепи и гликопротеина (секреторного компонента). Выделяют два изотипа- IgA1 преобладает в сыворотке, субкласс IgA2 - в экстраваскулярных секретах.
Секреторный компонент вырабатывается эпителиальными клетками слизистых оболочек и присоединяется к молекуле IgA в момент прохождения последней через эпителиальные клетки. Секреторный компонент повышает устойчивость молекул IgAs к действию протеолитических ферментов. Основная роль IgA- обеспечение местного иммунитета слизистых. Они препятствуют прикреплению бактерий к слизистым, обеспечивают транспорт полимерных иммунных комплексов с IgA, нейтрализуют энтеротоксин, активируют фагоцитоз и систему комплемента.
IgE. Представляет мономер, в сыворотке крови находится в низких концентрациях. Основная роль- своими Fc- фрагментами прикрепляется к тучным клеткам (мастоцитам) и базофилам и опосредует реакции гиперчувствительности немедленного типа. К IgE относятся “антитела аллергии”- реагины. Уровень IgE повышается при аллергических состояниях, гельминтозах. Антигенсвязывающие Fab- фрагменты молекулы IgE специфически взаимодействует с антигеном (аллергеном), сформировавшийся иммунный комплекс взаимодействует с рецепторами Fc- фрагментов IgE, встроенных в клеточную мембрану базофила или тучной клетки. Это является сигналом для выделения гистамина, других биологически активных веществ и развертывания острой аллергической реакции.
IgD.Мономеры IgD обнаруживают на поверхности развивающихся В- лимфоцитов, в сыворотке находятся в крайне низких концентрациях. Их биологическая роль точно не установлена. Полагают, что IgD участвуют в дифференциации В-клеток, способствуют развитию антиидиотипического ответа, участвуют в аутоиммунных процессах.
С целью определения концентраций иммуноглобулинов отдельных классов применяют несколько методов, чаще используют метод радиальной иммунодиффузии в геле (по Манчини)- разновидность реакции преципитации и ИФА.
Определение антител различных классов имеет важное значение для диагностики инфекционных заболеваний. Обнаружение антител к антигенам микроорганизмов в сыворотках крови- важный критерий при постановке диагноза- серологический метод диагностики. Антитела класса IgM появляются в остром периоде заболевания и относительно быстро исчезают, антитела класса IgG выявляются в более поздние сроки и более длительно (иногда- годами) сохраняются в сыворотках крови переболевших, их в этом случае называют анамнестическими антителами.
Выделяют понятия: титр антител, диагностический титр, исследования парных сывороток. Наибольшее значение имеет выявление IgM- антител и четырехкратное повышение титров антител (или сероконверсия- антитела выявляют во второй пробе при отрицательных результатах с первой сывороткой крови) при исследовании парных- взятых в динамике инфекционного процесса с интервалом в несколько дней- недель проб.
Реакции взаимодействия антител с возбудителями и их антигенами (реакция “антиген- антитело”) проявляется в виде ряда феноменов- агглютинации, преципитации, нейтрализации, лизиса, связывания комплемента, опсонизации, цитотоксичности и могут быть выявлены различными серологическими реакциями.
Динамика выработки антител. Первичный и вторичный иммунный ответ.
Первичный ответ- при первичном контакте с возбудителем (антигеном), вторичный- при повторном контакте. Основные отличия:
- продолжительность скрытого периода (больше- при первичном);
- скорость нарастания антител (быстрее- при вторичном);
- количество синтезируемых антител (больше- при повторном контакте);
- последовательность синтеза антител различных классов (при первичном более длительно преобладают IgM, при вторичном- быстро синтезируются и преобладают IgG- антитела).
Вторичный иммунный ответ обусловлен формированием клеток иммунной памяти. Пример вторичного иммунного ответа- встреча с возбудителем после вакцинации.
Роль антител в формировании иммунитета.
Антитела имеют важное значение в формировании приобретенного постинфекционного и поствакцинального иммунитета.
1. Связываясь с токсинами, антитела нейтрализуют их, обеспечивая антитоксический иммунитет.
2. Блокируя рецепторы вирусов, антитела препятствуют адсорбции вирусов на клетках, участвуют в противовирусном иммунитете.
3. Комплекс антиген- антитело запускает классический путь активации комплемента с его эффекторными функциями (лизис бактерий, опсонизация, воспаление, стимуляция макрофагов).
4. Антитела принимают участие в опсонизации бактерий, способствуя более эффективному фагоцитозу.
5. Антитела способствуют выведению из организма (с мочой, желчью) растворимых антигенов в виде циркулирующих иммунных комплексов.
IgG принадлежит наибольшая роль в антитоксическом иммунитете, IgM- в антимикробном иммунитете (фагоцитоз корпускулярных антигенов), особенно в отношении грамотрицательных бактерий, IgA- в противовирусном иммунитете (нейтрализация вирусов), IgAs- в местном иммунитете слизистых оболочек, IgE- в реакциях гиперчувствительности немедленного типа.
08 сентября 2015
- 1692
- 1,4
- 0
- 3
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Антитела как лекарства
В фармакологии используются два основных понятия: лекарство и мишень. Мишень — это структура организма, связанная с определенной функцией, нарушение которой приводит к заболеванию. В случае болезни на мишень можно оказать определенное воздействие, которое должно привести к лечебному эффекту. Лекарством называется вещество, специфически взаимодействующее с мишенью и влияющее на состояние клетки, ткани, организма [1]. В качестве мишени может выступать рецептор на поверхности клеточной мембраны, фермент или канал, проводящий в клетку различные соединения. Однако путь к потребителю для любого лекарства долог: после подтверждения его функциональной активности следуют стадии доклинических и клинических испытаний, на которых малые молекулы подстерегает опасность так никогда и не стать лекарством. Под действием ферментных систем пациента они могут стать ядовитыми, или их изомеры окажутся токсичными. Низкомолекулярное вещество может выводиться слишком быстро или, напротив, накапливаться в организме, отравляя его. Поэтому в последние годы всё бóльшую долю на рынке лекарственных средств занимают макромолекулы, и среди них важнейшую роль играют антитела — защитные белки организма (рис. 1).
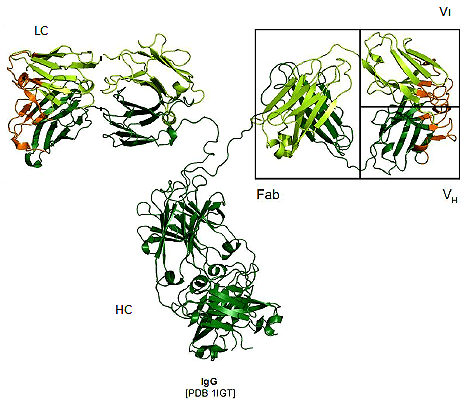
Рисунок 1. Структура антитела. Антитело состоит из двух тяжелых (HC) и двух легких (LC) аминокислотных цепей, соединенных между собой. Каждая из этих цепей имеет вариабельный домен (VH или VL), который ответственен за связывание антигена. Вариабельным он называется именно потому, что эти участки наиболее сильно отличаются у разных антител, то есть представлены множеством вариантов. Участок, который отщепляется ферментом папаином, называется Fab-фрагментом.
От структуры антитéла зависят такие важные свойства, как связывание им антигена, прочность этого связывания и стабильность молекулы. Однако природа создания антител в организме очень сложна, и никто не может гарантировать, что в ответ даже на идентичные антигены образуются одинаковые по структуре антитела. Если же для создания лекарства или диагностического набора используются антитела к одному и тому же антигену, но обладающие разной структурой, то из-за разницы в стабильности и специфичности о стандартизации и воспроизводимости результатов работы можно будет забыть. Это означает, что такие антитела никак не могут стать диагностическими или лекарственными. Отсюда вывод: нужны антитела с идентичной структурой.
Получение антител для нужд человека, как правило, начинается с иммунизации животных. Проводится несколько инъекций антигена, и в сыворотке крови накапливаются специфические антитела. Эти антитела, полученные напрямую из сыворотки иммунизированного животного, произведены разными плазматическими клетками, то есть они поликлональны. Для получения совершенно идентичных — моноклональных — антител в семидесятых годах прошлого века учеными Георгом Кёлером и Сéсаром Мильштейном был разработан метод гибридóм [3]. Он основан на слиянии плазматических лимфоцитов (продуцируют антитела, но не живут в культуре) и клеток миеломы (это опухолевые клетки, которые ничего не продуцируют, но зато замечательно культивируются), в результате чего такая гибридная клетка от В-лимфоцита наследует способность выделять нужные исследователям антитела, а от опухолевой — бессмертие (практически бесконечное деление).
Библиотека в пробирке
Метод, который был назван фаговым дисплеем, основан на способности бактериофагов (вирусов, поражающих бактерии) выставлять на своей поверхности случайные пептидные последовательности в составе поверхностных белков [5]. Бактериофаг представляет собой ДНК, окруженную белковой оболочкой — капсидом, — и способен размножаться только внутри клетки-хозяина. Проникая туда, он беззастенчиво пользуется ферментными системами несчастной бактерии, предоставляя ей свою ДНК для синтеза необходимых для его размножения белков [6]. Инфицированная фагом бактериальная клетка послушно воспроизводит всё, что закодировано в геноме вируса, чтобы его потомство собрало свою оболочку из готовых строительных блоков. Если в геном фага-прародителя исследователем внедрена нуклеотидная последовательность, кодирующая нужный пептид, у его потомства на поверхности вирусной частицы появляется несколько копий гибридного капсидного белка, состоящего из собственной полипептидной цепи и фрагмента антитела. Множество бактериофагов, на поверхности которых представлены случайные фрагменты антител, называется фаговой библиотекой (рис. 2).
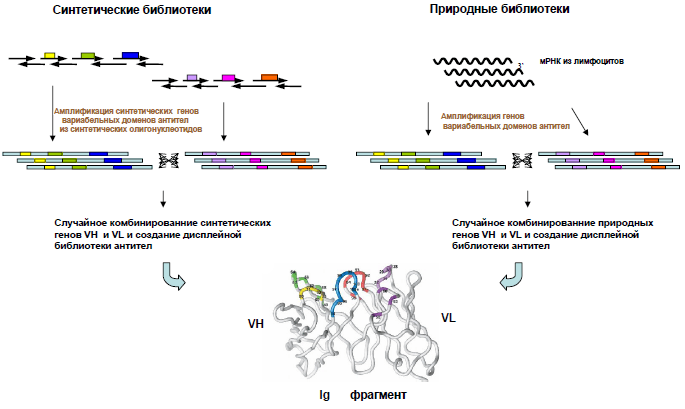
Рисунок 2. Создание синтетических и природных библиотек антител. За основу библиотеки берутся нуклеотидные последовательности вариабельных доменов антител (иммуноглобулинов, Ig), природные или синтетические. Далее их случайным образом комбинируют, и в результате образуется множество фрагментов антител, на основе которых можно создать фаговую библиотеку [8].
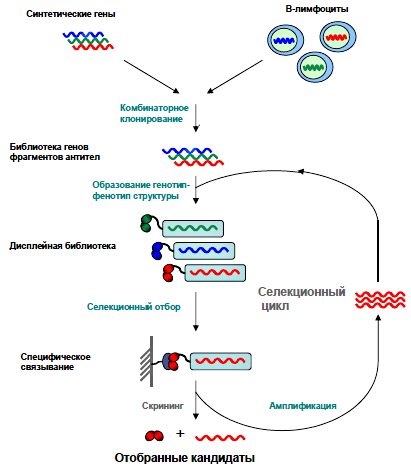
Рисунок 3. Схема селекции. Создание фаговой библиотеки из синтетического или природного источника предполагает образование структур, объединяющих в себе как нуклеотидные, так и аминокислотные последовательности фрагмента антитела (генотип-фенотип-структура). Затем обеспечивается контакт с антигеном (привязанным к пластику дисплейной библиотеки), который специфически связывается с определенными фрагментами антител, экспонированными на фаговой частице.
Обычно проводится 3–4 раунда селекции, в результате чего отбирается ДНК уже сравнительно небольшого количества фагов, и на ее основе в бактериальных клетках нарабатываются фрагменты антител для дальнейшего анализа. По источнику материала дисплейные библиотеки можно разделить на три группы.
- Библиотеки на основе ДНК иммунных клеток здоровых людей называются наивными. Раз люди-доноры здоровы, значит, их иммунным клеткам не доводилось сражаться с по-настоящему опасными антигенами. Как любого, кто не решал серьезных жизненных проблем, их называют наивными.
- Сфокусированные библиотеки создаются из клеток иммунизированного животного. В этом случае иммунной системе животного приходится потрудиться, ведь в течение нескольких недель ее регулярно атакуют, заставляя вырабатывать поликлональные антитела. Антиген, который вводят исследователи, оказывается в фокусе внимания иммунной системы животного, что увеличивает число вариантов антител к нужному антигену.
- Синтетические библиотеки состоят из генов, синтезированных искусственно [8].
Каждый из перечисленных видов библиотек имеет свои достоинства и недостатки. Например, синтетические библиотеки базируются на небольшом количестве структур вариабельных доменов антител, поэтому работать с ними гораздо проще, чем с природными, которые содержат разнообразные по термодинамическим и экспрессионным характеристикам последовательности. Зато при использовании вариантов из природных библиотек ниже вероятность развития иммунного ответа [9].
Полученные таким способом молекулы можно подвергнуть изменениям, совершенствуя их свойства. Кроме того, из одного и того же фрагмента антитела можно создать целый ряд терапевтических агентов. В зависимости от цели терапии его можно связать с токсином (например, для борьбы с опухолью), с цитокином (для адресной доставки к больному месту) или с другим фрагментом-помощником, даже с радионуклидом.
Успех современной фармакологии во многом зависит от развития таких областей науки, как молекулярная биология, биоинформатика и генная инженерия. Благодаря этим дисциплинам стало возможным синтезировать нужные последовательности ДНК, комбинировать и изменять их, а также получать животные белки в бактериальных системах. Несомненным достоинством современных технологий является то, что с их помощью можно не только получать аналоги уже существующих антител, но и создавать совершенно новые [7].
Рано праздновать победу!
Несмотря на все преимущества антител перед малыми молекулами, с их применением возникли проблемы. В 2004 году было обнаружено, что в нескольких случаях прием инфликсимаба (ремикейда, Remicade) — противовоспалительных моноклональных антител — сопровождался развитием у пациентов лимфом. В мае 2006 года в журнале Американской медицинской ассоциации (JAMA) опубликовали данные, что ремикейд усиливает риск развития рака в три раза [10]. В июне 2008 года FDA сообщило о возможной связи развития лимфом и других видов опухолей у детей и подростков с приемом ремикейда.
Установлено увеличение риска смертельного исхода у онкологических больных при приеме авастина (2,5%) — блокатора фактора роста эндотелия (VEGF) — по сравнению с использованием только химиотерапии (1,7%). Дело в том, что сам по себе Avastin (бевацизумаб) не взаимодействует с раковыми клетками. Он блокирует фактор роста эндотелия (клеток выстилки сосудов), который выделяет опухоль, чтобы создать вокруг себя больше кровеносных сосудов для интенсивного питания. Опухоль выделяет такой же VEGF, как и другие, здоровые части организма, поэтому блокирование роста определенной доли нужных организму сосудов (например, сосудов для питания сердца) оказывается неизбежным. Таким образом, в случае применения авастина повышение смертности пациентов связано не с основным заболеванием, а с сердечной недостаточностью [10].
Современные протоколы уже основаны на комбинированном подходе к лечению, включая вакцины, химиотерапию и моноклональные антитела. Исследователям еще предстоит разработать такие препараты и схемы терапии, которые обеспечат эффективное и безопасное лечение пациентов.
В онлайн-лаборатории Lab4U мы хотим, чтобы каждый из вас мог заботиться о своем здоровье. Для этого мы просто и понятно рассказываем о показателях организма.
Что такое антитела? И как расшифровать результаты анализа?
Антитела — это белки, которые иммунная система вырабатывает в ответ на проникновение инфекции. В лабораторной диагностике именно антитела служат маркером проникновения инфекции. Общим правилом подготовки к анализу на антитела является сдавать кровь из вены натощак (после приема пищи должно пройти не менее четырех часов). В современной лаборатории сыворотку крови исследуют на автоматическом анализаторе с использованием соответствующих реагентов. Иногда серологический анализ на антитела является единственным способом диагностики инфекционных заболеваний.
Анализы на инфекции могут быть качественными (дают ответ, есть ли инфекция в крови) и количественными (показывают уровень содержания антител в крови). Норма антител для каждой инфекции своя (для некоторых их не должно быть совсем). Референсные значения (показатели нормы) антител можно получить с результатом анализа.
В онлайн-лаборатории Lab4U можно сдатькомплекс анализов на все TORCH-инфекции за один раз и со скидкой 50%!
Различные классы антител IgG, IgM, IgA
Иммуноферментный анализ определяет антитела инфекций относящиеся к различным классам Ig (G, A, M). Антитела к вирусу, при наличии инфекции, определяются на очень ранней стадии, что обеспечивает эффективную диагностику и контроль течения заболеваний. Самые распространенные методы диагностики инфекций — это тесты на антитела класса IgM (острая фаза течения инфекции) и антитела класса IgG (устойчивый иммунитет к инфекции). Эти антитела определяют для большинства инфекций.
Однако, один из самых распространенных анализов — госпитальный скрининг (анализы на ВИЧ, сифилис и гепатиты B и С) не дифференцирует тип антител, поскольку наличие антител к вирусам данных инфекций автоматически предполагает хроническое течение заболеваний и является противопоказанием, например, для серьезных хирургических вмешательств. Поэтому важно опровергнуть или подтвердить диагноз.
Детальную диагностику типа и количества антител при диагностированном заболевании можно сделать, сдав анализ на каждую конкретную инфекцию и тип антител. Первичная инфекция выявляется при обнаружении диагностически значимого уровня антител IgM в образце крови или значимым ростом числа антител IgA или IgG в парных сыворотках, взятых с интервалом 1-4 недели.
Реинфекция, или повторная инфекция, выявляется быстрым подъемом уровня антител IgA или IgG. Антитела IgA имеют более высокую концентрацию у пациентов старшего возраста и более точно диагностируют текущую инфекцию у взрослых.
Перенесенная инфекция в крови определяется как повышенные антитела IgG без роста их концентрации в парных образцах, взятых с интервалом 2 недели. При этом отсутствуют антитела классов IgM и А.
Антитела IgM
Их концентрация повышается вскоре после заболевания. Антитела IgM определяются уже через 5 дней после его начала и достигают пика в промежутке от одной до четырех недель, затем снижаются до диагностически незначительных уровней в течение нескольких месяцев даже без проведенного лечения. Однако, для полной диагностики недостаточно определения только антител класса М: отсутствие этого класса антител еще не говорит об отсутствии заболевания. Острой формы заболевания нет, но может быть хроническая.
Антитела IgM имеют большое значение в диагностике гепатита А и детских инфекций (краснуха, коклюш, ветрянка), легко передающихся воздушно-капельным путем, так как важно как можно раньше выявить заболевание и изолировать заболевшего.
Антитела IgG
Основная роль антител IgG — это длительная защита организма от большинства бактерий и вирусов — хотя их выработка происходит более медленно, но ответ на антигенный раздражитель сохраняется более устойчивым, чем у антител класса IgM.
Уровни антител IgG повышаются медленнее (через 15-20 дней после начала заболевания), чем IgM, но остаются повышенными дольше, поэтому могут показывать давно текущую инфекцию при отсутствии IgM АТ. IgG могут находиться на низком уровне в течение многих лет, но, при повторном воздействии того же антигена, уровень антител IgG быстро повышается.
Для полной диагностической картины необходимо определить антитела IgA и IgG одновременно. При неясном результате IgA, подтверждение осуществляется определением IgM. В случае положительного результата и для точной диагностики второй анализ, сделанный через 8-14 дней после первого, должен быть проверен параллельно для определения роста концентрации IgG. Результаты анализа должны интерпретироваться в комплексе с информацией, полученной в других диагностических процедурах.
Антитела IgG, в частности, используются для диагностики Helicobacter pylori — одной из причин язвы и гастрита.
Антитела IgA
В сыворотке появляются через 10-14 дней после начала заболевания, и вначале их даже можно обнаружить в семенной и вагинальной жидкостях. Уровень антител IgA обычно снижается к 2-4 месяцу после инфицирования в случае успешного лечения. При повторном инфицировании уровень антител IgA вновь возрастает. Если уровень IgA не падает после проведенного лечения, то это — признак хронической формы инфекции.
Анализ на антитела в диагностике TORCH-инфекций
Аббревиатура TORCH появилась в 70-х годах прошлого столетия, и состоит из заглавных букв латинских названий группы инфекций, отличительной особенностью которых является то, что при относительной безопасности для детей и взрослых, TORCH инфекции при беременности представляют чрезвычайную опасность.
Анализ крови на TORCH инфекции является комплексным исследованием, в его состав входит 8 тестов:
Нередко, заражение женщины инфекциями TORCH-комплекса во время беременности (наличие в крови только антител IgM) является показанием для ее прерывания.
В заключение
Иногда, обнаружив в результатах анализа антитела IgG, например, токсоплазмоза или герпеса, пациенты приходят в панику, не посмотрев на то, что антитела IgM, которые показывают наличие текущей инфекции, могут отсутствовать вовсе. В этом случае анализ говорит о перенесенной ранее инфекции, к которой выработался иммунитет.
В любом случае, интерпретацию результатов анализа лучше доверить врачу, и с ним же в случае необходимости определиться с тактикой лечения. А сдать анализы вы можете доверить нам.
Почему быстрее, удобнее и выгоднее сдавать анализы в Lab4U?
Вам не нужно долго ждать в регистратуре
Все оформление и оплата заказа происходит онлайн за 2 минуты.
Путь до медцентра не займет более 20 минут
Наша сеть вторая по величине в Москве, а еще мы есть в 23 городах России.
Сумма чека не шокирует вас
Постоянная скидка в 50% действует на большинство наших анализов.
Вам не придется приходить минута-в-минуту или ждать в очереди
Сдача анализа происходит по записи в удобный промежуток времени, например с 19 до 20.
Вам не придется долго ждать результатов или ходить за ними в лабораторию
Мы пришлем их на эл. почту в момент готовности.
Читайте также:


