Активность вируса вычисляют методом спирмена кербера
Содержимое (Table of Contents)
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Вводится впервые
Настоящая общая фармакопейная статья определяет основные требования к биологическим методам испытаний препаратов интерферона с использованием клеточных культур и распространяется на субстанции и лекарственные формы интерферона человеческого всех типов природного и генно-инженерного происхождения.
ОБЩИЕ ПОЛОЖЕНИЯ
Биологические методы с использованием клеточных культур применяют для определения следующих показателей качества препаратов интерферона:
- Специфическая активность
- Подлинность
Методы определения специфической активности и подлинности основаны на способности интерферона подавлять цитопатическое действие индикаторного вируса в культуре клеток в сравнении со стандартным образцом интерферона (СО). Испытания проводят с использованием соответствующих линий клеток, чувствительных к определенному типу интерферона и к индикаторному вирусу.
Наиболее часто используют следующие комбинации клетка/вирус:
- линия клеток карциномы легкого человека А-549, линия клеток почки африканской зеленой мартышки Vero, линия клеток карциномы гортани человека Нер-2с, линия клеток фибробластов мыши L-929/ вирус энцефаломиокардита мышей (EMCV);
- клетки бычьих почек Madin-Darby MDBK, линия клеток почки африканской зеленой мартышки Vero, линия лимфоидных клеток человека Л-41, линия клеток карциномы легкого человека А-549, линия клеток фибробластов мыши L-929, линия клеток амниона человека WISH/ вирус везикулярного стоматита (VSV);
- клетки фибробластов человека/ вирус леса Семлики (SFV), вирус Синдбис (virus Sindbis) или иные.
В качестве СО может быть использован международный стандартный образец активности интерферона соответствующего типа или стандартный образец, откалиброванный в Международных единицах (МЕ) по соответствующему международному стандарту.
Испытания проводят в асептических условиях.
Подготовка к испытаниям
Требования к клеточным линиям (общие условия культивирования и пересева клеток, пассаж, на котором клетки проявляют оптимальную эффективность при проведении испытания, допустимый предел жизнеспособности клеток при пересевах и при взятии клеточной суспензии в испытание, процент сформированного монослоя) указывают в нормативной документации.
Пробоподготовку испытуемых образцов проводят в соответствии с указаниями, приведенными в нормативной документации. Для некоторых лекарственных форм препаратов интерферона (суппозитории, мази, гели и т.д.) при пробоподготовке необходимо экстрагирование активного вещества (интерферона) в раствор, с соблюдением следующих условий: используемые реагенты не должны оказывать токсического действия на культуру клеток в разведениях, необходимых для исследования; использование реагентов для экстрагирования должно быть обоснованным.
Суспензию индикаторного вируса готовят в соответствии с указаниями в нормативной документации на лекарственное средство, содержащее интерферон. Титр вируса должен быть не менее 10 5 ТЦД/мл.
К составу питательных сред, предназначенных для культур клеток животных и человека, предъявляют определенные требования. Для приготовления питательных сред обычно используются солевые растворы Эрла и Хенкса. Возможно использование стандартных коммерческих сред для ведения культур клеток: Игла MEM, МЕМ, DMEM (двойная модификация среды Игла), среды 199 , среды RPMI и др. Для стимуляции роста, прикрепления и деления клеток обычно добавляют 5 – 10 % инактивированной сыворотки коров/крупного рогатого скота. В среду для разведений интерферона добавляют 2 – 5 % сыворотки. Для обеспечения бактериологической стерильности в питательные среды вводят антибиотики: пенициллин (натриевая соль), стрептомицин (хлоркальциевый комплекс) из расчета 100—200 ЕД каждого на 1 мл среды , микостатин (нистатин) из расчета 20—25 ЕД на 1 мл или гентамицин (конечная концентрация 10 мкг/мл). Содержание L-глютамина в питательной среде должно быть около 292 мг/л.
В качестве поддерживающей среды обычно используют питательную среду без сыворотки с добавлением антибиотиков и L-глютамина.
Постоянство рН среды является одним из главных условий культивирования. Другим важным условием культивирования является осмотическое давление. Диапазоны рН и осмоляльности, при которых происходит размножение клеток, узки и варьируют в зависимости от типа клеток.
Оценить количество жизнеспособных клеток возможно при помощи красителей: метиленового синего, кристаллического фиолетового, тиазолинового синего (МТТ), Аламара голубого и других.
Раздел 1. Специфическая активность
Противовирусную активность интерферона определяют путем сравнения защитного действия испытуемого препарата (ИП) с аналогичным действием стандартного образца активности интерферона (СО).
Определение специфической активности препаратов интерферона проводят на монослое культур клеток, полученном при температуре (37±1) 0 С в атмосфере с (5,0±0,5) % СО2 в лунках 96-луночных плоскодонных культуральных планшетов.
Количество клеток, вносимых в каждую лунку планшета, должно быть достаточным для дальнейшего экспоненциального роста клеточной культуры и образования полноценного монослоя при вышеуказанных условиях культивирования в течение 24-48 ч.
Готовят серию разведений испытуемого препарата в среде для разведений интерферона с содержанием 2 – 5 % сыворотки (на 4 разведения выше и ниже предполагаемого титра активности). Параллельно готовят такие же разведения СО в среде для разведения интерферона. Рабочие разведения ИП и СО должны быть указаны в нормативной документации.
Из лунок планшетов с клеточным монослоем удаляют ростовую среду и вносят приготовленные разведения ИП и соответствующего СО, используя на каждое разведение не менее 4-х лунок с культурой клеток.
Возможно внесение ИП и СО в лунки планшета до внесения культуры клеток. В этом случае клеточный монослой будет формироваться с внесённым интерфероном.
Для контроля дозы индикаторного вируса оставляют 16 лунок с культурой клеток, а для контроля состояния монослоя клеток – 4 лунки. В эти 20 лунок вносят поддерживающую среду.
96-луночные планшеты с культурой клеток, разведениями ИП и СО инкубируют в течение 24-48 ч при температуре (37±1) 0 С в атмосфере с (5,0±0,5) % СО2. Затем в каждую лунку с ИП и соответствующим СО вносят вирусную суспензию, содержащую рассчитанную заранее дозу индикаторного вируса — 100 ТЦД50. В лунки контроля клеток вносят такой же объем поддерживающей среды.
Определение дозы индикаторного вируса начинают с установления его активности.
Для определения активности вируса-индикатора готовят десятикратные разведения вируса в поддерживающей среде (от 10 -1 до 10 -8 ). Из лунок 96-луночного планшета с клеточным монослоем удаляют ростовую среду. После этого вносят в лунки планшета, используемые для определения дозы вируса, поддерживающую среду в объеме, равном объему испытуемого образца. Затем вносят приготовленные разведения индикаторного вируса (не менее, чем по 4 лунки на каждое разведение) в объеме, равном объему внесенной до этого поддерживающей среды. 96-луночный планшет с разведениями вируса инкубируют в течение 24-48 ч при температуре (37±1) 0 С в атмосфере с (5,0±0,5) % СО2. За титр (активность) вируса принимают величину, обратную разведению вируса, при котором клеточный монослой в 50 % лунок оказался полностью пораженным цитопатическим действием. Титр вируса выражают в тканевых цитопатических дозах – ТЦД50/мл.
Активность вируса вычисляют методом Спирмена-Кербера по формуле:

Lg ED50 – десятичный логарифм титра вируса;
Dmax – десятичный логарифм разведения, ниже которого произошла 100 % гибель клеток (+);
d — десятичный логарифм интервала между разведениями (=1,0);
n — число лунок, приходящееся на каждое разведение вируса (=4);
р — число лунок, давших гибель (+) в разведении, ниже которого произошла 100 % гибель клеток, и последующих разведениях.
После установления активности вируса производят подсчёт дозы для последующего внесения в лунки с испытуемым препаратом (100 ТЦД50).
Одновременно с внесением вируса-индикатора осуществляют контроль взятой дозы вируса на 16-ти лунках с культурой клеток (по 4 лунки на каждое разведение вируса).
Вносят вирус, начиная с разведения, соответствующего 100 ТЦД50, и до разведения, соответствующего 0,1 ТЦД50 с коэффициентом разведения равным 10.
Лунки с культурой клеток для оценки состояния монослоя клеток остаются интактными.
После внесения индикаторного вируса в дозе 100 ТЦД50 96-луночный планшет инкубируют в течение 24-48 ч при температуре (37±1) 0 С в атмосфере с (5,0±0,5) % СО2 до появления первых признаков цитопатических изменений в клеточном монослое с индикаторным вирусом в дозе 1 ТЦД50. Монослой в лунках с 0,1 ТЦД50 индикаторного вируса должен соответствовать состоянию клеток в контрольных лунках.
Учёт активности интерферона осуществляют через 24-48 ч при выполнении следующих условий:
- доза внесённого вируса соответствует 100 ТЦД50;
- в лунках с клетками и минимальными концентрациями ИП и СО, зараженными индикаторным вирусом, наблюдается практически полный цитопатический эффект (80 -100 %);
- в лунках с контролем клеток отсутствуют признаки дегенерации.
Учёт активности интерферона осуществляют визуально или инструментально.
производится микроскопически при 100-кратном увеличении через 24-48 ч после внесения индикаторного вируса. За титр интерферона принимают величину, обратную разведению препарата, при котором клеточная культура в 50 % лунок полностью защищена от цитопатического действия вируса.
Титр интерферона вычисляют методом Спирмена-Кербера по формуле:
Dmax – двоичный логарифм разведения, ниже которого произошла 100 % защита (-);
d — двоичный логарифм интервала между разведениями (=1,0);
n — число лунок на каждую дозу (=4);
р — число лунок, давших защиту (-) в разведении, ниже которого произошла 100 % защита, и последующих разведениях.
Противовирусную активность интерферона (Ах) в исследуемом образце в МЕ вычисляют по формуле:

Асо — противовирусная активность СО интерферона в МЕ;
Инструментальный учет активности интерферона предполагает селективное окрашивание живых клеток, защищенных интерфероном от действия вируса, элюирование красителя, фотометрирование оптической плотности элюата и статистическую обработку результатов с помощью метода параллельных линий.
Как правило, результаты исследования снижения цитопатического эффекта соответствуют сигмоидальному графику доза-ответ: зависимость значений оптической плотности элюата ИП и СО от логарифма их разведения.
При расчете активности интерферона по сигмоидальным кривым ИП и СО должны быть соблюдены следующие условия:
- Измеренные оптические плотности для ИП и СО должны находиться в одном диапазоне оптических единиц, ограниченном значениями оптической плотности, измеренными в лунках контроля клеток и вируса;
- Полученные данные должны отвечать требованиям к параллельности, линейности и величине угла наклона кривых доза-ответ для СО и ИП, указанным в нормативной документации.
Используя линейный участок графика, рассчитывают титр ИП и СО, а затем рассчитывают активность интерферона по формуле:

Асо — противовирусная активность СО интерферона в МЕ;
ах — титр ИП, то есть разведение ИП, в котором наблюдается 50 %-е поражение клеточного монослоя индикаторным вирусом;
асо — титр СО, то есть разведение СО, в котором наблюдается 50 %-е поражение клеточного монослоя индикаторным вирусом.
Описание инструментального метода приводят в нормативной документации.
Раздел 2. Подлинность
Подлинность препаратов интерферона определяют путем нейтрализации противовирусной активности ИП моно- или поликлональными антителами против соответствующего типа интерферона, предусмотренными в нормативной документации на препарат. Реакцию нейтрализации противовирусной активности ИП проводят в культуре клеток, чувствительных к данному типу интерферона, в присутствии индикаторного вируса.
Определение подлинности препаратов интерферона проводят на монослое культур клеток.
Количество клеток, вносимых в каждую лунку 96-луночных культуральных планшетов, должно быть достаточным для дальнейшего экспоненциального роста клеточной культуры и образования полноценного монослоя в условиях культивирования при температуре (37±1) 0 С в атмосфере с (5,0±0,5) % СО2 в течение 24-48 ч.
Нейтрализующие антитела разводят средой для разведения до концентраций, указанных в нормативной документации.
Для приготовления нейтрализованной смеси подготовленные разведения антител объединяют в равных объемах с рабочими дозами ИП и СО. Полученную смесь инкубируют при температуре (37±1) о С в атмосфере с (5,0±0,5) % СО2 в течение 1 ч.
Из лунок 96-луночного планшета с монослоем культуры клеток удаляют ростовую среду, вносят в лунки планшета нейтрализованную смесь, не менее чем по 4 лунки на каждое разведение антител.
Нейтрализованную смесь допустимо вносить в лунки 96-луночного планшета как до внесения культуры клеток, так и после него.
Для оценки качества монослоя клеток в процессе постановки реакции нейтрализации (контроль) оставляют не менее 4 лунок, в которые не вносят нейтрализованную смесь. В этих лунках заменяют ростовую среду на поддерживающую.
Для контроля защитного действия интерферона также оставляют по 4 лунки на рабочие разведения СО и ИП без нейтрализующих антител.
Индикаторный вирус в дозе 100 ТЦД50 вносят во все лунки 96-луночного планшета, кроме 4 лунок, предназначенных для контроля монослоя клеток.
После внесения индикаторного вируса в лунки с культурой клеток планшеты инкубируют при температуре (37±1) 0 С в атмосфере с (5,0±0,5) % СО2 до появления первых признаков цитопатических изменений в клетках с индикаторным вирусом в дозе 1 ТЦД50 (обычно в течение 24-48 ч). Монослой в лунках с 0,1 ТЦД50 индикаторного вируса должен соответствовать состоянию клеток в контрольных лунках.
Учёт результатов осуществляют при выполнении следующих условий:
- доза внесённого вируса соответствует 100 ТЦД50;
- отсутствуют признаки дегенерации в контроле клеток и в лунках с рабочими разведениями СО и ИП без нейтрализующих антител.
Нейтрализация активности испытуемого образца анти-интерфероновыми антителами в сравнении с СО в аналогичном разведении свидетельствует о том, что в испытуемом образце содержится интерферон соответствующего типа.
Подробное описание проведения реакции нейтрализации приводят в нормативной документации.
Препараты, предназначенные для фармацевтического применения и включающие фармакологические активные компоненты, испытывают на животных, растениях и микроорганизмах. Первый шаг состоит в том, что устанавливают вид кривой " доза-эффект ". Под этим понимают геометрическое представление измеренных реакций в зависимости от дозы медикамента в системе координат, по оси абсцисс которой откладывается доза, а по оси ординат — реакция ( чаще всего интенсивность или частота).
Различают альтернативные и количественные кривые " доза-эффект ", в зависимости от того, альтернативную или количественную оценку реакции получают на их основе.
Пример альтернативного соотношения " доза-эффект ": в опытах на токсичность выборкам мышей вводят различные концентрации яда (токсина); по прошествии определенного времени подсчитывают, сколько мышей выжило, сколько умерло. Результатом опыта является "Да" или "Нет", "Все" или "Никто", следовательно, альтернатива .
Пример количественного соотношения " доза-эффект ": несколько групп каплунов получают каждая определенную дозу различно замешанных производных тестостерона; эффект измеряется увеличением длины и высоты гребешка. Результат опыта имеет, следовательно, количественное выражение .
В фармакологии и токсикологии важно понятие средней эффективности дозы 
, под которой понимается доза, вызывающая эффект у половины лечащихся индивидов. Ее оценка осуществляется по альтернативным зависимостям " доза-эффект ". По кривой накопленных процессов или накопленной функции распределения, для которой в большинстве случаев используют логарифмический масштаб по оси абсцисс, можно установить, у какого процента животных при этой и больших дозах обнаружен эффект и у какого процента при этой и меньших дозах не обнаружена реакция . Симптом может быть смерть или выживание (для ядов 50% — летальная доза, 
— доза, при которой погибает 50% подопытных животных).
Можно также контролировать другой симптом, как, например, неспособность к управлению автомобилем при алкогольных дозах (содержание алкоголя в крови в долях процента) или наступление наркоза при дозировании наркотизирующих веществ. 
— наименьшая доза, при которой следует ожидать 100% -ного действия наркоза.
Определение 
(соответственно 
) в большинстве случаев происходит с помощью пробит-анализа. Поскольку этот метод требует значительного объема вычислений, разработан ряд более простых, более пригодных для обычных исследований способов, которые позволяют получить математическое ожидание и дисперсии по зависимости " доза-эффект ". При трех нижеследующих условиях значение 
получают приближенно:
- дозы симметрично сгруппированы относительно среднего значения (значения накопленных процентов определены от 0 до 100%);
- отличие фаз друг от друга, или логарифм отношения для каждой из двух последовательных доз, должны поддерживаться постоянными;
- отдельные дозы должны быть распределены по одинаковому числу индивидов.
Рекомендуется выбирать для каждой отдельной дозы максимум 6 индивидов, и если в распоряжении имеется больше индивидов — уменьшать разницу между дозами.
Метод Спирмэна – Кербера (Bross, 1950, Cornfield, Mantel, 1950, Brown, 1961) представляет собой приближенный непараметрический метод, который позволяет быстро получить очень хорошие оценки математического ожидания и стандартного отклонения. Если распределение симметрично, то оценивают значение медианы – медианную эффективную дозу или медианную летальную дозу, равные дозам, при которых у 50% подопытных животных обнаруживается реакция или наступает смерть. При упомянутых выше условиях и дополнительной гипотезе, что данный тип распределения скорее нормальный, чем логарифмически нормальный, справедливо
 | ( 13.4) |
При этом 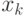
означает наименьшую дозу, начиная с которой всегда наблюдается 100%-ная реакция ; 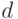
— отличие доз друг от друга; 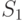
— сумарная доля реагирующих индивидов (при положительной реакции, см. табл. 13.1).
Стандартное отклонение 
, соответствующее 
, оценивают по формуле
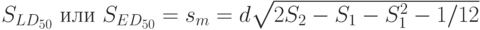 | ( 13.5) |
в которой 
— сумма непрерывно суммируемых накопленных долей реагирующих индивидов.
Государственный стандарт качества лекарственного средства
Общая фармакопейная статья ОФС
"Биологические методы испытания препаратов интерферона с использованием культур клеток
Настоящая фармакопейная статья определяет основные требования к биологическим методам испытаний препаратов интерферона с использованием клеточных культур и распространяется на субстанции и лекарственные формы интерферона человеческого всех типов природного и генно-инженерного происхождения.
Биологические методы с использованием клеточных культур применяют для определения следующих показателей качества препаратов интерферона:
2. Специфическая активность
3. Токсичность (для интерферона альфа-типа).
Методы определения подлинности и специфической активности основаны на способности интерферона подавлять цитопатическое действие вируса на клеточную культуру. При проведении испытаний используют клетки, чувствительные к данному типу интерферона и к вирусу-индикатору. Выбор комбинации "клеточная культура/вирус" основывается на том, какая из них обеспечивает наиболее чувствительный ответ для данного типа интерферона в сравнении со стандартным образцом (СО). Наиболее часто используются следующие комбинации клетка/вирус: клетки бычьих почек Madin-Darby (MDBK), лимфоидные клетки человека Л-41, диплоидные клетки человека Л-68 /вирус везикулярного стоматита (VSV); клетки линии Vero, Нер2С, L929, Л-41/вирус энцефаломиокардита мышей (EMCV); клетки фибробластов человека/вирус леса Семлики, вирус Синдбис.
Подготовка к испытаниям.
Клетки . Культуру клеток выращивают способом, предусмотренным для данного вида клеток в частной фармакопейной статье, таким образом, чтобы обеспечить образование полноценного монослоя в лунках культуральных планшетов в количестве, необходимом для проведения анализа.
Образцы препарата . Пробоподготовка используемых образцов для анализа производится в соответствии с указаниями, приведенными в частных фармакопейных статьях на конкретный препарат.
Приготовление суспензии индикаторного вируса . Суспензию индикаторного вируса готовят в соответствии с указаниями частной фармакопейной статьи на препарат.
Раздел 1. Подлинность
Подлинность препаратов интерферона определяют путем нейтрализации противовирусной активности испытуемого препарата (ИП) стандартным образцом анти-интерферонового иммуноглобулина (IgG) или анти-интерфероновыми поликлональными антителами, предусмотренными в нормативной документации (НД) на соответствующий препарат. Реакцию нейтрализации противовирусной активности ИП проводят в культуре клеток, чувствительных к данному типу интерферона, в присутствии индикаторного вируса.
Порядок определения подлинности
Для определения подлинности препаратов интерферона используют монослой культур клеток, чувствительных к исследуемому типу интерферона, полученного при температуре °С в атмосфере с % в 96-луночных культуральных планшетах, при конечной концентрации клеток 25000-30 000 кл/лунку.
Готовят разведения стандарта анти-интерферонового иммуноглобулина или анти-интерфероновых поликлональных антител, рабочую дозу ИП и стандарта для определения активности интерферона (СО).
Испытуемый препарат и стандартный образец интерферона разводят таким образом, чтобы конечное разведение содержало 10 ед. противовирусной активности интерферона (без перевода в МЕ).
Готовят двукратные разведения стандарта анти-интерфероновых иммуноглобулинов или анти-интерфероновых поликлональных антител до концентраций, указанных в частных фармакопейных статьях на конкретные препараты.
Объединяют в пробирках равные объемы (по 0,5 мл) соответствующих разведений анти-интерферонового иммуноглобулина (анти-интерфероновых поликлональных антител) с рабочей дозой испытуемого препарата и СО. Инкубируют полученные смеси при температуре °С в течение 1 ч. Из лунок микропанелей с культурой клеток выливают ростовую питательную среду, в лунки вносят по 0,1 мл нейтрализованной смеси, не менее чем по 4 лунки на каждое разведение анти-интерферонового иммуноглобулина (анти-интерфероновых поликлональных антител).
Для оценки качества монослоя клеток в процессе постановки реакции (контроль) оставляют не менее 4 лунок, в которые не вносят нейтрализованную смесь. В этих лунках заменяют ростовую питательную среду на поддерживающую, которая должна обеспечивать лишь переживание клеток в уже сформированном монослое при размножении в клетках вируса. В качестве поддерживающей среды обычно используют питательную среду без сыворотки плодов коров с добавлением антибиотиков.
Для контроля дозы индикаторного вируса оставляют 16 лунок в микропанели с культурой клеток, предварительно заменив в этих лунках ростовую питательную среду на поддерживающую.
Проверяют дозу вируса-индикатора и активность стандартного образца интерферона как описано в разделе 2 "Специфическая активность".
После внесения индикаторного вируса в лунки микропанелей с культурой клетки инкубируют при температуре °С в атмосфере с % до появления первых признаков цитопатических изменений в клетках с индикаторным вирусом в дозе 1 мл (обычно в течение 48 ч). Монослой в лунках с 0,1 мл индикаторного вируса должен соответствовать состоянию клеток в контрольных лунках.
Учет и интерпретация результатов.
Учёт результатов осуществляют при условии, что доза внесённого вируса соответствует 100 мл и при отсутствии признаков дегенерации в контрольной культуре клеток.
Нейтрализация активности испытуемого образца анти-интерфероновым иммуноглобулином (поликлональными антителами) в сравнении с МСО/СО, свидетельствует о том, что в испытуемом образце содержится интерферон соответствующего типа.
Раздел 2. Специфическая активность
Определение специфической активности является основным методом количественной оценки качества препаратов интерферона.
Активность интерферона определяют путем сравнения протективного действия испытуемого препарата (ИП) с аналогичным действием международного стандартного образца (МСО) или соответствующего стандартного образца (СО), откалиброванного в Международных единицах (МЕ) по соответствующему международному стандарту.
Метод испытан в трех международных исследованиях под эгидой Всемирной организации здравоохранения (ВОЗ) на международных стандартах всех типов человеческого интерферона (альфа, бета, гамма) и продемонстрировал чувствительность, надежность и воспроизводимость.
Определение специфической активности препаратов интерферона проводят на монослое культур клеток, чувствительных к исследуемому типу интерферона, полученном при температуре °С в атмосфере с % в 96-луночных культуральных планшетах. Плотность клеточной культуры при этом составляет 25000-30000 клеток в каждой лунке.
Противовирусную активность определяют в сравнении с МСО/СО активности человеческого лейкоцитарного интерферона для препаратов природного происхождения и в сравнении с МСО/СО активности человеческого рекомбинантного интерферона для генно-инженерных препаратов соответственно.
Готовят серию десятикратных и двукратных разведений исследуемого препарата в поддерживающей среде (на 4 разведения выше и ниже предполагаемого титра активности). Параллельно готовят соответствующие разведения стандартного образца.
Из лунок планшетов с клеточным монослоем удаляют ростовую среду и вносят приготовленные разведения испытуемого препарата и стандарта (по 100 мкл), используя на каждое разведение не менее 4 лунок с культурой клеток. Для контроля дозы индикаторного вируса оставляют 16 лунок с культурой клеток, а для контроля состояния монослоя клеток - 4 лунки. В эти 20 лунок вносят по 100 мкл поддерживающей среды, используемой для приготовления разведений испытуемых препаратов. Инокулированные и контрольные культуры клеток инкубируют в течение 24 ч при температуре °С в атмосфере с % . Затем в каждую лунку с испытуемым материалом и стандартом вносят по 100 мкл вирусной суспензии, содержащей рассчитанную заранее дозу индикаторного вируса - 100 . В лунки контроля клеток вносят такой же объем (100 мкл) поддерживающей среды.
Определение дозы вируса-индикатора
Определение дозы индикаторного вируса начинают с установления его активности.
Для определения активности вируса-индикатора готовят десятикратные разведения вируса в поддерживающей среде в лунках 24-луночного планшета. Из лунок культурального планшета удаляют ростовую среду и вносят по 100 мкл приготовленных разведений вируса не менее чем по 6 лунок на каждое разведение. Инокулированные и контрольные культуры клеток инкубируют в течение 24 ч при температуре °С в атмосфере с % . За титр (активность) вируса принимают величину, обратную разведению препарата, при котором клеточная культура в 50% лунок оказалась полностью пораженной цитопатическим действием. Титр вируса выражают в тканевых цитопатических дозах - .
Активность вируса вычисляют методом Спирмена-Кербера по формуле:
где - lg разведения ниже которого произошла 100% гибель клеток (+)
d - lg интервала между разведениями (1,0)
n - число лунок на каждую дозу (4)
р - число лунок, давших гибель (+) в и последующих разведениях.
После установления активности вируса производят подсчёт дозы для последующего внесения в лунки с испытуемым препаратом.
Одновременно с внесением вируса-индикатора осуществляется контроль взятой дозы вируса на 16 лунках с культурой клеток, предназначенных для этих целей (по 4 лунки на каждое разведение вируса).
Вносят вирус по 100 мкл, начиная с разведения, соответствующего 100 мл, и до разведения, соответствующего 0,1 мл с коэффициентом разведения равным 10.
Лунки с культурой клеток для оценки состояния монослоя клеток остаются интактными.
После внесения индикаторного вируса культуру клеток инкубируют при температуре °С в атмосфере с % до появления первых признаков цитопатических изменений в клетках с индикаторным вирусом в дозе 1 мл. Монослой в лунках с 0,1 мл индикаторного вируса должен соответствовать состоянию клеток в контрольных лукнах.
Учёт активности интерферона осуществляют при условии, что доза внесённого вируса соответствует 100 мл; в лунках с клетками, зараженными индикаторным вирусом, наблюдается практически полный цитопатический эффект (80-100%), а в контрольной культуре клеток отсутствуют признаки дегенерации.
За титр интерферона принимают величину, обратную разведению препарата, при котором клеточная культура в 50% лунок полностью защищена от цитопатического действия вируса.
Титр интерферона вычисляют методом Спирмена-Кербера по формуле:
где - разведения ниже которого произошла 100% защита (-)
d - интервала между разведениями (1,0)
n - число лунок на каждую дозу (4)
р - число лунок, давших защиту (-) в и последующих разведениях.
Противовирусную активность интерферона в МЕ/мл вычисляют по формуле:
- противовирусная активность интерферона в исследуемом образце в МЕ/мл
- противовирусную активность СО интерферона в МЕ/мл
- титр исследуемого образца
- титр СО в данном опыте
Возможен инструментальный учет результатов с использованием селективного окрашивания живых клеток, защищенных интерфероном от действия вируса, элюирования красителя, фотометрирования оптической плотности элюата и последующей компьютерной обработки результатов. Описание инструментального метода приводят в частных фармакопейных статьях.
Раздел 3. Токсичность
Для определения токсичности препаратов интерферона альфа-типа на клеточных культурах используют монослойные перевиваемые или диплоидные клетки, чувствительные к данному типу интерферона и применяемые для определения его специфической активности (см. раздел "Общие положения"). Клетки выращивают способом, указанным в соответствующей ФСП на препарат (так же, как и для определения специфической активности). В лунки с 1-3- суточным монослоем вносят по 0,1 мл препарата в разведении, указанном для каждого конкретного препарата в частной фармакопейной статье. В лунки с контрольной культурой вносят поддерживающую среду без препарата. Культуры выдерживают в течение 24-48 ч при температуре °С в атмосфере с % , после чего просматривают под микроскопом. Клеточный монослой должен оставаться неповрежденным, без признаков дегенерации и не отличаться от контрольных проб.
| > Государственный стандарт качества лекарственного средства. Фармакопейная статья ФС 42- "Вакцина сибиреязвенная комбинированная" |
| Содержание Информация Министерства здравоохранения РФ от 24 сентября 2013 г. "Общие фармакопейные статьи и фармакопейные статьи. |
Откройте актуальную версию документа прямо сейчас или получите полный доступ к системе ГАРАНТ на 3 дня бесплатно!
Если вы являетесь пользователем интернет-версии системы ГАРАНТ, вы можете открыть этот документ прямо сейчас или запросить по Горячей линии в системе.
Читайте также:


