Устойчивость микобактерий туберкулеза к изониазиду

Микобактериями туберкулеза в ходе эволюционного развития были выработаны механизмы защиты от факторов внешней среды, такие как толстая клеточная стенка, богатые метаболические возможности, которые способны обезвреживать многие клеточные токсины и вещества (альдегиды, перекиси), повреждающие клеточную стенку, также можно упомянуть способность к трансформации(переход в L-форму, образование доминантных клеток) [8].
Выделяют несколько классификаций лекарственной устойчивости микобактерии туберкулеза:
I. По чувствительности к противотуберкулезным препаратам [6, 8]
Истинная генетическая устойчивость – это видовой признак микроорганизмов, который связан с отсутствием точки приложения антибиотика с МБТ, ее недоступностью из-за плохой проницаемости клеточной стенки или разрушения ферментами.
МБТ обладают истинной генетической устойчивостью ко многим неспецифическим антимикробным препаратам, относящимся к семействам пенициллинов, β-лактамов, макролидов, карбапенемов, цефалоспоринов, тетрациклинов. Однако чувствительны к аминогликозидам (стрептомицин, канамицин, амикацин), полипептидам (капреомицин), рифампицинам (рифампицин, рифабутин) и фторхинолонам (ципрофлоксацин, ломефлоксацин, офлоксацин, левофлоксацин, моксифлоксацин, спарфлоксацин) [5].
Приобретенная лекарственная устойчивость МБТ проявляется в возможности размножаться при воздействии на них противотуберкулезных препаратов по средствам развития точечных мутаций [7] в хромосомах и формировании новых генов, контролирующих синтез новых белков-ферментов, разрушающих или инактивирующие конкретные противотуберкулезные препараты. Приобретенную лекарственную устойчивость подразделяют на первичную и вторичную. Первичная ЛУ определяется у больных, заразившихся лекарственно-устойчивыми МБТ. Эти пациенты ранее не принимали противотуберкулезные препараты [6]. Вторичная ЛУ развивается в процессе самого лечения больного туберкулезом. Устойчивость МБТ развивается через 3-6 месяцев с начала лечения [6].
II. По спонтанности возникновения мутаций (спонтанные и индуцированные)
В большой и активно размножающейся микобактериальной популяции всегда имеется небольшое количество лекарственно-устойчивых спонтанных мутантов в соотношениях:
1 клетка-мутант на 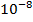
устойчивых к рифампицину;
1 клетка-мутант на 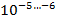
устойчивых к изониазиду, этамбутолу, стрептомицину, канамицину, фторхинолонам;
1 клетка-мутант на 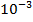
устойчивых к пиразинамиду, этионамиду, капреомицину и циклосерину.
С учётом того что в каверне величина микобактериальной популяции составляет 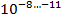
, там имеются мутанты ко всем противотуберкулезным препаратам; в очагах и осумкованных казеозных фокусах эта величина составляет 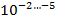
. Спонтанные мутации устойчивы только к одному препарату (спонтанная или эндогенная ЛУ) [6].
При экзогенной (индуцированной) ЛУ происходит естественный отбор в пользу мутантов с естественной ЛУ к противотуберкулезным препаратам. В дальнейшем это приводит к изменению в геноме, что приводит к увеличению бактериальной популяции с лекарственно-устойчивыми микобактериями. Этому способствует проведение неадекватной химиотерапии, при этом пациенту назначается неправильный режим, несбалансированное сочетание и дозы противотуберкулезных лекарственных средств [6].
По эпидемиологической классификации ВОЗ (2008) МБТ могут быть:
- монорезистентными (МР) – к одному противотуберкулезному препарату;
- полирезистентными (ПР) – к двум и более противотуберкулезным препаратам, но не к сочетанию изониазида и рифампицина;
- множественно лекарственно-устойчивыми (МЛУ) – как минимум к сочетанию изониазида и рифампицина. Такие больные обладают высокой эпидемиологической опасностью вследствие высокой вирулентности и контагиозности, длительного периода бактериовыделения. К группам повышенного риска относятся ВИЧ-инфицированные больные и ранее неправильно лечившиеся пациенты с туберкулезом [4]. При анализе заболеваемости туберкулёзом среди ВИЧ-инфицированных г. Краснокамска была выявлена МЛУ у 60% больных с впервые выявленным туберкулезом [1].
- широко лекарственно-устойчивыми (ШЛУ) – как минимум к сочетанию изониазида, рифампицина, фторхинолонов и инъекционных препаратов (канамицина, амикацина, капреомицина). Так как ШЛУ проявляет ЛУ к препаратам I ряда, а противотуберкулезные препараты II ряда не обладают выраженным антибактериальным действием, то можно утверждать, что такие штаммы опасны для жизни пациентов [4].
Генетические основы резистентности ко многим антибиотикам изучены недостаточно хорошо. По имеющимся данным в приобретении лекарственно-устойчивого фенотипа МБТ плазмиды и траспозоны особой роли не играют. Причиной возникновения лекарственно-устойчивых штаммов являются точечные мутации [7] и небольшие инсерции/делеции в геноме микроорганизма [2, 3].
Выделяют следующие механизмы лекарственной устойчивости микобактерий туберкулёза [8]: инактивация антибиотика ферментами, (например, β-лактамазами); изменение мишени (в результате мутации соответствующего участка генома происходит модификация белковой структуры); избыточное образование мишени, которое приводит к нарушению соотношения агент-мишень, в результате чего высвобождаются белки, необходимые для жизнедеятельности бактерии; выведение лекарственного вещества из бактериальной клетки (эффлюкс) по средствам включения стрессорных механизмов защиты; уменьшение проницаемости клеточной стенки, вследствие чего антибиотик не может проникнуть внутрь бактерии; появление дополнительного (обходного) пути обмена веществ.
Помимо прямого воздействия на метаболизм микробных клеток многие антибактериальные препараты (бензилпенициллин. стрептомицин, рифампицин) и другие неблагоприятные факторы (биоциды иммунной системы) приводят к появлению изменённых форм микобактерий (протопласты, L-формы), а также переводят клетки в дормантное состояние: интенсивность обмена клетки снижается и бактерия становится невосприимчивой к действию антибиотика [8].
Выделяют основные противотуберкулезные препараты I ряда: рифампицин, изониазид, этамбутол, стрептомицин, пиразинамид. Препараты II ряда являются резервными и используются для лечения полирезистентного туберкулеза, к ним относятся: этионамид, циклосерин, канамицин, виомицин, амикацин и др. [3, 5]
Механизм рифампицина основан на взаимодействии с β-субъединицей РНК-полимеразы (ген rpoB), в результате чего происходит ингибирование инициации транскрипции. МБТ устойчивы к рифампицину благодаря мутации в фрагменте β-субъединицы (27 кодонов – 507-533) этого фермента (более 95%штаммов). При мутации в кодонах 526 (36%) и 531 (43%) [3, 10] обнаруживают высокий уровень резистентности к антибиотику, в то время как, в кодонах 511, 516, 518 и 522 – низкий. У 4%штаммов механизм резистентности неизвестен, так как они не несут мутаций в данном гене [3, 6].
Изониазид является пролекарством. Молекула препарата активируется внутри микробной клетки под действием фермента каталазы-пероксидазы (ген katG). Мутации в гене katG (в положении 315) приводят к снижению активности фермента примерно на 50%. Также ферменты, участвующие в метаболизме миколевой кислоты (основной компонент клеточной стенки МБТ), являются мишенями для активированного изониазида: ацетилированный белок-носитель (ген acpM), синтетаза (ген kasA) и редуктаза (ген inhA) белка-носителя. Мутации, возникшие в этих генах, вызывают устойчивость, связанную с гиперпродукцией мишеней. Уровень устойчивости при этом ниже, чем при мутации в гене katG [3, 10].
О механизмах действия пиразинамида известно мало. Он также является пролекарством. Пиразинамид по средствам пассивной диффузии проникает в бактериальную клетку, где под действием фермента пиразинамидазы переходит в активную форму – пиразиноевую кислоту (ген pncA), которая блокирует ферменты биосинтеза жирных кислот. 72% изолятов, устойчивых к пиразинамиду, имеют мутации в гене pncA. У пиразинамидустойчивых МБТ выявляют также отсутствие АТФ-зависимого транспорта этого препарата в клетку [3, 6].
Стрептомицин приводит к ингибированию синтеза белка, связываясь с 16S рРНК (rrs). Мутации, ассоциированные с устойчивостью к стрептомицину, идентифицированы в генах, кодирующих 16S РНК (rrs) и белок малой рибосомной субъединицы 12S (rpsL). Есть данные о мутации, которая ведет к повышению устойчивости МБТ к стрептомицину – эти штаммы плохо растут, пока в их питательную среду не добавить данный антибиотик (стрептомицинзависимые штаммы) [6].
Этамбутол осуществляет свое влияние через белок embB (арабинозилотрансфераза), принимающий участие в синтезе структурных элементов клеточной стенки МБТ. Устойчивость к этому препарату появляется вследствие точечной мутации в 306-м кодоне [10].
Этионамид (протионамид) также способствует появлению мутаций в гене inhA, поэтому резистентность к этионамиду иногда возникает вместе с резистентностью к изониазиду, так как эти препараты имеют общего предшественника – никотинамид. Этионамид является пролекарством и для его активирования необходим фермент, который в настоящее время еще не установлен [3, 6].
Канамицин (амикацин) вызывает мутации в 16S рРНК (1400 позиция) – замена аденина на гуанин [6].
Фторхинолоны вызывают мутации в генах gyrA и gyrB ДНК-гиразы. Вследствие этого нарушается процесс репликации ДНК [9].
Представленная информация призвана способствовать формированию целенаправленной деятельности для контроля лекарственной устойчивости в интересах совершенствования лечебно-профилактических мероприятий у больных туберкулезом.
Лекарственная устойчивость — закономерное и одно из самых значимых проявлений изменчивости МБТ, отражающей основной биологический закон, выражение приспособления биологических видов к окружающей среде.
По последним научным данным, основные механизмы развития лекарственной устойчивости МБТ к противотуберкулезным препаратам — мутации в гене, ответственном за обменные процессы, и синтез белка-фермента, инактивирующего конкретный препарат.
Изучение биологических особенностей, ферментативной активности, химического состава лекарственно-устойчивых МБТ в сравнении с лекарственно-чувствительными, генетически однородными МБТ позволило выделить несколько основных механизмов, обусловливающих резистентность бактериальной клетки к данному антибактериальному агенту:
• появление нового пути обменных процессов, обходящего те обменные процессы, на которые воздействует данный препарат;
• увеличение синтеза фермента, который инактивирует данный препарат;
• синтез измененного фермента, который слабее инактивируется данным препаратом;
• уменьшение проницаемости бактериальной клетки в отношении данного препарата.
Все эти процессы могут происходить внутри бактериальной клетки и на уровне клеточной мембраны МБТ.
К настоящему времени установлены характерные особенности МБТ, устойчивых к различным противотуберкулезным препаратам, и изучены практически все гены, контролирующие лекарственную устойчивость к этим препаратам. 
В большой и активно размножающейся микобактериальной популяции всегда имеется небольшое количество лекарственно-устойчивых спонтанных мутантов.
С учетом того что в каверне величина микобактериальной популяции составляет 10 -8… -11 там имеются мутанты ко всем противотуберкулезным препаратам. Поскольку большинство мутаций специфичны для отдельных препаратов, спонтанные мутанты, как правило, устойчивы только к одному препарату. Это явление называют эндогенной (спонтанной) лекарственной устойчивостью МБТ.
При правильном проведении химиотерапии эти мутанты практического значения не имеют, однако в результате неправильного лечения, когда больным назначают неадекватные режимы и сочетания противотуберкулезных препаратов и не дают оптимальные дозы при расчете в мг/кг массы тела больного, изменяется соотношение между количеством лекарственно-устойчивых и чувствительных МБТ. Происходит естественный отбор лекарственно-устойчивых мутантов к противотуберкулезным препаратам при неадекватной химиотерапии, что при длительном воздействии может вести к изменению генома микобактериальной клетки без обратимости чувствительности. В этих условиях происходит размножение главным образом лекарственно-устойчивых МБТ, эта часть бактериальной популяции увеличивается. Это явление
определяется как экзогенная (индуцированная) лекарственная устойчивость.
Наряду с этим выделяют первичную лекарственную устойчивость —
устойчивость МБТ, определяемую у больных туберкулезом, не принимавших противотуберкулезные препараты. В данном случае больной заразился МБТ с устойчивостью к противотуберкулезным препаратам.
Первичная лекарственная устойчивость МБТ у больного туберкулезом характеризуется состоянием микобактериальной популяции, циркулирующей в данном регионе или стране, и ее показатели важны для оценки степени напряженности эпидемической ситуации и выработки региональных режимов химиотерапии.
Вторичная (приобретенная) лекарственная устойчивость определяется как устойчивость МБТ, развивающаяся в процессе химиотерапии у конкретного больного туберкулезом. Приобретенную лекарственную устойчивость следует рассматривать у тех больных, которые имели в начале лечения чувствительные МБТ, с развитием устойчивости через 3—6 мес.
Вторичная лекарственная устойчивость МБТ — объективный клинический критерий неэффективно проводимой химиотерапии. В клинической практике необходимо исследовать лекарственную чувствительность МБТ и по результатам этих данных подбирать соответствующий индивидуальный режим химиотерапии, а его эффективность сопоставлять с динамикой туберкулезного процесса.
По эпидемиологической классификации ВОЗ (2008) МБТ могут быть:
• монорезистентными (МР) — к одному противотуберкулезному препарату;
• полирезистентными (ПР) — к двум и более противотуберкулезным препаратам, но не к сочетанию изониазида и рифампицина;
• множественно лекарственно-резистентными (МЛУ) — как минимум к сочетанию изониазида и рифампицина;
• широко лекарственно-резистентными (ШЛУ) — как минимум к сочетанию изониазида, рифампицина, фторхинолонов и инъекционных препаратов (канамицина, амикацина и капреомицина).
Данная классификация дает представление о частоте распространенности региональной первичной и вторичной лекарственной устойчивости МБТ к трем самым эффективным противотуберкулезным препаратам — изониазиду, рифампицину и фторхинолонам, особенно при их сочетании. Это обусловлено тем, что частота распространенности МЛУ и ШЛУ в каждой стране различна.
Туберкулез легких — инфекционное заболевание, при котором развитие эпидемиологического процесса и химиотерапия больных зависят от частоты и характера лекарственной устойчивости МБТ, циркулирующих в данном регионе, что обусловливает региональный подбор наиболее эффективной комбинации противотуберкулезных препаратов.
Региональный подбор комбинации противотуберкулезных препаратов для химиотерапии больных туберкулезом должен соответствовать уровню распространенности МЛУ МБТ в конкретном регионе и стране.
В клинических условиях для эффективного проведения химиотерапии у конкретного больного необходимо знать индивидуальный спектр лекарственной чувствительности МБТ.
По клинической классификации В.Ю. Мишина (2002) больных, выделяющих МБТ, разделяют на три группы:
•больные с МБТ, чувствительными ко всем противотуберкулезным препаратам;
•больные с ПР и МЛУ МБТ к основным противотуберкулезным препаратам;
•больные с ПР и МЛУ МБТ к сочетанию основных и резервных противотуберкулезных препаратов.
Эта классификация определяет индивидуальную устойчивость МБТ. Такое деление лекарственной устойчивости имеет клиническое значение в плане адекватности режимов химиотерапии, что позволяет персонально подбирать дозу и комбинации основных и резервных противотуберкулезных препаратов у конкретного больного.

Лекарственная устойчивость к противотуберкулезным препаратам
Лекарственная устойчивость к противотуберкулезным препаратам является одним из самых значимых проявлений изменчивости МБТ.
По классификации ВОЗ (1998) МБТ могут быть: монорезистентные — к одному противотуберкулезному препарату; полирезистентные — к двум и более противотуберкулезным препаратам, но не к сочетанию изониазида и рифампицина (самые эффективные лекарства, обладающие бактерицидным действием на МБТ); множественно-лекарственно-резистентные — как минимум к сочетанию изониазида и рифампицина;
По клинической классификации В.Ю. Мишина (2000), больных, выделяющих МБТ, делят на четыре группы:
- больные, выделяющие МБТ, чувствительные ко всем противотуберкулезным препаратам;
- больные, выделяющие МБТ, устойчивые к одному противотуберкулезному препарату;
- больные, выделяющие МБТ, устойчивые к двум и более противотуберкулезным препаратам, но не к сочетанию изониазида и рифампицина;
- больные, выделяющие множественно-устойчивые МБТ как минимум к изониазиду и рифампицину, которые подразделяются на две подгруппы:
- больные, выделяющие МБТ, устойчивые к изониазиду и рифампицину в сочетании с другими основными противотуберкулезными препаратами: пиразинамидом, этамбутолом и/или стрептомицином;
- больные, выделяющие МБТ, устойчивые к изониазиду и рифампицину в сочетании с другими основными и резервными противотуберкулезными препаратами: канамицином, этионамидом, циклосерином, ПАСК и/или фторхинолонам.
Основными механизмами развития лркарственной устойчивости МБТ к противотуберкулезным препаратам являются мутации в гене, ответственном за синтез белка-мишени действия препарата, или гиперпродукция метаболитов, инактивирующих препарат.
В большой и активно размножающейся микобактериальной популяции всегда имеется небольшое количество лекарственно-устойчивых спонтанных мутантов в соотношении: 1 клетка мутант на 10 8 устойчивых к рифампицину; 1 клетка мутант на 10 5 — к изониазиду, этамбутолу, стрептомицину, канамицину, фторхинолонам и ПАСК; 1 мутант на 10 3 — к пиразинамиду, этионамиду, кацреомицину и циклосерину.
С учетом того, что в каверне величина микобактериальной популяции составляет 10 8 , там имеются мутанты ко всем противотуберкулезным препаратам, в то время как в очагах и осумкованных казеозных фокусах — 10 5 . Поскольку большинство мутаций специфичны для отдельных препаратов, спонтанные мутанты, как правило, устойчивы только к одному препарату. Это явление называют эндогенной (спонтанной) лекарственной устойчивостью МБТ.
При проведении правильной химиотерапии мутанты практического значения не имеют, но в результате неправильного лечения, когда больным назначают неадекватные режимы и сочетания противотуберкулезных препаратов и не дают оптимальные дозы при расчете мг/кг массы тела больного, изменяется соотношение между количеством лекарственно-устойчивых и чувствительных МБТ.
Происходит естественный отбор лекарственно-устойчивых мутантов к противотуберкулезным препаратам при неадекватной химиотерапии, что при длительном воздействии может вести к изменению генома МБТ клетки без обратимости чувствительности. В этих условиях происходит размножение главным образом лекарственно-устойчивых МБТ, эта часть бактериальной популяции увеличивается. Это явление определяется как экзогенная (индуцированная) лекарственная устойчивость.
К настоящему времени изучены практически все гены МБТ, контролирующие лекарственную устойчивость к противотуберкулезным препаратам:

Рифампицин воздействует на ДНК-зависимую РНК-полимеразу (ген гроВ). Устойчивость к рифампицину в подавляющем большинстве случаев (более 95% штаммов) связана с мутациями в сравнительно небольшом фрагменте. Размер указанного фрагмента составляет 81 пару оснований (27 кодонов). Мутации в отдельных кодонах различаются по своему значению. Так, при мутациях в кодонах 526 и 531 обнаруживают высокий уровень резистентности к рифампицину. Мутации в кодонах 511, 516, 518 и 522 сопровождаются низким уровнем устойчивости к рифампицину.
Изониазид по существу представляет собой пролекарство. Для проявления антибактериальной активности молекула препарата должна быть активирована внутри микробной клетки, однако химическая структура активной формы изониазида окончательно не выявлена. Активация происходит под действием фермента каталазы/пероксидазы (ген katG). Мутации в этом гене (обычно в положении 315), приводящие к снижению активности фермента на 50%, обнаруживают приблизительно у половины изониазид-устойчивых штаммов МБТ.
Вторым механизмом развития устойчивости МБТ к изониазиду является гиперпродукция мишеней действия активных форм препарата. К указанным мишеням относятся белки, участвующие в транспорте предшественников миколевой кислоты и ее биосинтезе: ацетилированный белок-носитель (ген асрМ), синтетаза (ген kasA) и редуктаза (ген inhA) белка-носителя.
Миколевая кислота является основным компонентом клеточной стенки МБТ. Мутации обычно выявляются в промоторных областях перечисленных генов. Уровень устойчивости связан с гиперпродукцией мишеней и, как правило, ниже, чем при мутациях в генах каталазы-пероксидазы.
Этионамид (протионамид) также вызывает мутации в гене inhA. Это объясняется тем, что для изониазида и этионамила общим предшественником является никотинамид, и устойчивость к этионамиду иногда приобретается вместе с устойчивостью к изониазиду. Этионамид является пролекарством и ему необходима активация ферментом, который до сих пор не выявлен.
Пиразинамид, как и изониазид, является пролекарством, так как их общим предшественником также является никотинамид. После пассивной диффузии внутрь микробной клетки пиразинамид превращается в пиразиноивую кислоту под действием фермента пиразинамидазы (ген рnсА). Пиразиноивая кислота, в свою очередь, ингибирует ферменты биосинтеза жирных кислот. У 70—90 % штаммов микобактерий, устойчивых к пиразинамиду, в структурных или промоторных областях пиразинамидазы обнаруживают мутации.
Стрептомицин вызывает два вида мутаций, приводящих к модификации участка связывания антибиотика с малой субъединицей (I2S) рибосомы: мутации в генах, кодирующих 16S рРНК (rrs), и генах, кодирующих 12S рибосомальный протеин (rspL). Есть и более редкая группа мутаций генов рибосом, которые настолько повышают устойчивость МБТ к стрептомицину, что эти мутанты называются стрептомицин- зависимыми, поскольку растут плохо до тех пор, пока в питательную среду не добавляют стрептомицин.
Канамицин (амикацин) вызывает мутации, кодирующие геном rrs, когда имеет место замена аденина на гуанин в позиции 1400 /6S рРНК.
Этамбутол воздействует на белок етbВ (арабинозилотрансфераза), который участвует в биосинтезе компонентов клеточной стенки МБТ. Устойчивость к этамбутолу в подавляющем большинстве случаев связана с точечной мутацией в 306 кодоне.
Фторхинолоны вызывают мутации в генах ДНК-гиразы (ген gyrA).
Следовательно, в клинической практике необходимо исследовать лекарственную чувствительность и по результатам этих данных подбирать соответствующий режим химиотерапии и сопоставлять его эффективность с динамикой туберкулезного процесса.
Наряду с этим выделяется первичная лекарственная устойчивость МБТ как устойчивость, определяемая у пациентов, не принимавших противотуберкулезные препараты. В данном случае подразумевается, что больной заразился именно этим штаммом МБТ.
Первичная множественная лекарственная устойчивость МБТ характеризуется состоянием микобактериальной популяции, циркулирующей на данной территории, и ее показатели важны для оценки степени напряженности эпидемической ситуации и выработки стандартных режимов химиотерапии. В России в настоящее время частота первичной множественной лекарственной устойчивости в отдельных регионах составляет 5—15%.
Вторичная (приобретенная) лекарственная устойчивость определяется как устойчивость МБТ, развивающаяся в процессе химиотерапии. Приобретенную лекарственную устойчивость следует рассматривать у тех больных, которые имели в начале лечения чувствительные МБТ с развитием устойчивости через 3—6 мес.
Вторичная множественная лекарственная устойчивость МБТ является объективным клиническим критерием неэффективно проводимой химиотерапии; в России она составляет 20—40%.
Способность бактерий туберкулеза быстро развивать устойчивость к лекарственным препаратам – одна из причин широкого распространения инфекции, снижения эффективности и удорожания лечения.

Когда у пациента диагностируется лекарственно-устойчивый туберкулез, то это означает, что лечение предстоит долгое, затратное и без гарантий эффективности. Чаще эта форма выявляется у пациентов с длительным анамнезом заболевания. Но иногда туберкулез, устойчивый к препаратам, диагностируется у здоровых, ранее не лечившихся людей.
Почему туберкулезная палочка приобретает устойчивость?
Лекарственно-устойчивый туберкулез формируется тогда, когда из-за спонтанных мутаций появляются бактерии, нечувствительные к лекарству, или когда не удается поддерживать необходимую концентрацию препарата в крови. В результате гибнут не все возбудители, менее чувствительные выживают. Если применяется несколько антибиотиков, то устойчивые бактерии могут быть уничтожены ими.
При монотерапии или при неправильно подобранной схеме выжившие палочки размножаются, и их потомки наследуют свойство резистентности к данному лекарству. Невосприимчивость туберкулезной палочки закрепляется генетически. Так формируется лекарственная устойчивость микобактерий туберкулеза.
Формированию устойчивости способствуют некоторые клинические ситуации. Знание этих условий необходимо для предотвращения перехода заболевания в устойчивую форму:
- недостаточная продолжительность курса лечения,
- пропуски в приеме препаратов,

использование дозы лекарства, ниже рекомендованной,- использование некачественных лекарственных средств,
- назначение сочетаний химиопрепаратов без проверки чувствительности к ним (если один из препаратов неэффективен, вероятность формирования резистентности к другому велика),
- назначение нерациональных схем,
- использование противотуберкулезных антибиотиков с широким спектром антимикробной активности (фторхинолонов) для лечения других бактериальных инфекций (например, пневмонии) с нераспознанным туберкулезом,
- перекрестная резистентность – если появляется резистентность к одному химиопрепарату может возникнуть резистентность и к другому из того же класса.
Стоит помнить, что одна из основных причин развития лекарственно-устойчивого туберкулеза – недостаточная приверженность терапии.
Больные, достигая положительных результатов терапии, часто перестают адекватно оценивать серьезность ситуации и начинают пропускать прием лекарств, а то и вовсе бросают лечение. Если к этому моменту не наступило выздоровление, через некоторое время заболевание снова начинает прогрессировать, но уже в виде устойчивой формы туберкулеза. Есть и другие причины формирования устойчивости (врачебные ошибки, недочеты в организации лечебного процесса, отсутствие лекарств).
Особую значимость в появлении лекарственно устойчивого туберкулеза имеет заболеваемость в местах лишения свободы. В появлении и распространении форм туберкулеза, устойчивого к лечению, среди лиц из МЛС участвуют следующие факторы:

высокая скученность зараженных людей,- пребывание социально неадаптированных лиц с высоким уровнем заболеваемости совместно с относительно благополучными заключенными,
- недостаточное обеспечение медикаментами,
- отсутствие преемственности в лечении (некоторая часть туберкулезных больных не обращаются в диспансеры после освобождения и не лечится).
Эта группа людей служит постоянным источником устойчивых штаммов возбудителя. В результате, излечение вновь заразившихся больных становится все более проблематичным, растет уровень заболеваемости, количество тяжелых форм и летальных исходов.
Важно! Заражение человека микобактерией, устойчивой к препаратам, ведет к заболеванию первично резистентным туберкулезом, который даже при выявлении на ранних стадиях очень плохо поддается лечению.
Виды лекарственно устойчивого туберкулеза и их терапия
Туберкулезная палочка может приобретать резистентность к нескольким химиопрепаратам. Чем более устойчива палочка, тем сложнее подобрать схему лечения. В зависимости от того, к каким препаратам возбудитель нечувствителен, выделяется 3 формы лекарственно-устойчивого туберкулеза:

Туберкулез с множественной лекарственной устойчивостью (МЛУ-ТБ). Эта форма диагностируется при устойчивости микобактерии к двум самым сильным противотуберкулезным химиопрепаратам первой линии – Изониазиду и Рифампицину, независимо от наличия или отсутствия устойчивости к другим препаратам этой группы.- Туберкулез с широкой лекарственной устойчивостью (ШЛУ-ТБ). Она диагностируется при устойчивости к Изониазиду, Рифампицину и другим препаратам – любому из фторхинолонов и любому из инъекционных антибиотиков третьей линии (Канамицину, Амикацину или Капреомицину).
- Абсолютно устойчивый туберкулез. Этот термин не является официально признанным медицинским сообществом, но он хорошо отражает ситуацию – микобактерия резистентна ко всем химиопрепаратам, тестирование на лекарственную чувствительность (ТЛЧ) к которым проводилось.
Кроме этого, различают первичную, когда больной изначально инфицирован устойчивой бактерией, и приобретенную устойчивость, появившуюся минимум после месяца лечения, монорезистентность (к одному из препаратов) и полирезистентность (к нескольким лекарственным средствам). Выделение туберкулеза МЛУ производится для стандартизации стратегий лечения этих больных.
Клинически эта форма болезни в момент постановки диагноза ничем не отличается, разница – в ответе на лечение. Заподозрить лекарственно-устойчивый туберкулез можно при отсутствии эффекта от терапии в течение 4–6 месяцев, при прогрессировании процесса на фоне приема лекарств, при продолжающемся бактериовыделении свыше 4 месяцев.
В идеале, тестирование на лекарственную чувствительность должно проводиться всем больным при установлении диагноза, по крайней мере, к основным химиопрепаратам. Организационно это не всегда возможно, поэтому определение чувствительности должно проводиться как минимум больным из групп риска:

больным, ранее получавшим лечение по поводу туберкулеза,- ВИЧ-инфицированным,
- работникам медицинских учреждений,
- пациентам, бывшим в контакте с больными устойчивыми формами или с умершим от МЛУ-ТБ,
- больным, продолжающим выделять микобактерию после 4 месяцев лечения,
- освободившиеся из МЛС.
Лечение больных с МЛУ–ТБ проводится в соответствии со стандартными схемами. В разработке стратегии лечения должны учитываться не только аспекты подбора препаратов и режима дозирования.
Важно! Для успешного лечения необходимо уделять внимание мотивации больных к соблюдению режима приема лекарств и выдерживанию необходимой продолжительности курса.
Основные принципы терапии лекарственно устойчивого туберкулеза:
- назначается одновременно 5 химиопрепаратов с доказанной чувствительностью к выделенному штамму, а при эмпирическом лечении или при тяжелых формах поражения – и более пяти препаратов,
- применяют максимальные дозы,
инъекционные антибиотики продолжают вводить еще 6 месяцев после прекращения бактериовыделения,- после получения отрицательного посева мокроты лечение продолжается еще 18 месяцев, общая продолжительность составляет около 2 лет,
- прием лекарств производится под контролем медицинского персонала 6 дней в неделю 2–3 раза (в зависимости от схемы) в день,
- обязательно получение информированного согласия на лечение,
- учет этих больных в единой базе данных.
Количество больных туберкулезом во всем мире постоянно увеличивается, в том числе и из-за роста числа больных, инфицированных устойчивыми штаммами. Кроме того, заболеваемость туберкулезом имеет довольно выраженный социальный характер. Ему подвержены в большей степени как раз именно те люди, лечение которых сложнее контролировать. Знание этих фактов, понимание механизмов развития устойчивости и строгое следование рекомендациям, разработанным научным сообществом – инструменты, дающие надежду на обретение контроля над этой болезнью.
Читайте также:


