Ифа тест система туберкулеза
Анализ крови при туберкулезе легких и других его видах — это диагностическая процедура, которая включает в себя несколько методик по определению возбудителя заболевания. Этот способ диагностики микобактерий не только один из самых эффективных, но и самый важный, подобные лабораторные исследования не имеют возрастных ограничений.
Анализ крови на туберкулез вместо Манту дает более точную информацию о картине заболевания.
Существуют разные виды такой диагностики:
- общий;
- биохимический;
- ИФА (иммуноферментный);
- ПЦР (полимеразная цепная реакция);
- IGRA;
- T-SPOT;
- QFT-GIT (квантифероновый тест).
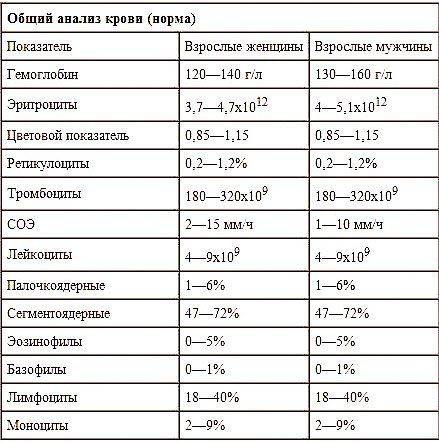
Клинический анализ крови не выявляет бактерии, но при наличии острой формы болезни покажет изменения в виде повышенных показателей. Результаты в данном случае будут схожи с результатами при пневмонии или раке легких.
Общий анализ крови при туберкулезе, поможет узнать, насколько иммунитет способен бороться с инфекцией. Изменения затрагивают, как правило, показатели лейкоцитов и СОЭ.
С помощью биохимического исследования изучается состав белков. Они занимают значимое место в процессах необходимых для жизни, гомеостазе организма, иммунитета, формировании и развитии инфекционных заболеваний. Изменения белкового состава во время инфекции связаны с тем, в какой форме и фазе проходит болезнь.
У пациентов с латентным течением болезни в сыворотке:
- не наблюдаются изменения показателей количества общего белка, фибриногена;
- не наблюдается С-реактивный белок;
- не повышается РОЭ;
- не изменяется коагуляционная проба.
При острой форме болезни наблюдаются изменения состава белков. Таким образом проявляется реакция на микобактерии туберкулеза. Происходит повышение РОЭ, меняется коагуляционная проба, образуется С-реактивный белок, увеличивается показатель фибриногена.
Рекомендуем посмотреть видео о том, как берут биохимический анализ крови:
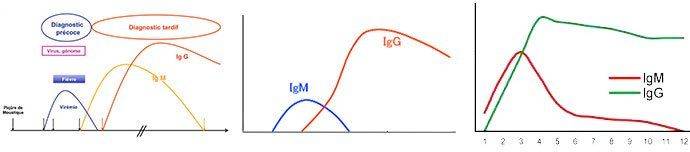
ИФА подходит в качестве предварительной диагностики наличия заболевания. Возможно назначение взамен реакции Манту у детей. Для исследования делают забор крови из вены.
Благодаря ИФА можно определить, есть ли в организме человека антитела к туберкулезу. Результаты могут быть информативны только в регионах с низкой заболеваемостью. Недостатком считается отсутствие определения стадии заболевания.
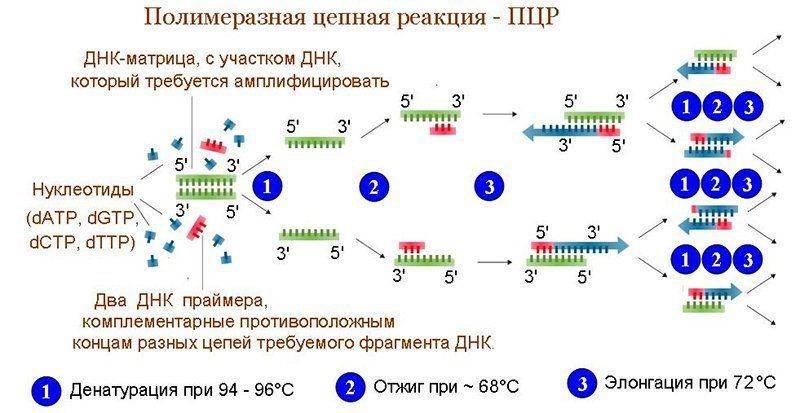
ПЦР на туберкулез применяют для диагностики и контроля эффективности назначенного курса терапии. Исследование редко дает ложные результаты, считается более информативным, чем ИФА и реакция Манту у детей. Происходит обследование на определении фрагментов ДНК. Также положительным моментом считается отсутствие необходимости вводить ребенку туберкулин.
С помощью реакции уже через двое суток получают сведения о стадии и локализации заболевания (кроме легких). Для исследования делать забор крови можно из вены или взять мокроту. В данном случае анализ мокроты будет более точным. ПЦР широко применяется в России для того чтобы определить туберкулез.
В Европе и некоторых западных странах используют этот вид анализа крови на туберкулез. Тест позволяет определить ответ иммунитета Т-лимфоцитов на антитела CFP-10, ESAT-6. В России этот вид диагностики не пользуется популярностью.
Исследование может показать более точные результаты, чем ИФА и ПЦР. Проводится у детей, которым противопоказана проба Манту.
- Сдать кровь на туберкулез необходимо из вены.
- Перед процедурой нельзя принимать пищу за два часа.
- Обследование основано на подсчете Т-клеток в крови.
Высокая степень информативности позволяет исключить дополнительные анализы и выявить открытую и закрытую степень. Точность теста составляет 95%. В России применение T-SPOT разрешено с 2012 года.
Современный способ лабораторной диагностики. Изучение основано на выявление в крови интерфероновой реакции на МТБ. Исследование является довольно точным, минусом считается то, что оно не показывает, какие органы поражены.
Тест подходит для применения у детей, которым противопоказана проба Манту. Так как у данного вида отсутствуют противопоказания, он легко переносится детьми. У взрослых возможен ложный результат. В России этот вид диагностики используется уже несколько лет, но пока не очень популярен. Сделать его можно только в крупных городах. Минусом считается высокая стоимость. Цена может меняться от 1500 до 4500 рублей.
Заключение
Исследование крови играет важную роль при правильной постановке диагноза и дальнейшем лечении.
К преимуществам такого вида относят:
- возможность постановки диагноза за короткий срок;
- отсутствие противопоказаний;
- отсутствие необходимости сдавать повторные тесты;
- анализ крови на туберкулез заменяет кожные пробы (Манту, Диаскинтест) ребенку;
- малая вероятность ложноположительных реакций.
Какие анализы крови сдавать при подозрении на решает врач исходя из клинической картины заболевания.
Лечение этой болезни — очень долгий и сложный процесс, который может занять от 6 месяцев до 2 лет. При обнаружении первых симптомов необходимо сразу обратиться за медицинской помощью, для проведения полного обследования.
Туберкулёз преследует человечество на протяжении всей его истории. К известным ранее факторам, способствующим возникновению этого заболевания (бедность, скученность, неполноценное питание), сейчас добавились новые: распространение СПИДа, стресс, загрязнение окружающей среды. За последние 5–6 лет заболеваемость туберкулёзом резко возросла не только в странах третьего мира, но и в развитых государствах. По данным ВОЗ, в 1995 году число больных туберкулёзом составило более 20 млн. человек, из которых умерло более 3 млн. (больше, чем от любой другой инфекционной болезни). В 1996 году туберкулёзом на земном шаре заболело около 8 млн. человек, в России в 1997 году — 81100 человек.
Туберкулёз более известен как заболевание легких, хотя он может поражать практически любой орган или систему органов. В последнее время получили распространение ранее довольно редкие формы: мелкоочаговый туберкулёз, туберкулёз периферических лимфатических узлов и туберкулёз половых органов. Все чаще туберкулёз встречается в составе сочетанных инфекций.

Возбудитель туберкулёза Mycobacterium tuberculosis распространяется, в основном, в виде аэрозолей при кашле и чихании, а также при контакте слизистых оболочек. При определенных условиях возбудителями туберкулёза могут быть также Mycobacterium bovis и Mycobacterium africanum. Причем заразными, по некоторым данным, могут быть не только люди, но и больные животные. Несмотря на контагиозность возбудителя (особенно M. tuberculosis) подавляющая часть инфицированных им людей не заболевает, и туберкулёз у них протекает в неактивной форме. Вероятность возникновения активного туберкулёзного процесса у таких людей в течении жизни составляет обычно не более 10%. Однако воздействие факторов риска может привести к ра збалансировке защитных механизмов организма и “пробою” иммунитета. В таких случаях вероятность развития активной формы туберкулёза значительно возрастает. Например, среди ВИЧ-положительных пациентов риск заболевания туберкулёзом возрастает на 10% за каждый год сочетанной инфекции.
По данным ВОЗ, для туберкулёза при отсутствии медицинской помощи характерна высокая смертность (55%). Эффективность современной терапии туберкулёза, достаточно высокая на ранних стадиях заболевания, резко снижается на более поздних стадиях. Поэтому смертность даже среди леченных больных в целом достигает 15 %. В этой связи ранняя диагностика туберкулёза может иметь решающее значение, при условии быстрого фармакологического вмешательства она способна существенно сократить заболеваемость и смертность от туберкулёза.
Определяющими требованиями к методам диагностики являются специфичность и чувствительность. Если метод имеет недостаточную специфичность, то при его использовании будет получено большое число ложноположительных результатов среди здоровых людей или среди нетуберкулёзных больных. Недостаточно чувствительный метод будет “пропускать” слишком много действительно больных активным туберкулёзом, а слишком чувствительный — может давать положительный результат при тестировании здоровых людей с неактивной формой туберкулёза или пациентов, относительно недавно вакцинированных БЦЖ. При выборе метода диагностики немаловажную роль также играют: время анализа, его стоимость, воспроизводимость результатов, а также возможность объективного инструментального учета результатов.
Среди классических методов диагностики туберкулёза лёгких, по-видимому, наибольшей специфичностью обладает метод идентификации культуры возбудителя в посеве мокроты пациента. Широко применяется также цитологическое (микроскопическое) определение микобактерий в мазках мокроты и плеврального экссудата больных после окраски прочным синим (АFВ-метод). Однако оба этих метода оказываются непригодными при небациллярных формах туберкулёза, когда микобактерии отсутствуют в биологических жидкостях. Поскольку такие формы туберкулёза встречаются в 2–3 раза чаще бациллярных, общая эффективность выявления больных при использовании данных методов невысока. Кроме того, культивирование микобактерий, из-за их медленного роста, достаточно длительная (около 1 месяца) и дорогая процедура, а цитологическая идентификация не обладает достаточной чувствительностью, чревата ошибками и слишком сильно зависит от квалификации персонала (при использовани и теста в лабораториях развивающихся стран выявляется 20–40% больных туберкулёзом, в развитых странах
При небациллярной форме туберкулёза лёгких и при туберкулёзе других органов определенное значение может иметь обследование вышеописанными методами биоптатов пораженной ткани. Однако на практике это, как правило, проводится лишь на достаточно поздних стадиях заболевания.
Диагностика легочного туберкулёза, основанная на рентгеноскопии грудной клетки, может давать неадекватные результаты из-за возникших под действием самых разнообразных факторов неспецифических изменений в лёгких. Кроме того, при различных сочетанных инфекциях, например, туберкулёз+ВИЧ, картина рентгеноскопии вообще может сильно отличаться от классической (характерной для активного процесса в лёгких).
В целом, три описанных выше метода диагностики туберкулёза (идентификация культуры, АFВ-метод и рентгеноскопия) малопригодны для массового скрининга населения, осуществимы только в специализированных лабораториях и требуют серьёзного финансирования. Практически всегда они используются лишь для подтверждения диагноза “активный туберкулёз”, а не для его обнаружения. В результате, ранняя диагностика туберкулёза зачастую основывается лишь на клинической картине и совокупности косвенных признаков. А принимаемые по этому поводу решения полностью зависят от квалификации и опыта врача.
Говоря о современных методах диагностики туберкулёза, нельзя не упомянуть о методе полимеразной цепной реакции (ПЦР или PCR). Это высокоспецифичный и чрезвычайно чувствительный тест, с помощью которого принципиально возможно идентифицировать в анализируемой пробе наличие даже одной-единственной молекулы ДНК возбудителя. На метод ПЦР возлагали большие надежды, он постоянно совершенствуется и в настоящее время, в принципе, уже нашел свою нишу в диагностике туберкулёза. Недостатками его являются высокая цена, сложность, дорогое инструментальное и приборное обеспечение. Кроме того, из-за своей сверхвысокой чувствительности этот тест часто определяет неактивную форму туберкулёза и очень зависим от уровня квалификации персонала и соблюдения особых требований к лабораторным помещениям, в которых проводится анализ. Минимальное загрязнение анализируемых образцов, инструментария и воздуха в помещении нуклеиновой кислотой микобактерий может дать ложноположительный результат. Поэтому применение этого метода в практике лабораторной диагностики пока довольно ограничено.
Разнообразие форм туберкулёза, быстрое распространение в последнее время внелёгочных форм со “стертой” картиной процесса заболевания, а также весьма индивидуальная реакция на него организма пациентов, представляют собой серьёзную проблему для диагностики туберкулёза вообще и для ранней его диагностики, в частности.
Относительно широкие возможности для скрининга туберкулёза предоставляют методы серодиагностики, среди которых наиболее распространены тесты, основанные на определении антител к антигенам микобактерий. Результаты серологических тестов в гораздо меньшей степени зависят от того, в какой форме — бациллярной или абациллярной — проявляется туберкулёз. Благодаря своей относительно невысокой стоимости, скорости, достаточно высокой чувствительности и специфичности, они незаменимы при массовых обследованиях. Казалось бы, что с серологическими методами конкурирует недорогой и простой в исполнении кожный туберкулиновый тест (реакция Манту), являющийся показателем напряженности клеточного иммунитета. Однако, из-за низкой специфичности и, по сути, неспособности дифференцировать активные и неактивные формы туберкулёза его применение в большинстве случаев вряд ли оправдано. Напротив, гуморальный иммунный ответ весьма характерен именно для активного процесса, поэтому серологические тесты, в которых провод ится определение специфичных к M. tuberculosis антител, намного достовернее кожных тестов.
Серологические методы отличаются большим разнообразием. Традиционные тесты, основанные на реакциях гемагглютинации, торможении гемагглютинации, фиксации комплемента и некоторые другие, относительно просты в постановке, недороги, имеют небольшое время проведения анализа (от 1 часа до суток), нуждаются в минимуме оборудования. Однако они в настоящее время морально устарели и, кроме того, эффективная диагностика туберкулёза с их помощью возможна только при комбинированном совместном использовании сразу нескольких тестов, например, РНГА+РПК+РПГ.
Результаты анализа при постановке традиционных серологических методов довольно плохо поддаются инструментальному учету. Поэтому к их недостаткам можно добавить известный субъективизм визуальной оценки и, следовательно, не слишком хорошую воспроизводимость результатов теста в “серой зоне” при невысоких титрах антител к антигенам микобактерий.
К современным методам серодиагостики туберкулёза, получившим в последнее время достаточно широкое применение, относятся иммунохроматография и дот-блоттинг. Тест-системы, в которых используются эти принципы, приспособлены для простого в исполнении экспресс-анализа с визуальной оценкой результата.
К иммунохроматографическим диагностикумам относится выпускаемый в Австрии набор “ТВ-Check-1”. Постановка анализа в данной тест-системе не вызывает особых затруднений у лаборанта и позволяет получить результат тестирования за 25–35 минут. К недостаткам теста можно отнести высокую стоимость анализа и серьёзную зависимость оценки результата от оператора при невысоком титре специфичных антител (т.е. в “серой зоне”).
Примером тест-системы, в которой используется дот-блоттинг, может служить набор “МycoDot”, выпускаемый фирмой “DynaGene”. Постановка анализа с применением данного набора сложнее, чем тестирование образцов в тест-системе “ТВ-Check-1”. Однако при его использовании за счет положительных и отрицательных контролей достигается большая точность визуальной оценки результата, а стоимость анализа несколько меньше, чем в тест-системе “ТВ-Check-1”.
Среди современных методов серодиагностики туберкулёза наибольшее распространение в России получили иммуноферментный и радиоиммуный анализы (ИФА и РИА). При их использовании, как правило, применяется инструментальный учёт и автоматическая (компьютерная) обработка результатов анализа, что позволяет исключить субъективную оценку. Для тест-систем, в которых используются принципы ИФА и РИА, характерны высокие технический уровень, степень стандартизации и воспроизводимость результатов анализа. Они удобны в работе и позволяют проводить одновременное тестирование большого количества проб, т.е. проводить скрининг.
Интенсивное развитие метода ИФА в последние 10–15 лет привело к тому, что иммуноферментные тест-системы по своим характеристикам, и в первую очередь по чувствительности, стали сравнимыми с радиоиммунными тестами. Проведение ИФА, в отличие от РИА, не требует оборудованных для работы с радиоактивностью помещений, высокой квалификации персонала и дорогостоящего оборудования, кроме того, стоимость анализа значительно ниже. Поэтому в большинстве лабораторий иммуноферментные тест-системы вытеснили радиоиммунные.
При использовании современных иммуноферментных диагностикумов на туберкулёз проблемы, связанные с недостаточной специфичностью, возникают достаточно редко. Однако их чувствительность, как правило, не удовлетворяет практических врачей. Дело в том, что антитела к микобактериям в том или ином количестве присутствуют в крови не только больных, но и здоровых инфицированных людей. В сыворотке крови больных титры антител могут иногда достигать очень больших величин, однако этот показатель слишком неявно (неопределенно) связан с давностью инфицирования или тяжестью заболевания. В большей степени он опосредуется особенностями течения болезни и состоянием иммунной системы пациента. Титры антител у людей с неактивным туберкулёзом обычно всё-таки существенно ниже, чем у больных, и это дает возможность при соблюдении определенных правил вывести некий дискриминационный уровень, при преодолении которого можно говорить о высокой вероятности активного туберкулеза.
Методы серодиагностики туберкулёза постоянно совершенствуются и развиваются, вместе с тем, ряд проблем не получил полного разрешения. Учитывая специфику заболевания (наличие неактивного и активного вариантов туберкулёза, многообразную локализацию процесса, индивидуальность реакций иммунной системы), достичь 100% чувствительности, вероятно, невозможно. Однако к этой отметке можно попытаться максимально приблизиться.
При разработке новой тест-системы для иммуноферментной серодиагностики туберкулёза сотрудники фирмы “Вектор-Бест” выделили два ключевых момента:
Во-первых, поскольку у каждого больного при возникновении активной формы туберкулёза вырабатывается свой собственный, индивидуальный спектр антител, при конструировании тест-системы было решено использовать не один-два, а комплекс наиболее иммуногенных антигенов в расчете на более универсальную чувствительность по отношению к различным формам туберкулёза.
Во-вторых, тест-система должна выявлять специфичные антитела, принадлежащие ко всем классам иммуноглобулинов. Большинство тест-систем рассчитано на определение только иммуноглобулинов класса G, поскольку считается, что IgM-антитела присутствуют в крови только в начале заболевания и, в основном, при неактивном туберкулёзе, а при развитии активного процесса уже исчезают. Однако это касается главным образом взрослых. У детей же IgM к возбудителю туберкулёза нередко присутствуют в крови в течение 2-х лет после начала заболевания, причем их уровень значителен даже при относительно низких титрах IgG.
Антитела класса IgA могут определяться при туберкулёзе как в крови (сывороточный IgA), так и в секретах, моче, мокроте (секреторный IgA). Часто в диагностической практике происходит недооценка этого факта. Установлено, что уровень специфических IgA при туберкулёзе подвержен значительным колебаниям, однако это относится в основном к секреторному IgA. В ряде опубликованных в последнее время работ сообщалось о увеличении чувствительности серологического анализа на туберкулёз (на 10–20%) при одновременном определении IgG и сывороточных IgA. По предварительным данным, полученным сотрудниками фирмы “Вектор-Бест”, дополнительное к IgG определение специфичных антител IgA и IgM у детей 7–13 лет увеличивает чувствительность ИФА-теста в среднем на 40 % без снижения специфичности.
При проведении исследований по разработке новой иммуноферментной тест-системы, названной “АТ-ТУБ-Бест”, полученные результаты сравнивали с данными анализа в тест-системах “Акватуб-АТ-1” (производства фирмы “Аквапаст”, Санкт-Петербург) и “МycoDot” (“DynaGen”, США). В табл. 2 приведены сравнительные характеристики чувствительности указанных тест-систем на двух выборках сывороток крови больных из Казахстана и г. Новосибирска и на здоровых донорах (СПК г. Новосибирска).
В результате проведенных предварительных исследований найден оптимальный вариант конструкции тест-системы, обеспечивающий ей более высокую чувствительность (при сохранении специфичности) по сравнению с тест системой “Акватуб-АТ-1” Это достигается за счет использования для иммобилизации на подложку очищенного комплекса антигенов микобактерий, а также применения сбалансированного пероксидазного конъюгата антивидовых антител к иммуноглобулинам трёх основных классов — G, M, и A.
Комплектация тест-системы готовыми к работе планшетами с сорбированным и стабилизированным в лунках антигеном позволяет упростить анализ и сократить его время. В набор тест-системы “АТ-ТУБ-Бест” входят все необходимые для проведения анализа реактивы и материалы. Дополнительное оборудование при визуальном учёте результата: флаконы, автоматические пипетки; при инструментальном — флаконы, автоматические пипетки, фотометр (с детекцией при 492 нм).
Идеальных тест-систем не существует. Диагностика туберкулёза очень сложна, и ни один тест не может быть самодостаточен. Только учтя все клинические симптомы и результаты анализов, можно сделать более-менее правильные выводы. Скрининговые обследования — это только начальный этап в диагностике туберкулёза. Обнаружение специфических антител в крови ещё не может служить достаточным основанием для постановки диагноза. Иногда высокие уровни антител могут быть и у здоровых людей, когда-то болевших туберкулёзом. Положительный результат может служить основанием лишь для немедленного углубленного обследования пациента, которое должно включать контроль характерных для активного туберкулёза симптомов (персистирующий кашель и субфебрильная температура, ночное потоотделение, боли в грудной клетке, общее недомогание, изменение в суставах и т.д.), анализ крови (лейкоцитоз), рентгеноскопию грудной клетки и обследование других органов, со стороны которых есть определенная симптоматика.
Антитела к возбудителю туберкулеза (M. tuberculosis) – это специфические иммуноглобулины, вырабатываемые иммунной системой в ответ на инфицирование возбудителем туберкулеза.
Суммарные антитела к Mycobacterium tuberculosis, иммуноглобулины класса G и M к возбудителю туберкулеза (микобактерии).
Anti-mycobacterium tuberculosis IgA, IgG, IgM, M. tuberculosis antibodies, IgA, IgG, IgM, MBT antibodies, total.
Иммуноферментный анализ (ИФА).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Туберкулез – это инфекционное заболевание, возбудителями которого являются аэробные микобактерии (M. tuberculosis, M. bovis, M. africanus, M. microti), распространенные в почве, воде и у животных. Mycobacterium tuberculosis – это вид микобактерий, который вызывает туберкулез у человека в 92 % случаев.
M. tuberculosis передается воздушно-капельным путем от больных туберкулезом в активной форме. У 90 % людей после первичного инфицирования микобактерии оседают в нижних отделах легких и не приводят к развитию заболевания, так как вырабатывается иммунный ответ, не допускающий увеличения количества бактерий. Однако в случае сильного ослабления иммунной системы туберкулезные палочки начинают активно размножаться и туберкулез переходит из латентной формы в активную. Возможно поражение легких, костей, суставов, мочеполовых органов, лимфатической системы, кожи, глаз и нервной системы.
Микроскопическое исследование посева мокроты по-прежнему считается "золотым стандартом" в диагностике туберкулеза. Однако данный метод имеет как свои достоинства (высокая специфичность), так и недостатки (низкая чувствительность, т. к. необходима определенная концентрация бактерий в образце). Эффективность метода ниже в отношении специфических категорий лиц (ВИЧ-инфицированных, людей старше 60 лет и детей, у которых к тому же существуют сложности со сбором мокроты). Кроме того, данное исследование занимает продолжительное время, т. к. для роста бактерий требуется 6-8 недель. Наряду с бактериологическим методом широко распространено рентгенологическое исследование. Оба метода применимы только к легочным формам туберкулеза. С другой стороны, при помощи метода туберкулиновой пробы практически невозможно дифференцировать латентную и активную формы туберкулеза.
Дифференциальная скрининговая диагностика активного туберкулеза возможна при помощи определения специфических антител к М. tuberculosis методом иммуноферментного анализа.
На активной стадии туберкулеза начинается интенсивная выработка IgG и IgM антител к специфическим антигенам, которые могут быть выявлены в сыворотке крови уже через месяц с начала активизации микобактерий. Среди антител при туберкулезе у взрослых обычно преобладают IgG, реже подавляющее количество антител представлено IgA. Антитела IgM у взрослых встречаются достаточно редко и более характерны для начальных стадий заболевания. У детей высокие титры специфических IgA и IgM отмечаются гораздо чаще, причем высокий уровень IgM иногда может сохраняться даже при большом стаже заболевания и относительно низких уровнях IgG и IgA-антител. В целом картина антительного ответа на туберкулез очень индивидуальна, сложна и зависит от большого числа факторов. Данный тест позволяет выявлять суммарный пул специфичных к антигенам микобактерий антител, что дает возможность охватить максимально большой спектр вариантов гуморального ответа на туберкулез. Высокая специфичность теста достигается использованием специфических для M. tuberculosis антигенов, что исключает ложноположительные результаты у вакцинированных и инфицированных другими микобактериями лиц. Чувствительность данной тест-системы составляет от 61 % (туберкулез лимфатических узлов) до 100 % (туберкулезный экссудативный плеврит) в зависимости от локализации инфекции; специфичность – 95 %.
Для чего используется исследование?
- Для выявления активного туберкулеза, в особенности внелегочных форм.
- Для мониторинга эффективности лечения туберкулеза.
- Для выявления инфицированных лиц.
- Для подтверждения диагноза (наряду с использованием дополнительных диагностических исследований).
Когда назначается исследование?
- Когда известно, что пациент имел длительный контакт с больными туберкулезом или что его работа связана с постоянным контактом с людьми из групп риска (бездомными, инъекционными наркопотребителями, лицами, находившимися в местах лишения свободы).
- При соответствующих симптомах: слабости, быстрой утомляемости, субфебрильной температуре тела, ночной потливости, персистирующем кашле в течение 2-3 недель, боли в грудной клетке (легочном туберкулезе), хронических болях в спине, суставах, брюшной области с невыясненной этиологией.
- При длительном безрезультатном лечении хронического простатита, цистита, пиелонефритов и при воспалении эндометрия (туберкулезе мочеполовых органов).
- При анемии, лейкоцитозе.
Что означают результаты?
- Отсутствие активной формы заболевания.
- Активная форма туберкулеза различной локализации.
- Антитела, оставшиеся после перенесенного заболевания.
- Тубинфицированность – присутствие микобактерий в организме (если нет клинических проявлений заболевания).
Что может влиять на результат?
Эффективное лечение туберкулеза сопровождается резким увеличением количества антител, уровень которых приходит в норму по истечении некоторого времени.
- Этот тест особенно важен, когда при отрицательном результате рентгенологического исследования, микроскопии и методе ПЦР есть симптомы неясного происхождения, схожие с проявлениями туберкулеза внелегочных форм.
- Положительный результат – недостаточное основание для постановки диагноза "активный туберкулез", так как данный анализ должен сопровождаться другими диагностическими тестами (микроскопией бактериальных культур, ПЦР) в соответствии с клинической картиной и предполагаемыми очагами локализации инфекции для более углубленного обследования.
- На ранней стадии инфекции тест может дать отрицательный результат из-за того, что еще не выработалось достаточное количество антител. В таких случаях при симптомах инфекции рекомендуется повторить исследование через 2-7 недель или провести другие виды тестирования.
- Тест нечувствителен к БЦЖ-вакцинации, так как в нем задействованы антигены, специфичные для M. Tuberculosis и нехарактерные для M. Bovis.
- Возможность ложноположительных результатов данного анализа исключена в связи с отсутствием взаимовлияния с другими видами микобактерий.
- Тест рассчитан на выявление только активной формы туберкулеза вне зависимости от его локализации.
- Данное исследование подходит для пациентов с иммунодефицитами различного происхождения (ВИЧ, онкологией), так как тест-система позволяет обнаружить иммуноглобулины всех трех классов (G, M, A).
Кто назначает исследование?
Фтизиатр, инфекционист, терапевт, врач общей практики.
Аннотация научной статьи по ветеринарным наукам, автор научной работы — Джакаит Д.А.
Разработана диагностическая тест-система на основе дот-блот иммуноферментного анализа для проведения скринговых исследований на туберкулез крупного рогатого скота на полевых условиях. По результатам исследований, установлено, что диагностика туберкулеза крупного рогатого скота методом иммуноферментного анализа с использованием ДМСО-антигенов является досто-тачно эффективным и дает дополнительную информацию к аллергическим исследованиям. Сравнительный анализ диагностической эффективности иммуноферментного анализа ( ИФА ) в классическом варианте и дот-блот иммуноферментного анализа при туберкулезе крупного рогатого скота, показал возможность использования дот-блот иммуноферментного анализа при выяснении эпизоотической ситуации по туберкулезу крупного рогатого скота в хозяйстве.
Похожие темы научных работ по ветеринарным наукам , автор научной работы — Джакаит Д.А.
DOT-BLOT IMMUNOANALYSIS TEST-SYSTEM FOR THE DETECTION OF ANTIBODIES TO MYCOBACTERIA OF BOVINE TUBERCULOSIS
We developed a diagnostic test-system on the basis of dot-blot enzyme-linked immunosorbent assay for conducting screening analysis for bovine tuberculosis under field conditions. According to the research results, it was established that diagnosing bovine tuberculosis using enzyme-linked immunosorbent assay gives additional information to the tuberculin skin test. Comparative analysis of the diagnostic efficacy of enzyme-linked immunosorbent assay ( ELISA ) in a classic variant and dot-blot enzyme-linked immunosorbent assay during the diagnosis of bovine tuberculosis , showed the possibility of using dot-blot enzyme-linked immunosorbent assay in ascertainment of epizootic situation of bovine tuberculosis in the farms.
5. Костенко, Т.С. Практикум по ветеринарной микробиологии и иммунологии / Т.С. Костенко, Е.И. Скрашевская, С.С. Ги-тельсон. - М.: Агропромиздат, 1989. - 272 с.
6.Gibert RO, Ship ST, Guard CL, Erb HN, Frajblat M: Prevalence of endometritis and
its effects on reproductive performance of dairy cows. Therigenology 2005, № 64: 1879-1888 p.
7. Cunningham, J., 2002. Physiology of reproductive system. In: textbook of veterinary physiology, 3rd ed., Webster B saunder Co., Philadelphia, pp: 402-403.
ВЛИЯНИЕ ВВЕДЕНИЯ ПЛАЦЕНТОЛИЗАТА НА ИММУНОЛОГИЧЕСКИЕ ПОКАЗАТЕЛИ
Дарменова А.Г., Юсупов С.Р., Зухрабов М.Г.
В результате двукратного введения плацентолизата лошадям опытной группы наблюдалось значительное увеличение титра антител в сыворотке крови, количества Т- и В-лимфоцитов, а также повышение бактерицидной, лизоцимной и фагоцитарной активности, что позволяет рекомендовать применение такой антиплацентарной крови (АПК) для ускорения регенерации карункулов и инволюции матки при лечении и профилактике послеродовых акушерско-гинекологических заболеваниях коров.
INFLUENCE OF INTRODUCTION OF PLATSENTOLIZAT ON IMMUNOLOGICAL INDICATORS
Darmenova A. G., Yusupov S. R., Zukhrabov M.G.
As a result of double introduction of the platsentolizat to horses of experienced group significant increase in an antiserum capacity in blood serum, the number of T - and V-lymphocytes and also rising of bactericidal, lizotsimny and fagotsitarny activity was observed that allows to recommend use of such anti-placental blood (agrarian and industrial complex) for acceleration of ontogenesis of caruncles and an involution of a uterus at treatment and prevention puerperal obstetric and gynecologic diseases of cows.
ДОТ-БЛОТ ИФА ТЕСТ-СИСТЕМА ДЛЯ ВЫЯВЛЕНИЯ АНТИТЕЛ К МИКОБАКТЕРИЯМ ТУБЕРКУЛЕЗА КРУПНОГО РОГАТОГО СКОТА
Джакаит Д.А - аспирант Казанская государственная академии ветеринарной медицины имени Н.Э. Баумана
Ключевые слова: Туберкулез крупного рогатого кота, ИФА, дот-блот ИФА, нитроцеллю-лозная мембрана, тест-система.
Key words: Bovine tuberculosis, ELISA, dot-blot ELISA, nitrocellulose membrane, test-system.
Одной из важнейших проблем в животноводстве являются инфекционные болезни, среди которых особое место занимает туберкулез крупного рогатого скота. В условиях современного сельскохозяйственного производства, особенно на крупных животноводческих комплексах, где концентрировано большое количество поголовья животных, проведение профилактических мероприятий по обеспечению надежного эпизоотического благополучия и разработка экспресс методов диагностики инфекционных болезней является практической необходимостью.
Наиболее значимыми в разработке экспресс-тестов для диагностики инфекционных болезней являются методы иммунохимиче-ского анализа [1]. При этом применяются различные технологии, среди которых немаловажную роль играют модифицированнные методы ИФА, среди которых наиболее перспективными являются методы ИФА в дот-блот варианте.
Целью нашей работы было разработать иммуноферментную тест-систему на основе дот- блот ИФА для прижизненной диагностики туберкулеза крупного рогатого скота.
Дот-блот ИФА на нитроцеллюлозных мембранах проводили путем точечного нанесения разведенного антигена на полоски НЦМ и инкубирования их с положительными и отрицательными сыворотками крови .
Для постановки дот-блот иммунофер-ментного анализа полоски нитроцеллюлоз-ной мембраны длиной 6 см и шириной 0,5 см маркировали карандашом на квадратики 5*5 мм для удобства при проведении реакции. Раствор антигена в карбонатном буфере с рН 9,6, наносили на каждый квадратик в объеме 2 мкл.
Для блокировки свободных от антигена мест, НЦМ инкубировали 0,01% раствором альбумина при комнатной температуре в течение 2-х часов. Полоски НЦМ промывали в твинфосфотном буфере, известном, в методике классического ИФА, как промывочный раствор. Рабочий титр и объем исследуемых сывороток крови определяли опытным путем, инкубировали 40 минут при комнатной температуре.
Раствор конъюгата и субстратной смеси наносили в объеме 2 мкл и инкубировали при комнатной температуре 20 и 7 минут соответственно. Реакцию останавливали стоп-реагентом (2Н раствор серной кислоты).
Результаты исследования и обсуждение. Всего исследовано 197 проб сывороток крови из различных по эпизоотической ситуации хозяйств РТ на выявление антител против возбудителей туберкулеза методом ИФА. Микобактериальные антитела выявляли против антигенов M.bovis, М.а^ит и M.nonchromogenes.
37 проб (18,8%) при иммунофермент-ном анализе показали положительнные результаты на M.bovis. Из них 21 - одновременно реагировали и с антигеном M.nonchromogenes.
121 проба из общего количества были исследованы в сравнении с результатами ту-беркулинизации, в т.ч. 46 (38,0%) - от реагирующих, 75 (62,0%) -нереагирующих на туберкулин коров. Результаты представлены в таблице 1.
При иммуноферментном анализе проб сывороток крови реагирующих на туберкулин животных, в 21 пробах обнаружены противотуберкулезные антитела в высоких титрах, а в 25 пробах получены отрицательные результаты, что составляет - 45,7% и 54,3% соответственно.
При анализе методом ИФА проб сывороток крови не реагирующих на туберкулин животных (75 проб) были получены следующие результаты: 2 (2,7%) пробы с положительной, 73 (97,3%) пробы с отрицательной реакцией.
Районы Всего проб ППД ИФА ИФА
Балтанский 23 13 10 2 11 - 10
Мензелинский 7 7 - 4 3 - -
Камскаутинс-кий 85 20 65 14 6 2 63
Петречинский 6 6 - 1 5 - -
ИТОГО: в % 121 46 75 21 25 2 73
38,0 62 17,4 20,7 1,7 60,3
Таблица 1 - ИФА проб сывороток крови в сравнении с результатами аллергической пробы коров
На следующем этапе исследований теста на основе дот-блот ИФА при туберку-
оценивали диагностическую эффективность лезе крупного рогатого скота. Исследовали
46 проб сывороток крови из предыдущего ны
опыта. Результаты исследования представле-
Таблица 2 - Результаты дот-блот ИФА сывороток крови в сравнении с результатами
ИФА в классическим варианте
Районы Всего ИФА Дот-блот ИФА
Балтанский 13 2 11 2 11
Мензелинский 7 4 3 4 3
Камскаутинский 20 14 6 12 8
Петречинский 6 1 5 1 5
ИТОГО 46 21 25 19 27
Результаты исследования проб сывороток крови на туберкулез крупного рогатого скота методом ИФА и дот-блот ИФА в целом совпали, только в 2-х пробах положительных в ИФА не обнаружен противотуберкулезных антител в дот-блот варианте.
Эпизоотическая ситуация по туберкулезу крупного рогатого скота во многих странах остается напряженной. Туберкулез крупного рогатого скота продолжает распространяться во многих странах, а также стал проявляться в тех регионах, которые долгое время считались благополучными по этому заболеванию [5, 6, 7].
Своевременная диагностика и изолирование больных животных являются главными элементами борьбы с этим заболеванием. Внутрикожная туберкулиновая проба играет ключевую роль в диагностике и контроле туберкулеза крупного рогатого скота. Однако на сегодняшний день этот метод малоэффективен, что обусловлено его недостаточной чувствительностью и специфичностью.
Проведенными ранее исследованиями на разных видах животных показана эффективность серологической диагностики туберкулеза. При этом особое внимание уделяют на выбор микобактериальных антигенов, динамика выработки антител к которым в организме инфицированных животных зависит от стадии развития инфекционного процесса при туберкулезе [2,4].
По результатам нашей работы, установлено, что диагностика туберкулеза крупного рогатого скота методом иммунофер-ментного анализа с использованием ДМСО-антигенов является достаточно эффективным и дает дополнительную информацию к аллергическим исследованиям. Повышается эффективность диагностических мероприятий, что выражается в увеличении достовер-
ности выявления больных туберкулезом животных, а также животных инфицированных другими видами микобактерий.
Технологии ИФА в дот-блот варианте, эффективность которой, при диагностике инфекционных болезней, доказана многими исследователями [1], вполне можем использоваться и при диагностике туберкулеза крупного рогатого скота.
Заключение. Полученные экспериментальные данные свидетельствуют о равноценной диагностической эффективности дот-блот ИФА и классической иммунофермент-ной реакции. Предложенный вариант ИФА может быть использован для экспресс анализа эпизоотической ситуации по туберкулезу в хозяйствах. Несмотря на то, что чувствительность дот-блот ИФА несколько ниже, он обладает рядом преимуществ в сравнении с классическим ИФА к которым относятся простота в постановке, доступность и возможность проведения в полевых условиях.
1. Бреус, Ю.В. Разработка и конструирование экпресс-теста для диагностики лейкоза крупного рогатого скота / Ю.В. Бреус, О.Д. Небещук, Я.В. Хоменко и др. // Вестник науки Казахского агротехнического университета им. С.Сейуфуллина. - 2013. - №4 (79). - С.15-21.
2. Шуралев, Э.А. Мультиплексный ИФА с хемилюминесцентной меткой для диагностики туберкулеза у кабанов / Э.А. Шу-ралев, М.Н. Мукминов, А.Р. Валеева и др. // Ветеринария. - 2013. - №2. - С. 25-28.
3. Якупов, Т.Р. Способ получения антигена для диагностики туберкулеза крупного рогатого скота / Т.Р. Якупов, К.С. Хаер-тдинов, Р.А. Хамзин, И.К. Фахртдинов // Патент №2416428 от 20.04.2011.
4. Якупов, Т.Р. Эффективность ИФА
сывороток крови в системе диагностических мероприятий при туберкулезе крупного рогатого скота / Т.Р. Якупов, К.В. Усольцев // Материалы международной научной конференции, посвященной 70-летию зооинженер-ного факультета Казанской государственной академии ветеринарной медицины имени Н.Э.Баумана. Казань. - 2000, С.140-144.
5. Delaune, D. Update on Mycobacterium bovis infections in France: 4 cases reports / D.Delaune, F.Janvier, C.Rapp, P.Gerome, F.Mechai, M.Fabre, C.Soler, A.Merens // Ann. Biol. Clin. (Paris). - 2012. - Vol. 70(2). - P.231-
6. Di Marco V. Epidemiological Significance of the Domestic Black Pig (Sus scrofa) in Maintenance of Bovine Tuberculosis in Sicily. / V.Di Marco, P.Mazzone, M.T.Capucchio, M.B.Boniotti et al // J. Clin. Microbiol. - 2012. -Vol. 50(4). - P.1209-1218.
7. Goodchild, A.V. Geographical association between the genotype of bovine tuberculosis in found dead badgers and in cattle herds. / A.V.Goodchild, G.H.Watkins, A.R.Sayers, J.RJones, R.S.Clifton-Hadley // Vet. Rec. -2012. - Vol. 170(10). - P.259.
ДОТ-БЛОТ ИФА ТЕСТ-СИСТЕМА ДЛЯ ВЫЯВЛЕНИЯ АНТИТЕЛ К МИКОБАКТЕРИЯМ ТУБЕРКУЛЕЗА КРУПНОГО РОГАТОГО СКОТА
Разработана диагностическая тест-система на основе дот-блот иммуноферментного анализа для проведения скринговых исследований на туберкулез крупного рогатого скота на полевых условиях.
По результатам исследований, установлено, что диагностика туберкулеза крупного рогатого скота методом иммуноферментного анализа с использованием ДМСО-антигенов является досто-тачно эффективным и дает дополнительную информацию к аллергическим исследованиям.
Сравнительный анализ диагностической эффективности иммуноферментного анализа (ИФА) в классическом варианте и дот-блот иммуноферментного анализа при туберкулезе крупного рогатого скота, показал возможность использования дот-блот иммуноферментного анализа при выяснении эпизоотической ситуации по туберкулезу крупного рогатого скота в хозяйстве.
DOT-BLOT IMMUNOANALYSIS TEST-SYSTEM FOR THE DETECTION OF ANTIBODIES TO
MYCOBACTERIA OF BOVINE TUBERCULOSIS
We developed a diagnostic test-system on the basis of dot-blot enzyme-linked immunosorbent assay for conducting screening analysis for bovine tuberculosis under field conditions.
According to the research results, it was established that diagnosing bovine tuberculosis using enzyme-linked immunosorbent assay gives additional information to the tuberculin skin test.
Comparative analysis of the diagnostic efficacy of enzyme-linked immunosorbent assay (ELISA) in a classic variant and dot-blot enzyme-linked immunosorbent assay during the diagnosis of bovine tuberculosis, showed the possibility of using dot-blot enzyme-linked immunosorbent assay in ascertainment of epizootic situation of bovine tuberculosis in the farms.
Читайте также:


