Что обуславливает устойчивость микобактерий туберкулеза

Микобактериями туберкулеза в ходе эволюционного развития были выработаны механизмы защиты от факторов внешней среды, такие как толстая клеточная стенка, богатые метаболические возможности, которые способны обезвреживать многие клеточные токсины и вещества (альдегиды, перекиси), повреждающие клеточную стенку, также можно упомянуть способность к трансформации(переход в L-форму, образование доминантных клеток) [8].
Выделяют несколько классификаций лекарственной устойчивости микобактерии туберкулеза:
I. По чувствительности к противотуберкулезным препаратам [6, 8]
Истинная генетическая устойчивость – это видовой признак микроорганизмов, который связан с отсутствием точки приложения антибиотика с МБТ, ее недоступностью из-за плохой проницаемости клеточной стенки или разрушения ферментами.
МБТ обладают истинной генетической устойчивостью ко многим неспецифическим антимикробным препаратам, относящимся к семействам пенициллинов, β-лактамов, макролидов, карбапенемов, цефалоспоринов, тетрациклинов. Однако чувствительны к аминогликозидам (стрептомицин, канамицин, амикацин), полипептидам (капреомицин), рифампицинам (рифампицин, рифабутин) и фторхинолонам (ципрофлоксацин, ломефлоксацин, офлоксацин, левофлоксацин, моксифлоксацин, спарфлоксацин) [5].
Приобретенная лекарственная устойчивость МБТ проявляется в возможности размножаться при воздействии на них противотуберкулезных препаратов по средствам развития точечных мутаций [7] в хромосомах и формировании новых генов, контролирующих синтез новых белков-ферментов, разрушающих или инактивирующие конкретные противотуберкулезные препараты. Приобретенную лекарственную устойчивость подразделяют на первичную и вторичную. Первичная ЛУ определяется у больных, заразившихся лекарственно-устойчивыми МБТ. Эти пациенты ранее не принимали противотуберкулезные препараты [6]. Вторичная ЛУ развивается в процессе самого лечения больного туберкулезом. Устойчивость МБТ развивается через 3-6 месяцев с начала лечения [6].
II. По спонтанности возникновения мутаций (спонтанные и индуцированные)
В большой и активно размножающейся микобактериальной популяции всегда имеется небольшое количество лекарственно-устойчивых спонтанных мутантов в соотношениях:
1 клетка-мутант на 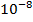
устойчивых к рифампицину;
1 клетка-мутант на 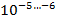
устойчивых к изониазиду, этамбутолу, стрептомицину, канамицину, фторхинолонам;
1 клетка-мутант на 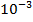
устойчивых к пиразинамиду, этионамиду, капреомицину и циклосерину.
С учётом того что в каверне величина микобактериальной популяции составляет 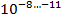
, там имеются мутанты ко всем противотуберкулезным препаратам; в очагах и осумкованных казеозных фокусах эта величина составляет 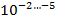
. Спонтанные мутации устойчивы только к одному препарату (спонтанная или эндогенная ЛУ) [6].
При экзогенной (индуцированной) ЛУ происходит естественный отбор в пользу мутантов с естественной ЛУ к противотуберкулезным препаратам. В дальнейшем это приводит к изменению в геноме, что приводит к увеличению бактериальной популяции с лекарственно-устойчивыми микобактериями. Этому способствует проведение неадекватной химиотерапии, при этом пациенту назначается неправильный режим, несбалансированное сочетание и дозы противотуберкулезных лекарственных средств [6].
По эпидемиологической классификации ВОЗ (2008) МБТ могут быть:
- монорезистентными (МР) – к одному противотуберкулезному препарату;
- полирезистентными (ПР) – к двум и более противотуберкулезным препаратам, но не к сочетанию изониазида и рифампицина;
- множественно лекарственно-устойчивыми (МЛУ) – как минимум к сочетанию изониазида и рифампицина. Такие больные обладают высокой эпидемиологической опасностью вследствие высокой вирулентности и контагиозности, длительного периода бактериовыделения. К группам повышенного риска относятся ВИЧ-инфицированные больные и ранее неправильно лечившиеся пациенты с туберкулезом [4]. При анализе заболеваемости туберкулёзом среди ВИЧ-инфицированных г. Краснокамска была выявлена МЛУ у 60% больных с впервые выявленным туберкулезом [1].
- широко лекарственно-устойчивыми (ШЛУ) – как минимум к сочетанию изониазида, рифампицина, фторхинолонов и инъекционных препаратов (канамицина, амикацина, капреомицина). Так как ШЛУ проявляет ЛУ к препаратам I ряда, а противотуберкулезные препараты II ряда не обладают выраженным антибактериальным действием, то можно утверждать, что такие штаммы опасны для жизни пациентов [4].
Генетические основы резистентности ко многим антибиотикам изучены недостаточно хорошо. По имеющимся данным в приобретении лекарственно-устойчивого фенотипа МБТ плазмиды и траспозоны особой роли не играют. Причиной возникновения лекарственно-устойчивых штаммов являются точечные мутации [7] и небольшие инсерции/делеции в геноме микроорганизма [2, 3].
Выделяют следующие механизмы лекарственной устойчивости микобактерий туберкулёза [8]: инактивация антибиотика ферментами, (например, β-лактамазами); изменение мишени (в результате мутации соответствующего участка генома происходит модификация белковой структуры); избыточное образование мишени, которое приводит к нарушению соотношения агент-мишень, в результате чего высвобождаются белки, необходимые для жизнедеятельности бактерии; выведение лекарственного вещества из бактериальной клетки (эффлюкс) по средствам включения стрессорных механизмов защиты; уменьшение проницаемости клеточной стенки, вследствие чего антибиотик не может проникнуть внутрь бактерии; появление дополнительного (обходного) пути обмена веществ.
Помимо прямого воздействия на метаболизм микробных клеток многие антибактериальные препараты (бензилпенициллин. стрептомицин, рифампицин) и другие неблагоприятные факторы (биоциды иммунной системы) приводят к появлению изменённых форм микобактерий (протопласты, L-формы), а также переводят клетки в дормантное состояние: интенсивность обмена клетки снижается и бактерия становится невосприимчивой к действию антибиотика [8].
Выделяют основные противотуберкулезные препараты I ряда: рифампицин, изониазид, этамбутол, стрептомицин, пиразинамид. Препараты II ряда являются резервными и используются для лечения полирезистентного туберкулеза, к ним относятся: этионамид, циклосерин, канамицин, виомицин, амикацин и др. [3, 5]
Механизм рифампицина основан на взаимодействии с β-субъединицей РНК-полимеразы (ген rpoB), в результате чего происходит ингибирование инициации транскрипции. МБТ устойчивы к рифампицину благодаря мутации в фрагменте β-субъединицы (27 кодонов – 507-533) этого фермента (более 95%штаммов). При мутации в кодонах 526 (36%) и 531 (43%) [3, 10] обнаруживают высокий уровень резистентности к антибиотику, в то время как, в кодонах 511, 516, 518 и 522 – низкий. У 4%штаммов механизм резистентности неизвестен, так как они не несут мутаций в данном гене [3, 6].
Изониазид является пролекарством. Молекула препарата активируется внутри микробной клетки под действием фермента каталазы-пероксидазы (ген katG). Мутации в гене katG (в положении 315) приводят к снижению активности фермента примерно на 50%. Также ферменты, участвующие в метаболизме миколевой кислоты (основной компонент клеточной стенки МБТ), являются мишенями для активированного изониазида: ацетилированный белок-носитель (ген acpM), синтетаза (ген kasA) и редуктаза (ген inhA) белка-носителя. Мутации, возникшие в этих генах, вызывают устойчивость, связанную с гиперпродукцией мишеней. Уровень устойчивости при этом ниже, чем при мутации в гене katG [3, 10].
О механизмах действия пиразинамида известно мало. Он также является пролекарством. Пиразинамид по средствам пассивной диффузии проникает в бактериальную клетку, где под действием фермента пиразинамидазы переходит в активную форму – пиразиноевую кислоту (ген pncA), которая блокирует ферменты биосинтеза жирных кислот. 72% изолятов, устойчивых к пиразинамиду, имеют мутации в гене pncA. У пиразинамидустойчивых МБТ выявляют также отсутствие АТФ-зависимого транспорта этого препарата в клетку [3, 6].
Стрептомицин приводит к ингибированию синтеза белка, связываясь с 16S рРНК (rrs). Мутации, ассоциированные с устойчивостью к стрептомицину, идентифицированы в генах, кодирующих 16S РНК (rrs) и белок малой рибосомной субъединицы 12S (rpsL). Есть данные о мутации, которая ведет к повышению устойчивости МБТ к стрептомицину – эти штаммы плохо растут, пока в их питательную среду не добавить данный антибиотик (стрептомицинзависимые штаммы) [6].
Этамбутол осуществляет свое влияние через белок embB (арабинозилотрансфераза), принимающий участие в синтезе структурных элементов клеточной стенки МБТ. Устойчивость к этому препарату появляется вследствие точечной мутации в 306-м кодоне [10].
Этионамид (протионамид) также способствует появлению мутаций в гене inhA, поэтому резистентность к этионамиду иногда возникает вместе с резистентностью к изониазиду, так как эти препараты имеют общего предшественника – никотинамид. Этионамид является пролекарством и для его активирования необходим фермент, который в настоящее время еще не установлен [3, 6].
Канамицин (амикацин) вызывает мутации в 16S рРНК (1400 позиция) – замена аденина на гуанин [6].
Фторхинолоны вызывают мутации в генах gyrA и gyrB ДНК-гиразы. Вследствие этого нарушается процесс репликации ДНК [9].
Представленная информация призвана способствовать формированию целенаправленной деятельности для контроля лекарственной устойчивости в интересах совершенствования лечебно-профилактических мероприятий у больных туберкулезом.

Микобактерии туберкулеза (mycobacterium tuberculosis) – это крайне опасные микроорганизмы, которые могут провоцировать заболеваемость как у человека, так и у животных. Данные патогенные микроорганизмы отличаются высокой степенью вирулентности, т.е. способны быстро адаптироваться к неблагоприятным внешним факторам.
Они способны за короткий период приобрести резистентность к использующимся для их подавления антибиотикам. Данный эффект сильно усложняет лечение этой бактериальной инфекции.
Какие бактерии вызывают туберкулез
Классификация группы Mycobacterium включает 74 разновидности микробов. Все они являются одноклеточными микроорганизмами. Многие виды микобактерий являются безопасными для человека. Данные типы обитают в почве и водной среде, но не вызывают заболеваемость людей и домашних животных.
Однако есть и опасные формы микобактерий туберкулеза. Наиболее патогенной считается вид mycobacterium tuberculosis. Другое название этого микроорганизма – палочка Коха. Это бактерии, вызывающие туберкулез у людей и животных.
Примерно 95% случаев заражения микобактериозом вызваны этим микробом.
Еще одной часто встречающейся разновидностью микобактерий выступает mycobacterium bovis. Этот микроорганизм чаще поражает крупный рогатый скот. Данная бактерия туберкулеза называется бычьей. У людей, страдающих туберкулезом, болезнь выявляется в 3-6% случаев. Данные бактерии провоцируют кишечную форму заболевания.
К распространенным разновидностям микобактерии относятся птичий и африканский типы. Они не вызывают заболеваемости у людей, но могут под действием различных неблагоприятных факторов контактировать с человеческим штаммом. Это повышает риск появления высоко патогенных атипичных микобактерий, имеющих устойчивость к препаратам.
Строение
Физиология микобактерий туберкулеза обусловлена крайне простым строением. Эти организмы представляют собой прямые или изогнутые палочки. Их длина достигает примерно 1-10 мкм. Их ширина не превышает 0,2-0,6 мкм. Оболочка микроорганизма представлена микрокапсулой. Она состоит из фибриллярных структур и мукополисахаридов. В ней также содержатся факторы вирулентности, отвечающие за изменчивость микобактерий туберкулеза.
Внутри оболочки располагается клеточная стенка. Данный элемент обеспечивает стабильность размера и формы клетки. Кроме того, от данного элемента зависят факторы патогенности и токсичность. Внутри оболочки присутствует цитоплазма. Она отвечает за процесс размножения микобактерий, который протекает путем деления. Внутри микроорганизма присутствует ядерная субстанция. ДНК микобактерии, представленная набором плазмидов и хромосом, содержится ядре.
Свойства
Бактерии возбудители туберкулеза относятся к грамположительным микроорганизмам. Они являются устойчивыми к кислотной среде. Это свойство микобактерии туберкулеза обусловлено присутствием в клеточной стенке воска. Они могут быть как свободноживущими в окружающей среде, так и вести паразитический образ жизни.
Эти организмы отличаются полиморфизмом. Если бактерия попадает в неблагоприятную среду, она переходит в L-форму. В этом виде организм неактивен, но может пережить влияние различных факторов. При изменении характеристик среды на более благоприятные патогенная микрофлора активизируется. Эти микробы не способны продуцировать споры.
Возбудитель туберкулеза является облигатным аэробом. Активизации деления способствуют следующие условия:
- температура 37-38°C;
- повышенное содержание кислорода:
- уровень рН -7,0-7,2.
- наличие белков и глицерина;
- присутствие железа, магния и других минеральных веществ.
Стимулятором их роста является лецитин. Размножение микроорганизмов происходит путем деления. Культивирование микобактерий туберкулеза проводится на яичных, картофельно-желчных и синтетических средах. Палочка при выращивании в искусственных условиях может образовывать R- и S-колонии.
В каком виде будет формироваться колония, зависит от корд-фактора микроорганизма.
Он обуславливает степень вирулентности. R-колонии отличаются шероховатостью и повышенной изменчивостью. S-колонии гладкие и обладают низкой изменчивостью. На жидкой питательной среде всего за 5-7 недель микроорганизмы формируют толстую морщинистую пленку. При проведении экспресс-диагностики применяют метод культивирования на стеклах с использованием жидкой питательной среды. Он позволяет получить результат всего за 2-3 суток.
Туберкулезная бактерия вырабатывает ряд ферментов, в т.ч. эстеразу, аминотрансферазу, трегалозу. Дыхание микроорганизма происходит за счет оксидоредуктазы. Вирулентность микроорганизма связана со способностью выработки пероксидазы и каталазы.
Жизненный цикл микобактерий протекает с продукцией большого количества никотиновой кислоты. Это вещество накапливается в жидкой питательной среде. Из-за этого при добавлении к ней раствора хлорамина Б и цианида калия происходит изменение цвета среды на ярко-желтый.
Для окраски препаратов с возбудителем туберкулеза не применяют анилиновые красители. В данном случае используется метод Циля-Нильсена, предполагающий сернокислое протравливание. При таком подходе в препаратах выявляются ярко-красные палочки, устойчивые к кислотной среде. Они могут располагаться одиночно или скоплениями по 2-3 клеток.
В какой среде выживает
Наличие в микроорганизме липидов обеспечивает ему высокую устойчивость к влиянию различных неблагоприятных факторов. Во внешней среде микобактерии выживают в почве, речной воде, канализационных стоках и других средах. В условиях падения температуры и влияния других неблагоприятных факторов происходит замедление воспроизведения микобактерий и их переход в L-форму. В мокроте и биологических жидкостях микроорганизм может сохраняться на протяжении длительного времени. МБТ устойчивы к дезинфицирующим средствам в стандартных концентрациях.
Сколько живет
Продолжительность жизни микобактерий зависит от характеристики питательной среды и внешних факторов. Жизненный цикл этих бактерий может протекать как внутри организма хозяина, так и в окружающей среде. При отсутствии доступа прямых солнечных лучей, высокой влажности и комнатной температуре в квартире этот микроорганизм проживет на поверхности предметов на протяжении нескольких месяцев.
При рассеянном свете они сохраняются около 1,5 месяцев.
В уличной грязи микобактерии нередко живут до 4 месяцев. В условиях речной воды микобактерии сохраняют жизнедеятельность до 7 месяцев. В сточной воде возбудители заболевания туберкулез могут жить около 1,5 лет. В почве они сохраняются до 2 лет. Под прямыми солнечными лучами бактерии сохраняются около 90 минут.
Как передается у людей
Наиболее часто источником распространения микобактерий являются инфицированные люди. В организме больного патогенная микрофлора стремительно размножается. Выделяются контактный и воздушно-капельный пути распространения микобактерий. Наиболее часто от больного человека инфекция распространяется воздушно-капельным путем. Патогенная микрофлора выделяется при чихании, кашле и при разговоре. В этом случае в воздух попадает большое количество капелек, в которых присутствуют активные микобактерии.
Инфицирование контактным путем часто происходит при совместном использовании средств личной гигиены, а также зараженных предметов интерьера, одежды, продуктов, воды и т.д. Вдыхание капелек, содержащих бактерии, и контакт с зараженными предметами не всегда приводит к инфицированию. В большинстве случаев заражение происходит на фоне длительного контакта с источником инфекции или при наличии сниженного иммунитета.
Исследование на наличие
Использующиеся методы диагностики позволяют выявить наличие туберкулеза до появления выраженных признаков заболевания. Для определения наличия заболевания назначаются:
- общий и биохимический анализы крови;
- исследование микробиологии мокроты;
- проба Манту;
- проба Пирке;
- бронхоскопия;
- бактериологический посев;
- биопсия;
- КТ;
- МРТ.
В процессе диагностики нередко используются новые методы выявления микобактерий туберкулеза. Точные данные позволяют иммунологические и серологические исследования крови и мокроты. Часто применяется при диагностике ПЦР, квантифероновый тест и ИФА. Для выявления внелегочной формы патологии часто назначается РПГА. Нередко оцениваются суммарные показатели, полученные при проведении исследований.
Данный метод обнаружения микроорганизмов, вызывающих туберкулез, предполагает исследование под микроскопом мазков мокроты, ликвора и других жидкостей. Материал окрашивается по методу Циля-Нильсена и дальнейшее обрабатывается спиртом и промывается водой.
В обработанном таким способом препарате микобактерии светятся красным цветом.
Данный эффект хорошо виден при рассмотрении препарата люминесцентным микроскопом. Недостатком этого метода диагностики является то, что действует он только при высокой концентрации бактерий в препарате. Если активность микобактерий невелика, положительная реакция не проявляется при проведении окрашивания.
Для выявления микобактерий и их штаммов диагностика дополняется путем проведения бактериологического посева. Данный метод предполагает занесение бактерий в питательную среду. В дальнейшем емкость перемещается в термостат, где выдерживается при температуре 37°C на протяжении 3-12 недель. Каждый день оценивается активность патогенной микрофлоры. При посеве на кровяной среде удается вырастить культуру быстрее. Это исследование позволяет выявить чувствительность микроорганизмов к антибиотикам и степень вирулентности.
Определение микобактерий биологическим методом позволяет быстро получить результат, даже если содержание в материале патогенных микроорганизмов невелико. Этот способ предполагает введение зараженного материала, полученного от человека, в брюшную полость морской свинки. Всего за 10-12 дней в месте укола формируется уплотнение. В дальнейшем развивается генерализованная форма туберкулеза. Вызываемая введением зараженного препарата реакция губительна для животного.
Примером этого метода выявления туберкулеза является проба Манту. Это исследование предполагает введение туберкулина в кожу предплечья. При отрицательной реакции след от укола исчезает за 72 часа. При положительной пробе появляется пятно, достигающее 1,5-2 см в диаметре. Данное исследование не всегда показательно. Если у человека сильно ослаблен иммунитет, при туберкулезе проба может давать отрицательный результат.
Что убивает
Если иммунная система у человека сильна, она вырабатывает специфические антитела к микобактериям. Они способны уничтожать патогенную микрофлору. Для формирования иммунитета детям делается прививка БЦЖ. Некоторые родители, не имея понятия о важности вакцинации от туберкулеза, отказываются от нее. Палочка Коха быстро погибает под действием:
- ультрафиолета;
- прямых солнечных лучей;
- длительного кипячения.
Поспособствовать гибели бактерий может длительный контакт с хлорсодержащими дезинфицирующими препаратами.
Причины лекарственной устойчивости микобактерий
У патогенной микрофлоры, вызывающей развитие туберкулеза, устойчивость во многом обусловлена генетически заложенной изменчивостью. Высокая вирулентность данного микроорганизма способствует его быстрой адаптации к влиянию возникших неблагоприятных факторов. Это приводит к тому, что каждое последующее поколение бактерий имеет заложенные механизмы нейтрализации влияния внешних неблагоприятных факторов. Кроме того, причины множественной лекарственной устойчивости (МЛУ) микобактерий кроются в нерациональном использовании антибиотиков.
Лекарственная устойчивость микобактерий туберкулёза (МБТ)
Лекарственная устойчивость микобактерий туберкулёза (МБТ) – одна из самых главных причин неэффективности химиотерапии.
Основным фактором риска развития лекарственной устойчивости микобактерий туберкулёза - является неэффективное лечение, особенно прерванное или незаконченное.
Лекарственную устойчивость подразделяют на:
— первичную устойчивость, отмечающуюся у больных, ранее не принимавших химиопрепараты или принимавших в течение месяца или менее;
— приобретенную устойчивость, развившуюся во время лечения, наблюдается у больных, имевших в начале лечения чувствительные МБТ и ставшие устойчивыми через 6 месяцев.
Лекарственная устойчивость микобактерий туберкулёза может быть:
монорезистентной – устойчивость к одному из противотуберкулёзных препаратов (при комплексной терапии встречается редко);
полирезистентной – устойчивость к двум и более препаратам, например: одновременную устойчивость к изониазиду и рифампицину следует трактовать как полирезистентность (или множественную лекарственную устойчивость).
В последние годы в связи с ухудшением эпидемической ситуации существенно увеличилось число больных, выделяющих штаммы МБТ, устойчивые к основным противотуберкулёзным препаратам.
Прием экстракта личинок восковой моли помогает подавить лекарственную устойчивость микобактерий туберкулёза к различным противотуберкулёзным препаратам ( в том числе и полирезистентную/множественную ).
Экстракт личинок восковой моли повышает эффективность химиотерапии и тем самым позволяет уменьшить лекарственную нагрузку на больного.
Режимы химиотерапии туберкулёза
В связи с разным состоянием бактериальной популяции на разных этапах течения болезни в процессе химиотерапии весь период лечения химиопрепаратами делят на два этапа (или фазы).
Первый этап характеризуется проведением интенсивной насыщенной химиотерапии четырьмя-пятью противотуберкулёзными препаратами. Его назначение заключается в подавлении размножающейся бактериальной популяции и уменьшении ее количества.
Второй этап — менее интенсивная химиотерапия. Ее назначение состоит в воздействии на оставшуюся бактериальную популяцию, в большинстве своем находящуюся внутриклеточно в виде персистирующих форм микобактерий. На этом этапе главными задачами являются предупреждение размножения оставшихся микобактерий, в том числе резистентных штаммов микобактерий.
Приказ Минздрава РФ № 109 от 21 марта 2003 года, утверждает несколько стандартных схем лечения туберкулёза: I, IIа, IIб, III и IV. Согласно этому приказу лечение подразделяется на две фазы: интенсивную и пролонгированную фазу лечения.
- больные с впервые выявленным бациллярным туберкулёзом легких разной протяженности;
- больные распространенными формами впервые выявленного туберкулёза легких, но без деструкции и бактериовыделения (милиарным туберкулёзом, диссеминированным туберкулёзом легких, полисерозитом, экссудативным плевритом) ;
- больные тяжелыми формами внелегочного туберкулёза (менингитом, осложненным туберкулёзом позвоночника, осложненным туберкулёзом костей и суставов, распространенным и/или осложненным туберкулёзом мочеполовой системы, распространенным и/или осложненным туберкулёзом женских гениталий, распространенным и/или осложненным абдоминальным туберкулёзом, осложненным туберкулёзным перикардитом, туберкулёзом надпочечников с гормональной недостаточностью) ;
- больные с сочетанием активного внелегочного туберкулёза любой локализации и туберкулёза органов дыхания любой активности.
В фазе интенсивной терапии назначают четыре основных препарата: изониазид, рифампицин, пиразинамид и стрептомицин или этамбутол. Интенсивную фазу химиотерапии продолжают не менее двух месяцев. За этот срок больной должен принять 60 доз комбинации из четырех основных препаратов. В случае пропуска приема полных доз длительность фазы интенсивной терапии увеличивают до 60 доз.
Через 2 месяца от начала лечения вопрос о переходе ко второму этапу решает экспертная комиссия на основании данных рентгенологического и микробиологического исследований.
При сохраняющемся после двух месяцев химиотерапии бактериовыделении фазу интенсивной терапии можно продолжить еще на месяц (30 доз) до получения данных о лекарственной чувствительности возбудителя. В зависимости от результата проводят коррекцию химиотерапии и продолжают фазу интенсивной терапии. При невозможности исследования лекарственной чувствительности и/или при отрицательной клинико-рентгенологической динамике процесса после трех месяцев химиотерапии больного направляют в вышестоящее учреждение для исследования лекарственной чувствительности и определения дальнейшей тактики лечения. В ожидании результатов лечение проводят в соответствии с интенсивной фазой терапии.
При тяжелом и осложненном течении туберкулёза любой локализации продолжительность фазы интенсивной терапии может быть увеличена.
При отрицательных результатах микроскопии мокроты после двух месяцев химиотерапии и положительной клинико-рентгенологической динамике переходят к фазе продолжения химиотерапии.
В фазе продолжения терапии назначают два основных препарата изониазид и рифампицин — в течение 4 месяцев (при туберкулёзе органов дыхании) или в течение 6 месяцев (при внелегочном туберкулёзе) ежедневно или в интермиттируюшем режиме (3 раза в неделю).
Во второй фазе лечения применяют изониазид и рифампицин в течение 4 месяцев ежедневно или интермиттирующим методом 3 раза в неделю. Как альтернативная комбинация в фазе долечивания может использоваться сочетание изониазида и этамбутола при их ежедневном приеме в течение 6 мес.
Интерминирующий режим назначают больным при амбулаторном проведении фазы продолжения терапии, при хронической почечной и печеночной недостаточности, больным с токсическими реакциями и неудовлетворительной переносимостью лечения, преклонного возраста.
IIa режим химиотерапии назначают при повторном курсе химиотерапии после перерыва в лечении или по поводу рецидива при невысоком риске лекарственной устойчивости микобактерий туберкулёза.
В фазе интенсивной терапии назначают 5 основных препаратов: изониазид, рифампицин, пиразинамид, этамбутол и стрептомицин. Через 2 месяца (60 принятых суточных доз) терапию продолжают четырьмя препаратами (изониазидом, рифампицином, пиразинамидом, этамбутолом) в течение еще одного месяца (30 доз). Общая длительность интенсивной фазы — не менее трех месяцев (90 суточных доз комбинации лекарств). В случае пропуска приема полных доз длительность интенсивной фазы увеличивают до приема 90 доз.
Через 3 месяца от начала фазы интенсивной терапии, вопрос о переходе ко второму этапу лечения решает комиссия на основании данных клинико-рентгенологического и микробиологического исследований.
При отрицательных результатах микроскопии мокроты через 3 месяца химиотерапии и положительной клинико-рентгенологической динамике приступают к фазе продолжения химиотерапии. К этому сроку, как правило, получают данные о лекарственной чувствительности микобактерий туберкулёза, которые могут потребовать коррекции химиотерапии.
При сохранении бактериовыделения и невозможности исследования лекарственной чувствительности микобактерий туберкулёза и/или при отрицательной клинико-рентгенологической динамике процесса через 3 месяца больного направляют в вышестоящее учреждение для исследования лекарственной чувствительности и определения дальнейшей тактики ведения. До получения результатов лечение проводят как в интенсивной фазе терапии.
При чувствительности микобактерий туберкулёза к основным химиопрепаратам в фазу продолжения терапии еще в течение 5 месяцев назначают изониазид, рифампицин и этамбутол ежедневно в интермиттирующем режиме (3 раза в неделю). Общая продолжительность терапии 8 месяцев.
IIб режим химиотерапии назначают больным с высоким риском лекарственной устойчивости микобактерий до получения результатов микробиологического исследования.
К 2б категории относятся:
- больные, у которых отсутствует эффект от химиотерапии либо обострен или прогрессирует процесс на фоне лечения;
- больные, не получавшие ранее противотуберкулёзные препараты, но у которых имеются веские основания для предположений о лекарственной устойчивости по анамнестическим и/или клиническим данным (контакт с больными, выделяющими микобактерий туберкулёза с множественной лекарственной устойчивостью, остропрогрессирующее течение) .
В фазе интенсивной терапии в течение 3 месяца назначают комбинацию из четырех основных препаратов (изониазида, рифампицина/рифабутина, пиразинамида, этамбутола) и двух-трех резервных (в зависимости от данных о лекарственной устойчивости по региону).
Дальнейшее лечение корректируют на основании данных о лекарственной чувствительности микобактерий туберкулёза и проводят в соответствии с режимами I, IIа или IV.
III режим химиотерапии назначают:
- впервые выявленным больным без бактериовыделения;
- больным с малыми (ограниченными) и неосложненными формами туберкулёза;
- больным с туберкулёзом внутригрудных лимфатических узлов (поражение одной-двух групп лимфатических узлов) , ограниченным плевритом при отсутствии кислотоустойчивых бактерий при микроскопии мазка мокроты или иного диагностического материала;
- больным менее тяжелыми формами внелегочного туберкулёза (неосложненным туберкулёзом позвоночника, костей и суставов, мочеполовой системы, ограниченным и неосложненным туберкулёзом женских гениталий, туберкулёзом периферических лимфатических узлов, ограниченным и неосложненным абдоминальным туберкулёзом, туберкулёзом кожи, глаз, ограниченным и неосложненным туберкулёзным перикардитом, туберкулёзом надпочечников без явлений гормональной недостаточности) .
В фазе интенсивной терапии назначают четыре основных препарата: изониазид, рифампицин, пиразинамид, этамбутол. Интенсивную фазу продолжают 2 месяца. За этот срок больной должен принять 60 доз комбинации из четырех (у детей из трех) основных препаратов. В случае пропуска приема полных доз длительность фазы интенсивной терапии увеличивают до приема 60 доз.
Через 2 месяца от начала интенсивной фазы терапии вопрос о переходе ко второму этапу лечения решает комиссия на основании данных исследований.
При появлении бактериовыделения и в случае отрицательной клинико-ренттенологической динамики процесса после двух месяцев лечения необходимы определение лекарственной чувствительности микобактерий туберкулёза и соответствующая коррекция химиотерапии. В ожидании результатов лечение не меняют в течение месяца. При невозможности исследования лекарственной чувствительности больного направляют в вышестоящее учреждение. Режим дальнейшего лечения определяют с учетом лекарственной чувствительности возбудителя.
В фазе продолжения терапии назначают два основных препарата - изониазид и рифампицин - 4 месяца ежедневно или в интермиттирующем режиме (3 раза в неделю). Другим режимом в фазе продолжения может быть прием изониазида и этамбутола в течение 6 месяцев.
IV режим химиотерапии назначают больным с выделением микобактерий, устойчивых к изониазиду и рифампицину одновременно.
В фазе интенсивной терапии назначают комбинацию как минимум из пяти противотуберкулёзных препаратов, чувствительность к которым сохранена, например: пиразинамид, препарат из группы фторхинолонов, канамицин/амикацин или капреомицин, протионамид/этионамид и этамбутол. Назначение препаратов резервного ряда зависит отданных исследования лекарственной чувствительности выделяемых больным микобактерий туберкулёза, причем необходимо также учитывать данные о лекарственной устойчивости микобактерий по региону.
При положительной клинико-ренттенологической динамике и отрицательных результатах культурального исследования мокроты после 6 месяцев химиотерапии переходят к фазе продолжения.
В фазе продолжения назначают не менее трех препаратов из числа тех, чувствительность к которым сохранена. Длительность фазы продолжения - не менее 12 мес.
Применение продуктов на основе личинок восковой моли для лечения туберкулёза
Экстракт, гомогенат и настойка личинок восковой моли, а также настойка ПЖВМ и мёд с гомогенатом личинок восковой моли оказывают губительное влияние на микобактерии туберкулёза, разрушая их восковые оболочки.
В экстракте, настойке и гомогенате ЛВМ, а также в настойке ПЖВМ и мёде с гомогенатом личинок восковой содержится специфический пищеварительный фермент личинок восковой моли - фермент цераза ( химически синтезированного аналога фермента цераза - НЕТ ), который способствует рассасыванию очаговых изменений и препятствует их дальнейшему распространению в организме.
Под воздействием фермента цераза увеличивается проницаемость клеток микобактерий туберкулёза для противотуберкулёзных препаратов всех видов, что помогает подавить лекарственную устойчивость микобактерий.
Применение гомогената, экстракта, настойки личинок восковой моли, а также настойки ПЖВМ и мёда с гомогенатом личинок восковой моли в комплексной терапии туберкулёза позволяет значительно снизить лекарственную нагрузку на организм, оказать разноплановое лечебное воздействие и повысить эффективность химиотерапии (сократив срок приема противотуберкулёзных препаратов).
Продукты пчеловодства на основе личинок восковой моли является мощными природными иммуностимуляторами.
Прием продуктов на основе личинок восковой моли значительно усиливает процесс фагоцитоза.
Фагоцитоз - процесс, при котором специально предназначенные для этого клетки иммунной системы организма - фагоциты защищают организм путем поглощения вредных чужеродных частиц, бактерий, мертвых /погибающих клеток. Осуществляется двумя разновидностями клеток: циркулирующими в крови зернистыми лейкоцитами (гранулоцитами) и тканевыми макрофагами.
В продуктах на основе личинок восковой моли присутствуют незаменимые природные компоненты (аланин, лейцин, треонин, валин, изолейцин, гистидин и др.), стимулирующие сопротивляемость организма, рост и размножение клеток.
Продукты пчеловодства на основе личинок восковой моли увеличиваут сопротивляемость ткани к туберкулёзной инфекции и способствуют заживлению туберкулёзных каверн в легких.
По мере затихания туберкулёзного процесса величина бактериальной популяции уменьшается вследствие подавления размножения микобактерий. В условиях продолжающейся химиотерапии и снижения бактериальной популяции в организме больного сохраняется часть микобактерий, которые находятся в состоянии персистирования. Персистируюшие микобактерий часто называют спящими или дремлющими. На этом этапе, когда интенсивное размножение бактериальной популяции сменяется состоянием персистирования оставшейся ее части, микобактерий находятся, главным образом, внутриклеточно (внутри фагоцитов - клеток иммунной системы).
Противотуберкулёзными препаратами очень трудно оказать воздействие действие на микобактерии расположенные внутриклеточно.
Применение продуктов на основе личинок восковой моли позволяет подавить жизнедеятельность внутриклеточно локализованных микобактерий.
Высокую лечебную эффективность продукты пчеловодства на основе личинок восковой моли проявляют и при лечении внелегочной туберкулёзной патологии и других органов человеческого организма: лимфатической и пищеварительной системы, костей и суставов, мочеполовых органов, кишечника, кожи, глаз, центральной нервной системы и мозговых оболочек.
Продукты на основе личинок восковой моли эффективны и против грибковых заболеваний легких (и прочих побочных реакций организма), являющихся частыми осложнениями химиотерапевтических курсов лечения туберкулёза.
Содержащаяся в продуктах на основе личинок восковой моли аспарагиновая кислота помогает печени выводить из организма остаточные продукты лекарств после курсов химиотерапии.
В течение десятилетий в обывательской и медицинской среде, существует мнение, что прием спиртосодержащих экстрактов и настоек и антибиотиков несовместимы, т. к. при этом снижается эффективность антибиотиков, и возникают различные побочные эффекты.
Однако анализ существующих научных исследований показывает, что в большей части это выдуманный миф, не имеющий за собой никаких доказательств.
Британские исследователи считают, что миф возник во время второй мировой войны, когда производство антибиотика пенициллина было трудоемким и дорого стоило. Поэтому пенициллин повторно извлекали из мочи раненых и больных военнослужащих. Для того чтобы уменьшить объем мочи и ускорить выделение пенициллина, им было запрещено принимать пиво, входящее в ежедневное довольствие.
Последние исследования, в которых определялось влияние алкоголя (до 30мг чистого этанола) на некоторые фармокинетические показатели различных антибиотиков, показывающих распределение их по организму, не выявили их изменений либо они были незначительны.
Небольшие дозы алкоголя (до 15мг чистого этанола) не влияют на фармокинетику большинства ( включая все противотуберкулёзные препараты ) антибиотиков в организме.
15мг чистого этанола – это, например, 44мл 40% алкоголя.
При туберкулёзе предпочтительней принимать 25% экстракт личинок восковой моли или 50% гомогенат личинок восковой моли (при нормальной переносимости - настойку продуктов жизнедеятельности личинок восковой моли, причем концентрация фермента цераза в 20% настойке ПЖВМ выше, чем в настойке, 25% экстракте личинок восковой моли и даже чем в 50% гомогенате личинок восковой моли! ), т. к. они имеет большую концентрацию полезных веществ при меньшем содержании этанола (спирта) в конечной дозе ( при полной непереносимости или неприятия спиртосодержащих продуктов подойдет мёд с гомогенатом личинок восковой моли).
Содержание этанола (спирта) в разовой дозе 25% экстракта личинок восковой моли (на 1 прием) - не изменит эндогенную концентрацию этанола в организме (эндогенное - естественное содержание алкоголя в крови – в норме составляет до 0,3 промилле).
Максимальная разовая доза 25% экстракта личинок восковой моли для человека любого веса и дозировки - поднимает концентрацию алкоголя в крови на 0,098 промилле (т. к. в формуле расчета концентрации, также учитывается вес).
В среднем эндогенная (естественная и постоянно присутствующая) концентрация этанола в организме составляет - 0,18 промилле. Непосредственно после приема экстракта личинок восковой моли концентрация увеличится до 0,278 промилле, что является допустимой нормой - можно управлять автомобилем, принимать при кодировке от алкоголизма и совместно с любым дисульфирамом (Антабус, Тетурам, Эспераль и др.).
Через 30 минут после приема 25% экстракта личинок восковой моли 0,098 промилле будут полностью переработаны организмом и концентрация придет к изначальному значению.
Практически во всех (95%), известных нам за 8 лет случаях приема экстракта личинок восковой моли для лечения туберкулёза, больные принимали экстракт личинок восковой моли одновременно с курсом противотуберкулёзных препаратов (в том числе и по рекомендации лечащих врачей). Случаев возникновения побочных реакций (аллергий и пр.) не было.
При правильном систематическом приеме – результат применения экстракта личинок восковой моли удивлял даже опытных врачей-фтизиатров!
Читайте также:


