Синдром эндогенной интоксикации у новорожденного
| Классы МПК: | G01N33/48 биологических материалов, например крови, мочи; приборы для подсчета и измерения клеток крови (гемоцитометры) | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Автор(ы): | Федотова Татьяна Александровна (RU) , Горшкова Марина Анатольевна (RU) | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Патентообладатель(и): | Государственное образовательное учреждение высшего профессионального образования "Тверская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию" (RU) | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Приоритеты: | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Таблица 1 Схема приготовления рабочих растворов для определения ПЭМ | ||
| Раствор мочевины 0,3 моль/л (мл) | Раствор NaCl 0,87% (мл) | Концентрация мочевины в рабочем растворе (моль/л) |
| 35 | 65 | 0,11 |
| 50 | 50 | 0,15 |
| 55 | 45 | 0,165 |
| 60 | 40 | 0,18 |
| 65 | 35 | 0,195 |
| 100 | 0 | 0,3 |
Гемолиз в смесях изотонических растворов мочевины и хлористого натрия обусловлен способностью мочевины быстро диффундировать через клеточную мембрану и, создавая гиперосмолярную концентрацию внутри эритроцита, вызывать его набухание с последующим гемолизом. Степень гемолиза выражают в единицах оптической плотности. ПЭМ определяют как отношение оптической плотности пробы к оптической плотности пробы с 100% гемолизом (6-я пробирка), умноженное на 100%. Степень гемолиза пропорциональна проницаемости данной популяции эритроцитов.
Опытным путем было установлено, что наиболее информативными для определения ПЭМ были показатели оптической плотности гемолиза с рабочим раствором 60:40 (4-я пробирка).
Материалом для исследования явилась капиллярная кровь 96 новорожденных детей от 0 до 8 мес., находившихся в реанимационном отделении детской больницы №1 г.Твери, забираемая планово для контроля за их состоянием. Было установлено, что в норме (клинически здоровые новорожденные) проницаемость эритроцитарных мембран (ПЭМ) составляет 5,04±0,2%. Показатели ПЭМ у новорожденных с гипербилирубинэмией имели большой разброс. При легкой степени гипербилирубинэмии показатели ПЭМ составили 12,05±0,06%, при среднетяжелой - 29,8±0,015%, при тяжелой форме - 58,23±0,24%.
Результаты исследования приведены в таблице 2.
| Таблица 2 Показатели ПЭМ зависимости от стадии эндогенной интоксикации (ЭИ) | |||||
| №п/п | Измеряемые показатели | Контроль n=13 | Легкая степень ЭИ n=28 | Среднетяжелая степень ЭИ n=34 | Тяжелая степень ЭИ n=21 |
| 1 | Количество эритроцитов (млн/мл) | 5,3±0,26 | 5,3±0,27 | 4,8±0,24 | 4,5±0,23 |
| 2 | Степень гемолиза (единицы оптической плотности) | 0,5±0,026 | 1,6±0,79 | 1,98±0,01 | 2,5±0,1 |
| 3 | ПЭМ (проницаемость эритроцитарных мембран) % | 5,04±0,2 | 12,05±0,06 | 29,8±0,015 | 58,23±0,24 |
Клинический пример №1
Больной С., 18 дней, история болезни 1409, поступил в отделение патологии новорожденных детской городской больницы №1 по поводу выраженного беспокойства (монотонный плач), незначительная желтушность кожи и склер, печень +3 см, гипертермия до 38 градусов С.ПЭМ было определено сразу при поступлении (результат в течение 30 минут: эритроциты у ребенка 4,7 Гигал, степень гемолиза в опытной пробе (60:40)=1,393 ПЭМ=Еоп./Е(100% гем.)*100%=1,393/2,401*100%=58,017%, что свидетельствовало о тяжелой степени эндогенной интоксикации). Больной переведен в реанимационное отделение, где ему проводилась интенсивная терапия. Окончательный диагноз: нарушение гемоликвородинамики, гипербилирубинэмия 3 стадии, тяжелая степень. Прогноз полностью подтвердился.
Клинический пример №2
Больной М., 2 мес, история болезни 1287, поступил в отделение патологии новорожденных детской городской больницы №1 по поводу выраженной желтушности склер, температура тела 38 градусов С, однократная рвота фонтаном, печень +2 см. Было определено ПЭМ сразу при поступлении (результат в течение 30 минут: эритроциты 5,1 Гигал, степень гемолиза в опытной пробе (60:40)=0,1201, ПЭМ=0,1201/1,001*100%=11,99%). Была диагностирована легкая степень эндогенной интоксикации. Ребенок после проведения дезинтоксикационных мероприятий был переведен в инфекционное отделение. Уже к концу первого дня госпитализации температура нормализовалась, ребенок активный, сосет хорошо, стул нормальный, рвоты не было, желтушность склер значительно уменьшилась. Окончательный диагноз: ОРВИ: энтеровирусная инфекция, гипербилирубинэмия 1 стадии, легкая степень. Прогноз подтвердился.
Клинический пример №3
Больной Д., 4,5 мес., история болезни 1187, поступил в реанимационное отделение городской больницы №1 по поводу желтушности склер и ладоней, многократной рвоты фонтаном, обезвоживания (запавший родничок), повышенной температуры тела до 38,5 градусов С. Печень +3 см. Стул светлый. Мама мальчика 8-й день находится в инфекционном отделении по поводу гепатита А. С ребенком сидела бабушка. Со слов бабушки заболел остро. Нарастала вялость, повысилась температура, началась рвота. По скорой доставлен в больницу. При поступлении у ребенка определили ПЭМ (результат в течение 30 минут: эритроциты 4,7 Гигал, степень гемолиза в опытной пробе (60:40)=0,58, ПЭМ=0,59/1,98*100%=29,798%).
Была диагностирована среднетяжелая степень тяжести интоксикации. После проведенных дезинтоксикационных мероприятий ребенок через сутки был переведен в инфекционное отделение. Окончательный диагноз: гепатит А, гипербилирубинэмия 2 стадии, средне-тяжелая степень тяжести. Прогноз полностью подтвердился.
ФОРМУЛА ИЗОБРЕТЕНИЯ
Способ определения степени тяжести эндогенной интоксикации у новорожденных детей с гипербилирубинэмией, включающий исследование крови, отличающийся тем, что осуществляют забор 0,02 мл капиллярной крови, определяют проницаемость эритроцитарных мембран по осмотической резистентности эритроцитов, и при значении проницаемости эритроцитарных мембран 12,05±0,06% диагностируют легкую степень эндогенной интоксикации, при значении 29,8±0,015% - диагностируют среднетяжелую степень эндогенной интоксикации, а при значении 58,23±0,24% - тяжелую степень эндогенной интоксикации.
Л.П. Парменова
Смоленская государственная медицинская академия, г. Смоленск
Ведущим патогенетическим синдромом, определяющим тяжесть состояния детей с заболеваниями верхних отделов пищеварительного тракта (ВОПТ), является эндогенная интоксикация (ЭИ), три стадии развития которой характеризуются различной степенью повреждения клеточных структур. Лечебные мероприятия, направленные на борьбу с ЭИ, следует считать важнейшим компонентом терапии при организации лечения детей с заболеваниями ВОПТ.
Endogenous toxicohemia (ЕТ) is a main pathogenetic syndrome determining general state of patients with upper gastrointestinal tract (UGIT) pathology. Its three stages are characterized by different degree of cell structures damage. Therapeutic measures for ET correction must be estimated as an important part of therapy during the organization of patient with UGIT pathology management.
Материалы и методы исследования
Обследовано 428 детей в возрасте от 5 до 16 лет, находящихся на лечении в областной детской клинической больнице г. Смоленск со следующими диагнозами: функциональная диспепсия - у 56 (13%), гастроэзофагеальная рефлюксная болезнь - у 13 (4%), хронический гастрит - у 158 (37%), хронический гастродуоденит - у 167 (39%), язвенная болезнь желудка и двенадцатиперстной кишки - у 34 (7%) детей.
Для диагностики и оценки степени ЭИ использовали следующие параметры: 1) лабораторные интегральные показатели ЭИ - активность перекисного окисления липидов (ПОЛ) методом индуцированной FeH202 хемилюминесценции: интенсивность быстрой вспышки (ИБВ), отражающая наличие перекисных продуктов; площадь светосуммы (ПС), указывающая на способность липидов подвергаться окислению; ПС/ИБВ; молекулы средней массы (МСМ) [9], олигопептиды, катаболический пул МСМ. Исследования выполнены на базе ЦНИЛ СГМА (руководитель канд. мед. наук Г.Н. Федоров); 2) клинические проявления полиорганных поражений по результатам клинико-инструментального обследования: эндоскопическое исследование (Olympus GIF Р-30) ВОПТ с гистоморфологическим исследованием биоптатов слизистой оболочки (СО); интрагастральная рН-метрия и суточное ее мониторирование ("Гастроскан-5М", "Гастроскан-24", "Исток-Система", Фрязино); ректороманоскопия с гистоморфологическим исследованием биоптатов СО прямой кишки; УЗИ гепатобилиарной системы, поджелудочной железы (SIMENS SONOLIN JZ-1); нагрузочные пробы с лактозой, D-ксилозой; ЭКГ, ФКГ, ЭХОКГ; исходный вегетативный тонус (ИВТ) оценивали по таблицам A.M. Вейна в модификации Н.А. Белоконь; кардиоинтервалография (КИТ), клиноортостатическая проба (КОП); общий анализ мочи, анализ мочи по Зимницкому, антикристаллообразующая способность мочи (АКОСМ), тест на кальцефилаксию; исследование мочи на микрофлору; УЗИ почек, радиоизотопная ренография по показаниям; кожно-скарификационные пробы с пищевыми и бытовыми аллергенами.
Результаты и их обсуждение
Результаты исследования показали, что у детей с заболеваниями ВОПТ в динамике развития болезни прослеживается 3 стадии патофизиологических изменений, характеризующихся различной степенью повреждения клеточных структур, которым соответствуют клинические, инструментальные и лабораторные проявления.
На I стадии под воздействием патогенетических факторов внешней и внутренней среды, индивидуальных для каждого ребенка, происходит повышение активности ПОЛ, сопровождающееся повышением активности антиоксидантной защиты (АОЗ) и физиологической константы - АОЗ/ПОЛ (рис. 1). Повышается уровень МСМ, олигопептидов и катаболического пула (рис. 2).
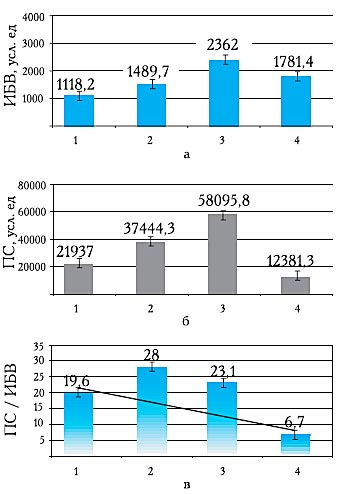
Рис. 1. Показатели импульса быстрой вспышки (а), площади светосуммы (б) и их отношения (в) у наблюдаемых больных.
Здесь и на рис. 2: 1 - контрольная группа, 2 - ЭИ I степени, 3 - ЭИ II степени, 4 - ЭИ III степени.
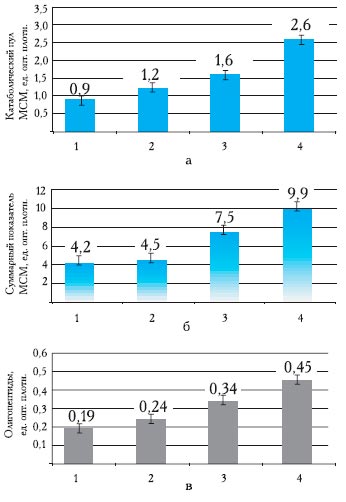
Рис. 2. Показатели катаболического пула МСМ (а), уровень суммарного показателя МСМ (б) и содержание олигопептидов (в) у наблюдаемых больных.
Таким образом, ЭИ средней тяжести - это стадия напряжения адаптации, появления признаков системного поражения мембран клеток, нарушения физиологического равновесия между пролиферацией клеток и их гибелью [10].
Таблица. Патогенетическая коррекция эндогенной интоксикации при заболеваниях верхних отделов пищеварительного тракта у детей.
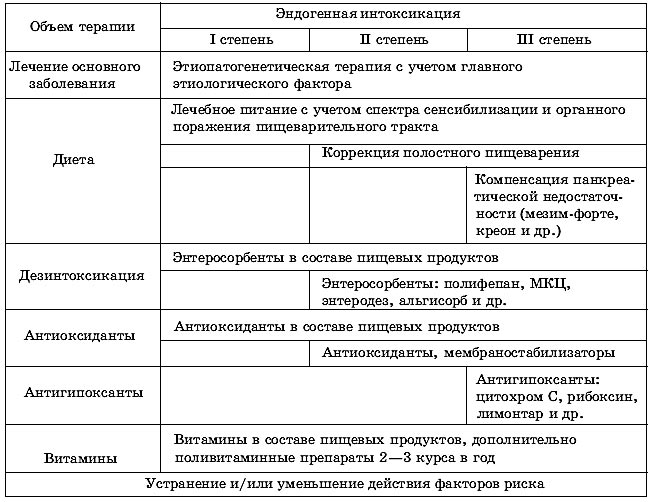
1. Ведущим патогенетическим синдромом, определяющим тяжесть состояния детей с заболеваниями ВОПТ, является ЭИ, три стадии развития которой характеризуются различной степенью повреждения клеточных структур.
2. Лечебные мероприятия, направленные на борьбу с ЭИ, - важнейший компонент лечения детей с заболеваниями ВОПТ. Объектами воздействия должны быть источники интоксикации, внутренние среды организма, выполняющие функции транспорта токсических веществ, а также системные и метаболические механизмы, нарушенные в результате развивающейся ЭИ.
1. Баранов А.Л., Щеплягина Л А. // РМЖ. - 2000. - Т. 8, № 18. - С. 4-15.
2. Волков А.И. // РМЖ. - 1999. - Т. 7, № 4. - С. 179-186.
3. Заболевания органов пищеварения у детей // Под ред. Баранова А.А., Климанской Е.В., Римарчук Г.В. - М., 1996. - 304 с.
4. Ивашкин В.Т., Лапина Т.Л. // РМЖ. - 2000. - Т. 8, № 17. - С. 697-704.
5. Мазурин А.В., Филин В.Л., Цветкова Л.Н. // Педиатрия. - 1997. - № 1. - С. 5-7.
б.Запруднов А.М. // Педиатрия. - 1995. - № 1. - С. 77-81.
7. Комаров Ф.И., Хуцишвили М.Б. // Свободные радикалы и болезни человека. - Смоленск, 1999. - С. 134-135.
8. Ерюхин А.И., Белый В.Я., Вагнер В.К. Воспаление как общебиологическая реакция. - Л., 1989. - 262 с.
9. 3абросаева Л.И. // Новые методы диагностики, лечения, реабилитации и профилактики патологических состояний. - Смоленск, 1994. - С. 48-49.
10. Аруин Л.И., Смотрова И.Л, Городинская В.С. // Бюлл. экспер. биол. мед. - 1989. - № 10. - С. 499-501.
11. Аруин Л.И. Helicobacter pylori: революция в гастроэнтерологии / Под ред. В.Т. Ивашкина, Ф. Мегро. - М., 1999. - С. 54-61.
12. Зенсков Н.К., Меныцикова Е.Б., Вольский Н.Н. и др. // Усп. совр. биол. - 1999. - № 5. - С. 440.

Летальность вследствие сепсиса возрастает и, по различным данным, колеблется от 28 до 50 %. Сепсис в структуре неонатальной смертности занимает 2-3-е место. Особую проблему представляют новорожденные, находящиеся в отделениях интенсивной терапии (ОИТ), среди которых частота развития сепсиса составляет 14-30 %, в том числе у недоношенных — 40-60 %.
Исход лечения напрямую зависит от времени постановки диагноза и начала лечения. Ранняя диагностика сепсиса дает возможность применять своевременную и рациональную этиопатогенетическую интенсивную терапию, в частности антибактериальную.
Стандарты определения сепсиса даны на согласительной конференции Всемирного общества пульмонологов и Общества специалистов критической медицины (ACCP/SCCM) в 1992 г. в Чикаго, США, и подтверждены на X Международном симпозиуме ISF 2007 г. в Париже. Однако и в настоящее время сохраняется путаница в терминологии и определениях. Поэтому целесообразно дать основные понятия.
Симптом (symptomum, греч. — совпадение, признак) — признак патологического состояния или болезни. Синдром (syndromum, греч. — стечение признаков болезни — син. симптомокомплекс) — совокупность симптомов, объединенных единым патогенезом; иногда этим термином обозначают самостоятельные нозологические единицы или стадии (формы) какой-либо болезни.
Воспаление (inflammation) — защитно-приспособительная реакция целостного организма на действие патогенного раздражителя, проявляющаяся развитием на месте повреждения ткани или органа изменений кровообращения и повышения сосудистой проницаемости в сочетании с дистрофией тканей и пролиферацией клеток.
И.Н. Лейдерман убежден, что системный воспалительный ответ (СВО) — это симптомокомплекс, характеризующий выраженность воспалительной реакции в системе эндотелиоцитов. Таким образом, СВО — ответ органов и систем на воспаление, а ССВО — симптомокомплекс основных патологических состояний (дыхательная недостаточность, сердечно-сосудистая недостаточность, острая почечная недостаточность и пр.).
Обобщая вышесказанное, отметим, что синдром эндогенной интоксикации (СЭИ) и ССВО являются идентичными. В основе обоих понятий лежит системное воспаление.
Примечательно, что участники Международной конференции, посвященной проблемам критериев СВО, состоявшейся в 2001 году, критически отнеслись к существующей терминологии, но оставили ее без изменений, признав полезной для дальнейшего использования как клиницистами, так и исследователями. Из недостатков было отмечено, что существующие критерии не позволяют оценить этапность и прогнозированность реакции макроорганизма на агрессию.
Особое место в патогенезе ССВО отводится повышению в крови провоспалительных цитокинов, которые обеспечивают согласованность действий иммунной, эндокринной и нервной систем в нормальных условиях и в ответ на патологические воздействия. Активирование провоспалительными цитокинами эндотелиальных клеток неизменно влечет за собой нарушение в свертывающей системе крови.
Анализ литературных данных позволяет выделить три ключевых этапа развития ССВО: эндотоксемия, тромбогеморрагические осложнения, эндотелиальная дисфункция и недостаточность. В настоящее время можно считать доказанным, что патогенез всех критических состояний сводится к механизмам развития воспаления, следовательно, терапевтическая тактика должна быть направлена на выявление и коррекцию предыдущих и профилактику последующих этапов развития воспалительного ответа.
Концепция сепсиса принята зарубежной академической наукой на протяжении последнего десятилетия. Различают колонизацию (микробиологическая ситуация), инфекцию (микробиологическая ситуация в сочетании с местной воспалительной реакцией), сепсис (микробиологическая ситуация в сочетании с системным воспалительным ответом), тяжелый сепсис (сепсис в сочетании с синдромом полиорганной недостаточности — ПОН), септический шок (тяжелый сепсис в сочетании с гипотензией).
В патогенезе синдрома системного воспаления и септического шока лежат изменения системной циркуляции, связанные с активацией компонентов иммунной системы: периферическая вазоконстрикция/вазодилатация, внутрисосудистое перемещение жидкости, депрессия миокарда, повышенный метаболизм. Все перечисленное ведет к нарушению равновесия между доставкой и потреблением кислорода и, как результат этого, к развитию глобальной тканевой гипоксии, вызывающей органную недостаточность.
Клиническим критерием ССВО (по данным согласительной конференции) является наличие хотя бы двух из следующих признаков:
- температура тела выше 38 °С или ниже 35,5 °С;
- частота сердечных сокращений более 165 в 1 мин;
- частота дыхания более 60 в 1 мин;
- количество лейкоцитов в периферической крови более 14 • 109/л или менее 5 • 109/л (или не менее 10 % незрелых клеток);
- тромбоцитопения менее 120 тыс.
Физиологической особенностью новорожденных является склонность к генерализации реакций в ответ на воздействие повреждающих факторов, в т.ч. инфекции. Поэтому клинические стадии сепсиса у новорожденных протекают молниеносно, их трудно отграничить по времени. Вот почему неонатальный сепсис даже в стадии СВО практически всегда протекает с полиорганной недостаточностью.
Возбудителями сепсиса у новорожденных могут быть свыше 40 видов условно-патогенных и патогенных микроорганизмов. Спектр наиболее вероятных возбудителей определяется временем инфицирования плода или ребенка (антенатальное, интранатальное или постнатальное), локализацией входных ворот инфекции и условиями инфицирования (внебольничная или больничная инфекция).
В течение последних 10 лет отмечается рост роли грамположительных условно-патогенных микроорганизмов, которые могут являться причиной развития внебольничного и больничного сепсиса (Streptococcus shh., Staphylococcus spp., Enterococcus spp.). Кроме того, в структуре грамотрицательных возбудителей сепсиса преобладают Pseudomonas aer., Klebsiella spp., Enterobacter, наиболее часто у пациентов в ОИТ, находящихся на искусственной вентиляции легких (ИВЛ).
Не следует также недооценивать роль вирусов в развитии и патогенезе сепсиса. У новорожденных наиболее часто определяют цитомегаловирус, PC-вирус, герпес.
В последние годы все более отчетливой становится тесная взаимосвязь воспаления и системы свертывания крови. Одним из проявлений тяжелого СВО является неуправляемая активация свертывающей системы крови, которая в условиях прогрессирования фибринолиза неизбежно приводит к развитою тромбоцитопении и коагулопатии потребления (ДВС-синдром).
То есть у всех пациентов с сепсисом обнаруживается нарушение свертывания крови, которое варьирует от легких отклонений параметров свертывания до молниеносного течения диссеминированного свертывания крови (ДВС) с одновременным тромбообразованием и профузным кровотечением.
Нарушение свертывания крови при сепсисе является следствием комплексных взаимодействий между эндотелием, контактной системой, клетками (моноциты, тромбоциты) и медиаторами воспаления (цитокины, тканевый фактор). Результатом такого нарушения является внутрисосудистое образование фибрина, играющее решающую роль в развитии полиорганной недостаточности.
Клиническая диагностика основана на тяжести общего состояния новорожденного, нарушении терморегуляции (у зрелых новорожденных чаще отмечается лихорадка, у недоношенных — гипотермия), лейкоцитоз/лейкопения, тромбоцитопения/тромбоцитоз, склонность к кровоточивости (иногда изолированная из ЖКТ), появившийся отечный синдром, гипер-/гиподинамический тип кровообращения (мраморность кожи), апноэ или тахипноэ (т.е. нарушение самостоятельного дыхания) при отсутствии воспалительных изменений на рентгенограмме, синдром угнетения ЦНС, быстрое нарастание желтухи, увеличение печени и селезенки (непостоянный признак), парез кишечника (дисфункция ЖКТ), некротизирующий энтероколит, отсутствие прибавки массы тела.
Лабораторная диагностика должна включать в динамике бактериологический мониторинг новорожденного, общий клинический анализ крови с тромбоцитами, осмолярностью и ВСК, расчет лейкоцитарного индекса интоксикации (ЛИИ) при поступлении и на 3-и, 7, 14-е сутки (по формуле Я.Я. Кальф-Калифа), что позволяет дать ответ о сроках инфицирования новорожденного, биохимический мониторинг, включающий определение уровня мочевины, креатинина, уровня среднемолекулярньгх пептидов (УСМ) крови — количественный маркер синдрома эндогенной интоксикации, выявление С-реактивного белка и индекса распределения (ИР).
Лабораторные исследования гемостаза позволяют выявить склонность к тромбообразованию, гиперкоагуляционные сдвиги, гипокоагуляционньге расстройства. Поэтому обязательными являются коагуляционные тесты, забор крови на общие сывороточные иммуноглобулины (A, G, М) и специфические при подозрении на вирусную инфекцию — ПЦР (обнаружение ДНК возбудителей), а также вирусологическое исследование (моча). При наличии необходимо проводить полуколичественный экспресс-РСТ-тест сыворотки крови.
Для ранней диагностики сепсиса у оперированных новорожденных целесообразно изучение гормона прокальцитонина (ПКТ), являющегося прогормоном кальцитонина (КТ) и вырабатываемого клетками щитовидной железы. Повышение концентрации ПКТ в плазме крови при генерализованном инфекционном процессе позволяет использовать его в качестве маркера септических осложнений.
Считается, что оксид азота играет ключевую роль в патогенезе септического шока, хотя большинство механизмов его действия при сепсисе изучены плохо.
Заметное волнение среди клиницистов вызвало определение провоспалительных медиаторов, способствующих началу сепсиса и ССВО, определение их дейотропических эффектов. Первыми из таких, требующих определения эндогенных медиаторов стали фактор некроза опухоли и интерлейкин-1.
Список вырос за счет массы других цитокинов, продуктов дегрануляции нейтрофильных лейкоцитов, тромбоцитов и образованных на их поверхности коагулирующих факторов, дополнительных фрагментов, тромбоцитактивирующих факторов и производных арахидоновой кислоты. Добавился и новый класс медиаторов — хемокины, которые запускают сильный эффект активации и хемотаксиса лейкоцитов.
Данный подход отличается достаточно высокой достоверностью, но, к сожалению, является сравнительно дорогостоящим для большинства клиник. Другие факторы, без сомнения, еще ждут своего открытия.
У детей, особенно раннего возраста, интоксикация может возникнуть на фоне любого вирусно-инфекционного заболевания и всегда сопровождается нарушением функций центральной и вегетативной нервной систем, водно-электролитного и других видов обмена веществ. Такое многообразие нарушений в детском организме, да еще в сочетании с функциональными расстройствами внутренних органов дает основание в таких случаях говорить о токсическом синдроме.
Появлению токсического синдрома способствуют как физиологические особенности детского организма (лабильность водного и других видов обмена веществ, несовершенство нервно-регуляторных механизмов жизненно важных функций), так и патологические состояния, характерные для детей раннего возраста (гипотрофия, гиповитаминозы, рахит и др.). Немаловажную роль играет и возбудитель инфекционных заболеваний, в частности его вирулентность.
Симптомы. Умеренно выраженный энтеральный токсикоз сопровождается учащением и разжижением стула, срыгиваниями, сменяющимися частыми, затем беспрерывными рвотами. Частый жидкий стул и рвоты приводят к обезвоживанию и потере основных солей и элементов. Кожа становится сухой, снижаются ее эластические свойства. Слизистая оболочка полости рта матовая, сухая. Язык обложен. Температура тела, как правило, повышена. Пульс учащен. Тоны сердца умеренно приглушены, иногда слышен очень нежный систолический шум. Умеренная одышка, но признаков пневмонии в легких нет. Выраженные нарушения функции центральной нервной системы: беспокойство, повышенная раздражительность, двигательное возбуждение, бессонница.
Среднетяжелый токсикоз характеризуется усиленным обезвоживанием, о чем свидетельствуют западение родничков, ввалившиеся глаза, заострившиеся черты лица, серовато-землистый оттенок кожи, значительное снижение тургора кожи, сухость и яркая краснота слизистых оболочек губ и полости рта. Тоны сердца становятся еще более глухими, появляются различные расстройства ритма сердечной деятельности. Одышка усиливается; в легких прослушиваются единичные сухие хрипы. Перкуторный звук над поверхностью обоих легких с тимпаническим оттенком. Двигательное беспокойство и другие признаки перевозбуждения нервной системы постепенно сменяются симптомами угнетения ее.
Тяжелая степень токсикоза напоминает коматозное состояние. Ребенок теряет сознание. Лицо маскообразное, застывшее. Взгляд безжизненный, устремленный вдаль. На внешние раздражители в периоды возвращения сознания практически не реагирует. Кожа резко бледная, сухая, легко собирающаяся в складки, медленно расправляющиеся, землистого цвета. Конечности холодные. Дыхание шумное, аритмичное (иногда типа Куссмауля) или частое, поверхностное. Пульс резко учащен, слабого наполнения и напряжения. Тоны сердца глухие, эмбриокардия. Диурез отсутствует. Периодически возникают судороги отдельных мышечных групп. Кататония: ребенку можно придать любое положение тела, наиболее типичное - положение фехтовальщика.
Характерными симптомами нейротоксикоза являются затемненное сознание, бред, резкое повышение температуры, судороги, симптомы раздражения мозговых оболочек, выраженная тахикардия с довольно быстро развивающейся сердечной недостаточностью, В зависимости от этиологии клиническая симптоматология может варьировать.
Лечение. Осуществляется в двух направлениях: борьба с возбудителем болезни и коррекции нарушений водно-электролитного обмена и ацидоза. Исходя из этиологии заболевания, применяют антибиотические вещества, а ацидотический сдвиг и обменные нарушения устраняются вливанием жидкостей и солевых растворов.
Первым этапом лечения является быстрое наводнение организма ребенка с целью компенсации потери внеклеточной жидкости. Назначают чайную диету на 12-18 ч. В течение этого периода ребенок получает только обильное питье слегка подслащенного чая или физиологического раствора.
Внутривенно вводят 200-300 мл смеси 5% раствора глюкозы и физиологического раствора (2/3 первого и 1/3 второго), затем солевые растворы - капельно по 150-180 мл на 1 кг массы в сутки. Солевые растворы, как уже подчеркивалось, назначаются в соответствии с состоянием электролитного обмена. Поскольку у всех больных с токсикозом имеется ацидоз, первоначально вводят 4% раствор бикарбоната натрия из расчета 5-7 мл на 1 кг массы, а в дальнейшем его назначают в строгом соответствии с лабораторными данными о степени ацидоза (щелочной резерв). К солевым растворам, вводимым капельно, добавляют плазму крови, витамины С(400-500 мг) и В1 (20-30 мг); при отсутствии плазмы - неокомпенсан (поливинилпирролидон - 5-15 мл 6% раствора на 1 кг массы в сутки), или полиглюкин, или какой-либо другой заменяющий плазму раствор.
Во всех случаях токсикоза применяют кортикостероидные препараты, в частности, преднизолон - по 2 мг на 1 кг массы в первую половину дня. При тяжелом токсикозе целесообразно введение преднизолона парентерально: внутривенно или внутримышечно.
Для поддержания удовлетворительной функции сердечнососудистой системы назначают кардиотонические средства: строфантин, кофеин, а также сосудистые средства (мезатон) В возрастной дозировке. Строфантин оказывает хороший и достаточно длительный эффект при капельном введении.
С целью уменьшения беспокойства в начале развития токсикоза применяют аминазин 0,2-0,6 мл 2,5% раствора (в зависимости от возраста), плегомазин, ларгактил по 1 мг на 1 кг массы в сутки внутримышечно (2-3 инъекции), а также литические смеси: 2,5% раствор аминазина, 2% раствор димедрола, 2% раствор солянокислого папаверина - по 0,2- 0,75 мл каждого препарата в зависимости от возраста - внутримышечно 2-3 раза в сутки. При очень высокой температуре внутримышечно вводят 1% раствор амидопирина из расчета 0,5 мл на 1 кг массы или 50% раствор анальгина (0,2-0,5 мл в зависимости от возраста). При судорогах назначают хлоралгидрат в клизмах.
При терапии солевыми растворами необходимо постоянно контролировать содержание основных электролитов в крови в связи с возможностью возникновения побочных явлений при регидратации; так, введение больших количеств ионов натрия вызывает отеки; введение большого количества поваренной соли - гипертермию; быстрое введение жидкости и излишков поваренной соли при наличии сердечно-сосудистой недостаточности - отек легких; передозировка жидкости - гипокалиемию; передозировка жидкости, хлорида натрия и щелочей - снижение содержания кальция в крови, затем судороги вследствие отека мозга; передозировка калия или олигурия и анурия - гиперкалиемию и также судороги; бесконтрольное введение калийсодержащих растворов, особенно при олигурии, - такие серьезные осложнения, как блокада сердца и даже остановку сердца.
Читайте также:
- Отравление от кефира с огурцом
- Лактофильтрум при отравлении ребенка отзывы
- Корень кровохлебки отзывы при отравлении
- Отравление цезием 137 симптомы
- Жидкий стул причины у взрослых не отравление
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.

