Питательные среды для золотистого стафилококка
Глава 14. Стафилококки
Впервые стафилококки были обнаружены Л. Пастером в 1897 г. Подробно они были изучены А. Огстоном (1882) и Ф. Розенбахом (1884).
Морфология. Стафилококки (от греч. staphyle - виноградная гроздь) имеют вид круглых шаров диаметром 0,5-1,5 мкм. Размножаясь, образуют скопления в виде грозди винограда. Такая форма является результатом деления микробов в различных плоскостях. Однако в гное встречаются единичные и парные кокки. Стафилококки неподвижны, не имеют спор, при специальных условиях культивирования образуют микрокапсулу, грамположительны.
Культивирование. Стафилококки - факультативные анаэробы, однако лучше растут в присутствии кислорода. Растут и размножаются на обычных питательных средах, хорошо растут на средах с кровью, оптимальные условия - температура 37° С, рН 7,2-7,4.
Элективными средами являются желточно-солевой агар и солевой агар. На МПА колонии стафилококка выпуклые, круглые, непрозрачные, блестящие, размером 2-4 мм с ровными краями. При росте стафилококки образуют пигмент: золотистый, лимонно-желтый или белый. Лучше всего пигмент образуется на молочной среде при комнатной температуре и рассеянном свете. Стафилококковый пигмент не растворяется в воде, растворяется в ацетоне, эфире, спирте и т. д. При росте некоторых штаммов стафилококка на агаре с кровью вокруг колонии образуется зона гемолиза. Рост на бульоне характеризуется равномерным помутнением и осадком на дне.
Ферментативные свойства. Стафилококки вырабатывают сахаролитические и протеолитические ферменты. Сахаролитические ферменты расщепляют ряд сахаров: лактозу, глюкозу, сахарозу, мальтозу, глицерин и другие с образованием кислоты.
Протеолитические свойства стафилококка выражаются в способности растворять казеин, разжижать желатин (медленно), расщеплять другие белковые субстраты.
Стафилококки продуцируют ферменты патогенности: 1) коагулазу (сворачивает плазму крови); 2) гиалуронидазу (фактор распространения); 3) лецитиназу (растворяет лецитин оболочки клеток); 4) фибринолизин (лизирует фибрин); 5) ДНКазу (деполимеризует ДНК); 6) фосфатазу и др.
Наличие плазмокоагулазы позволяет дифференцировать золотистый стафилококк от стафилококков других видов. Многие стафилококки вырабатывают пенициллиназу, разрушающую пенициллин.
Токсинообразование. Стафилококки вырабатывают экзотоксины. К их числу относятся гемолизины четырех типов, из которых наибольшее значение имеет α-токсин. Он обладает следующими свойствами: гемолитическим - вызывает гемолиз эритроцитов, дермонекротическим - при внутрикожном введении вызывает некроз, летальным - при внутривенном введении приводит к гибели чувствительных к нему животных.
Кроме гемолизинов стафилококки образуют лейкоцидин, убивающий лейкоциты, энтеротоксины шести типов, вызывающие пищевые отравления, эксфолиатины двух типов, приводящие к отслаиванию эпидермиса у новорожденных детей.
Антигенная структура. Стафилококки имеют протеиновый антиген А, общий для всех золотистых стафилококков, и полисахаридные антигены: А, Б, С.
Стафилококки выделяют бактериоцины (стафилоцины), которые обладают антагонистическим действием по отношению к микроорганизмам данного рода.
Среди золотистых (реже эпидермальных) стафилокков различают около 40 фаговаров. Определение чувствительности выделенных из различных объектов стафилококковых культур к типовым фагам имеет важное эпидемиологическое значение (при установлении источника и путей передачи возбудителя).
Классификация. В настоящее время стафилококки, выделенные от человека, делят на 3 вида (табл. 23): S. aureus, S. epidermidis, S. saprophyticus.

Таблица 23. Дифференциация видов стафилококков, выделенных от человека
Примечание. + наличие ферментации, устойчивости, - отсутствие ферментации, устойчивости.
Устойчивость к факторам окружающей среды. Стафилококки довольно устойчивы, поэтому они обнаруживаются в воздухе, почве, воде, на предметах обихода. При температуре 100° С они погибают моментально, при температуре 70° С - через 10-15 мин. Они хорошо переносят низкие температуры. При замораживании сохраняют жизнеспособность в течение нескольких лет. Хорошо переносят высушивание. Прямой солнечный свет убивает их только через несколько часов. Обычные растворы дезинфицирующих веществ (например, сулема в разведении 1:1000) убивают их через 15-20 мин. При обезвреживании выделений, содержащих гной, белок, мокроту, не следует применять фенол. Это дезинфицирующее вещество вызывает коагуляцию белков, что предохраняет микроорганизмы от гибели. Стафилококки чувствительны к бриллиантовому зеленому.
Восприимчивость животных. К стафилококку чувствительны крупный и мелкий рогатый скот, лошади, свиньи, куры. Из экспериментальных животных - кролики, белые мыши и котята.
Источники инфекции. Больной человек и бактерионоситель.
Пути передачи. Контактно-бытовой, воздушно-капельный, воздушно-пылевой, пищевой.
Заболевания у человека. Пиодермия, фурункулы, карбункулы, панариции, абсцессы; воспалительные процессы различных органов и тканей; ангины, циститы, остеомиелиты, холециститы, маститы; сепсис и септикопиемия; пищевые токсикоинфекции и многие другие. Описано около 120 нозологических форм стафилококковой этиологии.
Патогенез. Стафилококки проникают через кожу и слизистые оболочки.
Преимущественное значение при стафилококковых заболеваниях имеет золотистый стафилококк (S. aureus). Менее выражена роль в патологии человека S. epidermidis и S. saprophyticus. Патогенез обусловливается свойствами возбудителя - ферментами, экзотоксинами, веществами бактериальной клетки и состоянием иммунной системы макроорганизма.
Чаще поражается кожа и подкожная клетчатка - возникают пиодермиты, фурункулы, панариции. Нередко стафилококки обусловливают вторичные заболевания, например пневмонию при гриппе. Они также вызывают раневые инфекции. Особенно велика роль стафилококков в акушерской практике, так как новорожденные очень чувствительны к ним. В течении стафилококковых заболеваний имеет значение развитие аллергии, поэтому заболевание характеризуется рецидивами.
Особое место среди стафилококковых заболеваний занимают пищевые интоксикации. Клинически они протекают как токсикозы, сопровождаются рвотой, поносом, головной болью и другими явлениями.
Иммунитет. У человека имеется естественная резистентность, связанная с механическими факторами, фагоцитозом и наличием антител. Воспалительный процесс, возникающий в месте внедрения возбудителя, обусловливает задержку стафилококков и затрудняет их распространение по организму. В образовавшемся очаге стафилококки подвергаются фагоцитозу.
Образующийся в процессе заболевания антитоксин является важным фактором в общем комплексе иммунитета. Однако приобретенный иммунитет нестойкий, поэтому наблюдаются рецидивы.
Профилактика. Сводится к улучшению санитарно-гигиенических условий, активному выявлению больных и бактерионосителей, правильному режиму работы больничных учреждений.
Специфическая профилактика. Стафилококковый анатоксин и антистафилококковый иммуноглобулин.
Лечение. Антибактериальные препараты, поливалентный стафилококковый бактериофаг, антистафилококковая плазма и иммуноглобулин. В некоторых случаях при хроническом течении стафилококковых инфекций применяют аутовакцину.
1. По какому признаку кокки объединены в одну группу?
2. Какие ферменты и факторы патогенности продуцируют стафилококки?
3. Какие заболевания вызывают стафилококки?
4. Какие виды стафилококков Вы знаете?
Цель исследования: выделение и идентификация стафилококков.
1. Гной (фурункулы, карбункулы, абсцессы).
2. Слизь из зева (ангина).
3. Мокрота (пневмония).
4. Моча (пиелиты и циститы).
5. Дуоденальное содержимое (холецистит).
6. Кровь (подозрение на сепсис).
7. Рвотные массы, промывные воды желудка, пищевые продукты (пищевые отравления).
8. Слизь из носа (обследование на бактерионосительство).

Способы сбора материала

Первый день исследования
Все посевы ставят в термостат на сутки.
Обнаружение стафилококков при микроскопии гноя из закрытого абсцесса и осадка мочи, взятой катетером, позволяет дать предварительный положительный ответ: обнаружен стафилококк.
Посевы на плотных и жидких питательных средах вынимают из термостата и изучают. Подозрительные в отношении стафилококка колонии, выросшие на желточно-солевом агаре, отсевают на скошенный агар для получения и дальнейшего изучения чистой культуры. При этом учитывают наличие лецитиназы, которое проявляется в образовании радужного венчика вокруг колонии. Чашки с оставшимися колониями оставляют на 2-3 дня при комнатной температуре для выявления пигмента. Просматривают посевы на чашках с агаром, содержащим кровь. Колонии с четкой зоной гемолиза (просветление) вокруг них выделяют на скошенный агар. Посев крови в сахарном бульоне инкубируют 10 сут, производя через 2-3 дня высевы на агар с кровью и желточно-солевую среду.
При отсутствии роста на плотных питательных средах делают высев из бульона с глюкозой на агар с кровью. Посевы ставят в термостат на сутки.
Вынимают посевы из термостата. Из выделенных на скошенный агар культур делают мазки, окрашивают по Граму и микроскопируют. При наличии грамположительных стафилококков проводят дальнейшее изучение выделенной культуры:
а) ставят реакцию плазмокоагуляции;
б) изучают гемолитические свойства;
в) определяют продукцию ДНКазы;
г) определяют ферментацию маннита в анаэробных условиях;
д) определяют устойчивость к новобиоцину.
Реакция плазмокоагуляции. Цитратную плазму, полученную из крови кролика, разводят изотоническим раствором натрия хлорида в соотношении 1:4 и наливают в две преципитационные пробирки по 0,3-0,5 мл. В одну пробирку вносят петлю исследуемой культуры, другая пробирка служит контролем. Обе пробирки ставят в термостат при температуре 37° С. Учет реакции производят через 2-3 ч. При отсутствии свертывания плазмы посевы оставляют при комнатной температуре на 24 ч, после чего учитывают реакцию. При наличии фермента коагулазы плазма свертывается (не выливается из перевернутой пробирки). В контрольной пробирке консистенция плазмы не изменяется.
Ускоренный метод определения коагулазы. В стерильной капле воды на предметном стекле суспендируют выделенную культуру, к ней прибавляют одну каплю неразведенной плазмы. При положительной реакции из микробных клеток в течение 20-60 с образуются крупные хлопья. Этот метод используют при массовых обследованиях.
Определение гемолитических свойств. Производят посев на агар с 5% крови (штаммы, продуцирующие α-гемолизин, дают зоны просветления среды и на кроличьей и на бараньей крови, продуцирующие β-гемолизин лизируют только эритроциты барана).
Определение ДНКазы. Исследуемую культуру засевают на среду, содержащую ДНК. Посевы инкубируют. Через 18-20 ч на чашку с выросшими колониями стафилококка добавляют 5-7 мл раствора хлороводородной кислоты. ДНК реагирует с кислотой и среда становится мутной. Если выделенная культура продуцирует фермент ДНКазу, он деполимеризует ДНК и помутнение не образуется.
Расщепление маннита в анаэробных условиях. Исследуемую культуру засевают уколом на полужидкий агар с маннитом. Поверхность среды заливают вазелиновым маслом. Инкубируют 18-24 ч при 37° С. Положительная реакция характеризуется изменением цвета среды (в среде имеется индикатор).
Производят учет результатов (табл. 24).
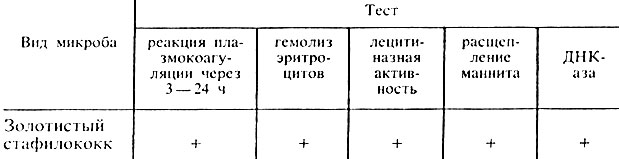
Таблица 24. Свойства золотистого стафилококка
Примечание. + положительная реакция.
Наличие перечисленных признаков позволяет отдифференцировать золотистые стафилококки от стафилококков других видов и дать окончательный ответ: выделен S. aureus (рис. 37).
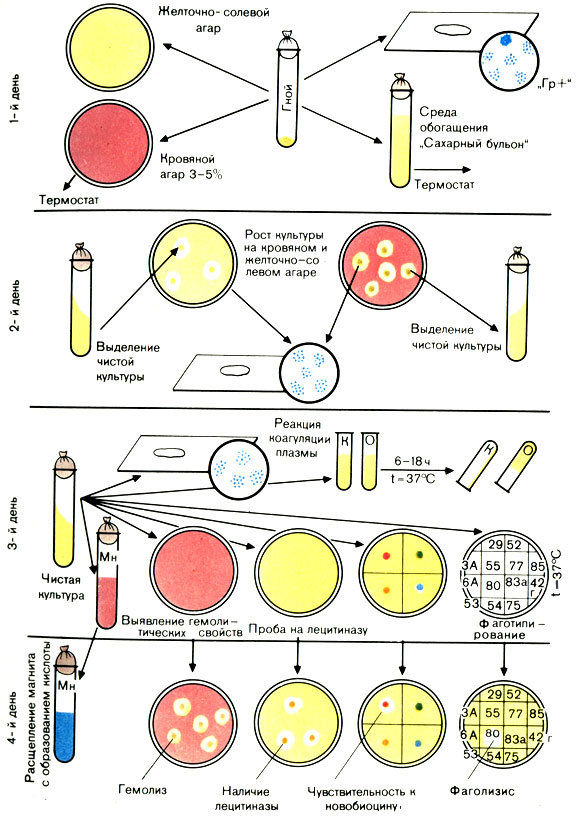
Рис. 37. Схема выделения и идентификации стафилококка
Для установления эпидемиологической цепочки выделенную культуру фаготипируют. Фаготипирование может подтвердить идентичность стафилококков, выделенных от разных больных и из объектов внешней среды.
Для фаготипирования используют критические тест-разведения фагов. Критическим тест-разведением называют то максимальное разведение фагов, при котором происходит полусливной лизис соответствующего штамма стафилококка.
Методика фаготипирования. В чашку Петри наливают 20 мл 1,5% МПА, дают ему застыть и подсушивают в термостате в течение 30-40 мин. На поверхность агара наносят 1 мл 4-6-часовой культуры выделенного стафилококка, распределяют по поверхности всей чашки, избыток жидкости отсасывают или дают ей испариться в термостате в открытой чашке. Предварительно дно чашки делят на секторы или квадраты. Число квадратов или секторов должно соответствовать количеству используемых фагов. Затем на каждый квадрат или сектор наносят один фаг.
Чашки ставят в термостат при температуре 37° С. Результаты определяют через 6-7 ч. Если чашки оставляют при комнатной температуре, то учет фаголизиса производят через 18-24 ч.
Биологические пробы. Проба на определение летальных свойств культуры. Для выявления летального действия токсина кролику вводят внутривенно (или внутрибрюшинно) фильтрат бульонной культуры стафилококка из расчета 0,1-0,2 мл фильтрата на 1 кг массы кролика. Гибель кролика через 3-4 дня свидетельствует о наличии летального действия токсина.
Дермонекротическая проба. Пробу ставят на кролике (наиболее чувствительному к этому токсину животному). Предварительно на боку или на спине животного выщипывают шерсть и вводят внутрикожно 0,2 мл двухмиллиардной взвеси стафилококковой культуры в изотоническом растворе натрия хлорида. При наличии в выделенной культуре некротических свойств в месте введения образуется инфильтрат, сопровождающийся некрозом.
Реакцию учитывают через 24-18 ч.
Полученную культуру стафилококка проверяют на чувствительность к антибиотикам методом бумажных дисков (см. главу 9).
1. Какой материал исследуют при заболеваниях, вызываемых стафилококками?
2. Каковы основные методы лабораторного исследования для выявления стафилококков?
3. Какова методика постановки реакции плазмокоагуляции?
4. На какой среде выявляют гемолитические свойства стафилококков?
5. С какой целью проводят фаготипирование?
Проверьте, к какому антибиотику чувствительна выделенная культура стафилококка.
Желточно-солевой агар Чистовича. Готовят желточную смесь (1 желток куриного яйца на 150 мл стерильного изотонического раствора натрия хлорида). К мясопептонному солевому агару (8-10% натрия хлорида), растопленному и остуженному до 45° С, добавляют 20% желточной взвеси (соблюдают стерильность) и разливают в чашки.
Агар с кровью. См. главу 7.
Солевой бульон, солевой агар. Готовят как обычные среды - МПБ и МПА, только натрия хлорид вносят в большем количестве (8-10%). Бульон разливают в колбы, пробирки, агар - в чашки.
Роды: Staphylococcys (типовой),
Род Staphylococcys включает около 30 видов. Доминируют 3 вида:
Морфология и биологические свойства
Staphyle— виноградная гроздь. Шарообразной формы, диаметр 0,6-1 мкм, неподвижный, спор не имеет, капсула формируется лишь в условиях организма (индуцибельный фактор). Хорошо окрашиваются анилиновыми красителями, грамположительны.
Хемоорганотроф, по типу дыхания — факультативный анаэроб, не прихотлив к питательным средам и условиям культивирования. Растет на простых питательных средах: МПБ — диффузное помутнение, МПА — колонии диаметром 2-4 мм, пигментированные (золотистого, лимонно-желтого или белого цвета). Пигмент — каротиноид, не растворим в воде, растворим в спирту, бензине, хлороформе. Синтезируется лучше на свету, при комнатной температуре, дополнительной аэрации на плотных питательных средах с молоком, картофелем или глицерином.
Пигментообразование: у S. aureus пигмент золотистый, у S. saprophyticus — лимонно-желтый, S. epidermidis — лимонно-желтый или белый.
Температурный диапазон роста 6-46° С, оптимальная 35-37°С, рН 4,2-9,3, оптимум 7,2.
Галотолерантный(устойчив к высоким концентрациям солей), большинство штаммов растет в присутствии 15% NaCl, сахарозы — до 40%, желчных кислот — до 40%.
Питательные среды для культивирования стафилококков:
2. Кровяной МПА с 5% бараньих или кроличьих эритроцитов — альфа-гемолиз;
3. Солевой МПБ — накопительная среда ( МПБ+ 7-10 % NaCl);
4. Желточно-солевой агар (ЖСА) — дополнительно содержит суспензию желтка куриного яйца (для определения лецитовителазы).
Семейство Micrococcaceae оксидаза(-), каталаза(+) — признак дифференциации от семейства Streptococcaceae; последнее оксидаза(-), каталаза(-).
Сахаролитические гидролазы: лактоза, глюкоза, маннит, мальтоза, сахароза — ферментация до кислоты без газа.
Примечание: стафилококк глюкозу и маннит ферментирует как в аэробных, так и в анаэробных условиях (отличие от стрептококка); NH3+, H2S-, индол +, восстанавливает нитраты в нитриты, разжижает желатин воронкообразно.
Липолитические ферменты: фосфотаза, лецитовителаза.
Факторы вирулентности стафилококков
1. Структурные компоненты: микрокапсула, компоненты клеточной стенки — протеин А, тейхоевые кислоты, пептидогликан.
2. Ферменты агрессии: плазмокоагулаза, лецитиназа, гиалуронидаза, муромидаза, фибринолизин и др.
3. Токсины: гемолизины, лейкоцидин, эксфолиативный токсин, токсин синдрома токсического шока, энтеротоксин.
Возникновение пищевых отравлений стафилококковой природы связано с действием термостабильных энтеротоксинов (100°С — 30 мин.), продуцируемых золотистыми стафилококками.
Экология и распространение
Стафилококки являются представителями микрофлоры кожи, слизистых полости рта, носоглотки, кишечника. Они постоянно выделяются из организма человека и могут быть обнаружены на предметах обихода, в воде, воздухе, почве. Особую опасность представляет S. aureus как потенциально патогенный для человека микроорганизм.
Источник стафилококковой инфекции: больной человек, носитель.
Механизмы и пути передачи: воздушно-капельный, контактный, алиментарный, инъекционный.
Стафилококки способны поражать практически все ткани организма и вызывать гнойно-воспалительные процессы различной локализации, раневую инфекцию, пищевые интоксикации.
При генерализации местных процессов возникает сепсис, септицемия (септикопиемия).
S. aureus может быть возбудителем внутрибольничных инфекций.
Исследуемый материал: гной, слизь, мокрота, кровь, моча, ликвор и др.
I. Бактериоскопический метод.
Микроскопия мазков, окрашенных по Граму — грамположительные кокки, в виде виноградных гроздей.
II. Бактериологический метод.
1. Посев на солевой бульон (среда накопления).
2. Посев на кровяной МПА — золотистые колонии с зоной α-гемолиза; ЖСА — колонии с радужным ореолом (положительная проба на лецитовиттеллазу).
3. Откол подозрительных колоний на косячок МПА с целью выделения чистой культуры.
4. Проверка чистоты выделенной культуры — микроскопия мазков, окрашенных по Граму (однородная популяция грамположительных гроздевидных кокков).
5. Постановка диагностических тестов: оксидаза (-), каталаза (+) — семейство Micrococcaceae; аэробное и анаэробное сбраживание глюкозы — род Staphylococcus; реакция на плазмокоагулазу (+/-), лецитовиттеллазу (+) — только у S. aureus.
6. Дифференцировка видов
Дифференцировка видов стафилоккоков
| Признак | виды | ||
| S. aureus | S. epidermidis | S. saprophyticus | |
| Плазмокоагулаза | + | - | - |
| Анаэробное сбраживание маннита | + | - | - |
| Окисление маннита | + | - | + |
| Чувствительность к новобиоцину | чувств. | нет | нет |
7. Внутривидовая дифференцировка. Определение антибиотикограммы и фаготипирование.
Иммунитет.Антимикробный, антитоксический, ненапряженный, непродолжительный, связан как с клеточными, так и гуморальными факторами.
Специфическая профилактика и терапия.Профилактика стафилоккоковых инфекций направлена на выявление микробоносителей золотистых стафилоккоков, главным образом, среди персонала хирургических отделений больниц и родовспомогательных учреждений и их санации. Для профилактики стафилоккоковых осложнений проводят активную иммунизацию стафилоккоковым анатоксином больных, накануне плановых хирургических операций, или беременных в конце беременности.
Для специфической терапии септических инфекци используют донорский антистафилоккоковый иммуноглобулин или антистафилоккоковую плазму.
При хронических инфекциях применяют стафилоккоковый анатоксин и/или стафилоккоковую аутовакцину с целью создания антитоксического и антимикробного иммунета.
Антибиотикотерапия стафилоккоковых инфекций проводится под контролем антибиотикограммы.
| | | следующая лекция ==> | |
| ОСНОВНЫЕ ВОЗБУДИТЕЛИ ГСИ | | | СТРЕПТОКОККИ |
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
3.22. Методы определения Staphylococcus aureus
Средства контроля и вспомогательные устройства. Аппаратура, материалы, реактивы по ГОСТ 9225 со следующими дополнениями:
Питательные среды. Гидролизованное и стерильное обезжиренное молоко по ГОСТ 10444.11.
Желточную эмульсию готовят следующим образом. Свежее куриное яйцо моют водопроводной водой, затем протирают ваткой, смоченной в спирте, и обсушивают. Отделяют желток и вносят его в 100 см 3 стерильного раствора хлористого натрия по ГОСТ 9225. Тщательно перемешивают. Приготовленная эмульсия может храниться при температуре 0–5 °С не более 72 ч.
Солевой бульон (допускается применение солевого бульона, который готовится согласно указанию на этикетке). Состав: натрий хлористый (NaCl) – 7,5 г; питательный сухой бульон – 1,5 г (или гидролизованное молоко – 100 см 3 ).
Приготовление: в 100 см 3 дистиллированной воды вносят 1,5 г сухого питательного бульона, кипятят 1–2 мин, фильтруют через ватный тампон, добавляют 7,5 г NaCl, устанавливают рН (6,9 ± 0,1).
Разливают в пробирки или колбы и стерилизуют при температуре (121 ± 1) °С в течение(10 ± 1) мин.
Или к 100 см 3 гидролизованного молока добавляют 7,5 г NaCl, устанавливают рН (6,9 ± 0,1), разливают и стерилизуют, как указано выше.
Желточно-солевой агар [1] . Состав: питательный агар [2] для культивирования микроорганизмов (на основе гидролизата кильки) – 35 г или питательный агар II 8 (на основе гидролизата кормовых дрожжей) 24 г; натрий хлористый (NaCl) – 75 г; эмульсия желточная – 50,0 см 3 ; вода дистиллированная – 1 дм 3 .
Приготовление: в 1 дм 3 дистиллированной воды вносят 36 г питательного агара для культивирования микроорганизмов или 24 г питательного агара сухого II, добавляют 75 г хлористого натрия (NaCl), кипятят до полного расплавления агара, фильтруют через ватный тампон, разливают во флаконы или колбы и стерилизуют при температуре (121 ± 1) °С в течение (20 ± 1) мин. После стерилизации охлаждают до температуры (45 ± 1) °С и добавляют 50 см 3 предварительно подготовленной желточной эмульсии. Смесь тщательно перемешивают и разливают в чашки Петри. Чашки со средой хранят в холодильнике не более 5 сут.
Молочно-солевой агар [3] . Состав: питательный агар [4] для культивирования микроорганизмов (на основе гидролизата кильки) – 35 г; или питательный агар II 10 (на основе гидролизата кормовых дрожжей) – 24,0 г; натрий хлористый (NaCl) – 75,0 г; молоко обезжиренное – 100 см 3 ; вода дистиллированная – 1 дм 3 .
Приготовление: среду готовят, как указано выше, но после охлаждения до температуры (45 ± 1) °С добавляют вместо желточной эмульсии 100 см 3 стерильного обезжиренного молока. Смесь тщательно перемешивают и разливают в чашки Петри. Чашки со средой хранят в холодильнике не более 5 сут.
Агар Байрд-Паркера. Среда готовится согласно указанию на этикетке. Состав. Основа среды: триптон – 10,0 г; дрожжевой экстракт – 1,0 г; мясной экстракт – 5,0 г; литий хлористый гексагидрат – 5,0 г; агар – 12,0–20,0 г; вода дистиллированная – 1 дм 3 .
Раствор пирувата натрия: пируват натрия – 20,0 г; вода дистиллированная –100 см 3 .
Раствор глицина: глицин – 20,0 г; вода дистиллированная – 100,0 см 3 .
Приготовление основы среды: в 1 дм 3 дистиллированной воды вносят 10 г триптона, 5 г мясного экстракта, 1 г дрожжевого экстракта, 5 г хлористого лития, 20 г агара.
При отсутствии мясного экстракта, триптона и дрожжевого экстракта вместо дистиллированной воды применяют 1 дм 3 мясопептонного бульона или питательный агар для культивирования микроорганизмов сухой или питательный агар сухой II.
Все компоненты, внесенные в 1 дм 3 дистиллированной воды (мясопептонный бульон), нагревают и перемешивают до полного растворения, охлаждают до температуры 50–60 °С. Устанавливают рН (7,2 ± 0,1), разливают в колбы или бутылки по 90 см 3 и стерилизуют при температуре (121 ± 1) °С в течение (20 ± 1) мин.
При использовании сухой среды в 1 дм 3 дистиллированной воды вносят 36 г питательного агара для культивирования микроорганизмов или 24 г питательного агара сухого II, добавляют 5 г хлористого лития. Нагревают до полного растворения, охлаждают до температуры 50–60 °С, устанавливают рН (7,2 ± 0,1), разливают и стерилизуют как указано выше.
Готовую основу среды хранят не более 30 сут при температуре (6 ± 2) °С.
Перед использованием к 90 см 3 расплавленной основы среды добавляют асептически стерилизованные фильтрованием через мембранный фильтр растворы: 6,3 см 3 раствора глицина, 5 см 3 раствора пирувата натрия; 1 см 3 раствора теллурита калия; 5 см 3 желточной эмульсии.
Допускается растворы глицина, пирувата натрия, теллурита калия и желточную эмульсию готовить в асептических условиях на стерильной дистиллированной воде.
После тщательного перемешивания приготовленную среду разливают в чашки Петри. Чашки со средой можно хранить не более 48 ч.
Порядок подготовки к проведению контроля. Приготовление растворов и реактивов . Раствор плазмы кроличьей цитратной готовится согласно инструкции по применению плазмы, прилагаемой к упаковке.
Растворы и реактивы для окраски препаратов готовят по ГОСТ 9225.
Приготовление реактивов для окраски по Грaму . Приготовление реактива 1: в 100 см 3 этилового спирта растворяют 0,5 г кристаллического фиолетового.
Приготовление реактива 2: к 96 см 3 спиртового раствора йодистого калия массовой концентрацией 5 г/дм 3 добавляют 2 см 3 спиртового раствора основного фуксина массовой концентрацией 50 г/дм 3 и 2 см 3 спиртового раствора йода массовой концентрацией 50 г/дм 3 .
Йодистый калий растворяют в спирте на водяной бане при температуре (45 ± 5) °С при постоянном помешивании.
Отбор и подготовка проб по ГОСТ 9225.
Метод определения количества Staphylococcus aureus с предварительным обогащением
Подготовка и проведение контроля. Из навески продукта готовят ряд десятикратных разведений по ГОСТ 9225 так, чтобы можно было определить наличие или отсутствие Staphylococcus aureus в определенной массе (объеме), указанной в нормативном документе на конкретный продукт.
Навеску продукта или его разведения засевают по 1 см 3 в пробирки или колбы с солевым бульоном.
Соотношение между количеством высеваемого продукта или его эквивалентным разведенной питательной средой 1:10.
Пробирки и колбочки с посевами выдерживают в термостате при температуре (37 ± 1) °С в течение 24 ч.
Для подтверждения принадлежности микроорганизмов, выросших на солевом бульоне, к Staphylococcus aureus делают пересев петлей из бульона для получения изолированных колоний или на чашки Петри с подсушенными средами типа Байрд-Паркера, желточно-солевой агар или молочно-солевой агар.
Чашки с посевами выдерживают в термостате при температуре (37 ± 1) °С в течение 24-48 часов.
После термостатирования посевы просматривают и отмечают рост характерных колоний.
На желточно-солевом агаре колонии Staphylococcus aureus имеют форму плоских дисков диаметром 2–4 мм белого, желтого, кремового, лимонного, золотистого цвета с ровными краями; вокруг колоний образуется радужное кольцо и зона помутнения среды.
На молочно-солевом агаре колонии Staphylococcus aureus растут в виде непрозрачных круглых колоний, окрашенных от белого до оранжевого цвета, диаметром 2–4 мм, слегка выпуклых.
На среде Байрд-Паркера колонии Staphylococcus aureus растут в виде черных, блестящих, выпуклых колоний диаметром 1–1,5 мм, окруженных зоной просветления среды шириной 1–3 мм.
С каждой чашки Петри отбирают не менее пяти характерных колоний и пересеивают на поверхность скошенного питательного агара, 1 см желточно-солевого агара, но без добавления хлористого натрия и желточной эмульсии.
Посевы выдерживают в термостате при температуре (37 ± 1) °С в течение 24 часов.
У выросших колоний определяют отношение к окраске по Граму и коагулированию плазмы кролика.
Из пяти изолированных, характерных для Staphylococcus aureus, колоний делают препараты, окрашивают по Граму и микроскопируют.
Для приготовления препарата на чистое и охлажденное после фламбирования предметное стекло наносят петлей каплю дистиллированной воды, в которую вносят петлей небольшое количество агаровой культуры, не размешивая в воде. Затем вносят петлей каплю реактива 1, для окраски по Граму.
Смесь распределяют на участке примерно 1 см 2 , просушивают при температуре (20 ± 2) °С, фиксируют, медленно пронося предметное стекло над пламенем горелки. На одном стекле можно готовить по шесть-восемь мазков, отделяя их один от другого линиями, проведенными с лицевой стороны стекла.
Препарат ополаскивают водой и тщательно просушивают фильтровальной бумагой.
После просушивания на препарат наносят с избытком реактив 2 для окрашивания по Граму так, чтобы жидкость покрыла всю поверхность стекла. Продолжительность окрашивания 0,5–1 мин. После окрашивания препарат быстро ополаскивают проточной водой, направляя струю под углом на стекло, помещенное вертикально. Препарат просушивают фильтровальной бумагой и просматривают под микроскопом с иммерсионной системой. Микробы, красящиеся по Граму, будут темно-фиолетового цвета, не красящиеся по Граму – красного цвета.
Стафилококки окрашиваются по Граму положительно (темно-фиолетового цвета), имеют шарообразную форму и располагаются скоплениями, чаще всего напоминающими гроздья винограда.
Постановка реакции плазмокоагуляции. В пробирку с 0,5 см 3 разведенной кроличьей плазмы вносят петлю суточной агаровой культуры. Внесенную культуру тщательно размешивают. Одну пробирку с плазмой оставляют незасеянной, в другую засеивают контрольный штамм Staphylococcus aureus (коагулазоположительный стафилококк).
Пробирки помещают в термостат и выдерживают при температуре (37 ± 1) °С в течение 3–6 ч. Если через 6 ч коагуляции плазмы не произошло, то оставляют эти пробирки до 24 ч. Если через 24 ч плазма не свернулась, то испытуемую культуру стафилококка относят к коагулазоотрицательной.
При определении коагулазной активности реакцию считают отрицательной в тех случаях, когда в плазме не образуются отдельные нити или сгустки, или в тех случаях, когда в плазме появились отдельные нити (реакцию плазмокоагуляции оценивают на один плюс).
Реакцию считают положительной, если:
+++ – сгусток, имеющий небольшой отсек;
++ – сгусток в виде взвешенного мешочка.
Все три варианта являются положительным результатом.
При получении положительной реакции считают, что в посевах обнаружен Staphylococcus aureus.
Обработка результатов контроля. Результаты оценивают по каждой пробе отдельно.
Оформление результатов контроля. Морфологические, культуральные свойства и положительная реакция плазмокоагуляции свидетельствуют о присутствии коагулазоположительных стафилококков в засеянной массе продукта.
Метод определения количества Staphylococcus aureus без предварительного обогащения
После термостатирования подсчитывают количество характерных колоний на каждой чашке Петри (желточно-солевой агар, молочно-солевой агар и агар Байрд-Паркера, см. предыдущий метод). С каждой чашки Петри отбирают не менее пяти характерных и/или подозрительных колоний Staphylococcus aureus, а в случае роста менее пяти – все колонии, характерные для Staphylococcus aureus, и пересевают на поверхность скошенного питательного агара, разлитого в пробирки (см. желточно-солевой агар), но без добавления хлористого натрия и желточной эмульсии. Пробирки с посевами выдерживают в термостате при температуре (37 ± 1) °С в течение 24 ч.
У выросших культур определяют отношение к окраске по Граму и коагулированию плазмы кролика как в предыдущем методе.
Обработка результатов контроля. Результаты оценивают по каждой пробе отдельно.
Оформление результатов контроля. Количество колоний Staphylococcus aureus в 1 г или 1 см 3 после определения его в определенной навеске продукта вычисляют по формуле:
где Σn1, Σn2 – количество колоний, выросших на всех чашках Петри в пределах одного разведения или засеянного объема; n – число десятикратных разведений.
Пример. Подсчитываем количество колоний Staphylococcus aureus, выросших на трех засеянных чашках при посевах продукта или его разведений:
| 1 г или 1 см 3 продукта: | 84 | 96 | 72 |
| 10 -1 разведение: | 9 | 10 | 7 |
| 10 -1 разведение: | 84 | 96 | 72 |
| 10 -2 разведение: | 99 | 10 | 7 |
[1] Допускается использовать солевой агар, который готовится согласно указанию на этикетке и к которому после стерилизации добавляется желточная эмульсия или обезжиренное молоко.
[2] При изменении заводом-изготовителем количества вносимой среды на 1 дм 3 дистиллированной воды, количество среды вносится согласно указанию на этикетке.
[3] Допускается использовать солевой агар, который готовится согласно указанию на этикетке и к которому после стерилизации добавляется желточная эмульсия или обезжиренное молоко.
[4] При изменении заводом-изготовителем количества вносимой среды на 1 дм 3 дистиллированной воды, количество среды вносится согласно указанию на этикетке.
Читайте также:





