Особенности иммунитета при протозойных инфекциях
Механизм образования противоинфекционного иммунитета ничем не отличается от развития иммунного ответа при введении других чужеродных антигенов (веществ). Тем не менее имеются некоторые различия, обусловленные особенностями конкретных возбудителей. Ворота инфекции и особенности возбудителя определяют, какой преимущественно будет форма иммунного ответа - гуморальная или клеточная.
Особенности иммунитета при бактериальных инфекциях. Патогенные микроорганизмы, размножающиеся в макроорганизмевнеклеточно, как правило, обусловливают гуморальный иммунитет. При этом вначале появляются антитела, относящиеся к иммуноглобулину М, а спустя несколько дней иммуноглобулины классов G и А. Антитела связываются с бактериальной клеткой и в присутствии комплемента обусловливают цитотоксическую реакцию, т. е. вызывают бактериолиз. Кроме того, антитела нейтрализуют токсины, вырабатываемые бактериями, а также опсонируют бактерии и тем самым способствуют усилению фагоцитарной активности. Важно отметить, что при остром течении инфекционного процесса выработка антител в организме запаздывает, в результате чего наступает гибель животного. Вот почему так важно при таких инфекционных заболеваниях как можно раньше ввести животному специфическую иммунную сыворотку (рожа свиней, столбняк и др.).
В том случае, когда патогенные микроорганизмы при попадании в организм размножаются внутриклеточно, то, как правило, они уничтожаются реакциями клеточного иммунитета (Т-киллерами, активизированными макрофагами). Клеточный иммунитет имеет особое значение, когда наблюдается незавершенный фагоцитоз бактерий. В этом случае возникает необходимость уничтожения фагоцитов, в которых находятся микробы. Уничтожают зараженные фагоциты сенсибилизированные Т-киллеры. Одновременно они выделяют лимфокины, которые активизируют в очаге воспаления макрофаги, последние приобретают способность уничтожать микробы. При многих бактериальных инфекциях, особенно с хроническим течением, формируется ГЗТ, где главную защитную роль выполняют сенсибилизированные Т-лимфоциты (Тгат) и лимфокины. При многих заболеваниях, обусловленных микроскопическими
грибами (аспергиллез, трихофития), формируется преимущественно клеточный иммунитет, что подтверждается развитием ГЗТ при многих болезнях. Такие грибные заболевания характеризуются длительным хроническим течением с периодическими обострениями, без склонности к самопроизвольному излечению.
Особенности иммунитета при вирусных инфекциях. Иммунитет при вирусных инфекциях обеспечивается антителами и сенсибилизированными Т-лимфоцитами. Вирусы, распространяющиеся гематогенно, могут быть обезврежены и удалены механизмами гуморального иммунитета. К группе защитных антител принадлежат только вируснейтрализующие антитела, подавляющие способность вирусов к репродукции благодаря блокированию первых этапов взаимодействия вируса с чувствительными клетками (адсорбция и проникновение). Эти антитела нейтрализуют и токсические свойства вируса. Стабильность комплекса вирус - антитело зависит от различий чувствительности вируса к антителам, авидности их, температуры и времени контакта и др. Часто соединение вируса с антителами носит обратимый характер, т. е. вирус после контакта с антителом сохраняет свои биологические свойства. Антитела не оказывают влияния на вирус, находящийся внутри зараженной клетки. В этом случае в организме на вирусы, находящиеся в зараженной клетке, образуются цитотоксические Т-лимфоциты, способные лизировать только клетки, зараженные вирусом. Следовательно, из-за внутриклеточного размножения вирусов особая роль принадлежит клеточному иммунитету. На роль механизмов клеточного иммунитета в защите от вирусных инфекций указывает и тот факт, что при большинстве вирусных инфекций возникает ГЗТ. Кроме сенсибилизированных Т-лимфоцитов при внедрении вируса в клетку включаются К-киллеры и природные киллеры, особенно при вирусных болезнях, отличающихся коротким инкубационным периодом (грипп, парагрипп).
Существуют вирусы, которые, несмотря на иммунный ответ, пожизненно персистируют в организме хозяина (вирус ИНАН, простого герпеса и др.). Они могут интегрироваться в геном клетки хозяина без проявления клинических симптомов.
Особенности иммунитета при протозойных и глистных заболеваниях. Для возбудителей протозойных заболеваний характерно исключительное разнообразие антигенного состава. Более того, большинство этих возбудителей имеет сложный жизненный цикл, что еще более затрудняет иммунологическую защиту. Установлено, что простейшие оказывают иммунодепрессивное действие в организме. При ряде протозойных болезней отмечают проявление аллергических реакций.
В последние годы появились сообщения об успешном применении культуральнои вакцины против тейлериоза крупного рогатого скота. В ряде птицеводческих бройлерных хозяйств применяют аттенуи-рованную вакцину против кокцидиоза (эймериоза) цыплят Глистные инвазии (аскаридоз, трихинеллез и др.) проявляются прежде всего стимуляцией синтеза иммуноглобулинов класса Е. На месте внедрения паразита часто находят инфильтрат, состоящий из эозинофилов, базофилов и тучных клеток. Однако в целом вопросы иммунного ответа как при протозойных, так и глистных заболеваниях еще слабо изучены.
Контрольные вопросы
1. Что такое аллергия?
2. Назовите механизмы развития ГНТ и ГЗТ.
3. Что такое анафилаксия?
5. Каковы стадии развития аллергических реакций?
6. Какие аутоиммунные заболевания вы знаете?
7. Приведите примеры заболеваний, обусловленных иммунными комплексами.
8. Какими факторами обусловливается недостаточность иммунной системы?
9. В чем особенности иммунной защиты при бактериальных и вирусных болезнях?
Как и при всех других инфекциях, при болезнях, вызываемых простейшими (Protozoa), инфекционный процесс и развивающийся по ходу его приобретенный иммунитет формируются на основе взаимоотношений хозяина и паразита.
Судьба возбудителя инфекции, проникающего в организм животного или человека, в первую очередь зависит от иммунологического состояния хозяина, которое Ш. Д. Мошковский характеризует как совокупность свойств макроорганизма, определяющих его взаимоотношения с данным возбудителем. Состояние организма хозяина до встречи с антигенами возбудителя (а также с антигенами неживой природы) обозначается Ш. Д. Мошковским как первичное, после встречи — как вторичное иммунологическое. Принципиальное различие между обоими формами иммунологического состояния заключается в том, что при вторичном иммунологическом состоянии к комплексу неспецифических факторов защиты присоединяются факторы специфической защиты — антитела.
Естественный иммунитет. При протозойных инфекциях естественный иммунитет, так же как при инфекциях другой этиологии, может быть абсолютным и относительным.
Абсолютный иммунитет обусловлен полным несоответствием условий в организме хозяина для развития и размножения возбудителей инфекции.
Относительный иммунитет выражается в большей или меньшей способности организма преодолевать инфекцию. Эта способность, как и при инфекциях, вызываемых возбудителями другой природы, может зависеть от ряда условий.
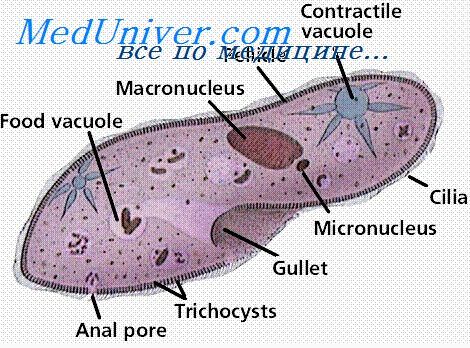
Одним из важнейших факторов, определяющих напряженность относительного иммунитета, является возраст. При ряде протозойных инфекций резистентность организма хозяина с возрастом значительно меняется. Некоторые инфекции у детей и молодых животных протекают тяжело, часто со смертельным исходом, в то время как у взрослых наблюдается более легкое, иногда бессимптомное течение. Примером может служить американский трипаносомоз (болезнь Шагаса). Инфекция Plasmodium berghei, смертельная для молодых крысят, у большинства взрослых крыс протекает доброкачественно.
При некоторых инфекциях наблюдаются обратные отношения. Так, например, при бабезиозе (Meitz, 1956) жеребята, ягнята, козлята, поросята до 3-месячного возраста проявляют высокую степень резистентности к соответствующим видам бабезий. Щенята, наоборот, очень чувствительны к этой инфекции. Предполагается, что эти различия обусловлены разной быстротой обратного развития тимуса, которому в последнее время приписывается значительная роль в формировании иммунитета. У щенят атрофия зобной железы наступает через несколько дней после рождения, у других животных — через несколько месяцев.
Большая роль в иммунитете к протозойным инфекциям принадлежит селезенке. Skrabolo и Deanovic (1957) описали у человека с удаленной селезенкой тяжелый пироплазмоз со смертельным исходом, вызванный Babesia bovis. Лица, не лишенные этого органа, к пироплазмозу невосприимчивы. Garnham и Вгау (1959) и Вгау и Garnham (1961) наблюдали тяжелую инфекцию Babesia divergans у шимпанзе только после спленэктомни. Хорошо изучена роль селезенки при малярии — экстирпация этого органа у людей, а также у обезьян в латентной (после серии первичных приступов) фазе инфекции приводит к развитию тяжелого, часто смертельного рецидива.
Известна различная степень восприимчивости у разных пород животных одного вида к одному и тому же возбудителю: у крупного рогатого скота породы зебу высокая чувствительность к Trypanosoma vivax и значительно меньшая у карликовой породы рогатого скота — ндама. Беспородные белые мыши, а также мыши разных линий высоко чувствительны к Plasmodium berghei, вызывающему у них острую смертельную инфекцию. Но у одной породы мышей — NMRI, наблюдается выраженная резистентность к данному паразиту — инфекция протекает легко и заканчивается выздоровлением (Kretschmar, 1962).
Простейшие, как и возбудители других инфекций и инвазий, для своего нормального развития и размножения в организме зараженного хозяина нуждаются в витаминах и других веществах, исключение которых из раниона больного или животного способствует более легкому течению и даже выздоровлению. Taк Maegraith и др., Hawking (1953, 1954) в опытах с Р. bеrghei показали, что у зараженных крыс, содержавшихся исключительно на маточной диете, инфекция не развивается. При добавлении парааминобензойной кислоты инфекция у крыс развивалась нормально. То же установлено и при некоторых формах малярии обезьян — P. knowlesi (Singh и др., 1953), P. cynomolgi (Вгау и Garnham, 1953; Hawking, 1954).
Некоторые виды малярийных паразитов нуждаются в пантотеноновой, фолиевой кислоте, метнонине и др. Для трипаносом необходима пантотеновая кислота.
Питание влияет на взаимоотношения хозяина и паразита и через организм хозяина, усиливая или ослабляя его сопротивляемость.
Невосприимчивость животных к возбудителям протозойных болезней является следствием естественного (врожденного) или приобретенного иммунитета.
Естественный иммунитет обусловлен врожденными биологическими особенностями организма животных, он является, как правило, видовым признаком хозяина. Способность организма животного противостоять патогенному воздействию возбудителя проявляется в зависимости от его возраста, породы, состояния естественной резистентности и условий, в которых находится животное (кормление, содержание и температура окружающей среды).
Естественный иммунитет к возбудителям может быть абсолютным или относительным. Абсолютный иммунитет наблюдают в тем случае, если при всех условиях снижения резистентности организм зевается невосприимчивым к возбудителям. Например, лошади не заражаются возбудителем тейлериоза крупного рогатого скота. Следовательно, у лошадей имеется абсолютный иммунитет к возбудителю тейлериоза крупного рогатого скота. Относительный иммунитет у животного проявляется в том случае, если возможно преодолеть его естественную резистентность и вызвать заражение. Так, взрослые мыши невосприимчивы к пироплазмам лошадей и собак, а новорожденные мыши заражаются указанными возбудителями. Таким образом, мыши имеют относительный естественный иммунитет к пироплазмидам животных.
Возможно, что абсолютная невосприимчивость к возбудителям протозойных болезней у многих видов животных может быть преодолена применением соответствующих методов и средств, снижающих естественную резистентность.
Приобретенный иммунитет к возбудителям протозойных болезней в зависимости от их вида может быть стерильным и нестерильным. Нестерильный иммунитет называют премуницией. С исчезновением возбудителя из организма кончается и премуниция.
Приобретенный иммунитет к протозойным болезням у животных обусловлен клеточным и гуморальным факторами, тесно связанными между собой. Фагоцитирующие клетки имеют значение в механизме усвоения антигенов и образования антител. В то же время образующиеся специфические антитела повышают фагоцитоз.
Организм, находящийся в утробе матери, защищен от большинства патогенных простейших, поскольку паразиты не могут пройти через неповрежденный плацентарный барьер, если даже животное больное или является паразитоносителем. Не проникают через плаценту и антитела, (последние попадают в плод у собак и овец). У новорожденных неспецифические защитные гуморальные факторы, как правило, отсутствуют, так как глобулины в постэмбриональный период еще не вырабатываются или же поступают в кровь в очень незначительном количестве. В организме иммуноглобулины начинают вырабатываться с 4-недельного возраста. Но в то же время в постэмбриональный период у животных резко выражена фагоцитарная способность. В этот период в защите молодого организма от возбудителей протозойных болезней принимают участие фагоциты и антитела, поступающие вместе с молозивом и молоком матери. Степень этой защиты у различных видов животных выражена по-разному. Например, у щенят очень высокая чувствительность к заражению их пироплазмами, а у телят повышенная устойчивость к бабезиидам по сравнению со взрослыми. У птиц в раннем возрасте гуморальные факторы защиты от возбудителей инвазии выражены незначительно, а фагоцитоз проявляется активно.
В защите животных от возбудителей протозойных заболеваний большое значение имеет клеточная система организма. Это подтверждается следующим опытом: если у животного-паразитоносителя удалить селезенку (основное депо фагоцитов), то у пего возникает рецидив данной болезни, которая излечивается уже с большим трудом. В процессе стимуляции защитных механизмов инвазированного организма принимают участие и гормоны, которые стимулируют или угнетают образование лимфоцитов. Все процессы выработки антител регулируются гипоталамо-гипофизо-адренокортиковой системой организма.
В возникновении гуморальных реакций иммунитета на антиген у животных при протозойных болезнях имеется полная аналогия в образовании антител при инфицировании их бактериями и вирусами. При протозойных болезнях установлены специфические комплементсвязывающие антитела, агглютинины, преципитины и другие антитела. Наибольшее практическое значение и использование получила реакция связывания комплемента (РСК).
Участие указанных антител не равноценно в подавлении жизнедеятельности возбудителя. У животных с резко положительной РСК процесс может окончиться летально. Возможно, что комплементсвязывающие вещества не связаны с иммунологической резистентностью. Выработка антител производится плазматическими клетками. Большинство исследователей считают, что иммунные антитела — глобулины отличаются от нормальных только своей способностью специфически реагировать с антигеном. У животных, инвазированных трипаносомами, появляются специфические антитела — абластины, которые вызывают задержку развития молодых трипаносом.
До настоящего времени у животных, инвазированных патогенными простейшими, не выявлено такого количества антител, чтобы их можно было применять в качестве серотерапии и серопрофилактики. Кроме того, существование скрытого носительства возбудителей вирусных и других заболеваний ограничивает возможность использования сыворотки крови и крови переболевших животных для терапии и профилактики протозойных болезнен без соответствующего обезвреживания.
При протозойиых болезнях в результате мобилизации клеточных, гуморальных и гормональных систем инвазированный организм становится здоровым и приобретает стерильный или нестерильный иммунитет.
Стерильный иммунитет у млекопитающих животных выявлен против трипаносом и у птиц против боррелий.
Против большинства возбудителей протозойных заболеваний у животных возникает нестерильный иммунитет, который является лабильным. При понижении резистентности организма происходит активирование жизнедеятельности паразита и может возникнуть рецидив. Нестерильный иммунитет, предохраняя животных от последующего заражения, в ряде случаев служит источником рассеивания возбудителя в окружающую среду через испражнения при кишечных простейших или через переносчиков при трансмиссивных болезнях.
При различных протозойных болезнях длительность премуниции неодинакова. Ослабление напряженности ее зависит от снижения вирулентности паразита. Если возбудитель из организма исчезает, наступает автостерилизация, и некоторое время отмечают стерильный иммунитет. Последний вскоре теряется, а организм вновь становится неиммунным и восприимчивым к тому же возбудителю.
Иммунитет у животных при протозойных болезнях строго специфичен, иммунные тела вырабатываются только против того вида или штамма возбудителя, который вызвал заболевание. Более того, иммунтела могут быть различными в зависимости от стадии развития у одного и того же вида простейшего. Например, у тейлерий организм, инвазированный шизонтами, вырабатывает антитела, которые не проявляют своего действия против внутриэритроцитарных форм. Эта специфическая выраженность антител против различных фаз развития паразитов, возможно, зависит от степени выраженности заболевания (малой антигенной раздражимости организма).
Нестерильный иммунитет при большинстве протозойных болезней адекватен степени перенесенного заболевания. Иммунитет будет наиболее стойким и продолжительным, если животные переболевают тяжело.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Реакция макроорганизма на антигены достаточно однотипна, так как она ограничена набором факторов иммунной защиты и физиологическими возможностями самого макроорганизма. Однако в зависимости от природы антигена иммунная система не обязательно должна включать для его устранения весь имеющийся арсенал — в отношении конкретного антигена достаточно использовать лишь наиболее эффективные механизмы и факторы защиты. Поэтому при воздействии различных по природе и свойствам антигенов иммунное реагирование макроорганизма имеет свои особенности.
12.2.1. Особенности иммунитета при бактериальных инфекциях
Иммунная реакция макроорганизма в ответ на бактериальную инфекцию в значительной степени определяется факторами патогеннос-ти микроба и, в первую очередь, его способностью к токсинообразованию. Различают антибактериальный (против структурно-функциональных компонентов бактериальной клетки) и антитоксический (против белковых токсинов) иммунитет.
Основными факторами антибактериальной защиты в подавляющем большинстве случаев являются антитела и фагоциты. Антитела эффективно инактивируют биологически активные молекулы бактериальной клетки (токсины, ферменты агрессии и др.), маркируют их, запускают механизм антителозависимого бактериолиза и участвуют в иммунном фагоцитозе. Фагоциты осуществляют фагоцитоз, в том числе иммунный, внеклеточный киллинг патогена при помощи ион-радикалов и анти-телозависимый бактериолиз.
Ряд бактерий, относящихся к факультативным внутриклеточным паразитам, отличается повышенной устойчивостью к действию комплемента, лизоцима и фагоцитов (незавершенный фагоцитоз). К их числу относятся микобактерии, бруцеллы, сальмонеллы и некоторые другие. В отношении этих микробов антитела и фагоциты недостаточно эффективны, а сам инфекционный процесс имеет склонность к хроническому течению. В такой ситуации макроорганизм вынужден переключать нагрузку на клеточное звено иммунитета, что ведет к аллергизации организма по типу ГЗТ. Особое значение приобретают активированный макрофаг и естественный киллер, осуществляющие антителозависимую клеточно-опосредованную цитотоксичность, а также gadeТ-лимфоцит.
Кроме перечисленных, на внедрившиеся бактерии воздействует весь арсенал факторов неспецифической резистентности. Среди них важная роль в борьбе с грамположительными микробами принадлежит лизоциму и белкам острой фазы (С-реактивному и маннозосвя-зывающему протеинам).
Напряженность специфического антибактериального иммунитета оценивают в серологических тестах по титру или динамике титра специфических антител, а также состоянию клеточной иммунореактивности (например, по результатам кожно-аллергической пробы).
12.2.2. Особенности противовирусного иммунитета
Иммунная защита макроорганизма при вирусных инфекциях имеет особенности, обусловленные двумя формами существования вируса: внеклеточной и внутриклеточной.
Основными факторами, обеспечивающими противовирусный иммунитет, являются специфические антитела, Т-киллеры, естественные киллеры, интерферон и сывороточные ингибиторы вирусных частиц.
Специфические противовирусные антитела способны взаимодействовать только с внеклеточным вирусом, внутриклеточные структуры прижизненно для них недоступны. Антитела нейтрализуют вирусную частицу, препятствуя ее адсорбции на клетке-мишени, инфицированию и генерализации процесса, а также связывают вирусные белки и нуклеиновые кислоты, которые попадают в межклеточную среду и секреты после разрушения зараженных вирусами клеток. Образовавшиеся иммунные комплексы элиминируются путем иммунного фагоцитоза. Специфическое связывание антител с вирусными белками, экспрессированными на ЦПМ инфицированных клеток, индуцирует цитотоксическую активность естественных киллеров (см. гл. 11, разд. 11.3.1).
Клетки, инфицированные вирусом и приступившие к его репликации, экспрессиру-ют вирусные белки на цитоплазматической мембране в составе молекул антигенов гис-тосовместимости — МНС I класса (см. гл. 10, разд. 10.1.4.2). Это является сигналом для активации Т-киллеров, которые распознают зараженные вирусом клетки и уничтожают их (см. гл. 11, разд. 11.3.2).
Мощным противовирусным действием обладает интерферон (см. гл. 9, разд. 9.2.3.5). Он не действует непосредственно на внутриклеточный вирус, а связывается с рецептором на мембране клетки и индуцирует ферментные системы, подавляющие в ней все биосинтетические процессы.
Сывороточные ингибиторы неспецифически связываются с вирусной частицей и нейтрализуют ее, препятствуя тем самым адсорбции вируса на клетках-мишенях.
Напряженность противовирусного иммунитета оценивают-преимущественно в серологических тестах — по нарастанию титра специфических антител в парных сыворотках в процессе болезни. Иногда определяют концентрацию интерферона в сыворотке крови.
12.2.3. Особенности противогрибкового
Антигены грибов имеют относительно низкую иммуногенность: они практически не индуцируют антителообразование (титры специфических антител остаются низкими), но стимулируют клеточное звено иммунитета. Между тем, основными действующими факторами противогрибкового иммунитета являются активированные макрофаги, которые осуществляют антителозависимую клеточно-опосредованную цитотоксичность грибов.
При микозах наблюдается аллергизация макроорганизма. Кожные и глубокие микозы сопровождаются, как правило, ГЗТ. Грибковые поражения слизистых дыхательных и мочеполовых путей вызывают аллергизацию по типу ГНТ (реакция I типа). Напряженность противогрибкового иммунитета оценивается по результатам кожно-аллергических проб с грибковыми аллергенами.
12.2.4. Особенности иммунитета
при протозойных инвазиях
Противопаразитарный иммунитет изучен слабо. Известно, что паразитарная инвазия сопровождается формированием в макроорганизме гуморального и клеточного иммунитета. В крови определяются специфические антитела классов М и G, которые чаще всего не обладают протективным действием. Однако они активируют антителозависимую клеточно-опосредованную цитотоксичность с участием макрофагов, а в случае внутриклеточного паразитирования — естественных киллеров и gadeТ-лимфоцитов. Паразитарные инвазии сопровождаются аллергизацией макроорганизма — отмечается усиление ГЗТ на протозойные антигены.
Характер противопаразитарного иммунитета определяется структурно-функциональными особенностями паразита и его жизненного цикла при инвазии макроорганизма. Многие паразиты обладают высокой антигенной изменчивостью, что позволяет им избегать действия факторов иммунитета. Например, каждой стадии развития малярийного плазмодия соответствуют свои специфические антигены.
Напряженность противопаразитарного иммунитета оценивается в серологических тестах по титру специфических антител и в кожно-аллергических пробах с протозойным антигеном.
12.2.5. Особенности противоглистного
иммунитета
Антигены гельминта, связываясь также с рецепторными комплексами тучных клеток слизистой оболочки, вызывают их деграну-ляцию. Экскретированные биологически активные соединения вызывают интенсивную перистальтику, удаляющую паразита или его останки из просвета кишки.
Эозинофилы и тучные клетки синтезируют цитокины и липидные медиаторы, потенцирующие воспалительную реакцию в месте внедрения гельминта. Глистная инвазия сопровождается аллергизацией, в основном, по типу ГЗТ.
12.2.6. Трансплантационный иммунитет
Трансплантационным иммунитетом назы
вают иммунную реакцию макроорганизма,
направленную против пересаженной в него
чужеродной ткани (трансплантата). Знание
механизмов трансплантационного иммуните
та необходимо для решения одной из важней
ших проблем современной медицины — пе
ресадки органов и тканей. Многолетний опыт
показал, что успех операции по пересадке
чужеродных органов и тканей в подавляющем
большинстве случаев зависит от иммунологи
ческой совместимости тканей донора и реци
пиента.
Иммунная реакция на чужеродные клетки и ткани обусловлена тем, что в их составе содержатся генетически чужеродные для организма антигены. Эти антигены, полу-
чившие название трансплантационных или антигенов гистосовместимости (см. гл. 10, разд. 10.1.4.2), наиболее полно представлены на ЦПМ клеток.
Реакция отторжения не возникает в случае полной совместимости донора и реципиента по антигенам гистосовместимости — такое возможно лишь для однояйцовых близнецов. Выраженность реакции отторжения во многом зависит от степени чужеродности, объема трансплантируемого материала и состояния иммунореактивности реципиента.
При контакте с чужеродными трансплантационными антигенами организм реагирует факторами клеточного и гуморального звеньев иммунитета. Основным фактором клеточного трансплантационного иммунитета являются Т-киллеры. Эти клетки после сенсибилизации антигенами донора мигрируют в ткани трансплантата и оказывают на них антителонезависимую клеточно-опосредо-ванную цитотоксичность.
Специфические антитела, которые образуются на чужеродные антигены (гемагглюти-нины, гемолизины, лейкотоксины, цитоток-сины), имеют важное значение в формировании трансплантационного иммунитета. Они запускают антитело-опосредованный цитолиз трансплантата (комплемент-опосредованный и антителозависимая клеточно-опосредован-ная цитотоксичность).
Возможен адоптивный перенос трансплантационного иммунитета с помощью активированных лимфоцитов или со специфической антисывороткой от сенсибилизированной особи интактному макроорганизму.
Механизм иммунного отторжения пересаженных клеток и тканей имеет две фазы. В первой фазе вокруг трансплантата и сосудов наблюдается скопление иммунокомпетент-ных клеток (лимфоидная инфильтрация), в том числе Т-киллеров. Во второй фазе происходит деструкция клеток трансплантата Т-киллерами, активируются макрофагальное звено, естественные киллеры, специфический антителогенез. Возникает иммунное воспаление, тромбоз кровеносных сосудов, нарушается питание трансплантата и происходит его гибель. Разрушенные ткани утилизируются фагоцитами.
В процессе реакции отторжения формируется клон Т- и В-клеток иммунной памяти. Повторная попытка пересадки тех же органов и тканей вызывает вторичный иммунный ответ, который протекает очень бурно и быстро заканчивается отторжением трансплантата.
С клинической точки зрения выделяют острое, сверхострое и отсроченное отторжение трансплантата. Различаются они по времени реализации реакции и отдельным механизмам.
Отсроченное отторжение имеет тот же механизм, что и острое. Возникает через несколько лет после операции у пациентов, получавших иммуносупрессивную терапию.
Сверхострое отторжение, или криз отторжения, развивается в течение первых суток после трансплантации у пациентов, сенсибилизированных к антигенам донора, по механизму вторичного иммунного ответа. Основу составляет антительная реакция: специфические антитела связываются с антигенами эндотелия сосудов трансплантата и поражают клетки, активируя систему комплемента по классическому пути. Параллельно инициируется иммунное воспаление и свертывающая система крови. Быстрый тромбоз сосудов трансплантата вызывает его острую ишемию и ускоряет некротизацию пересаженных тканей.
Следовательно, при пересадке органов и тканей во избежание иммунологического отторжения трансплантата необходимо проводить тщательный подбор донора и реципиента по антигенам гистосовместимости.
12.2.7. Иммунитет против новообразований В сложноорганизованном организме, наряду с нормальными физиологическими процессами, направленными на поддержание гомеостаза, с определенной частотой происходят и дезинтегрирующие события, обусловленные ошибками и старением сложноорга-низованной биологической системы. В част-
ности, появляются мутантные и опухолевые клетки.
Мутантные клетки возникают в результате нелетального действия химических, физических и биологических канцерогенов. К последним относятся разнообразные инфекционные агенты — облигатные внутриклеточные паразиты, и, в первую очередь, вирусы. Мутантные клетки отличаются от нормальных метаболическими процессами и антигенным составом, в частности, имеют измененные антигены гистосовместимости. Поэтому они активируют гуморальное и клеточное звенья иммунитета, осуществляющие надзорную функцию. Важную роль в этом процессе играют специфические антитела (запускают комплемент-опосредованную реакцию и антителозависимую клеточно-опос-редованную цитотоксичность) и Т-киллеры, осуществляющие антителонезависимую кле-точно-опосредованную цитотоксичность.
Механизм противоопухолевого иммунитета до сих пор слабо изучен. Считается, что основную роль в нем играют активированные макрофаги; определенное значение имеют также естественные киллеры. Защитная функция гуморального иммунитета во многом спорная — специфические антитела могут экранировать антигены опухолевых клеток, не вызывая их цитолиза.
Вместе с тем, в последнее время получила распространение иммунодиагностика рака,
которая основана на определении в сыворотке крови раковоэмбриональных и опухоль-ассоциированных антигенов. Таким путем в настоящее время удается диагностировать некоторые формы рака печени, желудка, кишечника и др.
Между состоянием иммунной защиты и развитием новообразований существует тесная связь. Об этом свидетельствует повышенная заболеваемость злокачественными новообразованиями индивидуумов с имму-нодефицитами и престарелых в связи с понижением активности иммунной системы. Иммуносупрессивная химиотерапия также нередко сопровождается пролиферативны-ми процессами. Поэтому в лечении опухолей нашли применение иммуномодуляторы (интерлейкины, интерфероны), а также адъ-юванты (мурамилдипептиды, вакцина БЦЖ и др.).
12.2.8. Иммунология беременности
CD56 MHoro естественные киллеры (см. гл. 11, разд. 11.3.2), которые устраняют активированные аллоантигена-ми плода лимфоциты путем индукции у них апоптоза.
Механизмы иммунологической толерантности во время беременности чрезвычайно активны. Известно, например, что самки животных в этот период не отторгают трансплантат отца ее эмбриона. Однако после родоразрешения (или абортирования плода) толерантность быстро угасает, а надзорная функция иммунной системы быстро восстанавливается, и трансплантат отторгается.
Дата добавления: 2016-02-04 ; просмотров: 1637 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Читайте также:


