Хромогенные среды для стафилококков
Золотистый стафилококк (Staphylococcus aureus) является главной патогенной бактерией в клинической области и в пищевой промышленности. Внутрибольничные инфекции, вызванные S. aureus, создают увеличивающееся число проблем. Поэтому становится более важной задлачей обнаружение S. aureus, и в частности метициллин-резистентного S. aureus (MRSA). Обычные среды для обнаружения S. aureus являются маннито-солевым агаром (названный Агаром Чапмана в Европе). У этой среды, основанный на повышенной солености и брожении маннита, есть чрезмерное количество ложно-положительных и ложно-отрицательных результатов. CHROMagar Staphylococcus aureus является отборной хромогенной средой c высокой спецификой и высокой чувствительностью. Другой обычной средой для обнаружения S. aureus является Кровяной агар, который требует утомительной и дорогостоящей экспертизы с иммунологическими тестами 5-10 колоний на подозреваемом образце. С другой стороны, CHROMagar Staphylococcus aureus более удобен и более эффективен, чем обычные методы благодаря устранению ложно-положительных результатов. Используя CHROMagar Staphylococcus aureus, будет достаточно проверить единственную колонию с типичным цветом для дальнейшей идентификации и обнаружения S. aureus с высокой вероятностью.
Артикул (Кат. №) TA670: банка, кол-во порошка для приготовления 1000 мл,
Артикул (Кат. №) TA672: банка, кол-во порошка для приготовления 5000 мл.
Возможны другие варианты фасовок, пожалуйста, уточняйте.
Хранение
Порошок хранить при температуре 15/30°C. Использовать до даты срока годности, указанной на этикетке.
Состав (г/л)
Агар 15,0; Пептон и дрожжевой экстракт 40,0; Соли 25,0; Хромогенная смесь 2,5; pH: 6,9 +/- 0,2
(Классический состав, скорректированный для соответствия с рабочими характеристиками).
Инокуляция
Если чашка агара была остужена, необходимо довести ее до комнатной температуры перед инокуляцией.
Нанести образец на чашку и инкубировать при температуре 37°C 24 часа.
Интерпретация
МИКРООРГАНИЗМЫ — Внешние признаки колоний
S. aureus – от розового до розовато-лилового
Другие бактерии – нет роста, бесцветные, голубые
ТОЛЬКО ДЛЯ ИН-ВИТРО ДИАГНОСТИКИ.
Для использования обученным персоналом.
Приготовление
Для приготовления определенного количества среды, добавить сухой порошок в очищенную воду в соответствующем количестве ИЛИ, развести среду в пропорции 82,5 грамм на литр очищенной воды. Размешать порошок вращательными движениями для разбухания агара. Нагреть и довести до кипения (100°C), при регулярном перемешивании круговыми движениями. Если используется автоклав, делать без давления. НЕ НАГРЕВАТЬ ВЫШЕ 100°С. Смесь также можно довести до кипения в микроволновой печи: после закипания вынуть из печи, аккуратно перемешать, затем поместить обратно в печь, дать быстро вскипеть несколько раз, до получения полностью однородной смеси (зерна агара должны исчезнуть). Кипения должно проходить без вспенивания, крупными пузырями. Примечание: в некоторых случаях использование автоклава может быть лишним, и кипения при 100°С может быть достаточно для стерилизации. Охладить на водяной бане до 45-50°C, аккуратно помешивая. Аккуратно перемешать до образования однородной массы. Разлить в стерильные чашки Петри или пробирки дать застыть (до консистенции геля) и высохнуть. Хранить в темном месте. Готовые чашки со средой можно хранить при комнатной температуре одни сутки. При температуре 2/8°C – до одного месяца, в темноте, не допуская высыхания.
Рабочие характеристики и ограничения
Чувствительность и специфичность S.aureus составляет 95,5 %, a специфичность 99,4% (Gaillot et al., 2000).
Для подтверждения требуется дополнительное тестирование.
Примечание: для прямого выявления MRSA можно использовать селективную среду CHROMagar™ MRSA.
Утилизация отходов
После интерпретации чашки автоклавировать при 121°C в течение минимум 20 минут.
Больше полувека миру известна технология создания хромогенных питательных сред для микробиологии. Но полноценное ее использование для анализа образцов началось только в последнее десятилетие.
- Уменьшить время получения результата по сравнению с традиционными методами
- Идентифицировать несколько микроорганизмов на одной среде
- Проводить анализ визуально, без использования оборудования
- Выполнять подтверждающие тесты без пересева на дополнительные среды
Давайте познакомимся с хромогенными питательными средами ближе.
Это питательные среды для микробиологии со специальными хромогенными субстратами, которые в присутствии целевых микроорганизмов вызывают появление специфического окрашивания колоний. Хромогенные питательные среды подходят для культивирования, дифференциации и селекции микроорганизмов.
Как работают хромогенные питательные среды?
Рассмотрим принцип работы хромогенных питательных сред на примере хромогенного агара для Enterobactersakazakii (ENTEROBACTER SAKAZAKII ISOLATION CHROMOGENIC AGAR (ESIA) ISO 22964). Enterobactersakazakii считается причиной возникновения менингитов и некротических колитов у детей со смертностью на уровне 40–80%. Именно поэтому контроль наличия Enterobactersakazakii в детском питании особенно важен.
В состав хромогенной среды входят:
- Пептонная смесь
- Факторы роста
- Ингибиторы грамотрицательной флоры
- Агар
- Хромогенный субстрат, который расщепляется ферментом Enterobactersakazakii, окрашивая колонии в синий цвет
 |
| Селективная среда для предварительного обнаружения и подсчета E.coli |
| Селективная среда для одновременного обнаружения E.coli и других колиформ |
| Для быстрого выделения видов Pseudomonas |
| Выделение Enterobacter sakazakii из детских молочных продуктов |
| Обнаружение и выделение Vibrio cholerae, V. parahaemolitycus и Vibrio alginolyticus |
| Выделение сальмонелл из клинических проб, пищевых продуктов и воды |
| Одновременное обнаружение E.coliи колиформ с помощью флуоресценции |
| Одновременное обнаружение E.coliи колиформ с помощью флуоресценции |
| Дифференциальная среда для одновременного обнаружения E.coliи энтеробактерий |
| Селективная и дифференциальная среда для обнаружения E.coli 0157:H7 |
| Выделение и дифференциация Enterococcus faecalis и E. faecium |
| Выделение и подсчет энтерококков из воды методом одноступенчатой мембранной фильтрации |
| Селективная среда для обнаружения и подсчета Listeriamonocytogenes |
| Обнаружение и дифференциация видов Staphylococcus |
| Подсчет Escherichia coli и колиформ в воде |
Чего ждать в будущем?
Соединение классической микробиологии и знаний о биохимических особенностях микроорганизмов позволило создать мощный инструмент для быстрого и удобного анализа в микробиологии – хромогенные питательные среды. Полагаю, это далеко не полный перечень хромогенных питательных сред, ведь исследовательские лаборатории продолжают трудиться над созданием новых, более совершенных формул.
На сегодня существует несколько групп субстратов, с которыми проводят исследования:
Получение формулы питательной среды – дело кропотливое и длительное, ведь необходимо не только подобрать субстрат и фермент, но и исключить возможность ложных результатов, влияние на ростовые качества. Также важно, чтоб состав оставался стабильным продолжительное время и не требовал особых условий хранения.
К сожалению, не многие формулы оказываются жизнеспособными в условиях производства в промышленных масштабах. Но те, что прошли проверку, со временем завоевывают благосклонность пользователей и даже становятся международными стандартами. Так, например, на сегодня среди стандартов ISO уже четыре хромогенные среды:
- Хромогенный агар для E.coli и колиформ (ISO 9308)
- Хромогенный агар TBX для горизонтального подсчета Escherichia coli (ISO 16649-2)
- Основа хромогенного агара для Listeria (ISO 11290)
- Агар для изоляции Enterobactersakazakii (ISO 22964)
Несмотря на то, что хромогенные питательные среды дороже традиционных, все больше пользователей в Украине выбирают именно их. А Вы пользуетесь хромогенными средами?
История питательных сред имеет многовековой опыт. Начинается она с открытия Л. Пастера. В 1861 году он доказал, что брожение есть процесс, тесно связанный с жизнедеятельностью дрожжевых грибков, которые питаются и размножаются за счёт бродящей жидкости, т.е. положил начало культивированию в жидких средах.

В 1883 году Р. Кох разработал метод выделения чистых культур микробов путем посева на пластинки желатина. Другой состав плотной среды, который используется до сих пор, предложил в 1884 году немецкий микробиолог В. Хессе. Основным компонентом был агар-агар, который его жена использовала для приготовления фруктового желе.

Осталось только найти форму, в которую удобно заливать плотные среды, и наблюдать за ростом микробов. Такая форма в виде донышка, отрезанного от лабораторной бутыли, была предложена в 1887 году Ю. Петри и получила название - чашка Петри. Эти открытия положили основу для разработки, а затем промышленного выпуска и широкого практического использования жидких, полужидких и плотных питательных сред, которые, так же как и чашки Петри, до сих пор являются неотъемлемым атрибутом каждой микробиологической лаборатории.

В 1905 году бактериолог А. Мак-Конки разработал первую хромогенную среду. В ее состав входят селективные компоненты (нейтральный красный и соли желчных кислот), которые ингибируют рост грам-положительных микробов, и специфический субстрат – лактоза. Кишечные бактерии ферментируют лактозу, что приводит к понижению рН и изменению окраски рН-индикатора. В результате колонии сальмонелл, шигелл и колиформных бактерий имеют красный цвет и окружены мутной зоной преципитации желчных солей.

В настоящее время хромогенные питательные среды получают в мировой бактериологической практике все более широкое применение. Из основных производителей следует назвать Oxoid, Merck, bio Merieux, HiMedia, Fluka, Sifin, Biolife. Выпуск освоен и отечественными производителями: НПП "Питательные среды" (г. Махачкала), ГНЦ прикладной микробиологии и биотехнологии (г. Оболенск), НИИ эпидемиологии и микробиологии имени Пастера (г. Санкт-Петербург) и др.
Принцип действия и классификация
Слово хромоген является комбинацией двух греческих слов: chroma (chromatos) - цвет и genes – порождающий. Принцип действия заключается в образовании окрашенных веществ (индикаторов) в результате взаимодействия высокоспецифичных ферментов бактерий с компонентами среды. В зависимости от консистенции их делят на жидкие и плотные.
Жидкие питательные среды
Примером, основанным на способности микробов ферментировать неокрашенный субстрат в окрашенный, является хромогенный бульон на энтерококки фирмы Merck. Содержащийся в бульоне субстрат (5-бром-4-хлор-3-индолил-бета-D-глюкопиранозид) под действием бета-D-глюкозидазы энтерококков и D-стрептококков образует растворимый продукт сине-зеленого цвета. Рост сопутствующих грамм-отрицательных бактерий (колиформные бактерии), также имеющих бета-D-глюкозидазы, подавляется наличием в бульоне азида натрия.

| Тест-штаммы | Рост | Сине-зеленый цвет среды |
|---|---|---|
| Enterococcus faecalis ATCC 11700 | Средний/хороший | + |
| Enterococcus faecalis ATCC 19433 | Средний/хороший | + |
| Enterococcus faecium ATCC 6057 | Средний/хороший | + |
| Streptococcus bovis DSMZ 30187 | Средний/хороший | + |
| Staphylococcus aureus ATCC 25923 | Средний/хороший | - |
| Aeromonas hydrophila DSZM 30187 | Слабый | - |
| Escherichia coli ATCC 25922 | Роста нет | - |
| Pseudomonas aeruginosa ATCC 27853 | Роста нет | - |


Наиболее широкое практическое применение нашли среды с рН-индикаторами. Их механизм действия основан на изменении окраски индикатора при изменении рН. Ферментация аминокислот или мочевины приводит к защелачиванию, а ферментация сахаров - к закислению.


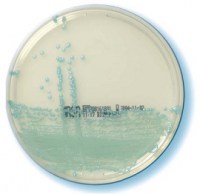
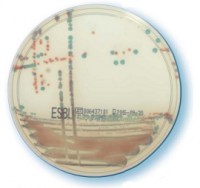

Компания bioMérieux предлагает широкий диапазон хромогенных питательных сред, в том числе для прямой идентификации Staphylococcus aureus, Candida albicans, основных возбудителей инфекций мочевых путей, а также селективного выделения и идентификации серотипов Salmonella. Недавно была выпущена среда Strepto B ID для скрининга перинатальных инфекций, вызванных стрептококками группы В.
Также разработаны новые среды для борьбы с нозокомиальными инфекциями и множественной устойчивостью: chromID MRSA, chromID ESBL и chromID VRE.
Хромогенный агар для выделения, подсчета микроорганизмов в моче и прямой идентификации Escherichiacoli, Enterococcus, группы KESC (Klebsiella, Enterobacter, Serratia, Citrobacter) и Proteeaeв один этап
Колонии на агаре хорошо изолированы; их легко идентифицировать благодаря насыщенной, интенсивной дифференцирующей окраске.
Среда бесцветна, и яркие колонии легко подсчитывать.
Хромогенный агар для селективного выделения всех серотипов Salmonella
Среда содержит три хромогенных субстрата для оптимального селективного выделения и дифференциации бактерий рода Salmonella:
• Специфическое определение эстеразной активности на бесцветном фоне = колонии Salmonella окрашены в цвета: от розового до розовато-лилового (учет результата через 18-24 часа).
• Дифференциация других грамотрицательных бактерий (колонии другого цвета).
• Ингибирование роста грамположительных бактерий и дрожжей.
Хромогенный агар для селективного выделения стафилококков и прямой идентификации S. aureus
Принцип определения
Прямая быстрая идентификация S. aureus основана на том, что колонии продуцирующих α-глюкозидазу микроорганизмов спонтанно окрашиваются в зеленый цвет (патент заявлен).
Быстрота получения результата
Прямая немедленная идентификация S. aureus = зеленые колонии
(учет результата - через 18-24 часа после посева образца).
Выделите MRSA и изолируйте пациента!
Хромогенный агар для определения метициллинрезистентных штаммов S. aureus (MRSA)
Агар chromID MRSA предназначен для прямой, не требующей подтверждения идентификации метициллинрезистентных штаммов Staphylococcus aureus. Его использование облегчает активный мониторинг штаммов MRSA и контроль нозокомиальных инфекций в лечебных учреждениях.
Принцип определения
Прямая идентификация штаммов MRSA основана на спонтанном окрашивании в зеленый цвет колоний микроорганизмов, продуцирующих a-глюкозидазу (патент заявлен), и на присутствии в агаре антибиотика цефокситина.
Быстрота получения результата
• Немедленная идентификация штаммов MRSA. Эти штаммы образуют характерные зеленые колонии через 18-24 часа культивирования. Для идентификации не требуется никаких дополнительных реактивов **.
Высокая достоверность
• Прекрасные рабочие характеристики среды: питательные свойства, чувствительность определения и специфичность окраски MRSA.
• Определение штаммов MRSA, включая гетерорезистентные штаммы, благодаря наличию в среде цефокситина.
• Ингибирование роста большинства бактерий, не принадлежащих к роду Staphylococcus, и дрожжей.
Простота и удобство в применении
• Необыкновенно легко учитывать результат.
• Среда готова к использованию.
• Специальная хромогенная среда для MRSA.
• Выделение, получение чистой культуры и идентификация - на одной чашке
Хромогенный агар для определения энтеробактерий, продуцирующих бета-лактамазы расширенного спектра действия (БЛРС)
Выделите продуцента БЛРС и изолируйте пациента!
Впервые устойчивость к антибиотикам, обусловленная выработкой бета-лактамаз расширенного спектра действия (БЛРС), была обнаружена в начале 80-х годов XX века в Европе, а затем в США, после введения в клиническую практику цефалоспоринов третьего поколения. В настоящее время этот механизм устойчивости широко распространен; продуцирующие БЛРС энтеробактерии являются частыми возбудителями нозокомиальных инфекций.
Своевременная изоляция носителей штаммов, продуцирующих БЛРС, эффективна с медицинской и экономической точек зрения. Для выявления таких пациентов и обеспечения их своевременной изоляции необходим эффективный скрининг продуцентов БЛРС

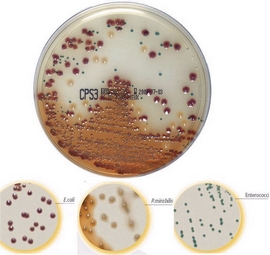
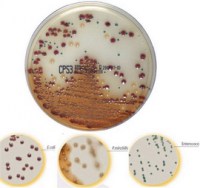
Среда для выделения Staphylococcus aureus | CHROMagar™ Staph aureus
Золотистый стафилококк (Staphylococcus aureus) является главной патогенной бактерией в клинической области и в пищевой промышленности. Внутрибольничные инфекции, вызванные S. aureus, создают увеличивающееся число проблем. Поэтому становится более важной задлачей обнаружение S. aureus, и в частности метициллин-резистентного S. aureus (MRSA). Обычные среды для обнаружения S. aureus являются маннито-солевым агаром (названный Агаром Чапмана в Европе). У этой среды, основанный на повышенной солености и брожении маннита, есть чрезмерное количество ложно-положительных и ложно-отрицательных результатов. CHROMagar Staphylococcus aureus является отборной хромогенной средой c высокой спецификой и высокой чувствительностью. Другой обычной средой для обнаружения S. aureus является Кровяной агар, который требует утомительной и дорогостоящей экспертизы с иммунологическими тестами 5-10 колоний на подозреваемом образце. С другой стороны, CHROMagar Staphylococcus aureus более удобен и более эффективен, чем обычные методы благодаря устранению ложно-положительных результатов. Используя CHROMagar Staphylococcus aureus, будет достаточно проверить единственную колонию с типичным цветом для дальнейшей идентификации и обнаружения S. aureus с высокой вероятностью.
Артикул (Кат. №) TA672: банка, кол-во порошка для приготовления 5000 мл.
Возможны другие варианты фасовок, пожалуйста, уточняйте.
Хранение
Порошок хранить при температуре 15/30°C. Использовать до даты срока годности, указанной на этикетке.
Состав (г/л)
Агар 15,0; Пептон и дрожжевой экстракт 40,0; Соли 25,0; Хромогенная смесь 2,5; pH: 6,9 +/- 0,2
(Классический состав, скорректированный для соответствия с рабочими характеристиками).
Инокуляция
Если чашка агара была остужена, необходимо довести ее до комнатной температуры перед инокуляцией.
Нанести образец на чашку и инкубировать при температуре 37°C 24 часа.
Интерпретация
МИКРООРГАНИЗМЫ — внешние признаки колоний
S. aureus — от розового до розовато-лилового
Другие бактерии — нет роста, бесцветные, голубые
ТОЛЬКО ДЛЯ ИН-ВИТРО ДИАГНОСТИКИ.
Для использования обученным персоналом.
Приготовление
Для приготовления определенного количества среды, добавить сухой порошок в очищенную воду в соответствующем количестве ИЛИ, развести среду в пропорции 82,5 грамм на литр очищенной воды. Размешать порошок вращательными движениями для разбухания агара. Нагреть и довести до кипения (100°C), при регулярном перемешивании круговыми движениями. Если используется автоклав, делать без давления. НЕ НАГРЕВАТЬ ВЫШЕ 100°С. Смесь также можно довести до кипения в микроволновой печи: после закипания вынуть из печи, аккуратно перемешать, затем поместить обратно в печь, дать быстро вскипеть несколько раз, до получения полностью однородной смеси (зерна агара должны исчезнуть). Кипения должно проходить без вспенивания, крупными пузырями. Примечание: в некоторых случаях использование автоклава может быть лишним, и кипения при 100°С может быть достаточно для стерилизации. Охладить на водяной бане до 45-50°C, аккуратно помешивая. Аккуратно перемешать до образования однородной массы. Разлить в стерильные чашки Петри или пробирки дать застыть (до консистенции геля) и высохнуть. Хранить в темном месте. Готовые чашки со средой можно хранить при комнатной температуре одни сутки. При температуре 2/8°C – до одного месяца, в темноте, не допуская высыхания.
Рабочие характеристики и ограничения
Чувствительность и специфичность S. aureus составляет 95,5 %, a специфичность 99,4% (Gaillot et al., 2000).
Для подтверждения требуется дополнительное тестирование.
Примечание: для прямого выявления MRSA можно использовать селективную среду CHROMagar™ MRSA.
Утилизация отходов
После интерпретации чашки автоклавировать при 121°C в течение минимум 20 минут.
Для выделения культур стафилококков обычно используют 5%-ный кровяной агар (кровь овцы, кролика, крупного рогатого скота). При исследовании образцов, содержащих постороннюю микрофлору, целесообразно использовать селективные среды.
Таблица 9. Дифференциальные признаки стафилококков, имеющих основное медицинское значение
| Признак | S. aureus | S. epidermidis | S. saprophyticus | |
| Anaerobius | Aureus | |||
| Наличие каротиноидного сегмента | – | ± | – | + |
| Способность к росту в анаэробных условиях (тиогликолевая среда) | + | + | + | ± |
| Рост на средах с 10% NaCI | + | + | ± (слабо) | + |
| Рост при: | ||||
| 15°С | ? | + | – (слабо) | + |
| 45°С | – | + | + | ± |
| Образование кислоты при ферментации углеводов в аэробных условиях: | ||||
| ксилоза | – | – | – | – |
| арабиноза | – | – | – | – |
| раффиноза | – | – | – | – |
| сахароза | + | + | + | + |
| маннит | – | + | – | ± |
| манноза | – | + | ± | – |
| трегалоза | – | + | – | + |
| лактоза | – | + | ± | ± |
| галактоза | – | + | ± | – |
| фруктоза | + | + | + | + |
| ксилит | – | – | – | ± |
| Восстановление нитратов | – | + | + (слабо) | – |
| Щелочная фосфатаза | + | + | + | – |
| Гиалуронидаза | + | + | + | ? |
| Уреаза | ? | ± | + | + |
| Коагулаза (на сыворотке кролика) | + | + | – | – |
| Фибринолизин | ? | ± | ± | ? |
| Гемолитическая активность | + | + | – (слабо) | – |
| ДНКаза | + | + | – (слабо) | – |
| Чувствительность к новобиоцину (МИК >1,6 мкг/мл) | + | + | + | – |
С целью дифференциации патогенных стафилококков от сапрофитных, а также от микрококков, используют среды, позволяющие одновременно определить один из признаков, характеризующих патогенные стафилококки. Приводим рецепты некоторых питательных сред.
Молочно-солевой агар
В 100 мл МПБ растворяют 6,5 г хлорида натрия, 20 г агар-агара. Устанавливают рН 7,4, стерилизуют при 121°С 20 минут. Перед использованием агар расплавляют, охлаждают до 45°С, добавляют 10% стерильного обезжиренного молока и разливают по чашкам Петри. На этой среде определяют пигментообразование и способность к росту при наличии 6,5% хлорида натрия.
Лактозо-солевой бульон с фенолротом
В 1000 мл дистиллированной воды растворяют 10 г триптона, 5 г мясного экстракта, 1 г дрожжевого экстракта, 5 г хлористого лития, 20 г агара. Устанавливают рН 6,8, разливают по пробиркам и стерилизуют при 121°С 15 минут. При росте коагулазоположигельных стафилококков среда желтеет (тест на коагулазу положительный).
Теллурит-полимиксин-желточный агар Крисли
В 1000 мл дистиллированной воды растворяют 10 г триптона, 5 г дрожжевого экстракта, 5 г маннита, 20 г хлорида натрия, 2 г хлористого лития, 18 г агара. Устанавливают рН 7,3, стерилизуют 15 минут при 121°С. Перед использованием в среду добавляют 100 мл 30%-ной желточной эмульсии (на физиологическом растворе), 0,4 мл стерилизованного фильтрацией 1%-ного водного раствора полимиксина М, 10 мл стерилизованного автоклавированием (121°С 15 мин) 1%-ного водного раствора теллурита натрия.
Среда Джиолиотта и Кантони
В 1000 мл дистиллированной воды растворяют 10 г триптона, 5 г мясного экстракта, 5 г дрожжевого экстракта, 5 г хлористого лития, 20 г маннита, 5 г хлористого натрия, 1,2 г глицина, 3 г пирувата натрия. Устанавливают рН 6,9, стерилизуют при 115°С 20 мин. Перед употреблением к среде добавляют 0,1 мл 1%-ного водного раствора теллурита натрия, стерилизованного фильтрацией, При росте коагулазоположительных стафилококков наблюдается почернение среды или черный осадок.
Среда Бэрда-Паркера
К 90 мл основной среды с температурой 45°С добавляют 6,3 мл глицинового раствора, 1 мл раствора теллурита натрия, 5 мл эмульсии желтка, перемешивают и разливают в чашки Петри. Среда пригодна к использованию в течение 28 дней (хранение при 4°С). Перед посевом на поверхность среды наносят 0,5 мл 20%-ного водного раствора пирувата натрия, стерилизованного фильтрацией; распределяют по поверхности, подсушивают. Колонии коагулазоположительных стафилококков черные, блестящие, с узкой серо-белой полосой и окружены прозрачной зоной.
Желточная эмульсия. Свежее куриное яйцо выдерживают в 0,001%-ном растворе HgCl2. Соблюдая требования асептики, отделяют желток и эмульгируют его в 200 мл физиологического раствора.
Глициновый раствор. Глицин — 20 г, дистиллированная вода — 100 мл. Стерилизуют при 120°С 15 минут.
Раствор теллурита натрия. Теллурит натрия — 1 г, дистиллированная вода — 100 мл. Стерилизуют фильтрацией.
Желточно-солевой агар Чистовича
В расплавленный МПА с 10% хлорида натрия (рН 7,2), охлажденный до температуры 60°С, добавляют желточную эмульсию. После тщательного перемешивания питательную среду разливают в чашки Петри.
Среда Чаплина-Бернса
К 100 мл МПА добавляют 3,3 мл 0,1%-ного водного раствора кристаллического фиолетового и 5 г лактозы. Устанавливают рН 6,8. Стерилизуют автоклавированием (110°С 30 минут). Колонии патогенных стафилококков растут быстрее, чем непатогенных, и приобретают фиолетовый или оранжевый цвет.
Среда Чемпена (для выделения патогенных стафилококков)
Вариант 1: пептон — 1%, D-маннит — 1%, натрия хлорид — 7,5%, дрожжевой экстракт — 0,25%, двузамещенный фосфорнокислый калий — 0,5%, агар-агар — 1,5%. Среду стерилизуют 90 минут при 110°С, устанавливают рН 7,0 и добавляют 10% стерильного обезжиренного молока (молоко способствует лучшему образованию пигмента).
Вариант 2: пептон — 1%, дрожжевой экстракт — 0, 25%, желатин — 3%, лактоза — 0,2%, D-маннит — 1%, натрия хлорид — 7,5%, двузамещенный фосфорнокислый калий — 0,5%, агар-агар — 1,5%. Стерилизуют 90 минут при 110°С, устанавливают рН 7,0.
Читайте также:


