Вич вирус геном клетки
Вирус иммунодефицита человека (ВИЧ, на английском HIV) является причиной ВИЧ-инфекции, которая всегда заканчивается развитием СПИДа — синдрома приобретенного иммунодефицита человека, при котором развиваются инфекционные заболевания в тяжелой форме и неопластические процессы.
Источником вирусов является только больной человек. Его кровь, сперма и влагалищный секрет имеют в достаточном для заражения концентрацию инфекционного материала. Половой, парентеральный и трансплацентарный являются основными путями передачи инфекции. Вирус иммунодефицита человека — 1 является наиболее вирулентным. Именно он является причиной эпидемий во многих странах мира.
ВИЧ впервые был открыт в 1983 году в двух независимых лабораториях: лаборатории Люка Монтаньи Института Пастера (Франция) и Национальном институте рака в лаборатории Роберта Галло (США).
Рис. 1. Люк Монтанье (фото слева) и Роберт Галло (фото справа).
Вирусы иммунодефицита человека поражают клетки, на поверхности которых имеются СD4 + -рецепторы:
- Т-лимфоциты (распознают и уничтожают клетки, несущие чужеродные антигены),
- тканевые макрофаги и моноциты (захватывают и переваривают бактерии и чужеродные частицы),
- фолликулярные дендритные клетки (стимулируют Т-лимфоциты),
- клетки нейроглии,
- клетки Лангерганса,
- эпителиальные клетки кишечника и шейки матки.
При их концентрации Т-лимфоцитов ниже 200 в 1 мкл клеточный иммунитет перестает защищать организм больного. Инфицированные клетки погибают. Развивается СПИД.
Рис. 2. ВИЧ покидает клетку-мишень. Теперь она называется вирионом.
Классификация ВИЧ
Вирус иммунодефицита человека относится к семейству ретровирусов, роду лентивирусов. Обладает лимфотропностью. Различают 2 основных вида вирусов иммунодефицита — ВИЧ-1 и ВИЧ-2. Виды ВИЧ-3 и ВИЧ-4 являются редкими разновидностями. Их роль в распространении инфекции малозаметна.
- Ретровирусы (от латинского retro — обратный) относятся к семейству РНК-содержащих вирусов, заражающие позвоночных. ВИЧ в отличие от онковирусов приводит инфицированные клетки к гибели, а не вызывает их пролиферативный рост, как онковирусы. Ретровирусы являются причиной развития злокачественных процессов в виде саркомы и лейкемии у целого ряда животных и только один вид вызывает лимфосаркому у человека.
- Лентивирусы (от латинского lentus — медленный) вызывают заболевания с длительным инкубационным периодом и медленным, но неуклонно прогрессирующем течением. Лентивирусы доставляют в клетку хозяина значительное количество генетического материала и обладают способностью к репликации (возобновлению) в неделящихся клетках.
Рис. 3. При выходе нового вируса наружу он называется вирионом. На фото незрелый вирион. Нуклеокапсид не структурирован. Внешняя оболочка широкая и рыхлая.
ВИЧ-1 и ВИЧ-2 — основные виды ВИЧ
Вирусы иммунодефицита человека отличаются друг от друга генетически и по антигенным характеристикам. Современная классификация выделяет 2 основных вида вирусов: вирус иммунодефицита человека — 1 (ВИЧ-1) и вирус иммунодефицита человека — 2 (ВИЧ-2). Однако известны еще ВИЧ-3 и ВИЧ-4 — редкие разновидности с малозаметной ролью в распространении эпидемии. Предполагают, что ВИЧ-1 возник в результате передачи людям вируса иммунодефицита шимпанзе, а ВИЧ-2 — красноголовых мангобеев.
Оба вида вируса при попадании в организм человека вызывают иммунодефицит. Наблюдаются отличия в клиническом течении заболевания.
Рис. 4. Предполагают, что ВИЧ-1 возник в результате передачи людям вируса иммунодефицита шимпанзе, а ВИЧ-2 — красноголовых мангобеев.
ВИЧ-1 впервые описан в 1983 году. Он является самым патогенным и распространенным среди всех вирусов ВИЧ. Незначительные изменения в геноме этого типа вируса приводят к появлению большого числа новых штаммов, что позволяет возбудителю ускользать от иммунной системы больного и приобретать лекарственную устойчивость к противовирусным препаратам.
- Именно ВИЧ-1 стал виновником глобальной эпидемии.
- Вирусы иммунодефицита человека — 1 подразделяются на несколько групп: M, N, O и Р, 90% которых составляет группа М. В свою очередь группа М подразделяется на 11 подтипов, доминирующих в тех или иных частях света.
- ВИЧ-1 подтип А широко распространен в России и Африке. В настоящее время произошло смешение штамма А, доминирующего в настоящее время и штамма АG, занесенного из Средней Азии. Так появился более опасный штамм ВИЧ-1А63.
- При инфицировании ВИЧ-1 заболевание чаще переходит в стадию СПИД.
- В стадии СПИД чаще развивается кандидоз ротовой полости, саркома Капоши и хроническая лихорадка.
В каждом случае, когда нет указаний на вид вируса, подразумевают вирус иммунодефицита человека-1.
ВИЧ-2 возник в результате передачи людям вируса иммунодефицита от красноголовых мангобеев. Идентифицирован в 1986 г. Описано 8 групп вирусов, но в эпидемическом плане более опасными являются только группы А и В.
- ВИЧ-2 обладает меньшей вирулентентностью, чем ВИЧ-1.
- При одновременном попадании в организм человека ВИЧ-1 и ВИЧ-2, ВИЧ-2 обеспечивает, пусть и небольшую, защиту клеток от инфицирования ВИЧ-1.
- Заболевание протекает более продолжительно и реже переходит в стадию СПИД.
- При заболевании в 1 мкл крови вирусов значительно меньше, чем при инфицировании ВИЧ-1.
- При ВИЧ-2 чаще развиваются такие инфекции, как хроническая диарея, холангит, энцефалит и тяжелые цитомегаловирусные инфекции.
Строение ВИЧ
Рис. 5. Строение ВИЧ.
Вирус, пребывающий вне клетки, называется вирионом. Вирионы являются конечной фазой развития вирусов. Именно на этих представителях микромира основана классификация и систематизация вирусов.
ВИЧ-1 и ВИЧ-2 имеют ядро (пулевидный нуклеокапсид), состоящее из РНК и ферментов и оболочку (мембрану или суперкапсид). Зрелые вирионы содержат до нескольких тысяч разного типа белковых молекул, имеют сферическую форму диаметром от 100 до 180 нм.
- Внутри ВИЧ располагаются 2 одноцепочечные вирусные РНК и 3 фермента: обратная транскриптаза (ревертаза), интеграза и протеаза, прочно связанные (упакованные) с капсидными белками р24, р7 и р9.
- Снаружи капсида находится 2000 молекул матриксного р17-белка толщиной 5 — 7 нм. Они располагается между капсидом вируса и внешней оболочкой.
- Нуклеокапсидный белок р7 и р9 обеспечивает связь с геномной РНК.
- С капсидом ВИЧ-1 связано 200 копий циклофилина А, участвующего в сборке вириона.
- Внутри (или за пределами?) капсида вириона находится белок Vhr.
Геном вируса представляет собой совокупность генов, содержащих биологическую информацию, которая необходима для построения и поддержки жизнедеятельности микроорганизма. Геномная нуклеиновая кислота сама по себе не является инфекционным фактором.
Интеграза — это фермент, ускоряющий (катализирующий) включение (интеграцию) ДНК ВИЧ в хромосому хозяина. ДНК вируса перед интеграцией замыкаются в кольцо.
Протеаза — это фермент, который расщепляет пептидные связи между аминокислотами в белках.
- Оболочки ВИЧ (капсидная и суперкапсидная) защищают генетический материал от химических, физических и механических повреждений. Наружная оболочка помогает вирусу взаимодействовать с рецепторами клетки-мишени.
- Оболочка образуется в период почкования и состоит из слоя фосфолипидов, пронизанного 72-я гликопротеиновыми комплексами и мембранных клеток хозяина.
- Благодаря гликопротеинам оболочки вирусы стремятся только к определенным клеткам хозяина, несущими на своей поверхности специальные рецепторы СD4 + — Т-лимфоцитам, моноцитам, тканевым макрофагам, фолликулярным дендритным клеткам, нейроглии, клеткам Лангерганса, эпителиальным клеткам кишечника и шейки матки, что и определяет развитие проявлений ВИЧ-инфекции.
- При встрече с клетками хозяина в их оболочки вставляются трансмембранные гликопротеины gp41 и поверхностные гликопротеины gp120. Вирусы, лишенные этих белков, не способны проникать в клетки-мишени.
Рис. 7. На фото 3D-модель ВИЧ.
Рис. 8. На фото справа ВИЧ в разрезе.
Геном ВИЧ
Геном ВИЧ представлен двумя идентичными нитями РНК. Длина каждой нити составляет около 10 тыс. нуклеотидов. В геном входят 3 основных структурных и 7 регуляторных и функциональных генов, кодирующих 15 различных белков.
- Структурные (капсидные и суперкапсидные) белки ВИЧ кодируются геном Gag.
- Неструктурные белки кодируются геном Pol.
- Гены Tat, Nef, Vif, Rev, Vpu и Vpr кодируют белки, регулирующие процессы размножения и сборки вирусов, подавляют активность клеточных противовирусных систем.
Рис. 9. Нормальный лимфоцит (фото слева), зараженный ВИЧ (фото справа). На поверхности зараженной клетки образуются множественные пузырьки.
Белки ВИЧ
Как только вирион проник внутрь клетки хозяина (теперь он называется вирусом) при помощи фермента обратной транскриптазы происходит синтез ДНК-копии генома, которая встраивается в геном клетки хозяина. Так образуется провирус.
Далее при помощи ферментов на матрице провирусов синтезируются новые молекулы РНК вируса, а также структурные и регуляторные белки, осуществляющие сборку и почкование вирусов. Внутри вируса, как и на его поверхности, кроме кодируемых геномом находятся белки, которые захватываются вирусной частицей из клеток хозяина.
Гены Gag, Pol и Env отвечают за синтез основных белков ВИЧ.
За синтез структурных белков ВИЧ отвечает ген Gag. Структурные белки входят в состав самой вирусной частицы. Они формируют капсид и вирусную оболочку.
Капсидные белки образуют вместилище (футляр) для нуклеиновой кислоты, входят в состав геномных белков и формируют ферменты. Капсидная оболочка собирается не из отдельных белков, а из субъединиц. Ее сборка запрограммирована в РНК.
- Белок р24 образует оболочку нуклеокапсида.
- Белок р17 образует матриксное вещество.
- Белок р9 и р7 обеспечивает связь с геномной РНК.
Рис. 10. Лимфоцит, поражённый ВИЧ. Вытянутые структуры на поверхности клетки вызваны гиперпродукцией белка Gag. (Фото NIBSC).
За синтез оболочечных белков ВИЧ отвечает ген Env. Белки этой группы входят в состав наружной мембраны вириона, которая состоит из слоя фосфолипидов, пронизанного 72-я гликопротеиновыми комплексами. Свободная (наружная) часть гликопротеинового комплекса содержит аминогруппу ДО-конец. Погруженный в липидный слой конец содержит гидроксильную группу С-конец. Благодаря гликопротеиновым комплексам вирионы прикрепляются к клетке хозяина. Их называют прикрепительными белками.
В ходе эволюции вирусы приобрели адресную функцию — поиск нужных клеток хозяина среди множества других клеток, для чего на их поверхности появились специальные белки, распознающие чувствительные клетки и их рецепторы.
Внешняя оболочка вириона состоит из белковых комплексов (белка gp120 и gp41) и клеток оболочки хозяина, которые захватываются вирусами при почковании.
- Белок gp120 (самый наружный) обеспечивает связывание с клетками-мишенями.
- Белок gp41 обеспечивает проникновение вирионов в клетку.
Неструктурные белки кодируются геном Pol. Они обслуживают процессы репродукции вирусов на разных его этапах. Ген Pol кодирует ферменты, участвующие в процессе интеграции генома вируса в геном клетки хозяина и ферменты, участвующие в процессе размножения вируса.
Наиболее изучены в настоящее время следующие неструктурные белки ВИЧ:
- р66 — обратная транскриптаза (участвует в синтезе ДНК на матрице РНК);
- р31 — интеграза (катализирует интеграцию ДНК вируса в хромосому хозяина;
- р10 — протеаза (расщепляет пептидные связи между аминокислотами в больших белковых молекулах).
Такие гены, как Tat, Nef, Vif, Rev, Vpu и Vpr кодируют белки, регулирующие процессы размножения и сборки вирусов, подавляют активность клеточных противовирусных систем.
Рис. 11. На фото слева зафиксирован процесс отпочкования вирионов. Нуклеокапсид еще не структурен, внешняя оболочка более толстая из-за наличия мембранных белков. На фото справа зрелые вирионы во внеклеточном пространстве (электронная микрофотография). Нуклеокапсиды приобрели форму усеченного конуса. Оболочка стала тонкой, так как часть белков внешней оболочки утерян.
Антигенная структура ВИЧ
Вирусы иммунодефицита человека — 1 подразделяются на несколько групп: M, N, O и Р, 90% которых составляет группа М. В свою очередь группа М подразделяется на 11 подтипов, доминирующих в тех или иных частях света. Они отличаются друг от друга по аминокислотному составу белков.
К главным антигенам вируса иммунодефицита человека относятся:
- группо- и видоспецифичные антигены: белки, составляющие оболочку нуклеокапсида — р24;
- типоспецифичные антигены: белки, которые обеспечивают связь с клетками-мишенями — gр120 и белки, обеспечивающие проникновение вирионов в клетки — gр41.
ВИЧ обладают высокой биологической активностью и частотой генетических изменений (высокой изменчивостью), которые возникают в процессе самовоспроизведения, что создает большие препятствия на пути создания вакцины и эффективных лекарств.
Репликация ВИЧ
Репликация (воспроизведение) ВИЧ происходит в клетке хозяина поэтапно.
-
Встреча с клеткой. Вирионы в организме человека присутствуют во всех биологических жидкостях, но в эпидемиологическом плане наибольшую опасность представляют кровь, влагалищный секрет и сперма, имеющие в достаточном для заражения концентрацию инфекционного материала.
Рис. 12. ВИЧ заражают иммунную клетку (обозначено желтым).
Рис. 13. Вирионы собираются под внешней мембраной клетки. Видны необычные выпячивания — места выхода вирионов.
Рис. 14. На фото показан процесс почкования ВИЧ (образование вирионов).
Рис. 16. На поверхности зараженной клетки видны множественные пузыри, между которыми появились новообразованные вирусы. Пузырьки значительно больше по размеру и менее плотные, чем ВИЧ.
Мутации ВИЧ
- ВИЧ является самым патогенным и распространенным среди всех вирусов. Незначительные изменения в его геноме приводят к появлению большого числа новых штаммов, что позволяет возбудителю ускользать от иммунной системы больного и приобретать лекарственную устойчивость к противовирусным препаратам. Антигенная изменчивость ВИЧ в разы превышает изменчивость вирусов гриппа и атипичной пневмонии, частота мутаций которых составляет 10 -5 нуклеотидов в день. Его скорость транскрипции выше, чем у других вирусов и составляет около 20 млн. вирусных частиц в сутки. Все это затрудняет как диагностику, так и поиск методов специфической профилактики этого грозного заболевания.
- В организме инфицированного больного происходит беспощадная борьба между его иммунной системой и ВИЧ. Под воздействием иммунитета вирус мутирует. Но, как установили ученые, постоянные мутации приводят к ослаблению микроорганизма: снижается его поражающая способность, удлиняются сроки развития СПИД.
Устойчивость ВИЧ во внешней среде
- Нагревание до 56°С инактивирует вирус в течение 30 минут, при кипячении вирус погибает мгновенно.
- Возбудитель чувствителен ко всем дезинфицирующим средствам: перекиси водорода, лизолу, эфиру, ацетону, гипохлориту натрия, этиловому спирту, хлорамину, хлорной извести и др. Инактивация наступает в течение 3 — 5 минут.
- Гибель вируса наступает при изменении pH среды — ниже 0,1 и выше 13.
- Губительным является ультрафиолетовое и ионизирующее излучение.
- В крови и ее компонентах для переливания ВИЧ живут годы.
- В жидкой среде при температуре от 23 до 27°С — 25 суток.
- В замороженной сперме — несколько месяцев, сыворотке крови — до 10 лет.
- ВИЧ погибают при замораживании ниже 70°С;
- В высушенном виде в сыворотке крови и сперме сохраняют жизнеспособность в течение суток.
Рис. 18. Множество созревших вирионов готовы инфицировать другие клетки.

Китайские врачи опробовали CRISPR-отредактированные клетки на пациенте с ВИЧ-инфекцией и Т-клеточной лейкемией. После облучения больному ввели его собственные кроветворные клетки, в которых разрушили ген CCR5. Отредактированные клетки прижились в организме и образовали разные типы клеток крови. Серьезных побочных эффектов не возникло. Правда, защитить пациента от вируса они не смогли — из-за низкой эффективности редактирования. Статья опубликована в журнале New England Journal of Medicine.
В 2017 году Лей Сюй (Lei Xu) из Центра исследований стволовых клеток пекинского университета и его коллеги запустили небольшое клиническое исследование, чтобы попробовать создать устойчивость к ВИЧ в клетках крови с помощью CRISPR/Cas9. В своей статье ученые отчитываются о первом пациенте, который прошел их новую терапию. Кроме технологии редактирования, которую использовали китайские ученые, есть и еще одна деталь, которая отличает их эксперимент от исследования Sangamo Therapeutics. Китайцы забирали у пациента не Т-клетки, а стволовые клетки крови. Расчет был на то, что кроветворные клетки приживутся в красном костном мозге и будут постоянно поставлять в организм пациента устойчивые к ВИЧ Т-лимфоциты.
Ученые работали с 27-летним пациентом, у которого кроме ВИЧ-инфекции диагностировали еще и Т-клеточную лейкемию. Его планировали лечить лучевой терапией, которая убивает существенную часть клеток крови, и пересадка кроветворных клеток ему понадобилась бы в любом случае. Ученые решили совместить лечение с экспериментальной процедурой: после облучения ввели больному уже отредактированные собственные клетки. В этот момент антиретровирусную терапию пришлось прервать, чтобы можно было оценить результат эксперимента.
CRISPR-модифицированные клетки прижились в организме и не вызвали острого отторжения. С начала эксперимента прошло уже 19 месяцев, и клетки с разрушенным геном CCR5 все еще можно найти в крови пациента — причем не только Т-лимфоциты, но и другие клетки крови. Это значит, что отредактированные кроветворные клетки работают полноценно и производят разные типы клеток, у которых мутация сохраняется.
Тем не менее, полностью отредактировать кроветворение пациента не удалось. Среди всех клеток, которые ученые у него забрали для редактирования, внести изменения в геном получилось лишь у 17,8 процентов. После возвращения в организм новые клетки начали конкурировать со старыми за заселение красного костного мозга. И в течение всего времени наблюдения они составляли лишь 5-8 процентов от общей кроветворной популяции.
Однако сделать пациента устойчивым к вирусу не удалось: после отмены ретровирусной терапии количество вирусной РНК в крови начало расти, и ему пришлось снова назначить лечение, чтобы инфекция не прогрессировала. В этом смысле китайский эксперимент, равно как и испытание Sangamo Therapeutics, не достиг заявленной цели. Причиной тому стала низкая эффективность редактирования. В китайском эксперименте она была ниже 20 процентов, в исследовании Sangamo Therapeutics — 11-28 процентов, и этого количества клеток недостаточно, чтобы справиться с инфекцией. Для того, чтобы ввести технологию редактирования генов в клиническую практику борьбы с ВИЧ, исследователям придется сначала повысить эффективность метода.
Тем не менее, авторы работы отмечают, что у их исследования есть и позитивный результат. Этот эксперимент — самое долгое на сегодняшний день наблюдение за CRISPR-отредактированными клетками в организме человека, и оно показывает, что такие клетки могут быть безопасны. Исследователи не обнаружили в клетках никаких незапланированных изменений (то есть следов нецелевого редактирования генома). Клетки также не превратились в опухолевые — о чем предупреждали некоторые ученые в 2018 году. Таким образом, китайская работа стала демонстрацией принципа: CRISPR-модифицированные клетки можно использовать в терапевтических целях без риска для пациента.
19 октября 2016
- 6829
- 5,6
- 1
- 9
Система CRSIPR/Cas9 удалит вирусную информацию в геноме человека, зараженного ВИЧ

Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
CRISPR/Cas9
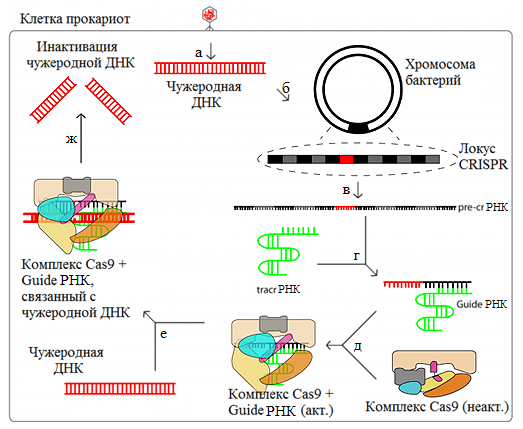
Рисунок 1. Система CRISPR/Cas9 как один из вариантов бактериального иммунитета. а — Внедрение чужеродной ДНК в клетку бактерии. б — Приобретение спейсера. в — Транскрипция CRISPR-локуса. г — Образование guideРНК. д — Образование активного комплекса Cas9 + guideРНК. е — Связывание чужеродной ДНК. ж — Внесение двухцепочечного разрыва в ДНК. Сокращения см. в тексте.
Но затем в 2012 году бактериальную защитную систему взяли на вооружение ученые, ведь если соединить Cas9 с определенной РНК, то можно разрезать необходимый ген. Разрезанный ген запускает в клетке систему репарации, которая в буквальном смысле пытается соединить концы с концами. При этом происходят различные мутации репарируемого гена — в основном удаления, но бывают и разные вставки. Однако если мы предоставим матрицу для репарации, ген может вернуться к правильной форме. Так можно вносить любые изменения в геном. Это означает, что мы в теории можем лечить генетические заболевания, рак и не только. Сегодня мы поговорим о том, как CRISPR/Cas9 поможет решить проблему избавления от вируса иммунодефицита человека (ВИЧ).
ВИЧ — возбудитель синдрома приобретенного иммунодефицита (СПИДа) — относится к роду лентивирусов семейства ретровирусов, чей геном представлен двумя копиями одноцепочечной РНК, на двух концах которой находятся длинные концевые повторы (или по-английски long terminal repeat, LTR) [7]. В самой вирусной частице содержатся еще три фермента: протеаза, обратная транскриптаза и интеграза (рис. 2). Протеаза расщепляет продукты считывания вирусных генов с образованием зрелых белков.
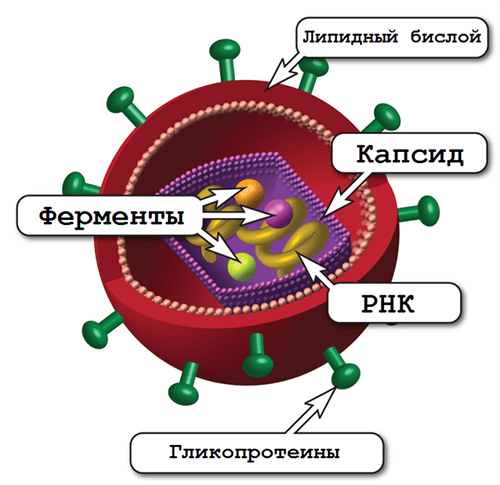
Рисунок 2. Строение вириона ВИЧ. Частица покрыта липидным бислоем, происходящим из клеточной мембраны организма-хозяина, и усеяна молекулами вирусных гликопротеинов.
Жизненный цикл ВИЧ довольно прост (рис. 3). Вначале вирус инфицирует клетку, причем в качестве рецептора служит молекула CD4, а корецепторами становятся рецепторы хемокинов, поэтому поражаются клетки иммунной системы: T-лимфоциты (T-хелперы), моноциты, макрофаги, а также клетки мозга (макрофаги, микроглия, астроциты), клетки лимфоидной ткани желудочно-кишечного тракта и другие. Затем одноцепочечный РНК-геном с помощью обратной транскриптазы превращается в двухцепочечную ДНК, так называемую провирусную ДНК. Наконец интеграза встраивает двухцепочечную провирусную ДНК в геном хозяина. Эта встроенная информация считывается, причем промоторами (то есть местами, привлекающими РНК-полимеразу для транскрипции) служат длинные концевые повторы — LTR. Собираются новые вирусные частицы, поражающие новые клетки. В целом весь этот процесс приводит к частым мутациям вируса, особенно вариабельны поверхностные гликопротеины, в том числе поэтому частицы ВИЧ так неуловимы для нашего иммунитета [8], [9].
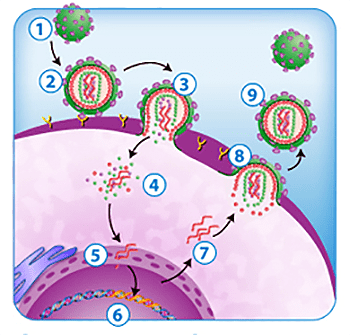
Рисунок 3. Жизненный цикл ВИЧ. 1 — зрелая вирусная частица; 2 — связывание с клеткой благодаря рецепторам; 3 — слияние мембран вируса и клетки; 4 — высвобождение вирусной РНК; 5 — превращение РНК в ДНК (обратная транскрипция); 6 — интеграция в геном клетки; 7 — считывание вирусной информации; 8 — сборка и выход вирусной частицы; 9 — новая вирусная частица.
Терапия ВИЧ

Рисунок 4. Удаление провируса из генома человека приведет к невозможности размножения и распространения вируса.
Современная высокоактивная антиретровирусная терапия основывается на ингибировании обратной транскриптазы, протеазы, интегразы, слияния вируса с клеткой, что значительно осложняет жизнь вируса. Но все же ВИЧ-инфекция в настоящий момент остается неизлечимым заболеванием, так как такая терапия никак не влияет на ДНК вируса у нас в геноме: у пациентов, принимающих антиретровирусную терапию, около 10 6 клеток содержат провирус. Сверх того, у пациентов могут быть серьезные побочные эффекты или устойчивость к антиретровирусной терапии [10].
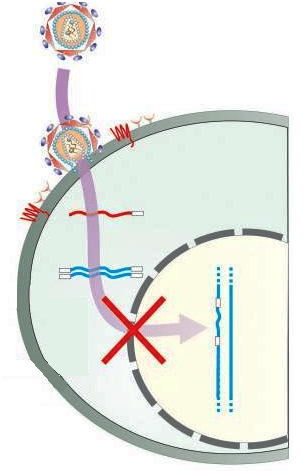
Рисунок 5. Система CRISPR/Cas9, интегрированная в клетки, может препятствовать их заражению вирусом и интеграции вируса в геном.
Предложенная система протестирована японскими учеными в 2013 году на культуре клеток человеческих T-лимфоцитов [8]. В качестве мишени они предложили использовать LTR, а в них — разные участки, необходимые для связывания факторов инициации и элонгации транскрипции. Трехкратное внесение в клетки конструкции CRISPR/Cas9 снижало считывание вирусного генома почти в 3 раза (с 97,8% до 35,5%). Дальнейший анализ показал, что почти все клетки содержали в области провируса различные мутации.
Так как LTR — это концевые повторы, то разрезание с двух концов теоретически может привести к полному вырезанию встроенного в геном вирусного куска. И действительно — почти у трети клеток (31,8%) после трехкратного внесения системы CRISPR/Cas9 этот участок полностью удалялся.
А что насчет мутаций вируса? Ведь если целевой участок изменит свою структуру, система CRISPR/Cas9 не сможет его найти и обезвредить. Понимая это, ученые выбрали именно тот участок LTR, что содержит высококонсервативные последовательности ДНК, практически одинаковые у всех подвидов ВИЧ.
Не все так просто

Рисунок 6. Повышение специфичности разрезания гена с использованием никаз, вносящих одноцепочечные разрывы.
Предложенная система изменения генов не так чудесна, как может показаться на первый взгляд, как бы я ни старалась вас в этом убедить. Есть много подводных камней, которые требуют дальнейшего исследования.
Одной из главных проблем этого метода остается его эффективность. Зачастую работы по прицельному изменению одного участка требуют много времени и средств, но не приводят к 100% результату: не все мишени удается найти и исправить.
Таким образом, стремительно развивающаяся генная терапия с использованием CRISPR/Cas9 — ключ к избавлению от ВИЧ-инфекции и ассоциированных с ней заболеваний и осложнений. Однако не стоит ожидать, что такое лекарство сегодня-завтра появится на прилавках в аптеке, ведь еще о многом стоит подумать, чтобы разработать действительно эффективное и безопасное лечение.


Ученым удалось удалить ВИЧ-инфекцию из ДНК мышей. С помощью долгосрочной лекарственной терапии и инструмента для редактирования генома исследователи смогли избавить клетки от вируса.
Как сообщает Университет Темпл из штата Пенсильвания в США, вирусологам из Медицинской школы Каца и Медицинского центра университета Небраски удалось успешно удалить ДНК ВИЧ-инфекции из генома зараженных мышей. Исследование проводилось на гуманизированных грызунах - специально выведенные животные способны производить Т-лимфоциты человека, восприимчивые к ВИЧ. Побороть инфекцию ученым удалось с помощью антиретровирусной терапии (АРТ) длительного действия и технологии для редактирования генома CRISPR-Cas9.


Ранее ученым уже удалось устранить геном ВИЧ из культивируемых клеток человека - для этого использовалась технология CRISPR-Cas9. Исследование показало, что такая система позволяет вырезать большие фрагменты вирусного ДНК из инфицированных клеток. Новая технология объединена с антиретровирусной терапией длительного действия - LASER ART. Это новый, модифицированный препарат, который приостанавливает репликацию ВИЧ на длительный период. Лекарство "упаковывают" в нанокристалы, которые доставляю его в ткани со "спящим" вирусом. Оказавшийся в нужном месте препарат остается там на несколько недель, медленно высвобождая активное вещество, подавляющее активность ВИЧ.
- Мы хотели посмотреть, сможет ли LASER ART подавлять репликацию ВИЧ достаточно долго для того, чтобы CRISPR-Cas9 полностью избавил клетки от вирусной ДНК, - рассказал один из создателей CRISPR-Cas9 доктор Камель Халили.
В ходе эксперимента к гуманизированным мышам, зараженным ВИЧ, применяли препарат LASER ART, после чего вводили им CRISPR-Cas9. Как только технология удаляла вирусную ДНК из генома животных, подопытных обследовали. В результате полная элиминация вируса была обнаружена у трети мышей, инфицированных ВИЧ. В ходе дальнейших исследований выяснилось, что после лечения ВИЧ не обнаруживается ни в крови, ни в лимфоидной ткани, ни в костном мозге и головном мозге.


В течение года исследователи планируют испытать новую технологию борьбы ВИЧ на приматах и, если это будет возможно, на людях. Пока результаты исследований являются предварительными - ученым до сих пор не удалось понять, почему некоторым зараженным мышам не удалось избавиться от вируса.
На данный момент лечение ВИЧ-инфекции основано на применении антиретровирусных препаратов. Они не избавляют от вируса полностью, но не дают ему распространяться в организме. АРТ требует постоянного применения на протяжении всей жизни зараженного пациента. В случае приостановки терапии ВИЧ возобновляет репликацию, что впоследствии приводит к конечной стадии развития вируса - СПИДу. АРТ значительно снизила смертность от ВИЧ, однако побороть распространение вируса до конца пока не удалось.
На данный момент существует лишь два человека, полностью излечившихся от ВИЧ. Это так называемые "берлинский пациент" Тимоти Браун, избавившийся от вируса в 2008 году в ходе лечения рака крови, и "лондонский пациент", имя которого пока не сообщается - о нем миру стало известно в марте 2019 года. Оба ВИЧ-инфицированных перенесли трансплантацию костного мозга, после чего медики обнаружили у них отсутствие инфицированных клеток.
Читайте также:


