Рнк вирусы при вич

В интернете можно найти немало информации о новом коронавирусе. Но далеко не все предоставленные сведения являются правдой. Для того, чтобы знать, как избежать заражения и не впасть в паническое состояние, необходимо отличать правду от лжи и домыслов. В период пандемии информационный детокс имеет огромное значение.
В частности, в сети можно найти информацию о сходстве ДНК и ВИЧ. Существуют даже различные конспирологические теории о том, что новое заболевание имеет неестественное происхождение. Вот от таковых необходимо сразу же отказаться.
Новая инфекция — не чье-либо биологическое оружие, а результат мутации уже существовавшего коронавируса. А вот в чем сходство ВИЧ и коронавируса, вы узнаете в нашей статье.
Сходства ДНК коронавируса и ВИЧ
О сходстве ДНК коронавируса и ВИЧ ученые начали говорить еще в феврале 2020 года. Исследователи из Индии вывели в геноме возбудителя новой коронавирусной инфекции четыре аномальные вставки. По словам ученых, у других вирусов из данной группы нет ничего похожего, однако нечто похожее есть у ВИЧ-ретровируса. По этой причине исследователи предположили, что у нового коронавируса искусственное происхождение.
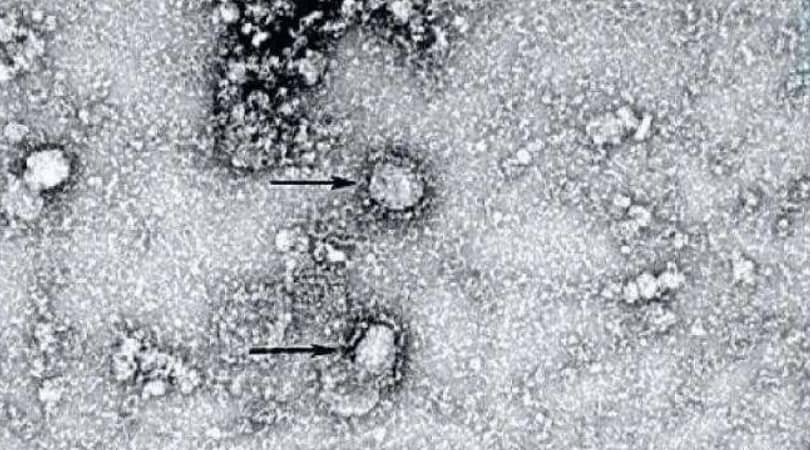
Материал из статьи индийских исследователей
Тем не менее, выводы индийцев критикуют как ненаучность. Одним из критиков является наш соотечественник, сотрудник Сибирского Института Клинической и Экспериментальной Медицины, Илья Цырлов. По его словам, выводы о сходстве вставок с белками генома ВИЧ ложны, и 2 из четырех содержатся в коронавирусе летучих мышей.
К аналогичному выводу пришел и доктор Конерманн из Стэнтфордского университета. Ученый утверждает, что 2 из указанных индийскими исследователями вставок действительно найдены в возбудителе коронавирусной инфекции у летучих мышей. Из оставшихся двух сходство с ВИЧ есть только у одной, но вставки вируса иммунодефицита гораздо длиннее. Поэтому сходство можно считать незначительным.
В свою очередь, ученый из Университета Джорджии Сонг Янг отмечает, что схожий набор генных вставок можно обнаружить в коронавирусе Bat-SARS Like CoV, который был отрыт в 2013 году. Все вышеперечисленные ученые сходятся во мнении, что вирус 2019-nCoV имеет естественное происхождение и не имеет отношения к ВИЧ.
Течение коронавируса при ВИЧ
Чтобы понять, каково течение коронавируса при ВИЧ, прежде всего необходимо вспомнить, что происходит с организмом при инфицировании вирусом иммунодефицита человека. Патоген в первую очередь оказывает влияние на иммунную систему заболевшего. Говоря простыми словами, иммунитет перестает справляться с болезнетворными бактериями и вирусами.
В свою очередь, у Covid-19 есть 2 стадии — легкая и тяжелая. Легкий период наступает сразу же после инкубации патогена. Стадия характеризуется такими симптомами, как сухой кашель, температура и общая слабость. Если иммунитет у больного достаточно крепок, он переборет болезнь, и здоровье человека придет в норму.
Если этого не произойдет, наступит тяжелая стадия, характеризующаяся атипичной пневмонией и невозможностью самостоятельно дышать. Бесконтролькое размножение патогена может привести к смерти пациента.
Учитывая деградацию иммунной системы, коронавирус при ВИЧ нередко протекает в тяжелой форме. Поэтому ВИЧ-положительных пациентов можно отнести к группе риска. Особенно это касается больных, не проходивших антиретровирусную терапию.
Почему коронавирус лечат лекарством от ВИЧ?
Калетра — это лекарственное средство, относящееся к антиретровирусной терапии. Как препарат от ВИЧ-инфекции, данное лекарство официально одобрено Минздравом и ВОЗ. Клинические опыты также показали, что лекарственное средство эффективно и при лечении Covid-19. Таким образом, Калетра — это лекарство от ВИЧ и коронавируса.
Препарат содержит сразу 2 активных компонента: Лопинавир и Ритонавир. Это — мощные ингибиторы белков РНК патогена, препятствующие активному синтезу вирионов. Новые вирусные агенты производятся с мутациями, делающими их нежизнеспособными.

Эффект от приема лекарства от ВИЧ и коронавируса зависит от диагноза и общего состояния больного. В случае ВИЧ, прием Калетры по назначению врача обеспечивает снижение вирусной нагрузки и избежание перехода заболевания в стадию СПИДа. При своевременном лечении Covid-19 можно обеспечить полное выздоровления больного.
Но почему коронавирус лечат лекарством от ВИЧ, если между этими вирусами нет подтвержденного генетического сходства? Дело в том, что для жизнедеятельности вирусу нужен белковый фермент протеаза. Лопинавир и Ритонавир блокируют данный белок, поэтому и используются в рамках борьбы с Covid-19. Следует уточнить, что все методы терапии коронавируса экспериментальны, точный способ лечения новой болезни еще не выявлен.
Просто о сложном


-->СТАТЬИ -->
| [07.07.2014] | [Вирусы] |
| Натуральная оспа (0) | |
| [18.07.2014] | [Вирусы] |
| Вирусы. Краткий обзор (0) | |
| [21.07.2014] | [Общие понятия] |
| Вирусология (0) | |
| [03.07.2014] | [Общие понятия] |
| Немного истории (0) | |
| [04.07.2014] | [Инфекции] |
| Цитомегаловирусная инфекция (0) | |
| [21.08.2014] | [Вирусы] |
| Вирус иммунодефицита человека (ВИЧ) (0) | |
| [22.08.2014] | [Вирусы] |
| Строение и жизненный цикл вируса иммунодефицита человека (ВИЧ) (1) | |
| [09.02.2016] | [Вирусы] |
| Лихорадка Зика (0) | |
Строение вируса иммунодефицита человека
 |
| Строение вируса иммунодефицита человека |
Вирионы ВИЧ имеют вид сферических частиц, диаметр которых составляет около 100—120 нанометров (это приблизительно в 60 раз меньше диаметра эритроцита).
В состав зрелых вирионов входит несколько тысяч белковых молекул различных типов.
Капсид зрелого вириона, состоящий из примерно 2000 молекул белка р24, имеет форму усечённого конуса.
Внутри капсида находится белково-нуклеиновый комплекс: две нити вирусной РНК, прочно связанные с белком нуклеокапсида p7, ферменты (обратная транскриптаза, протеаза, интеграза).
С капсидом также ассоциированы белки Nef и Vif (7—20 молекул Vif на вирион).
Внутри вириона (и, вероятнее всего, за пределами капсида) обнаружен белок Vpr8-11. Кроме того, с капсидом ВИЧ-1 (но не ВИЧ-2) связазны около 200 копий клеточного фермента пептидилпролилизомеразы, необходимого для сборки вириона.
Капсид окружён оболочкой, образованной примерно 2000 молекул матриксного белка p17. Матриксная оболочка в свою очередь окружена двуслойной липидной мембраной, являющейся наружной оболочкой вируса. Она образована молекулами фосфолипидов, захваченными вирусом во время его отпочковывания от клетки, в которой он сформировался.
С помощью белка gp120 вирус присоединяется к рецептору CD4 и корецептору, находящимся на поверхности Т-лимфоцитов человека. Стехиометрическое соотношение p24:gp120 в вирионе составляет 60—100:1.
Белки gp41 и в особенности gp120 интенсивно изучаются в качестве возможных мишеней для разработки лекарств и вакцины против ВИЧ .
При формировании наружной оболочки вируса также происходит захват некоторого количества мембранных белков клетки, в том числе человеческих лейкоцитарных антигенов (HLA) классов I и II и молекул адгезии.
Функции важных структурных белков ВИЧ-1
Сокращение
Описание
Функции
gp41 (TM, transmembrane)
Трансмембранный гликопротеин массой 41 кДа
gp120 (SU, surface)
Гликопротеин массой 120 кДа
Наружный белок вириона. Нековалентно связан с трансмембранным белком gp41. С одной молекулой gp41 связаны 3—5 молекул gp120. Способен связывать рецептор CD4. Играет важную роль в процессе проникновения вируса в клетку.
Белок массой 24 кДа
Образует капсид вируса
Матриксный белок массой 17 кДа
Около двух тысяч молекул этого белка образуют слой толщиной 5—7 нм, располагающийся между внешней оболочкой и капсидом вируса.
p7 (NC, nucleocapsid)
Нуклеокапсидный белок массой 7 кДа
Входит в состав ка псида вируса. Образует комплекс с вирусной РНК.
Геном и кодируемые белки
 |
| Геном ВИЧ-1 |
Геном ВИЧ-1
Генетический материал ВИЧ представлен двумя копиями положительно-смысловой (+)РНК. Геном ВИЧ-1 имеет длину 9000 нуклеотидов. Концы генома представлены длинными концевыми повторами (англ. long terminal repeat, LTR), которые управляют продукцией новых вирусов и могут активироваться и белками вируса, и белками инфицированной клетки. 9 генов ВИЧ-1 кодируют, по крайней мере, 15 белков.
Ген pol кодирует ферменты: обратную транскриптазу (RT), интегразу (IN) и протеазу (PR).
Ген gag кодирует полипротеин Gag/p55, расщепляемый вирусной протеазой до структурных белков p6, p7, p17,p24.
Ген env кодирует белок gp160, расщепляемый клеточной эндопротеазой фурином на структурные белки gp41 и gp120.
Другие шесть генов — tat, rev, nef, vif, vpr, vpu (vpx у ВИЧ-2) — кодируют белки, отвечающие за способность ВИЧ-1 инфицировать клетки и производить новые копии вируса. Репликация ВИЧ-1 in vitro возможна без генов nef, vif, vpr, vpu, однако их продукты необходимы для полноценной инфекции in vivo.
Gag: Полипротеин-предшественник Gag/p55 синтезируется с полноразмерной геномной РНК (которая в данном случае служит в качестве мРНК) в процессе стандартной кэп-зависимой трансляции, но возможна и IRES-зависимая трансляция. Предшественники функциональных белков располагаются в составе полипротеина Gag/p55 в следующем порядке: p17…p24…p2…p7…p1…p6 (р1 и р2 — соединительные пептиды; другие продукты расщепления Gag/p55 описаны выше).
Домен М, расположенный внутри области p17/МА, миристилируется (присоединяются остатки миристиновой кислоты) и направляет Gag/p55 к плазматической мембране. Домен I, находящийся внутри области p7/NC, отвечает за межмолекулярные взаимодействия отдельных мономеров Gag/p55. Домен L, также локализованный в области p7/NC, опосредует отпочковывание вирионов от плазматической мембраны; в этом процессе участвует также р6 область полипротеина Gag/p55.
Vpu: Двумя важными функциями белка Vpu являются:
1) разрушение клеточного рецептора CD4 в эндоплазматическом ретикулуме путём привлечения убиквитинлигазных комплексов и
Vpr: Белок Vpr необходим для репликации вируса в неделящихся клетках, в том числе макрофагах. Этот белок, наряду с другими клеточными и вирусными белками, активирует длинные концевые повторы генома ВИЧ. Белок Vpr играет важную роль в переносе провируса в ядро и вызывает задержку деления клетки в периоде G2.
Nef: Белок Nef выполняет несколько функций. Он подавляет экспрессию молекул CD4 и HLA классов I и II на поверхности инфицированных клеток, и тем самым позволяет вирусу ускользать от атаки цитотоксических T-лимфоцитов и от распознавания CD4+-лимфоцитами. Белок Nef может также угнетать активацию T-лимфоцитов, связывая различные белки-компоненты систем внутриклеточной передачи сигнала.
У инфицированных вирусом иммунодефицита макак-резусов активная репликация вируса и прогрессирование болезни возможны только при интактном гене nef. Делеции гена nef были обнаружены в штаммах ВИЧ, выделенных у группы австралийцев с длительным непрогрессирующим течением инфекции.
Однако у части из них со временем появились признаки прогрессирования инфекции, в том числе снижение числа CD4+-лимфоцитов. Таким образом, хотя делеции гена nef и могут замедлять репликацию вируса, это не гарантирует полной невозможности прогрессирования заболевания.
Tat и Rev: Регуляторные белки Tat (транс-активатор) и Rev накапливаются в ядре клетки и связывают определённые участки вирусной РНК. Белок Tat имеет молекулярную массу около 14-15 кДа, связывает вторичную структуру геномной РНК вблизи 5'-нетранслируемой области активирует обратную транскрипцию геномной РНК ВИЧ, синтез вирусных мРНК, необходим для репликации вируса почти во всех культурах клеток, регулирует выход вирионов из зараженных клеток, нуждается в клеточном кофакторе — циклине T1. Белок Rev регулирует экспрессию белков вириона, связывает мРНК гена env в области RRE (англ. Rev response element) интрона, разделающего экзоны генов Tat и Rev.
Белки Tat и Rev стимулируют транскрипцию провирусной ДНК и транспорт РНК из ядра в цитоплазму, а также необходимы для трансляции. Белок Rev обеспечивает также транспорт компонентов вируса из ядра и переключение синтеза регуляторных белков вируса на синтез структурных.
Жизненный цикл
На схеме показано слияние вирриона ВИЧ и плазматической мембраны Т-лимфоцита человека

Этап 1. Взаимодействие вирусного белка gp120 с клеточным рецептором CD4 (указано красной стрелкой)

Этап 2. Конформационные изменения вирусного белка gp120 обеспечивают связывание с клеточным рецептором CCR5 (указано красной стрелкой)

Этап 3. Концевые участки вирусного белка gp41 проникают в плазматическую мембрану клетки (указано красной стрелкой)

Этап 4. Вирусный белок gp41 подвергается значительным конформационным изменениям, складывается пополам (указано красной стрелкой) и образует спираль, что приводит к сближению и слиянию мембран вириона и клетки. Таким образом ВИЧ захватывает Т-лимфоцит с целью дальнейшей репродукции.
Проникновение в клетку и интеграция
Вирусная инфекция начинается, когда вирион ВИЧ сталкивается с человеческой клеткой, имеющей на своей мембране рецептор CD4. Вирусный гликопротеин gp120 прочно связывает рецептор CD4. В результате такого взаимодействия gp120 претерпевает конформационные изменения, которые позволяют ему также связать молекулу корецептора CXCR4 или CCR5 (экспрессируемых на поверхности Т-лимфоцитов, макрофагов, дендритных клеток и микроглии).
В зависимости от способности связывать эти корецепторы, ВИЧ классифицируют на R5-тропные (связывают только CCR5), X4-тропные (связывают только CXCR4) и R5X4-тропные (могут взаимодействовать с обоими корецепторами). Препараты, блокирующие корецепторы могут быть эффективны против ВИЧ.
После описанных событий мембрана клетки и мембрана вириона ВИЧ сливаются, и содержимое вириона проникает внутрь клетки. Белок gp41 очень важен для слияния мембран, поэтому его рассматривают в качестве мишени для разработки противовирусных препаратов. Внутри клетки вирусная РНК высвобождается из капсида, и происходит обратная транскрипция — синтез ДНК на основе матрицы одноцепочечной геномной РНК вируса, катализируемая обратной транскриптазой.
Большая часть лекарственных препаратов, одобренных для применения при ВИЧ-инфекции, направлена на нарушение работы обратной траскриптазы. Синтезированная ДНК транспортируется внутрь ядра клетки и встраивается в хромосому хозяина под действием интегразы. Несколько препаратов, ингибирующих интегразу, проходят ранние стадии клинических испытаний. Вирусная ДНК, встроившаяся в хромосому клетки, называется провирусом.
Человеческая РНК-полимераза в ядре клетки синтезирует информационную РНК (мРНК), а позднее и геномную РНК вируса. Синтезированные РНК транспортируются обратно в цитоплазму, где на матрице мРНК на рибосомах синтезируются вирусные ферменты, структурные и регуляторные белки.
Сборка и отпочковывание вирионов
Геномная РНК вируса, а также вирусные белки транспортируются к местам сборки вирионов. Сборка вирионов происходит на мембране, куда направляется миристилированный полипротеин Gag/p55. Вирионы первоначально формируются из полипротеинов-предшественников структурных белков и ферментов и на этой стадии не являются инфекционными.
В ходе созревания вирусной частицы вирусная протеаза расщепляет белки-предшественники до функциональных компонентов. Несколько одобренных противовирусных препаратов ингибируют работу протеазы и препятствуют формированию зрелых вирионов.
Новые вирусные частицы отпочковываются от поверхности клетки, захватывая часть её мембраны, и выходят в кровяное русло, а клетка хозяина, несущая рецептор CD4, погибает. Недавние исследования показали, что процесс отпочковывания вирионов может быть более сложным, чем считалось ранее. Так было обнаружено, что благодаря взаимодействию белка Gag с компонентами клетки вирионы накапливаются в особых внутриклеточных мультивезикулярных тельцах, которые обычно служат для экспорта белков. Таким образом вирусные частицы высвобождаются из клетки, эксплуатируя её собственную систему транспорта макромолекул.
Распространение по организму
В период острой фазы ВИЧ-инфекции отсутствие специфического иммунного ответа позволяет вирусу активно реплицироваться и достигать высоких концентраций в крови.
Вирус заселяет органы лимфатической системы, CD4 + -лимфоциты, CD8 + -лимфоциты и макрофаги, а также другие клетки: альвеолярные макрофаги лёгких,клетки Лангерганса, фолликулярные дендритные клетки лимфатических узлов, клетки олигодендроглии и астроциты мозга и эпителиальные клетки кишки.
В лимфоидной ткани ВИЧ размножается на протяжении всего заболевания, поражая макрофаги, активированные и покоящиеся CD4 + -лимфоциты и фолликулярные дендритные клетки. Количество клеток, содержащих провирусную ДНК, в лимфоидной ткани в 5—10 раз выше, чем среди клеток крови, а репликация ВИЧ в лимфоидной ткани на 1—2 порядка выше, чем в крови.
Резервуаром ВИЧ служат лимфатические узлы и конкретно дендритныe клетки, в которых вирус сохраняется длительное время после периода острой виремии.
Для активации CD8 + -лимфоцитов и образования антиген-специфических цитотоксических T-лимфоцитов необходима презентация пептидного антигена в комплексе с человеческим лейкоцитарным антигеном класса I.
Дендритные клетки, необходимыe для начала первичных антиген-специфичных реакций, захватывают антигены, перерабатывают и переносят их на свою поверхность, где эти антигены в комплексе с дополнительными стимулирующими молекулами активируют T-лимфоциты.
Заражённые клетки часто не выделяют дополнительных стимулирующих молекул и поэтому не способны вызвать активацию достаточного числа B и T-лимфоцитов, функция которых зависит от дендритных клеток.
После завершения обратной транскрипции в CD4 + -лимфоците вирусный геном представлен провирусной невстроенной ДНК. Для встраивания провирусной ДНК в геном клетки-хозяина и для образования новых вирусов необходима активация T-лимфоцитов.
Контакт CD4 + -лимфоцитов и антигенпредставляющих клеток в лимфоидной ткани, наличие вирусов на поверхности фолликулярных дендритных клеток и присутствие провоспалительных цитокинов (ИЛ-1, ИЛ-6 и ФНОα) способствуют размножению ВИЧ в инфицированных клетках. Именно поэтому лимфоидная ткань служит самой благоприятной средой для репликации ВИЧ.
На 2014 год ВИЧ-инфекция остаётся неизлечимым заболеванием, так как геном вируса интегрируется в хромосомы клеток и может реактивироваться даже после курса антиретровирусной терапии.
В настоящее время идёт поиск безопасных способов редактирования генома человека и исключения из него провирусной ДНК. В 2014 году был предложен метод удаления генома ВИЧ-1 из заражённых клеток при помощи системы CRISPR/Cas9. С помощью этого метода исследователям удалось вырезать фрагмент провирусной ДНК, заключённый между 5'- и 3'-концевыми LTR-областями из хромосом зарежённых клеток в культуре.
Кроме того, этот метод оказался также эффективным для профилактики заражения неинфицированных клеток. Описанный подход может привести к разработке способа полного избавления от ВИЧ-инфекции.
14 октября 2013
- 19751
- 15,7
- 2
- 4
Распространенность СПИДа в мире на 2009 год.

Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Иммунная система

Рисунок 1. Упрощенная схема иммунного ответа. Молниями указано, как один тип клеток активирует другие. Мф — макрофаг, Б — бактерия, ТХ — Т-хелпер, ВКл — B-клетка, ПлКл — плазматическая клетка, Ат — антитела, Б+Ат — бактерия, покрытая антителами, привлекающими макрофагов, В — вирус, ЗМф — зараженный макрофаг, ТК — Т-киллер, ЗК — клетка, зараженная вирусом, УК — умирающая (апоптотирующая) клетка, В+Ат — вирус, покрытый антителами.
рисунок автора статьи
Жизненный цикл ВИЧ
Видео. Жизненный цикл ВИЧ.

Обратная транскрипция осуществляется вирусным белком обратной транскриптазой [31]. Обратная она потому, что обычно в клетке все наоборот — информация переносится с ДНК на РНК (а с РНК — в последовательность аминокислот белков). РНК по сравнению с ДНК очень нестабильна, и поэтому для ВИЧ характерна огромная скорость мутации — в десятки тысяч раз быстрее, чем для человека. Если скорость нейтральных мутаций для ДНК составляет у различных видов и для различных генов в среднем меньше 10 −9 замен на сайт в год, то скорость мутирования генетического материала РНК-вирусов — около 10 −3 замен на сайт в год (у гена env ВИЧ: 10 −2 –10 −3 замен на сайт в год [21]). Это одна из причин, почему иммунная система не может справиться с ВИЧ — он слишком быстро изменяется.
Таким образом, после того как копия вируса в геноме клетки начинает действовать, на её поверхности появляются знакомые нам белки gp41 и gp120, в цитоплазме — остальные вирусные белки и вирусная РНК. И через некоторое время от зараженной клетки начинают отпочковываться всё новые и новые копии ВИЧ.
Способы уничтожения иммунной системы
При отпочковывании вирус использует клеточную мембрану клетки, и со временем это должно вызвать ее разрушение. К тому же, вирусный белок Vpu вызывает увеличение проницаемости мембраны клетки [6]. При активации вируса в клетке появляется неинтегрированная в геном двуцепочечная ДНК [19], наличие которой может рассматриваться клеткой как повреждение ее генетического материала и индуцировать ее смерть через апоптоз (С точки зрения организма такая клетка потенциально может стать раковой). Помимо этого, вирусные белки напрямую нарушают баланс про- и противоапоптотических белков в клетке. К примеру, вирусная протеаза p10 может разрезать противоапоптотический фактор Bcl-2. Белки Nef [26], Env [22] и Tat [24] вовлечены в возрастание количества клеточных белков CD95 и FasL, служащих индукторами апоптоза по т.н. Fas-опосредованному пути. Белок Tat положительно регулирует каспазу 8 [2] — ключевой фактор индукции апоптоза.
Если же клетки не погибли сами, они активно уничтожаются Т-киллерами. (Это стандартный ответ иммунитета на заражение любыми вирусами.)
Помимо этого, при производстве gp120 и Tat часть их выбрасывается зараженной клеткой в кровоток, а это оказывает токсическое действие на организм [4], [28]. gp120 оседает на все СD4 + -клетки (в том числе и здоровые), что имеет три последствия:
- Белок СD4 важен для взаимодействия Т-хелпера с фагоцитом, при слипании же СD4 с gp120 T-хелпер перестает выполнять эту функцию.
- На gp120 как на чужеродный белок образуются антитела; после оседания gp120 на здоровые клетки, последние маркируются антителами, и иммунная система их уничтожает [9].
- После обильного связывания Т-хелпером gp120 клетка умирает сама. Дело в том, что CD4 — это корецептор. Он усиливает сигнал от TCR (T-cell receptor) — главного белка, позволяющего выполнять Т-клеткам функцию иммунитета. В норме эти рецепторы активируются вместе. Если же активируется один тип рецепторов, но не активируется другой, это является сигналом, что что-то пошло не так, и клетка умирает посредством апоптоза.
Антитела, призванные препятствовать инфекции, в случае с ВИЧ часто, наоборот, ее усиливают [28]. Почему так происходит — не совсем понятно. Одну причину мы рассмотрели выше. Возможно, дело в том, что антитела сшивают несколько вирусных частиц вместе, и в клетку попадает не один, а сразу много вирусов. Помимо этого, антитела активируют клетки иммунитета, а в активированной клетке вирусные белки синтезируются быстрее.
Вдобавок, gp120 и gp41 имеют участки, похожие на участки некоторых белков, участвующих в иммунитете (например, MHC-II [25], IgG [23], компонент системы комплемента Clq-A [14]). В результате на эти участки образуются антитела, способные помимо вируса маркировать совершенно здоровые клетки (если на них будут эти белки), с соответствующими для них последствиями.
Так как на поверхности зараженной клетки появляется gp120, то она, как и вирусная частица, будет сливаться с другими СD4-содержащими клетками, образуя огромную многоядерную клетку (синцитий), неспособную выполнять какие-либо функции и обреченную на смерть.
На самом деле, помимо Т-хелперов, СD4 содержатся во множестве других клеток — предшественниках Т-киллеров/Т-хелперов, дендритных клетках, макрофагах/моноцитах, эозинофилах, микроглии (последние четыре — разновидности фагоцитов), нейронах (!), мегакариоцитах, астроцитах, олигодендроцитах (последние две — клетки, питающие нейроны), клетках поперечно-полосатых мышц и хорионаллантоиса (присутствует в плаценте) [29]. Все эти клетки способны заражаться ВИЧ, но сильно токсичен он лишь для Т-хелперов. Это и определяет основное клиническое проявление СПИДа — сильное снижение количества Т-хелперов в крови. Однако для других клеток заражение тоже не проходит бесследно — у больных СПИДом часто снижена свертываемость крови, имеются неврологические и психиатрические отклонения [16], наблюдается общая слабость.
Пути заражения ВИЧ
Внимание! Ввиду того, что СПИД является венерическим заболеванием, информация, приведенная в этом разделе, может вас оскорбить либо вызвать неприятные эмоции при прочтении. Будьте осторожны.
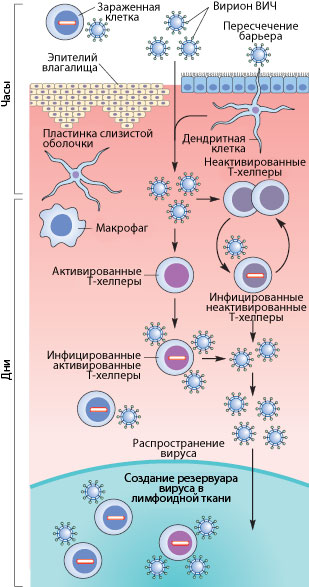
Рисунок 3. Пути проникновения ВИЧ в организм при половом контакте. Слева указано примерные временные рамки каждого этапа.
Как же происходит первичное заражение человека ВИЧ? Думаю, что с переливанием крови или с использованием общего шприца при употреблении наркотиков читателю все понятно — вирус доставляется напрямую из зараженной крови в здоровую. При вертикальном способе передачи инфекции (от матери к ребенку) заражение может произойти во время внутриутробного развития, в момент родов или в период кормления ребенка грудью (т.к. вирус и зараженные вирусом клетки содержатся в молоке матери) [17], [20]. Тем не менее, даже у ребенка, рожденного от ВИЧ-инфицированной матери, есть шанс остаться здоровым, особенно если мать использует ВААРТ (высокоактивную антиретровирусную терапию) [5]. А почему же люди заражаются при половом контакте?
Механизмы передачи вируса при половом акте не до конца ясны. Тем не менее, они понятны в общих чертах. Итак, рассмотрим барьеры, которые необходимо преодолеть вирусу, чтобы добраться до макрофагов и Т-хелперов. К сожалению, рассматривать особо нечего: барьер только один — это слой эпителиальных клеток и вырабатываемая ими слизь, находящиеся во влагалище (а также пенисе, прямой кишке, глотке). Барьер этот тонок — он может быть всего одну клетку в толщину, — но для вируса труднопреодолим, доказательством чего может служить сравнительно небольшой процент заражений — примерно 1–2 случая на 100 половых контактов. Итак, и какими же путями преодолевает вирус это препятствие?
Наиболее очевидный механизм — это микротравмы. При обычном половом контакте, а особенно при анальном сексе, почти неизбежно появляются микротрещины; при наличии же венерических заболеваний часто возникают изъязвления слизистой. Через эти микротравмы вирус, содержащийся в сперме и влагалищном секрете, может проникнуть к иммунокомпетентным клеткам [17], [20].
Помимо дендритных клеток, в кишечнике существует другой тип клеток, предназначенный для ознакомления организма с антигенами внешней среды. Это так называемые М-клетки, пропускающие через себя довольно крупные объекты неповрежденными из просвета кишечника. В т.ч. через них может проходить и вирион ВИЧ.
Свой вклад в заражение вносит и провоспалительный процесс, в норме присутствующий в женских половых путях из-за наличия в них спермы. Благодаря ему Т-клетки подвержены активации, что способствует их восприимчивости к инфекции.
Итак, риск заразиться ВИЧ возрастает в ряду (Классический секс → Анальный секс → переливание крови / использование общих шприцов при принятии наркотиков). Что же касается орального секса, то весьма небольшой шанс заразиться есть только у принимающей стороны — слюна и тем более желудочный сок инактивирует ВИЧ. Теоретически, этим способом может заразиться и мужчина, но для этого необходимы ранки на пенисе.
При поцелуях и обычных бытовых контактах вирус не передается — он очень неустойчив в окружающей среде .
Заключение
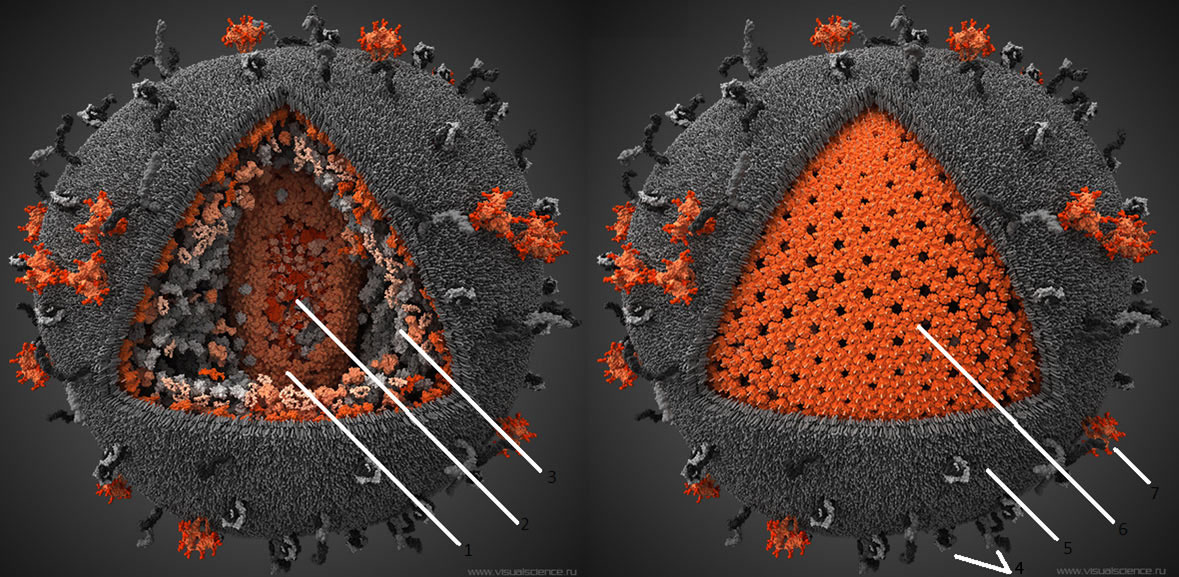
10000 нуклеотидов в каждой. Всего геном включает девять генов, которые в результате альтернативного сплайсинга кодируют 15 различных белков. 3 — Различные белки, захваченные вирусом из хозяйской клетки. 4 — Человеческие белки, обычно находящиеся на поверхности мембраны клеток. Захваченые в результате отпочковывания, они увеличивают вирулентность вируса. 5 — Внешняя оболочка ВИЧ, ведущая свое происхождение от цитоплазматической мембраны клетки, от которой когда-то отпочковался вирион. 6 — Матрикс, образованный тримерами белка р17. 7 — Тримерные комплексы белков gp120 и gp41, при помощи которых вирус проникает в клетку. На поверхности среднего вириона насчитывается около 20 таких тримеров. Чтобы увидеть рисунок в полном размере, нажмите на него.
. Все эти факты позволяют надеяться, что вскоре ВИЧ, как и оспа, останется в прошлом.
Читайте также:
- Как скрыть от парня что у меня вич
- Лечение хронического трихомониаза наксоджином
- Вич инфицированные за 2009
- Может ли при вич инфекции быть хорошим мазок
- Почему нет смысла изолировать вич инфицированных
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.

