Экспериментальная группа по вич
Мэтт Шарп спокойно наблюдал, как медсестра закрепила иглу капельницы в его руке. Шарп знал, на что идет: будучи одним из первых людей, на которых испытывали экспериментальный метод лечения, он мог в итоге получить дозу бешеных клеток-мутантов. Но он был так заворожен целью эксперимента, что не волновался. За те двадцать лет, что Шарп жил с ВИЧ, он успел увидеть, как на пике эпидемии СПИДа болезнь унесла жизни дюжин его друзей и возлюбленных. Он был убежден, что в этот день делает шаг к исцелению.
Грейс Гонзага из Центра клинических исследовний Quest в комнате, где она вливала отредактированные гены Мэтту Шарпу.
В последнее десятилетие пациенты с ВИЧ, такие как Шарп, оказались в авангарде научных исследований редактирования генов. Благодаря тому, что сообщество людей с ВИЧ имеет активную правозащитную сеть, а гены, из-за которых люди инфицируются ВИЧ, хорошо известны, пациенты с этим заболеванием становятся идеальными добровольцами инновационных — пусть иногда и рискованных — экспериментов. Методика редактирования генов, связанных с ВИЧ, потрясла медицинское и научное сообщество в прошлом месяце, когда китайский исследователь Хэ Цзянькуй сделал шокирующее заявление, что он изменил геномы не инфицированных ВИЧ детей-близнецов, дабы сделать их устойчивыми к инфекции. Этот безрассудный секретный эксперимент был широко осужден научными кругами. Однако взрослые пациенты с ВИЧ добровольно участвуют в экспериментах, на которые наука закрывает глаза, прокладывая дорогу для будущей работы над генетической терапией, например, рака и слепоты.
Китайского ученого, создавшего генетически модифицированных детей, могут казнить. Он обвиняется в коррупции и взяточничестве, за которые в Поднебесной полагается смертная казнь. Как сообщает The Telegraph, сейчас китайский ученый Хэ Цзянькуй находится под домашним арестом в городе Шэньчжэнь, где расположен университет, в котором ранее работал генетик. По информации издания, с помощью взяток исследователь пытался продвигать свои научные изыскания. Так, Цзянькуй заработал около $50 тыс, продавая технологии секвенирования генома, которые в итоге и мог пустить на финансирование своих исследований.
То, что произошло с Шарпом, после того как он подписался на революционное переливание крови, демонстрирует, как редактирование ДНК потенциально может расширить человеческие возможности и что генетическая медицина в качестве панацеи имеет свои пределы.
Шарп, которому сейчас 62, продвигал инновационную экспериментальную медицину с 1980 годов. По его словам, как ветерана активистской организации СПИД-коалиция для мобилизации силы (ACT UP) его арестовывали как минимум 8 или 9 раз — он не помнит точно — во время выступлений против замедленного изучения и поиска способов лечения ВИЧ. Впервые он встретил основателя центра Quest Джея Лалезари в Сан-Франциско в начале 90-х, когда молодой доктор еще только делал себе имя дерзкими экспериментами с потенциально токсичными препаратами. Исследования Лалезари давали людям с ВИЧ надежду на жизнь, но с активистами у него сперва сложились непростые отношения: ACT UP устроила радикальную акцию протеста на одном из его выступлений на конференции по ВИЧ.
Мэтт Шарп
Когда Шарп узнал об исследовании генного редактирования, он схватился за возможность поучаствовать и согласился стать пациентом номер 2 в проверке безопасности метода. Ко всеобщему облегчению после переливания крови Шарп столкнулся только с одним побочным эффектом: его тело стало издавать сильный запах. Когда на следующий день он вернулся в Quest для анализов, медсестра узнала о его появлении, стоило ему войти в дверь. Документация Sangamo подтверждает, что химическое вещество, которое они используют, может привести к появлению чесночного запаха, который пройдет в течение нескольких дней. Однако медсестры говорят, что Шарп и его коллеги по эксперименту скорее начали пахнуть, как протухшая кукурузная каша.

Когда стали известны результаты анализов, Шарп обнаружил, что его показания в медкарте улучшились потрясающим образом. Впервые с тех пор, как ему поставили диагноз ВИЧ, количество его иммунных клеток — ключевой маркер работы иммунной системы — подскочило до нормального, здорового уровня. Шарп хотел присутствовать среди зрителей на ведущей конференции по ВИЧ, когда эти данные станут доступны, так что в феврале 2011 года он полетел в Бостон. Он еще не знал, не был ли его результат случайным колебанием. Когда Лалезари вывел на экран слайд, демонстрирующий значительное повышение числа иммунных клеток других пациентов, по словам Шарпа, в зале все ахнули.
Ректальная биопсия, анализы крови и другие анализы не выявили никаких серьезных осложнений у участников исследования. Но ситуация Шарпа была нетипичной. Другие пациенты все-таки столкнулись с заметными побочными эффектами, включавшими жар, озноб, головную и мышечную боль. Одно исследование утверждает, что это скорее реакция организма на вливание миллиардов клеток, чем на их генетические изменения. Но были и другие проблемы. Трехлетнего периода, во время которого ученые наблюдали за здоровьем пациентов, могло не хватить, чтобы выявить осложнения, способные проявиться в долгосрочной перспективе, например, рак, вызванный повреждением генов в ходе эксперимента.

Мэтт Шарп
Самым важным следующим шагом для Лалезари после его выступления в 2011 году в Бостоне было продолжить исследования. Если бы он смог добиться полного исцеления, о котором говорят некоторые из его пациентов, редактирование гена и правда перевернуло бы сферу борьбы с ВИЧ. Но его работа внезапно встала, столкнувшись с суровой реальностью инновационной науки — проблемами с финансированием. Sangamo Therapeutics, биотехнологическая компания, которая оплатила первое исследование, решила сократить ВИЧ-направление и вместо этого с помощью своей технологии редактирования генома стала разрабатывать лекарства от других болезней.

Сэнди Макри, президент и CEO Sangamo, оспаривает этот вывод, утверждая, что решение отложить тему ВИЧ возникло до биржевого скандала Уинсона Танга. Однако компания признает, что они не считают исследование ВИЧ особо ценной инвестицией. Макри возглавил Sangamo в прошлом году, вскоре после того, как акции компании упали примерно до 3 долларов за акцию, и с тех пор старался восстановить ее позиции. Центральный офис компании приютился в Ричмонде (Калифорния), городе на краю залива Сан-Франциско, между магазином лодочных запчастей, железнодорожным депо, нефтеперерабатывающим заводом Shevron, яхт-клубом и Национальным парком имени Рози Клепальщицы.

Однако Шарп непоколебим. Не сумев выбить средства из Sangamo, он начал лоббировать проект среди госчиновников США и исследователей ВИЧ. Отчасти благодаря его усилиям Рафик-Пьер Секали, профессор медицинского факультета университета Кейс Вестерн Резерв, вдохновился продолжать исследование редактирования генов в терапии ВИЧ. В этом году Национальный институт здравоохранения выделил Секали 11 000 000 долларов на новый эксперимент под названием Trailblazer, и ему удалось оплатить использование технологии, принадлежащей Sangamo.
Данное письмо было отправлено в следующие организации, занимающиеся проблемой ВИЧ- инфекции в Российской Федерации:
1) Федеральный Научно-Методический центр по Профилактике и Борьбе Со Спидом Центрального Научно-Исследовательского Института Эпидемиологии Роспотребнадзора ФГУ
Москва, ул. Соколиной Горы 8-я, 15, корп.2
2) Государственный Научный центр институт Иммунологии Федерального Медико-Биологического Агентства России
Москва, Каширское ш., 24, стр. 2
3) Научно-Исследовательский институт Вирусологии им. Ивановского Д.И. Минздравсоцразвития РФ ФГУ
Москва, ул. Гамалеи, 16
Предполагая Вашу возможную реакцию на данное письмо, убедительно прошу Вас дочитать его до конца.
Суть нашего предложения заключается в следующем. Чтобы доказать, что ретровирус, именуемый Монтанье LAV, Галло – HTLV-3, и названный впоследствии HIV (в переводе на русский - ВИЧ), не является причиной угнетения иммунной системы человека, то есть не является причиной синдрома приобретённого иммунодефицита (СПИДа), инициативная группа, состоящая из 12 человек (9 мужчин и 3 женщин) в возрасте от 22 до 41 года готова провести на себе эксперимент по умышленному заражению ВИЧ, чтобы доказать это. Способ заражения – переливание зараженной крови. После чего все члены группы согласны проходить медицинское обследование на протяжении любого срока и в обязательном порядке обязуются не принимать высокоактивную антиретровирусную терапию (ВААРТ).
Для чистоты проведения эксперимента прошу обеспечить следующие условия:
1) Кровь донора в каждом конкретном случае должна совпадать с кровью участника эксперимента по группе и резус-фактору;
2) Кровь доноров должна выдавать положительный результат во всех скрининговых тест-системах, во всех тест-системах твердофазного иммуноферментного анализа (ИФА, Elisa), во всех тест-системах иммунного блотинга (ИБ, Western Blot), а также во всех анализах типа полимеразная цепная реакция (ПЦР);
3) Вирусная нагрузка донора должна быть умеренной и составлять 5000…10000 ед/мл., при этом, количество Т-хелперов CD-4 значения не имеет;
4) В крови доноров должны отсутствовать возбудители других заболеваний: вирусы гриппа любых штаммов, вирусы гепатитов A, B, C и других, вирусы герпеса, бледные спирохеты и другие микроорганизмы, вследствие деятельности которых могут развиться заболевания;
5) В крови доноров должны полностью отсутствовать токсические вещества и шлаки, которые есть у потребителей инъекционных наркотиков (ПИНов), а также у лиц, принимающих ВААРТ;
6) Доза переливаемой крови должна быть достаточной для предположительного инфицирования (не менее 50 мл.);
7) Предоставить экспериментальной группе беспрепятственную возможность к ежедневному многократному тестированию методами скрининга, ИФА, ИБ и ВН. Предоставить доступ к технологиям подсчёта CD4. Чтобы исключить возможность манипулирования результатами анализов, назначить ответственных за их проведение, и в случае махинаций со стороны этих людей, привлечь их к административной или уголовной ответственности (желательно, пожизненное тюремное заключение);
8) Создать ученую комиссию, которая будет состоять на 50% из числа ученых, которые придерживаются вирусной гипотезы происхождения иммунодефицита, и на 50% из числа ученых, которые отрицают данную гипотезу и считают, что иммунодефицит развивается по причинам, которые не связаны с вирусами. Предоставить данной комиссии широкие полномочия;
9) По истечению 1 года с начала эксперимента в обязательном порядке обнародовать его результаты в малейших деталях.
В случае, если заражения не произойдет, и иммунитет людей из экспериментальной группы по-прежнему останется высоким, Вы поймете, что ВИЧ не является для человека опасным, а все деньги, потраченные на борьбу со СПИДом необходимо перенаправить на борьбу с сердечно-сосудистыми заболеваниями, онкологическими заболеваниями, туберкулёзом, гепатитами и др. В этом случае все НИИ, областные СПИД- центры, которые сегодня занимаются ВИЧ-инфекцией должны быть переквалифицированы или закрыты уже на следующий день после окончания эксперимента. А с ВИЧ-инфицированных граждан Российской федерации должно быть снято это позорное клеймо.
Со своей стороны, инициативная группа отказывается предъявлять претензии любого рода кому бы то ни было. Любые бумаги и документы, необходимые для этого, будут подписаны. Все члены группы будут принимать участие в эксперименте под своими именами и фамилиями, при необходимости будут предоставлены необходимые личные данные. Эксперимент не должен проводиться анонимно. Тем не менее, сейчас я не могу открыть имена и фамилии участников.
Надеюсь на Ваше понимание и поддержку в установлении истины. Искренне желаю успехов в исследованиях и побольше новых открытий, которые сделают нашу жизнь лучше.
Агрессивный новичок
- Вадим Альбертович, ВИЧ был обнаружен еще в конце прошлого века. Почему лекарство так сложно было создать? Чем этот вирус отличался от других?
- С точки зрения биологии этот вирус очень похож на многие другие. Единственное, его фатальное отличие от других вирусов – это поражение иммунной системы человека, именно поэтому организм не может с ним бороться самостоятельно.
- Это своего рода агрессивный новичок?
Мыши на вес золота
- Вы уже дошли до клинических испытаний?
- До клинических - нет, но лабораторных мышей мы уже успешно лечим.
- Зачем в этом проекте мы и американцы нужны друг другу?
- Во-первых, потому что работа с вирусом ВИЧ требует астрономических денежных ресурсов. Ни одна сторона не хотела брать на себя всю тяжесть потенциальных финансовых потерь, поскольку велик риск, что мы будем много работать, но в итоге не сможем создать препарат принципиально нового поколения. Во-вторых, это крайне сложная работа, ее невозможно было сделать только в России, у нас нет ни адекватных моделей на животных, ни биологических технологий для проведения тестов. Например, для экспериментов на животных надо использовать безумно дорогих мышей, которые есть только в США. В то же время, российская химическая школа является ведущей мировой школой в области тонкого химического синтеза. Мы были лидерами 100 лет назад, и надеюсь, останемся ими в будущем. Именно поэтому наших ученых и привлекли для участия в совместном проекте.
- Почему нужны безумно дорогие мыши? Нельзя было найти подешевле?
- А это особые мыши - гуманизированные. У них с помощью современных технологий создали иммунную систему, которая идентична человеческой, можно сказать, что это просто человеческая иммунная система. Такие мыши - очень удобный лабораторный объект, можно испытать препарат и понять, как он будет воздействовать на человека.
- Как с американцами делили зоны ответственности?
- Как я уже сказал, российская сторона отвечает за химическую составляющую, дизайн и синтез соединений. Американские коллеги занимаются биологической частью и компьютерным моделированием. Выглядело это так: сначала мы с американскими партнерами обсуждали идеи, затем их специалисты на суперкомпьютерах проверяли насколько наши предположения реалистичны. Так формировался некий список перспективных соединений. Синтез этих соединений осуществляется здесь в Москве , в ФИЦ Биотехнологии РАН. И в конечном итоге готовые соединение тестируются в США.
От лаборатории до аптеки дистанция 10 лет
- Когда готовое лекарство может появиться в аптеках?
- От лаборатории до аптеки очень длинная дистанция. При благоприятном раскладе понадобится минимум 10 лет. Быстрее невозможно. Это связано с определенной последовательностью экспериментов и необходимым количеством данных, которые надо накопить. А отчасти с тем, что человечество само себе создало огромное количество преград на пути появления новых лекарств. Пройти согласование во всех регулирующих инстанциях очень тяжело и очень дорого. И это не только у нас, это практика всех стран мира. Кроме того, через год наш совместный проект заканчивается и надо будет искать финансирование под практические работы. Многие фармкомпании и фонды не стремятся вступать в такие долгие и дорогостоящие проекты, именно поэтому и сегодня наши исследования финансируются государственными фондами как со стороны России, так и со стороны США. Разработка лекарства для борьбы с ВИЧ это скорее задача государства.
- Я с большой осторожностью отношусь к заявлениям, что кто-то от чего-то вылечился на единичном примере. Мы не знаем достоверно, вылечился он или нет, это не клинические испытания, которые делаются в соответствии с очень строгим протоколом и которым можно доверять. Вирус может затаиться в нейронах и проснуться, когда пройдет много времени. Мы в своей работе придерживаемся позиций доказательной медицины, когда есть слепые клинические испытания на большой выборке. Что касается стволовых клеток, то это вопрос неоднозначный. Безусловно, есть примеры, когда стволовые клетки работают успешно, но это не касается вируса ВИЧ. Поэтому мы исходим из традиционных подходов: с одной стороны, есть вирус, с другой стороны - надо найти вещество, которым этот вирус можно уничтожить.
- А откуда все-таки появился ВИЧ? Существуют самые разные теории, по одной из версий вирус - это побочный эффект разработок биологического оружия…
- Происхождение вируса не является областью моей компетенции, моя ответственность - это разработка вещества, способного убить вирус. На самом деле есть только одна серьезная научная версия происхождения ВИЧ. Вирус появился в процессе мутации в Африке . Сначала он возник у человекообразных приматов, потом был перенесен на человека. Все остальные версии: космические, Божественные, конспирологические, не имеют отношения к здравому смыслу и научным сообществом не рассматриваются. И это не последний случай появления неизвестных ранее смертельных инфекций. Мы считаем, что новые вирусы будут появляться по мере развития человека, а мы будем придумывать вещества для их уничтожения. Это бесконечный непрерывный процесс.
ЧИТАЙТЕ ТАКЖЕ
В Лондоне выздоровел пациент с ВИЧ: случайный успех или победа человечества над СПИДом?
Пациенту, у которого болезнь перешла в смертельно тяжелую стадию, пересадили костный мозг, и ВИЧ пропал из организма (подробности)
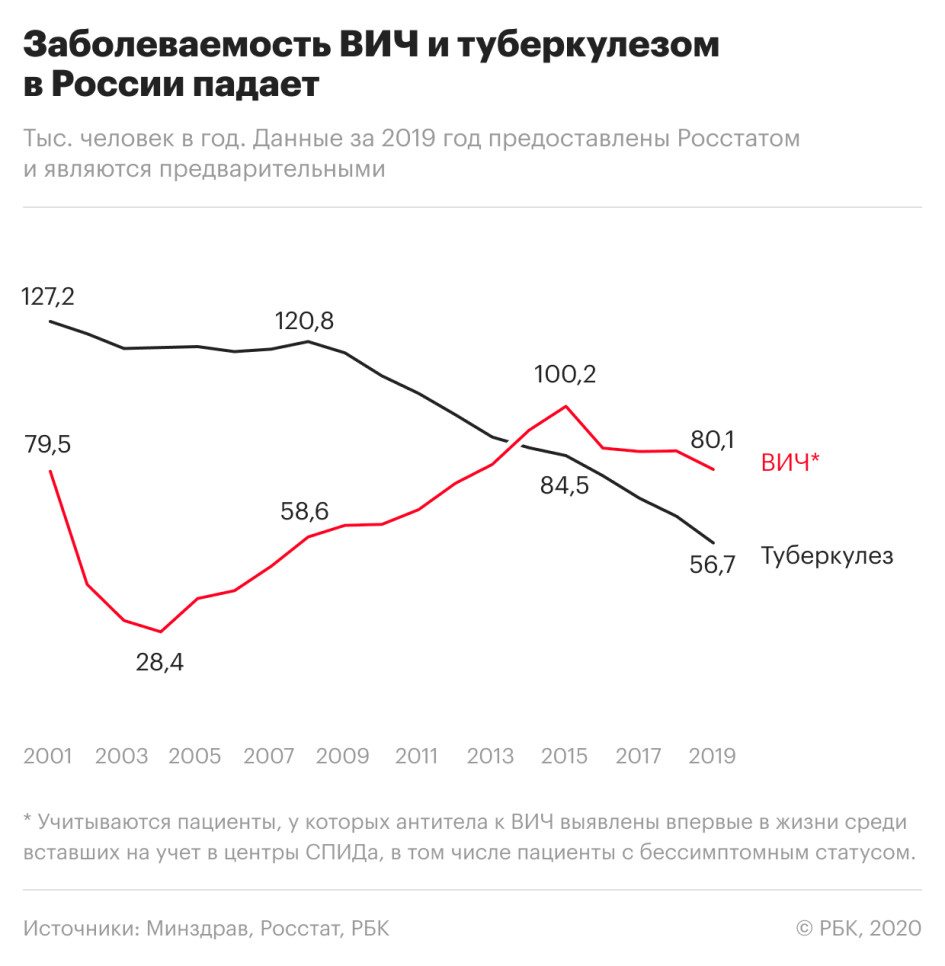
Число заболевших ВИЧ-инфекцией снизилось на 7% по сравнению с 2018 годом — такое значительное снижение наблюдается впервые с 2015 года.
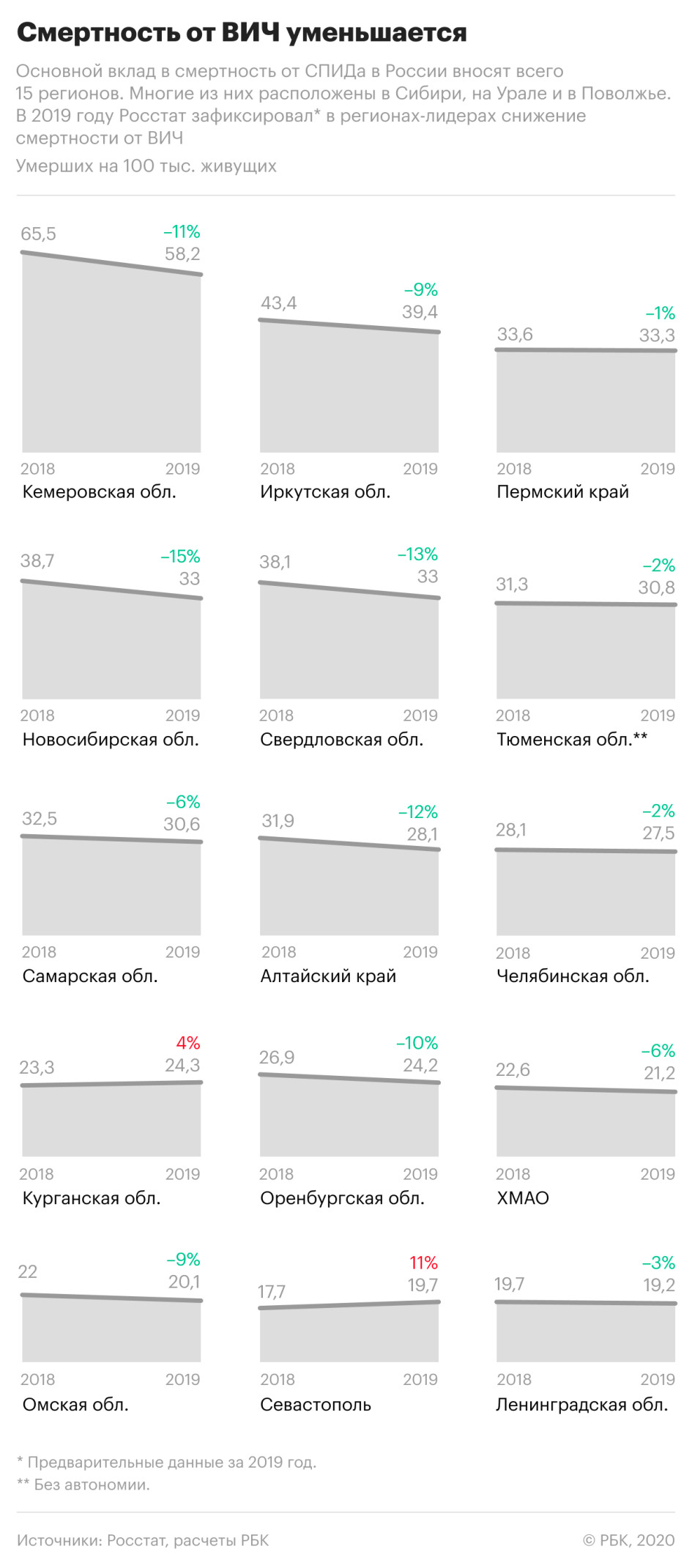
Смертность, связанная с ВИЧ, также уменьшилась — на 8% по сравнению с 2018 годом. В частности, от СПИДа, который развивается на фоне ВИЧ-инфекции, в прошлом году умерли 18,9 тыс. россиян.
При этом смертность от вызванных ВИЧ-инфекцией заболеваний значительно снизилась в регионах, которые являлись лидерами по этому показателю в предыдущие годы. Так, в Кемеровской области смертность по причинам, связанным с ВИЧ-инфекцией, снизилась на 11%, в Иркутской области — на 9%, в Свердловской области — на 13%, в Новосибирской — почти на 15%.
Одновременно показатель существенно вырос в Севастополе — +11%, рост на 4% зафиксирован в Курганской области. РБК направил запросы властям этих регионов.
Кемеровская область, несмотря на снижение смертности, осталась в России лидером по смертям, вызванным ВИЧ-инфекцией. В 2019 году там умерли около 38 тыс. человек, из них 1552 — от вызванных ВИЧ заболеваний, это каждый 25-й из умерших. В Кузбассе, как и в некоторых других регионах Сибири, от иммунодефицита по-прежнему умирают чаще, чем в результате самоубийств, убийств, ДТП и отравлений алкоголем вместе взятых.
По данным министерства здравоохранения региона, в Кемеровской области живут более 31,5 тыс. носителей ВИЧ — это более 2% трудоспособного населения. Антиретровирусную терапию (АРВТ) получают 73% больных — в министерстве уточнили, что это все, у кого есть показания для назначения лечения. Министр здравоохранения области Михаил Малин рассказал РБК, что в 2019 году регион потратил 288,7 млн руб. на противодействие ВИЧ, в 2020 году эта сумма вырастет в 1,4 раза, причем большую часть ее составляют средства регионального бюджета.
В Новосибирской области охват АРВТ составляет 75%, рассказал РБК министр здравоохранения региона Константин Хальзов. Это позволяет увеличить продолжительность жизни зараженных, уточнил он. Всего в регионе живут 31,3 тыс. носителей ВИЧ — это 2% жителей Новосибирской области трудоспособного возраста. Терапию из них получают 61%. Для борьбы с распространением инфекции в регионе действует программа равного консультирования, которая, по мнению министра, помогает социализации людей, живущих с ВИЧ, и формирует у них желание лечиться. Равные консультанты — это люди, живущие с вирусом и обученные консультировать новых пациентов.
В Иркутской области живут 30,1 тыс. больных ВИЧ, сообщила РБК замминистра здравоохранения Иркутской области Елена Голенецкая. АРВТ получают 58% из них. По словам Голенецкой, это все пациенты, которые нуждаются в терапии. Улучшение ситуации с смертностью от ВИЧ в регионе связывают с ростом числа пациентов, проходящих диспансеризацию.
Наркотрафик и другие причины эпидемии
Регионы, в которых больше всего жителей заразилось ВИЧ-инфекцией и умерло от СПИДа, во многом пересекаются с регионами, в которых популярны наркотики опийной группы. Именно в этих регионах, как показывает статистика МВД, в 2019 году правоохранительные органы изъяли большую часть опиатов.
Осторожный оптимизм и фильм Дудя
В 2019 году каждый четвертый россиянин прошел тестирование на ВИЧ, сообщили РБК в пресс-службе Минздрава. Антиретровирусную терапию получают 68,9% заболевших. Эти показатели выше плановых, указанных в Государственной стратегии по противодействию распространения ВИЧ-инфекции.


Кроме того, по словам Вадима Покровского, в некоторых регионах еще остается практика, когда вместо диагноза СПИД ставят непосредственную причину смерти пациента для улучшения отчетности.
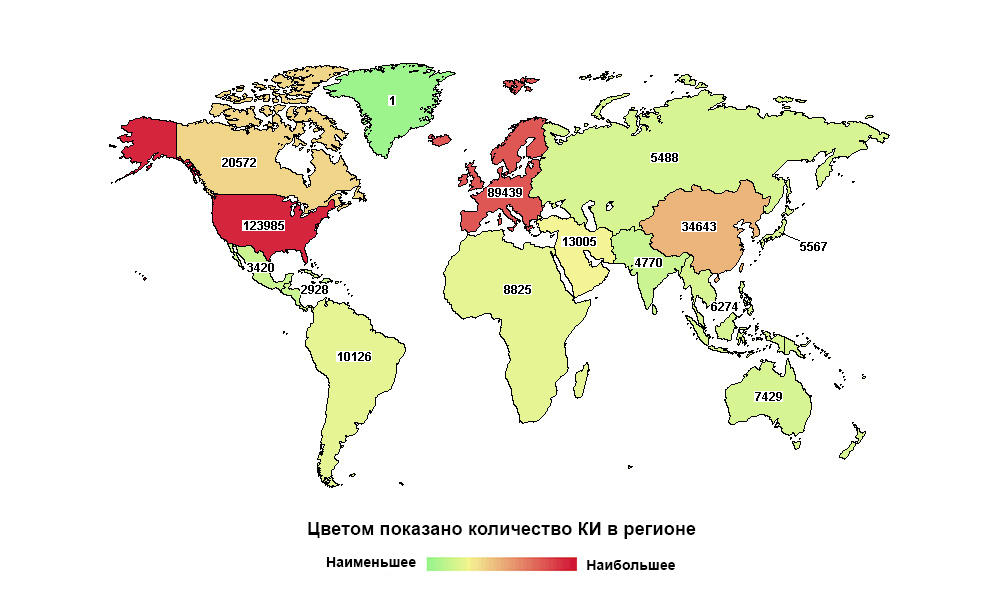
Россия далеко не на первом месте в мире, но первая по количеству исследований в своем макрорегионе
Для частных клиник практика необычная: минимум коммерческой выгоды, слишком много сложностей в организации процесса и строгие требования к лечебному учреждению. Обычно только крупным федеральным центрам удается им соответствовать.
А ведь для многих пациентов в России клиническое испытание препарата – единственный шанс получить бесплатное лечение от смертельной болезни. Но среди российских онкопациентов 30% просто не знают, что такое клиническое исследование, и лишь немногие принимали в них участие.
Поэтому мы хотим, чтобы как можно больше людей узнали и проверили: возможно, у них есть шанс получить препарат, который может спасти им жизнь.
В этой статье мы расскажем, зачем нужны и как устроены клинические исследования, кто и как может туда попасть.
Клиническое исследование/испытание (далее – КИ)– научное исследование с участием людей в качестве испытуемых, которое проводится с целью оценки эффективности и безопасности нового лекарственного препарата или расширения показаний к применению уже известного. Кроме лекарств, КИ могут также изучать эффективность и безопасность новых методов лечения и диагностики.
Медицина эволюционирует и превращается в точную науку, которая не обходится без статистики.
Когда медицина стала массовой, у врачей возникла необходимость вырабатывать действительно безошибочные тактики лечения. Определенные лекарства должны были помогать в заданных условиях большинству пациентов.
И именно клинические исследования – основа доказательной медицины.
До середины XX (!) века не было никакого регулирования исследований новых препаратов. Чтобы навести порядок, как часто бывает, понадобилась пара трагедий.

Мамы этих детей пили снотворное, не проверенное на людях
С тех пор лекарства перед регистрацией очень тщательно изучают. Регулируется это Международными гармонизированными трехсторонними правилами Надлежащей клинической практики (ICH Harmonized Tripartite Guideline for Good Clinical Practice, сокращённо — ICH GCP). С 1996-97 г. они действуют в США, Японии и ЕС, а с 2003 года введены и в России.
Весь процесс создания препарата можно поделить на 3 крупных фазы.
1. Поиск идеи и доклинические исследования – в пробирках и на животных.
2. Если на этом все не закончилось – то начинаются клинические исследования, с людьми: сначала осторожные, потом более массовые.
3. Затем препарат регистрируется в регуляторных органах, чтобы стать привычным наименованием в медицинских справочниках.
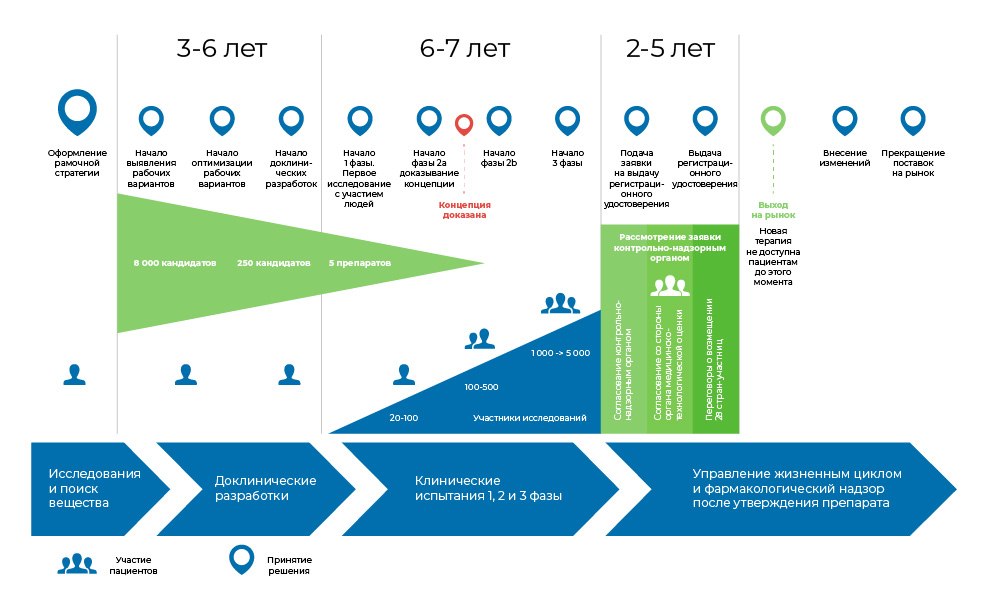
Процесс разработки медицинского препарата. С момента создания молекулы до момента начала продажи лекарства проходит от 8 до 20 лет.
Значит, это кому-нибудь нужно? Онкология — одна из самых вопиющих сфер медицины в плане неудовлетворенной потребности в лекарствах. По данным Всемирной организации здравоохранения, в 2018 году онкологические заболевания убили 9,6 миллиона человек. Часто опухоли обнаруживают на поздних стадиях, когда остается лишь паллиативное лечение.
При этом открытия в сфере молекулярной биологии и генетики позволили понять механизмы, которые способствуют развитию и прогрессированию рака, улучшилось понимание работы противоопухолевого иммунитета.
И сегодня разработка противоопухолевых препаратов – одно из самых наукоемких и востребованных направлений медицины.
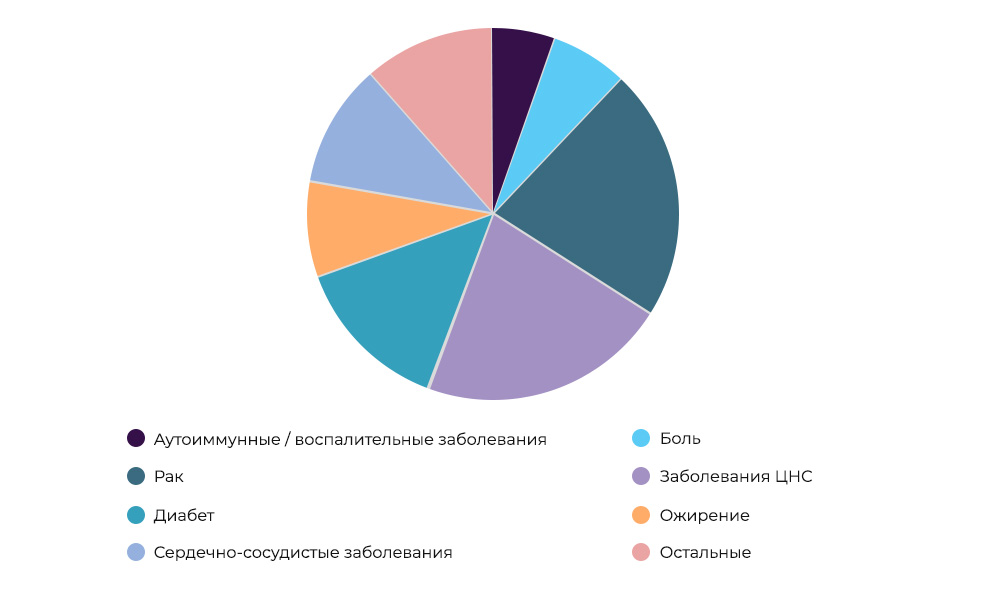
Исследования противораковых препаратов – 23% всех КИ в мире
Раньше многие фармкомпании проводили исследования самостоятельно, силами своего штата ученых. Сейчас медицинское учреждение, которое прошло аккредитацию и соответствует определенным требованиям, может стать площадкой и исполнителем для эксперимента.

Механизм работы таргетных препаратов при колоректальном раке. Раковые клетки прекращают делиться, либо приращивать к опухоли дополнительные кровеносные сосуды, либо препарат предохраняет соседние клетки от превращения в злокачественные
Чтобы найти такие вещества, а потом выбрать из кандидатов подходящие, требуется много ресурсов и времени на исследования in vitro и in silicio – то есть в пробирке или с помощью компьютерного моделирования.
Выбранное вещество запасают в нужном количестве – производят по специальным правилам (в России это ГОСТ Р 52249-2009), без примесей и нарушения технологии. И с этими пробирками ученые отправляются тестировать препарат на животных.
Мышь – двигатель прогресса. После проверки идей в пробирке ученый с запасом своего потенциального препарата идет в виварий – нужно проверить, как поведет себя прототип в теле млекопитающего (in vivo).
И до сих пор в медицине без опытов на животных – не обойтись. Львов и коней, правда, оставили в покое. Доклинические исследования во всем мире происходят, в основном, на мышах, морских свинках и кроликах.

Лабораторным мышкам даже поставили памятник в Новосибирском Академгородке
На этом этапе проверяют, насколько вреден/безопасен препарат:
- вызывает ли аллергию,
- оказывает ли токсичное влияние на ткани и органы,
- как влияет на способность животных к размножению и нормальному развитию плода и т.п.
Кроме того, наблюдают, как кандидат в лекарства ведет себя внутри организма зверька (фармакокинетика):
- скорость всасывания и нарастание концентрации в крови,
- каковы максимальная и минимальная доза,
- как быстро выводится из организма, и т.п.
Все эти данные нужны, чтобы решить: можно ли применять исследуемое вещество для людей. И если да – то сколько его нужно.
Неизбежное зло. Бюрократия. За правильным ходом КИ следят Департамент гос. регулирования обращения лекарственных средств Минздрава и Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор).
Если ученый пришел к моменту, когда нужно переходить к клиническим исследованиям на людях – пора готовить заявку на проведение КИ. Для этого ему нужно несколько документов.
- Досье исследуемого лекарственного препарата. Все, что уже выяснили о препарате: данные о фармакокинетике, эффективности, токсичности и т.п.
- Протокол исследования. В нем подробно описан план будущего исследования и методики оценки результатов;
- Брошюра исследователя. Краткая шпаргалка, чтобы понятно объяснить суть исследования волонтерам и пациентам и получить их информированное согласие.
Этический комитет. Следующий этап квеста – получить оценку и заключение комитета по этике.
Комитет по этике – это независимая группа врачей, ученых, медицинского персонала и неспециалистов (представителей общественности). Они изучают протокол исследования и информированное согласие, чтобы до старта исследования удостовериться, что между пациентом, исследователями, фармкомпанией и национальным компетентным органом регулирования достигнуто согласие, ничьи права не нарушены, никто не подвергается принуждению и никому не прищемили свободу воли.
После проверки всех документов и одобрения этического комитета потенциальный препарат переходит в стадию клинических испытаний – на людях.
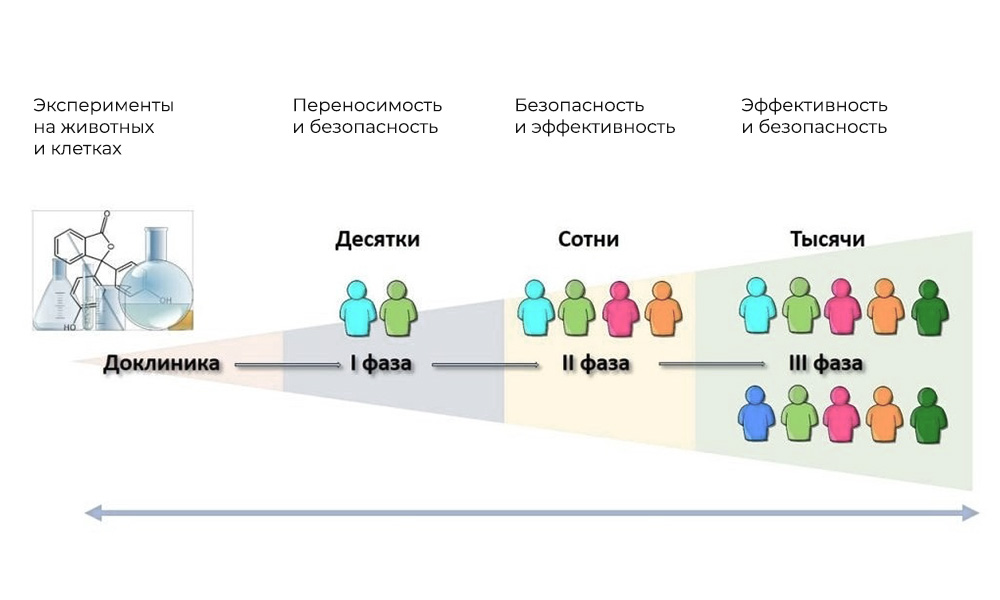
Основные фазы клинических исследований – на людях
Участники: 20 – 100 человек.
Длительность: от нескольких месяцев до 1 года.
Цель: изучить переносимость, фармакодинамику и фармакокинетику.
Проверяется, действует ли вещество на людей так же, как на животных, безопасно ли оно.
В первой фазе клинического исследования должны, теоретически, участвовать здоровые добровольцы, но в онкологии тестирование сильнодействующих веществ на здоровом организме нельзя назвать этичным. Поэтому участвуют люди с соответствующим заболеванием, против которого может быть эффективен будущий препарат.
Участникам постепенно вводят все бОльшие дозы препарата, начиная с минимальной и до максимально допустимой. После каждого введения отслеживается состояние пациента.
Оценивают фармакокинетику: скорость всасывания и экскреция (выделение неизменённого вещества), распределение по тканям и органам. Также оценивается фармакодинамика: действие препарата на клетки опухоли, на другие такни и органы, побочные эффекты. Выясняется предпочтительный вариант применения и уровень дозировки.
Кроме исследований с нарастающими дозами, в фазе I проверяют:
- действие пищи на препарат;
- взаимодействие с другими препаратами;
- влияние прочих заболеваний, которые могут повлиять на нужные дозы препарата (например, у пациента с почечной недостаточностью).
По данным FDA, первую фазу КИ успешно проходят 70% препаратов.
Участники: 100 – 500 пациентов.
Длительность: от нескольких месяцев до 2 лет.
Цель: проверка эффективности при определенных показаниях
Необходимо изучить, насколько новый препарат эффективнее по сравнению с плацебо или уже существующим лечением. Плюс, большее количество участников позволяет обнаружить более редкие побочные эффекты, которые не выявлены в фазе I.
Обычно на этой стадии исследования проводятся как двойные слепые рандомизированные плацебо-контролируемые.
Двойное ослепление: ни врач, ни пациент не знают, кто получает активное вещество, а кто – плацебо или оптимальное существующее на данный момент лечение.
Рандомизация подразумевает, что пациенты делятся на группы случайным образом – с помощью генератора случайных чисел. Повлиять на этот процесс не может ни врач, ни участник КИ.
Плацебо-контроль означает, что участники одной группы будут получать плацебо в таких же условиях, что и участники другой группы, которым дают активное вещество.

Всем – одинаковые на вид, вкус и запах лекарства.
Согласно данным FDA, лишь 33% препаратов, дошедших до фазы II, успешно проходят КИ и переходят в следующую фазу.
Количество участников: 300 – 3 000 и более.
Продолжительность: от года до нескольких лет.
Цель: подтверждение эффективности и безопасности исследуемого вещества на больших выборках.
Это самая крупномасштабная, сложная и дорогостоящая часть процесса разработки препарата. Цель таких исследований — подтвердить эффективность и безопасность исследуемого вещества при применении большим количеством пациентов.
По результатам этой фазы производители препарата получают разрешение для вывода его на рынок.
В фазе III могут принимать участие тысячи пациентов из разных стран. Все должно быть спланировано до мелочей, чтобы во всех местах проведения исследования его дизайн и значимые условия были абсолютно одинаковыми.
Дизайн исследования настолько узкий, что в него может попасть не только умирающий, но и пациент с прогнозом на стойкую ремиссию. Препарат должен быть настолько безопасным, чтобы его можно было давать практически здоровому человеку – и качество жизни не снижалось.
Перед началом фазы III проводится множество консилиумов и обсуждений между исследователями и сторонними экспертами: очень важно продумать дизайн экспериментов так, чтобы не упустить важное и получить все нужные данные.
В ходе фазы III окончательно подтверждается эффективность и безопасность нового лекарства, зависимость эффекта от дозы.
Анализируется соотношение преимуществ и рисков. По результатам контролирующий орган принимает решение о том, можно ли выводить препарат на рынок. Для этого нужно, чтобы соблюдались условия:
- препарат более эффективен, чем ранее известные аналоги,
- дает меньше побочных эффектов/лучше переносится,
- эффективен, когда не работают ранее известные препараты,
- более выгоден экономически,
- проще в применении.
Процесс рассмотрения заявки надзорным органом занимает 12-18 месяцев.
По данным FDA, третья фаза клинических исследований заканчивается положительным результатом лишь в 25-30% случаев от всех, что были на старте третьей фазы.
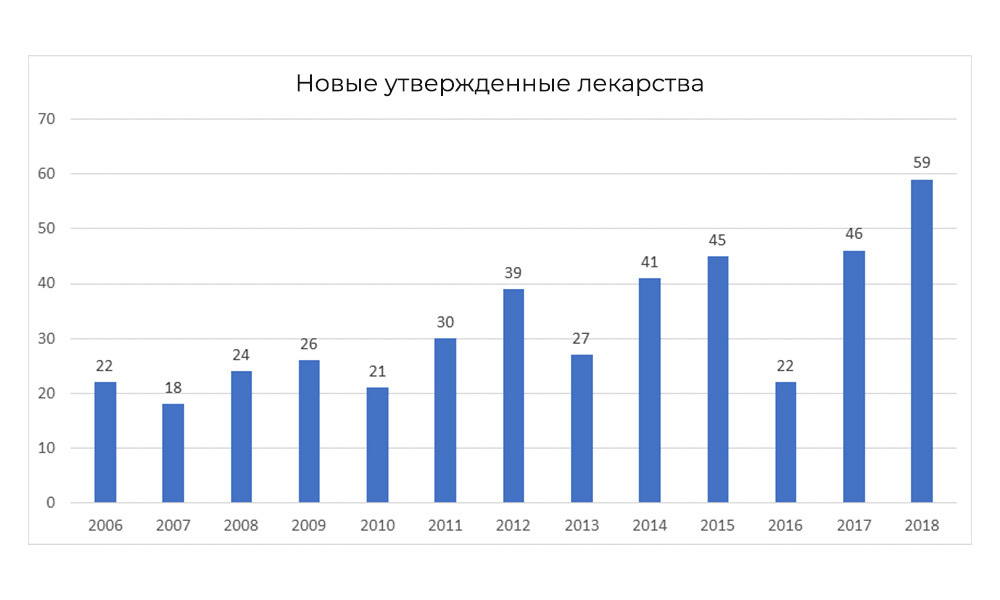
Тем не менее, в 2018 FDA побила собственный рекорд по числу одобренных препаратов
У контроля за новыми препаратами в России есть свои баги (или фичи, как посмотреть). По закону, одобренные зарубежные препараты должны пройти дополнительные клинические испытания в России: якобы, это повысит качество зарубежных препаратов.
Когда препарат уже прошел 3 фазы, вышел в продажу на мировой рынок, в нашей стране он еще может быть не зарегистрирован. Мы знаем, что он работает, в его инструкции на иностранных языках есть показания, подтвержденные 3 фазами исследований в США, или Канаде, или Европе.
Скажем, 12 показаний – 12 диагнозов, при которых препарат будет эффективен. Но в России еще не все эти показания подтвердили официально, только 6 из 12. И если у пациента именно тот вид рака, для лечения которого препарат еще пока официально не зарегистрирован в РФ, такой препарат бесплатно, в рамках ОМС, он не получит.
Это на 2-3 года замедляет пациентам доступ к новым лекарствам.
К сожалению, нас таких мало. Не всякая клиника может принимать у себя КИ.
Во-первых, у клиники должен быть сертификат GCP, Good Clinical Practice.
Во-вторых, исследователей должно быть минимум двое. У них тоже сертификаты, и не так-то просто их добыть: выдаются контролирующим органом страны-производителя препарата. В нашем случае это США и Франция. Проверяли двух врачей полгода.
В-третьих, сама клиника. Обязательно отделение реанимации, своя лаборатория, сертифицированные медсестры, правильная калибровка нужных автоматов, определенные помещения для хранения препаратов и документов, анонимные помещения, где нет камер – для пациентов. Чтобы запуститься в первый раз – пришлось переоборудовать некоторые кабинеты и палаты: вплоть до новых кроватей, все по дизайну КИ.

Для разных препаратов – разные холодильники
Словом, те клиники и врачи, которые хотят этим заниматься, должны еще постараться, чтобы создать определенные условия.
Набираем 2 или 3 группы пациентов, подписываем с ними информированное согласие.
Обычно на участие в клинических исследованиях люди соглашаются по 2 причинам:
- отсутствие эффективных методов лечения их болезни,
- желание сделать вклад в развитие науки.
В любом случае это исключительно добровольное решение. Исследователи обязаны в письменном виде предоставить пациенту информацию о цели КИ, о том, как оно будет проводиться, какое лекарство будет применяться, и т.п. Все это отражено в особом документе —информированном согласии. Каждый участник исследования застрахован от причинения вреда жизни и здоровью.
Наши пациенты пока ни разу не отказывались – для них это невероятный шанс получить лечение, причем бесплатное, когда остальные методы терапии уже исчерпали себя.
Но онкологических пациентов у нас много. Если клиент признается, что денег на лечение нет – мы обязательно проверяем требования к участникам исследования. Вполне возможно, что ему найдется место.
В данный момент открыт набор в 18 крупномасштабных исследований.
Конечно, масштабы в частной клинике – совсем не то, что в большом НИИ, но обычно 3-4 пациента в неделю попадают в протокол исследования. Это немало: не менее 10 человек в месяц, которые получают самое продвинутое передовое лечение – бесплатно.
И у них самих появляется дополнительный шанс, и будущие пациенты скорее смогут получить этот препарат, когда закончится КИ.
Пациенты вовсе не обязательно постоянно находятся в клинике – если это не запрещено дизайном КИ и пациент чувствует себя хорошо – он участвует амбулаторно. Приходит, получает свою капельницу и уходит. Есть и такие, кому лучше остаться в клинике, под присмотром.
В результате долгих месяцев скрупулезного выполнения длинного списка требований, постоянного мониторинга состояния пациента, консолидации данных по десяткам параметров мы делаем исследования, которые будут опубликованы, а пользоваться результатами – расширенной возможностью применения новых препаратов – будут все врачи из всех онкоцентров страны. И несколько десятков человек получают шанс на лечение прямо сейчас.
Надеемся, этот текст был для вас просто интересным чтением.
Читайте также:



