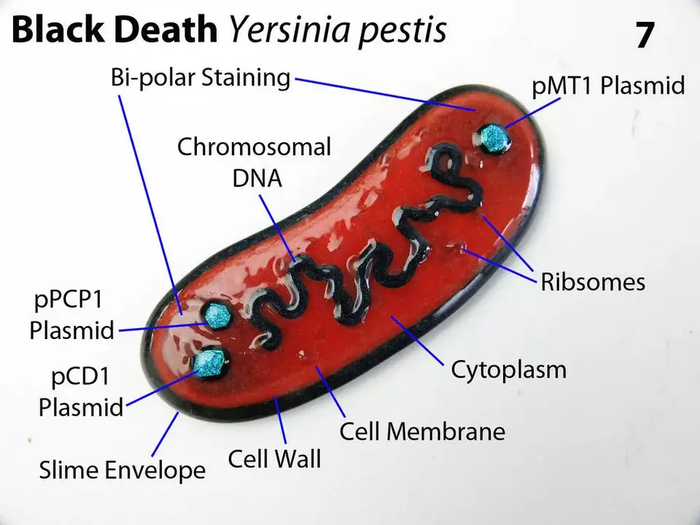
Crispr cas9 в лечении вич в китае

Китайские врачи опробовали CRISPR-отредактированные клетки на пациенте с ВИЧ-инфекцией и Т-клеточной лейкемией. После облучения больному ввели его собственные кроветворные клетки, в которых разрушили ген CCR5. Отредактированные клетки прижились в организме и образовали разные типы клеток крови. Серьезных побочных эффектов не возникло. Правда, защитить пациента от вируса они не смогли — из-за низкой эффективности редактирования. Статья опубликована в журнале New England Journal of Medicine.
В 2017 году Лей Сюй (Lei Xu) из Центра исследований стволовых клеток пекинского университета и его коллеги запустили небольшое клиническое исследование, чтобы попробовать создать устойчивость к ВИЧ в клетках крови с помощью CRISPR/Cas9. В своей статье ученые отчитываются о первом пациенте, который прошел их новую терапию. Кроме технологии редактирования, которую использовали китайские ученые, есть и еще одна деталь, которая отличает их эксперимент от исследования Sangamo Therapeutics. Китайцы забирали у пациента не Т-клетки, а стволовые клетки крови. Расчет был на то, что кроветворные клетки приживутся в красном костном мозге и будут постоянно поставлять в организм пациента устойчивые к ВИЧ Т-лимфоциты.
Ученые работали с 27-летним пациентом, у которого кроме ВИЧ-инфекции диагностировали еще и Т-клеточную лейкемию. Его планировали лечить лучевой терапией, которая убивает существенную часть клеток крови, и пересадка кроветворных клеток ему понадобилась бы в любом случае. Ученые решили совместить лечение с экспериментальной процедурой: после облучения ввели больному уже отредактированные собственные клетки. В этот момент антиретровирусную терапию пришлось прервать, чтобы можно было оценить результат эксперимента.
CRISPR-модифицированные клетки прижились в организме и не вызвали острого отторжения. С начала эксперимента прошло уже 19 месяцев, и клетки с разрушенным геном CCR5 все еще можно найти в крови пациента — причем не только Т-лимфоциты, но и другие клетки крови. Это значит, что отредактированные кроветворные клетки работают полноценно и производят разные типы клеток, у которых мутация сохраняется.
Тем не менее, полностью отредактировать кроветворение пациента не удалось. Среди всех клеток, которые ученые у него забрали для редактирования, внести изменения в геном получилось лишь у 17,8 процентов. После возвращения в организм новые клетки начали конкурировать со старыми за заселение красного костного мозга. И в течение всего времени наблюдения они составляли лишь 5-8 процентов от общей кроветворной популяции.
Однако сделать пациента устойчивым к вирусу не удалось: после отмены ретровирусной терапии количество вирусной РНК в крови начало расти, и ему пришлось снова назначить лечение, чтобы инфекция не прогрессировала. В этом смысле китайский эксперимент, равно как и испытание Sangamo Therapeutics, не достиг заявленной цели. Причиной тому стала низкая эффективность редактирования. В китайском эксперименте она была ниже 20 процентов, в исследовании Sangamo Therapeutics — 11-28 процентов, и этого количества клеток недостаточно, чтобы справиться с инфекцией. Для того, чтобы ввести технологию редактирования генов в клиническую практику борьбы с ВИЧ, исследователям придется сначала повысить эффективность метода.
Тем не менее, авторы работы отмечают, что у их исследования есть и позитивный результат. Этот эксперимент — самое долгое на сегодняшний день наблюдение за CRISPR-отредактированными клетками в организме человека, и оно показывает, что такие клетки могут быть безопасны. Исследователи не обнаружили в клетках никаких незапланированных изменений (то есть следов нецелевого редактирования генома). Клетки также не превратились в опухолевые — о чем предупреждали некоторые ученые в 2018 году. Таким образом, китайская работа стала демонстрацией принципа: CRISPR-модифицированные клетки можно использовать в терапевтических целях без риска для пациента.

Что произошло
В ноябре 2018 года китайский ученый Хэ Цзянькуя (He Jiankui) рассказал на отраслевой конференции , что внес изменения в эмбрионы семи пар, когда они проходили репродуктивное лечение. В итоге с измененным ДНК родились девочки-двойняшки Лулу и Нана.
Некоторое время сам факт операции вызывал сомнения. Потому что, кроме слов Хэ на конференции и его же интервью Associated Press, никакого подтверждения не было. Однако три месяца спустя власти КНР официально подтвердили заявления Хэ Цзянькуя, обязали остановить исследования и обвинили ученого в нарушении нескольких государственных законов.
Перед этим ученый говорил, что выбрал Китай для эксперимента именно потому, что в стране не действовал запрет на редактирование генома эмбрионов. Видимо, он проверил не все законы. 30 декабря 2019 года Суд города Шэньчжэнь на юге Китая приговорил ученого Хэ Цзянькуя (He Jiankui) к трем годам тюрьмы и штрафу в 3 млн юаней (около $430 тыс.). Он осужден за модификацию генома эмбрионов человека.
Что сделал ученый
Хэ Цзянькуй в своей лаборатории в Шэнчжене
Как менялось отношение научного сообщества
Когда Хэ рассказал об исследованиях на Втором международном саммите по генетическому редактированию человека в Гонконге, большинство коллег отнеслось к ним негативно. Нобелевский лауреат Дэвид Балтимор (David Baltimore) напомнил, что отключение гена CCR5 повышает опасность заражения лихорадкой Западного Нила и другими вирусными заболеваниями, а также увеличивает вероятность смерти от гриппа. Неприемлемым назвала эксперимент и Дженнифер Дудна (Jennifer Doudna), одна из создательниц технологии редактирования генома CRISPR/Cas9, которую использовал Хе.
Введение белка Cas9 в пипетку

В феврале 2019 года в американском рецензируемом журнале Cell вышла статья о позитивном побочном эффекте редактирования генома. Тесты показали, что удаление у мышей того самого гена CCR5 улучшает их когнитивные (познавательные) функции. Также ученые выяснили, что люди, у которых CCR5 отсутствует из-за естественной мутации, быстрее восстанавливаются после инсульта.
Ввод белка Cas9 в эмбрион

Что пошло не так
Хэ мог бы получить Нобелевскую премию, если эксперимент прошел так, как он планировал. А планировал он воссоздать существующую в природе мутацию в гене CCR5, которая должна защищать своего носителя от ВИЧ. Однако поздний анализ генома девочек показал, что система редактирования внесла не ту мутацию. Причина неудачи в особенности работы CRISPR/Cas9. Ломает ген он легко, а вот нужные изменения вносит хоть и точнее других технологий, но далеко не идеально.
Хэ Цзянькуй, взяв на себя риск, не справился с задачей. Он понял, что редактирование генов может принести ему хорошую прибыль, и в погоне за личной славой и выгодой еще в 2016 году на собственные средства привлек сообщников и использовал технику, уровень безопасности и эффективности которой до сих пор не ясны. И, намеренно избегая какого-либо надзора и контроля, осуществил официально запрещенный в стране эксперимент по модификации ДНК. Больше того, он подделал материалы о соответствии эксперимента морально-этическим нормам и ввел в заблуждение испытуемых, создав впечатление, что эксперимент проводится законно. По крайней мере, так утверждает Государственный комитет КНР по делам здравоохранения и планового деторождения.
Эмбриологи команды Хэ Цзянькуя рассматривают изображения эмбриона на компьютере

Правда, Грили полагает, что произойдет это не скоро. Пока технология CRISPR слишком сложна. И крупные игроки не будут заниматься незаконными исследованиями, чтобы спрогнозировать возможную выгоду.
Эксперименты продолжатся
А пока ученые по всему миру продолжают изучать возможность воздействия на геном человека. Просто делают это не с эмбрионами. В США еще в январе 2018 года начали вводить добровольцам модифицированные лимфоциты в качестве иммунотерапии рака. В Великобритании, где в 2016 году было разрешено в исследовательских целях редактировать геном эмбрионов человека, запрет после истории с китайскими двойняшками так и не был введен. И там в том же 2016 году на свет появился ребенок, родителями которого можно считать трех человек.
Эмбрион с модифицированными генами
В России этой технологией интересуется не только Денис Ребриков. В феврале этого года Минобрнауки вместе с РАН разработали проект программы развития генетических технологий на 2019–2027 годы. Сделать это распорядился в ноябре 2018 года президент Владимир Путин. Тогда отмечалось, что программа нужна для ускорения развития генетических технологий и предупреждения чрезвычайных ситуаций биологического характера.


В каких целях возможно использование системы редактирования генома CRISPR/Cas9 и какие преимущества она даст.
Система редактирования генома CRISPR/Cas9 — одно из самых нашумевших и многообещающих открытий последнего десятилетия. Она была открыта в 2007 году и вот уже 10 лет тестируется для лечения разных болезней: от ВИЧ-инфекции до рака легких.
Суть CRISPR/Cas9 заключается в том, что она умеет распознавать и изменять точно заданные последовательности ДНК. Это значит, что система может просто-напросто вырезать вирус из клетки. А в случае генетических болезней — убрать или починить поврежденный ген.

Источник изображения: wikipedia.org/Thomas Splettstoesser
Изучают эту систему почти по всему миру. В разработках принимают участие биологи крупнейших научно-исследовательских центров и доктора ведущих университетских клиник.
Про самые многообещающие исследования применения CRISPR/Cas9 в медицине мы расскажем сегодня.
Если CRISPR/Cas9 умеет вырезать последовательности ДНК, то логично предположить, что она может вырезать вирусный генетический материал из клетки. Вирусы — это неклеточные формы жизни, состоящие из белковой оболочки (капсида) и молекулы нуклеиновой кислоты (ДНК либо РНК). После инфицирования вирусный наследственный материал встраивается в генетический аппарат клетки и только с этого момента начинается размножение или репликация. Так что, удалив вирусные гены, получится навсегда убрать патоген из организма.

Источник изображения: wikipedia.org/CDC/Dr. Edwin P. Ewing, Jr.
После нескольких попыток в 2016 году ученым впервые удалось полностью убрать ВИЧ из клеток человека. Исследование проводилось в культуре клеток, то есть зараженные клетки человека изъяли, и опыты проходили в лабораторных условиях. Успех такого эксперимента дает большую надежду на полное излечение от ВИЧ в будущем.
Лечение ВИЧ — лишь одно из многих возможных применений системы CRISPR/Cas9. Еще одно поле ее действия — лечение генетических болезней. Данные исследования менее успешны по сравнению с разработками, направленными против вирусов, и на это есть ряд причин. Во-первых, система CRISPR/Cas9 имеет некоторые недостатки: неточность редактирования, возможность применения только к болезням, вызванным определенным типом мутаций и т.п.
Вторая сложность заключается в том, что проведение экспериментов с использованием человеческих эмбрионов запрещено в большинстве стран. Но, несмотря на все сложности, ученым удалось отредактировать эмбрионы человека, полученные при искусственном оплодотворении в лаборатории. Первым стал эксперимент ученых из Китая. В нем они избавляли эмбрионы от талассемии (наследственное заболевание крови). Это исследование не дало эффективных результатов, зато выявило множество недостатков системы CRISPR/Cas9.

Источник изображения: flickr.com/University of Michigan School for Environment and Sustainability
CRISPR/Cas9 нашла применение даже в лечении рака. Например, в исследовании 2014 года китайские ученые пишут о том, как с помощью CRISPR/Cas9 заставить раковые клетки самоуничтожаться. Напомним, что сегодня главный подход к лечению рака — это уничтожение злокачественных клеток токсичными препаратами химиотерапии, которые наносят огромный побочный урон здоровым клеткам.
В эксперименте биологам удалось модифицировать систему так, чтобы она не вырезала гены из клетки, а, наоборот, чинила их. В случае раковых клеток — это восстановление системы апоптоза (самоуничтожения). Такая система во всех нормальных клетках работает слаженно, а в раковых — нет. Именно поэтому злокачественные опухоли характеризуются неограниченным ростом. Пока что исследования проводились в культуре клеток. Ученые работали с раком мочевого пузыря и раком легких.

Источник изображения: pixnio.com
Сейчас технология CRISPR/Cas9 — одна из самых интересных и исследуемых в мире. Биологи пробуют лечить болезни глаз, мышечную дистрофию, онкологию и вирусные болезни. Также ведется работа с самой системой редактирования генома — выявляются и исправляются ошибки, налаживается корректное функционирование CRISPR/Cas9.
К сожалению, в ближайшем будущем за лечение людей с помощью CRISPR/Cas9 никто приниматься не будет. Пока что надо добиться 100% работы системы. Затем получить успешные результаты лечения культуры клеток и провести тестирование системы на животных. Только после этого (и еще пары-тройки лет бюрократической волокиты) CRISPR/Cas9 вступит в стадию клинических исследований.
- 4048
- 3,5
- 2
- 8
Модифицированные с помощью CRISPR-Cas9 иммунные клетки получают возможность лучше атаковать опухоль.

Биология в Московском физтехе
Лаборатория геномной инженерии МФТИ — молодая и интенсивно развивающаяся лаборатория со многочисленными проектами и планами. Реализация большей части из них связана с использованием в качестве основного инструмента технологии CRISPR-Cas9. Одним из самых привлекательных направлений использования данной технологии является персонализированная медицина [1], желающая поставить себе на вооружение метод высокоточного геномного редактирования для борьбы со многими тяжелыми наследственными заболеваниями или злокачественными опухолями. Молекулярная технология CRISPR-Cas9 успешнее других претендует на роль этого универсального оружия, и первые шаги по ее применению к реальным пациентам подобны первым полевым испытаниям.
Откуда мы знаем про CRISPR-Cas9?
Превращение механизма бактериального иммунитета в инструмент редактирования геномов высших организмов потребовало решения ряда сложных задач, связанных, главным образом, с повышением точности определения участка ДНК, который распознается и вырезается комплексом белка Cas9 со специальной молекулой РНК, служащей для белка гидом к этому участку. Однако труды генных инженеров увенчались успехом и уже к 2013 году позволили создать удобный способ доставки молекулярного комплекса CRISPR-Cas9, который был опробован на культуре человеческих клеткок [6]. Будучи успешно испытанной на клетках многих модельных организмов и доказав свою эффективность на этой стадии, технология CRISPR-Cas9 приковала всеобщее внимание как перспективный инструмент в клинической практике для лечения многих заболеваний, включая наследственные и онкозаболевания. На настоящий момент развитие технологии вплотную подошло к проверке ее эффективности в клинических испытаниях.
Первый рывок в гонке клинических испытаний CRISPR-Cas
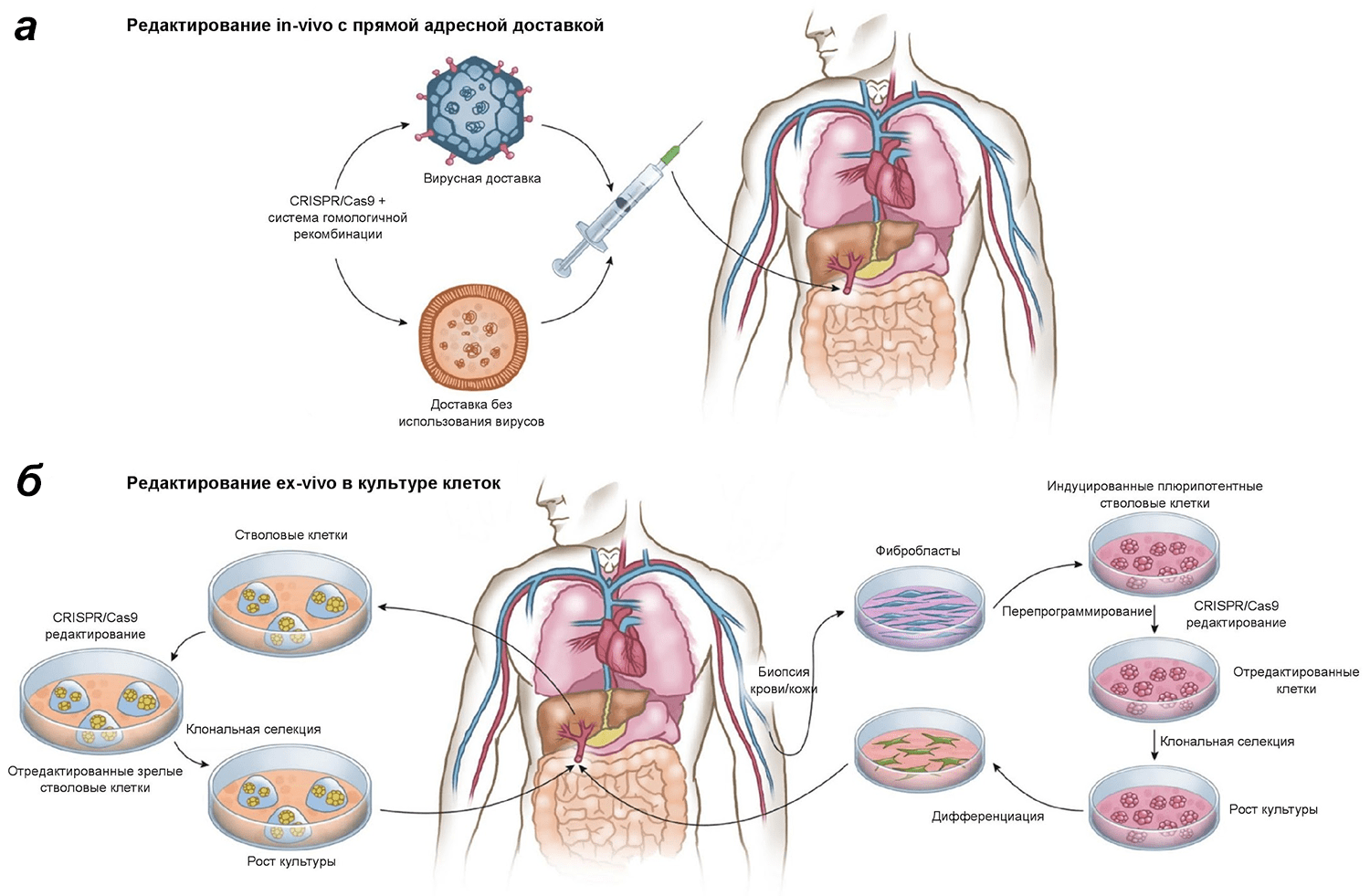
Рисунок 1. In vivo и ex vivo подходы к использованию CRISPR-Cas9 в генной терапии. Китайские исследователи использовали ex vivo подход к редактированию клеток пациента. Однако он — лишь один из двух возможных вариантов лечения патологий с помощью CRISPR-Cas9. а — In vivo CRISPR-Cas9-система доставляется прямо в организм пациента с использованием специальных векторов вирусного или не вирусного происхождения и позволяет произвести редактирование в организме самого пациента. б — Ex vivo редактированию с помощью CRISPR-Cas9 подвергаются, например, соматические стволовые или прогениторные клетки, которые были первоначально взяты у пациента. После редактирования клетки с измененным геномом отбирают, растят в культуре и трансплантируют (инъецируют) обратно пациенту.
Детальные результаты проведенного китайскими исследователями испытания пока не сообщаются, однако уже заявлено, что пациенту была произведена вторая инъекция. Также авторы поделились своими планами по проведению дальнейших испытаний с участием еще 10 пациентов. Каждому из них планируется произвести от двух до четырех инъекций, а затем всех будут тщательно наблюдать в течение последующих шести месяцев для выявления возможных серьезных негативных последствий. Независимо от первого успеха китайских коллег, американские исследователи еще в июле заявили о готовности развернуть в 2017 году масштабные клинические испытания с использованием CRISPR-Cas9 против рака простаты, почек и мочевого пузыря. Старт запланирован на начало 2017 года.
Уникальна ли CRISPR-Cas в качестве технологии геномного редактирования?
Несмотря на явное преимущество по уровню информационного освещения, технология CRISPR-Cas9 не является единственной технологией редактирования ДНК, которая может использоваться для лечения реальных заболеваний.
Однако эффективность редактирования оказалась невысокой — только в 25% клеток редактирование нужного гена прошло успешно. Тем не менее после инъекции редактированных клеток в прогнозе пациентов были отмечены позитивные изменения — у всех 12 человек после прекращения антиретровирусной терапии уровень ВИЧ восстанавливался гораздо медленнее, чем в норме, а уровень Т-лимфоцитов оставался достаточно высоким в течение нескольких недель. Интересно, что у одного из пациентов уровень вируса не восстанавливался в течение целых 12 недель после остановки терапии. Авторы, исследовав геном пациента, обнаружили, что он имеет одну мутировавшую копию гена CCR5, что, по всей видимости, и позволило ему лучше сопротивляться вирусу по сравнению с другими пациентами. Несмотря на достигнутые положительные результаты, испытание данной технологии выявило ряд сложностей, делающих их использование в терапии затруднительным. Во-первых, это недостаточная точность редактирования ДНК в клетках пациентов. Во-вторых, в ходе испытания у пациентов отмечались некоторые малоприятные побочные эффекты, вызванные инъекцией. Например, не исчезающий в течение нескольких дней ужасный запах, исходящий от тел пациентов, возникающий вследствие метаболизма диметилсульфоксида (ДМСО), который используется в качестве криоконсерванта для клеточной культуры [14].
Вторым видом технологии геномного редактирования стало использование фермента TALEN (Transcription activator-like effector nuclease) для спасения маленькой однолетней пациентки с лейкемией в Британии [15]. Испытать подобную технологию авторы исследования решились после того, как все остальные способы лечения ребенка потерпели неудачу. Исследователи использовали Т-лимфоциты, взятые у здорового донора, повысив их устойчивость к противоопухолевым препаратам и модифицировав с помощью технологии UCART (Universal Chimeric Antigene Receptor T-cells), позволяющей им атаковать опухолевые клетки, но не причинять вреда здоровым клеткам пациентки. Авторы признались, что инъекция подобных иммунных клеток с редактированной ДНК не позволяет однозначно вылечить заболевание, однако у пациента появляется шанс дождаться подходящего донора костного мозга. И в данном случае такой донор был найден. Модифицированные иммунные клетки позволили организму девочки побороть опухолевые клетки, а трансплантация — восстановить иммунную систему, сильно пострадавшую в ходе курса химиотерапии и борьбы с опухолью. Случай выздоровления юной пациентки получил широкий общественный резонанс и позволил технологиям редактирования генетической информации еще на шаг приблизиться к применению в клинической практике.
Комментарий Павла Волчкова, заведующего лабораторией геномной инженерии МФТИ

Рисунок 2. Павел Юрьевич Волчков, заведующий лабораторией геномной инженерии МФТИ
Первые шаги в виде первых клинических испытаний очень важны для внедрения технологии в клиническую практику. Они хорошо привлекают общественное внимание, что в свою очередь довольно хорошо стимулирует скорость интеграции технологии, а также увеличивает количество сопряженных разработок и позволяет привлечь дополнительное финансирование. Если смотреть на историю развития подходов к редактированию генома, то, начиная с 90-х годов, она будет идти плавно и поступательно с небольшими пиками, соответствующими тем или иным громким событиям, например, попыткам применения определенной технологии на пациентах. В 2014 и 2015 годах такими событиями стали первые применения ZNFs и TALEN для лечения пациентов с ВИЧ и лейкемией соответственно.
Важно понимать, что сам молекулярный механизм, производящий редактирование ДНК, это важная составляющая будущего клинического продукта, но одной ее недостаточно для того, чтобы лечить пациентов. В список сопутствующих технологий, необходимых для использования геномного редактирования в терапии, входят методы культивирования клеток, которые предполагается редактировать (например, Т-клетки иммунной системы), а также технологии доставки редактирующей молекулярной системы (например, использование вирусных векторов). Кроме того, развитие технологий геномного редактирования толкает вперед развитие приборостроения, поскольку машин, которые автоматически выполняли ли бы всю работу, связанную, например, с отобранными клетками, в клинике сейчас нет. Однако такие машины просто необходимы, поскольку нам важны время и автоматизация процесса для эффективной терапии.
Что же касается заболеваний, в лечении которых планируется попробовать использовать CRISPR-Cas9, то их список достаточно обширен. Editas — одна из крупнейших и многообещающих компаний, разрабатывающих клинические продукты на основе CRISPR-Cas9, — решила сфокусировать свое внимание на заболеваниях, лечение для которых на настоящий момент практически отсутствует или является недостаточно эффективным (см. таблицу).
| Наши программы | Механизм редактирования | Способы доставки | Коммерческие права |
|---|---|---|---|
| Заболевания глаз | |||
| Амавроз Лебера | NHEJ — небольшие делеции | AAV локальная инъекция | Editas |
| Генетические и инфекционные заболевания глаз Синдром Ушера, вирус простого герпеса первого типа (HSV-1) | NHEJ | AAV локальная инъекция | Editas |
| Редактирование Т-клеток | |||
| Редактирование генов в Т-клетках для терапии рака | NHEJ | RNP ex vivo | Juno Therapeutics |
| Дополнительные исследовательские программы | |||
| Доброкачественные гематологические заболевания Бета-талассемия, серповидноклеточная анемия | HNJEJ & HDR | RNP ex vivo | Editas |
| Генетические заболевания мышц Миодистрофия Дюшенна | NHEJ — малые и большие делеции | AAV или LNP | Editas |
| Генетические заболевания легких Муковисцидоз | HNJEJ & HDR | AAV или LNP | Editas |
| Генетические и инфекционные заболевания печени Дефицит альфа-1-антитрипсина | HNJEJ & HDR | AAV или LNP | Editas |
Основные клинические направления, которые Editas выбрала для исследований, можно разделить на три группы.
В дополнительную группу также можно выделить инфекционные заболевания, например, герпетическое поражение глаз, для которых существуют методы лечения, однако они недостаточно эффективны или подразумевают сильное хирургическое вмешательство.
Для всех групп заболеваний в качестве корректирующего механизма Editas планирует использовать технологии, основанные на разных способах репарации ДНК после ее разрезания Cas9. Эти технологии включают в себя такие механизмы репарации, как негомологичное соединение концов (non-homologous end joining, NHEJ) и гомологичную рекомбинацию (homology directed repair, HDR) [16].
Старт клинических испытаний намечен на 2017 год, и Editas — не единственная компания, заявившая о них. Подобные схемы будущих испытаний уже предложили другие крупные компании — Intellia Therapeutics и Crispr Therapeutics.
Никто не застрахован от ошибок
Несмотря на громкий успех китайских исследователей, менее чем через неделю это событие оказалось омрачено печальной новостью из США. В ходе клинический испытаний, проводимых компанией Juno Therapeutics по редактированию Т-лимфоцитов пациентов с острым лимфобластным лейкозом, двое пациентов скончались по причине проявившихся осложнений после трансплантации редактированных клеток. На данный момент FDA — Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration) — приостановило испытания до полного выяснения обстоятельств и причин гибели пациентов. Некоторые эксперты предполагают, что данный прецедент может серьезно ограничить Juno в дальнейших разработках технологии CAR (chimeric antigen receptor) для модификации иммунных клеток онкопациентов.
Случившиеся последовательно успех и неудача использования CRISPR-Cas9 в клинических испытаниях — хороший пример того, насколько сложен путь вхождения технологий геномного редактирования в практику для лечения реальных пациентов. Отбросив весь информационный шум, объективно можно сказать, что говорить об эффективности технологии, а главное о ее безопасности — довольно рано. Пока у нас нет данных успешных клинических испытаний с участием большого числа пациентов, ажиотаж вокруг развивающейся генной терапии будет подкрепляться исключительно общественными ожиданиями, но никак не реальными клиническими показателями. Тем не менее наши ожидания от технологий геномного редактирования огромны, и на настоящий момент представить ближайшее будущее без этих технологий довольно сложно (см. видео).
видео сделала группа Kurzgesagt и перевёл портал Naked Science
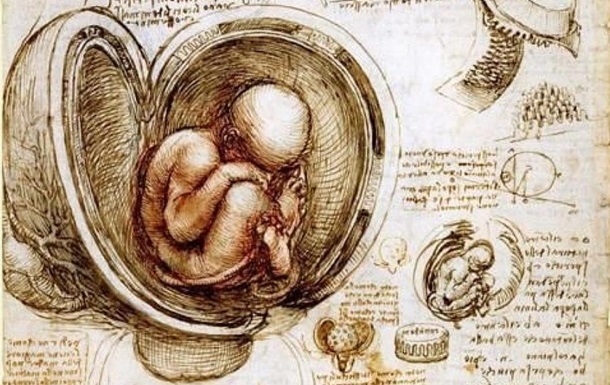
Исследователь из КНР при помощи метода CRISPR удалил у эмбрионов ген CCR5, который "открывает ВИЧ двери в клетки организма". Многие ученые его осудили.
Kитайский ученый Цзянькуй Хэ в начале недели заявил о рождении первых в мире детей с отредактированным геномом. 28 ноября на конференции в Гонконге Хэ рассказал о еще одной беременности в рамках этого проекта.
Власти начали расследование о законности действий ученого. А более ста китайских ученых написали открытое письмо, в котором обвинили Хэ в открытии ящика Пандоры.
Исследователь Хэ Цзянькуй из Шэньчжэня заявил, что изменил гены эмбрионов при помощи метода CRISPR, в результате чего родились первые в мире дети с модифицированным геномом. Ими стали девочки-близнецы Лулу и Нана.
В эксперименте приняли участие семь пар из программы лечения бесплодия. Все мужчины были ВИЧ-инфицированы, а женщины - здоровы. Всего ученому удалось отредактировать 16 из 22 эмбрионов, 11 из которых использовались в шести попытках - одна из которых уже закончилась беременностью и родами.
Его целью было не лечение или предотвращение наследственных заболеваний, а наделение организма способностью к невосприимчивости ВИЧ.
Хэ Цзянькуй утверждает, что удалил у девочек ген CCR5, который "открывает ВИЧ двери в клетки организма", чем обеспечил им иммунитет к вирусу. В видеообращении ученый назвал рождение двух здоровых детей с измененными генами "историческим прорывом Китая в профилактике заболеваний".
"Теперь они будут здоровы, а у отца появился смысл жить и работать, у него есть цель", - сказал ученый.
Пока результаты его работы не публиковалась в научных журналах и не проверялась другими генетиками. О своей работе ученый рассказал одному из организаторов международной конференции по редактированию генов в Гонконге, а позже дал агентству AP интервью.
"Суть модификации заключается в том, чтобы придать организму невосприимчивость к вирусу ВИЧ. Подобная мутация естественно встречается среди людей, но очень редка", - объяснил Хэ.
Редактирование происходило во время экстракорпорального оплодотворения. Он отметил, что хочет проложить путь таким исследованиям в дальнейшем.
"Общество решит, что будет делать дальше", - подчеркнул ученый.
28 ноября на конференции в Гонконге заявил, что в рамках этого проекта есть еще одна беременность.
Метод направленного редактирования генома, называемый CRISPR-Cas9, был обнаружен учеными совсем недавно. Активные лабораторные эксперименты, направленные на изучение возможностей метода, проводятся с 2012 года.
Это относительно простой способ, который на генетическом уровне может помочь в лечении смертельных заболеваний. Пока в США и Европе запрещено применение метода на человеческом организме и разрешено только в рамках лабораторных исследований.
Китай - одна из наиболее продвинутых в плане работы с человеческими генами стран. В законах КНР, в отличие от многих других стран, нет прямого запрета на работу с генами эмбрионов. С 2015 года ученые страны, по информации газеты Wall Street Journal, отредактировали гены 86 человек, больных ВИЧ и раковыми заболеваниями.
Тем не менее случаев рождения детей с измененными генами до случая с Хэ Цзянькуем зарегистрировано не было.
Цзянькуй учился в Америке, прежде чем открыть лабораторию и начать исследования на родине, в Южном научно-технологическом университете в Шэньчжэне. Также у него есть две собственные "генетические компании".
Китайский исследователь объяснил, что в течение нескольких лет проводил исследования на мышах и обезьянах, а затем на человеческих эмбрионах, и даже собирался запатентовать свой метод. Выбор редактирования генома для борьбы с ВИЧ он обосновал тем, что этот вирус представляет серьезную проблему для Китая.
Он также отметил, что его университет не знал о проекте, который Хэ финансировал из собственных средств.
На ученого обрушились с критикой
Президент университета Чэнь Шии созвал экстренное совещание, на котором собрал всех ученых, имевших хотя бы косвенное отношение к проекту, и объявил им, что ЮУНТ не имеет к этому никакого отношения.
Руководство университета объявило, что Хэ Цзянькуй серьезно нарушил стандарты академической этики и что университет собирается провести расследование.
Экспертный совет по медицинской этике города Шэньчжэня также сообщил, что начинает расследование в отношении Хэ Цзянькуя.
Национальная комиссия по здравоохранению Китая намерена тщательным образом проверить законность действий ученого.
Многие исследователи были поражены экспериментом Хэ. 122 китайских ученых написали открытое письмо, в котором осудили своего коллегу и призвали правительство резко ограничить работу с генами человека.
"Ящик Пандоры открыт, но мы можем еще закрыть его, пока не слишком поздно. Это просто нечестно по отношению к тем китайским исследователям, которые защищают трудолюбие и инновации, основанные на научной этике", - говорится в письме.
"Это бессовестный эксперимент над людьми, который нельзя оправдать ни с этической, ни с моральной точки зрения", - отметил доктор Киран Мусунуру, генетик из Университета Пенсильвании.
Против подобных экспериментов выступил и один из создателей технологии генетического инжиниринга CRISPR Фэн Чжан. Он заявил, что "при нынешнем состоянии технологий" считает разумным введение "моратория на подсадку модифицированных эмбрионов".
Он также указал на то, что, уменьшив риск заболевания ВИЧ, две новорожденные девочки получили повышенный риск заболевания лихорадкой Западного Нила.
Однако знаменитый генетик Джордж Черч из Гарвардского университета поддержал китайского ученого, назвав редактирование генов для противостояния ВИЧ оправданной попыткой, поскольку это заболевание несет "серьезную угрозу для здравоохранения".
Источник кореспондент нет
Если кто еще знает что - пишите в комменты плиз
![]()
два дня достаточно, это же пикабу
Тут, по видимому, принцип я не видел - значит не боян. А вообще что это за отсебятина про иммунитет к СПИДУ? ТС хоть знает что такое СПИД и почему бессмысленно писать об иммунитете к нему?
Эволюция живых организмов, происходящая прямо на глазах

У эволюции много доказательств:
морфологические, эмбриологические палеонтологические, биохимические, биогеографические, и генетические. Самые наглядные - это филогенетические ряды, на которых можно поэтапно пронаблюдать изменения в строении животных. Правильно расставить порядок скелетов позволяет радиоизотопный и другие виды анализов возраста окаменелостей.

Здесь, например, вы можете посмотреть, как исчезли пальцы, возникли копыта и изменилась форма черепа лошади. Но креационистам мало подобных филогенетических рядов. Они говорят, что пока эволюцию вживую никто не видел, она не может называться фактом. И мутации не бывают полезными. Чтобы это опровергнуть, вспомним историю австралийских кроликов

В Австралию завезли кроликов, и они быстро расплодились, нанося вред сельскому хозяйству. Тогда учёные использовали вирус миксоматоза. Вирус очень быстро выкашивал кроликов, добрался даже до домашних. Часть кроликов, пережившая эпидемию, сново расплодилась. Но у них было отличие от предыдущих поколений. Это мутация в гене, кодирующем интерферон IFN-α21A. Это влияет на иммунную систему и ее борьбу с вирусом. То есть несмотря на то, что мутации чаще редки и приводят к болезням, порой они приводят и к положительным изменениям. Это эволюция.

Ещё более интересна ситуация, произошедшая с итальянской стенной ящерицей. Тут речь идёт о более радикальных изменениях. Экспериментаторы перевезли их с острова Копиште в Адриатике на соседний остров Мрчару. Там было много травы и не было хищников. Через 36 лет у ящериц изменилось страница тела. Поскольку травы было много, насекомоядные рептилии стали травоядными, их челюсти стали более массивными и сильными для переживывания травы. В их пищеварительной системе появилось место для бактерий, которые помогают переварить траву. Поскольку им больше не надо было быть юркими, чтобы убегать от хищников, они стали большими и неповоротливыми.

Но креационистам этого не достаточно. Их ведь и селекция как доказательство не устраивает. Они хотят увидеть более серьезные изменения в строении организмов. Но полезным мутациям нужно накопиться, чтобы изменения было серьезны, поэтому такая эволюция длится миллионы лет. Неужели мы не можем посмотреть на эволюцию? Можем. Благодаря вирусам и бактериям, у которых смена поколений происходит гораздо быстрее. Учёные в лабораториях наблюдают, что кардинальные изменения в строении вирусов и бактерий происходят не мгновенно, по воле божьей, а засчет процесса накопления полезных мутаций. То есть строение вируса или бактерии продиктовано эволюцией.
Когда смотришь на то, как совершенно устроены животные, кажется, что такое разумное строение мог обеспечить только разумный создатель. А у вирусов и бактерий, напомню, доказано, что строение обусловлено эволюцией. И они устроены не менее "разумно", чем животные. Порой они даже похожи на роботов.
Рассмотрим, к примеру, вирус бешенства. Он поражает мозг заражённого животного именно таким образом, чтобы вызвать у него агрессию. Тогда жертва кусает других и переносит вирус. Разумно? Разумно.

Или вирус СПИДА. Он поражает именно своих главных врагов в теле человека - клетки иммунной системы. В результате организм не способен ему противостоять и выздороветь. Разве не гениально он устроен?
Или чума.. Бубонная чума размножается в глотке блохи и перекрывает ее. Блоха не может пить. В результате насекомое в порыве жажды мечется от жертвы к жертве, отчаянно пытаясь напиться,и заражает чумой больше жертв. Тоже разумно. Но это бактерия, а доказано, что они формируются в процессе эволюции.
А напомню, что с животными происходят те же процессы, что и при эволюции бактерий, только медленные. Мы не можем увидеть в лаборатории эволюцию животных, но благодаря микроорганизмам мы всё же можем пронаблюдать ее вживую.

![]()
В Златоусте для медика, которой в глаза попала кровь ВИЧ-инфицированного, второй день ищут противовирусный препарат
По ее словам, накануне вечером фельдшер в темном подъезде оказывала помощь ВИЧ-инфицированному мужчине, у которого уже развился СПИД. Кровь пациента брызнула в глаза медику.
По словам депутата, главврач станции скорой помощи Златоуста заявила, что давала поручение закупить противовирусные средство еще прошлом году, но почему-то этого сделано не было.
В результате необходимое лекарство нашлось только в областном ВИЧ-центре в Челябинске. Сегодня его передадут в Златоуст.
В Минздраве региона оперативно прокомментировать ситуацию не смогли
![]()
Второй пациент вылечен от ВИЧ: новый рубеж в борьбе с глобальной эпидемией СПИДа
Учёные долго пытались повторить последовательность действий, которые привели к первой долгосрочной ремиссии 12 лет назад. С так называемым “Лондонским пациентом” у них, кажется, получилось.

Уже во второй раз с начала глобальной эпидемии пациент излечен от ВИЧ-инфекции – вируса, который вызывает СПИД.
Новость появилась почти через 12 лет после того, как стало известно об излечении первого пациента – о подвиге, который учёные долго и безуспешно пытались повторить.
Исследователи опубликовали свой доклад в журнале “Nature” и представили некоторые детали на конференции по ретровирусам и оппортунистическим инфекциям в Сиэтле. В данной публикации учёные описывают этот случай как долгосрочную ремиссию. В интервью же большинство экспертов называли это излечением, но с оговоркой, что очень сложно определить, какое слово стоит использовать, так как пока известно только два таких случая.
Оба выдающихся результата достигнуты благодаря пересадке заражённым пациентам костного мозга. Но в обоих случаях трансплантация предназначалась для лечения рака, а не ВИЧ.
Трансплантация костного мозга вряд ли станет предпочтительным вариантом лечения в ближайшем будущем. Сейчас для контроля ВИЧ-инфекции используются сильнодействующие препараты, пересадка же остается рискованным вмешательством из-за серьёзных побочных эффектов, которые могут длиться годами.
Однако, как говорят учёные, замена собственных иммунных клеток организма на специально модифицированные к сопротивлению ВИЧ-инфекции может успешно применяться на практике.
Доктор Венсинг соруководитель “IciStem” – консорциума европейских учёных, изучающих пересадку стволовых клеток в качестве лекарства от ВИЧ-инфекции. Консорциум поддерживается “amfAR” – американской организацией по изучению СПИДа.
Новый пациент предпочел сохранить анонимность, и учёные называют его исключительно “Лондонским пациентом”.
На той же конференции в 2007 году доктор из Германии описал первый случай излечения “Берлинского пациента”, позже идентифицированного как Тимоти Рэй Браун 52-х лет, сейчас проживающего в Палм Спрингс, Калифорния.
Эта новость, размещенная на плакате в задней части конференц-зала изначально не привлекла много внимания. Как только стало ясно, что мистер Браун вылечен, учёные начали попытки повторить этот результат с другими раковыми пациентами, зараженными ВИЧ.
Раз за разом вирус возвращался примерно через девять месяцев после того, как пациенты прекращали антиретровирусную терапию, или же пациент умирал от рака. Неудачи заставляли учёных гадать, останется ли излечение мистера Брауна счастливой случайностью.
У мистера Брауна была лейкемия, и после неудачной химиотерапии ему потребовалась пересадка костного мозга.
Трансплантация была от донора с мутацией белка CCR5, который находится на поверхности определенных иммунных клеток. ВИЧ использует этот белок, чтобы проникнуть внутрь клеток, но не может попасть в их мутированную версию.
Мистеру Брауну давали сильнейшие имуносупрессивные лекарства, которые больше не используются, он страдал от сильнейших побочных эффектов месяцами после трансплантации костного мозга. Его даже погрузили в искусственную кому, и он едва не умер.
У него была лимфома ходжкина, и он перенес трансплантацию костного мозга от донора с мутацией белка CCR5 в мае 2016 года. Ему также была назначена имуносупрессивная терапия, но лечение было менее интенсивным, согласно нынешним стандартам трансплантации.
Он перестал принимать лекарства от ВИЧ в сентябре 2017 года, что сделало его первым пациентом после Брауна, у которого не обнаружен вирус спустя более чем год после прекращения терапии.
Хотя “Лондонский пациент” после трансплантации не был болен так же сильно, как мистер Браун, вмешательство все равно сработало: трансплантация уничтожила рак без разрушительных побочных эффектов. Пересаженные иммунные клетки, устойчивые к ВИЧ, похоже, полностью заменили его собственные уязвимые клетки.
Большинство людей с мутацией устойчивости к ВИЧ, названной “Дельта 32”, североевропейского происхождения. В базе данных “IciStem” насчитывается около 22 тысяч таких доноров.
Пока учёные отслеживают 38 ВИЧ-инфицированных, перенесших пересадку костного мозга, включая шестерых с пересадкой от доноров без мутации. Лондонский пациент 36-й в этом списке. Другой, 19-й номер из списка, называемый также “Дюссельдорфским пациентом”, не принимает анти-ВИЧ терапию уже четыре месяца. Детали этого случая будут представлены на Сиэтльской конференции позже.
Консорциум учёных повторно проанализировал кровь “Лондонского пациента” на наличие вируса. Они увидели слабые признаки инфекции в одном из 24-х тестов, но говорят, что это может быть результатом загрязнения образца.
Большинство экспертов, которые знают подробности, согласны, что этот новый случай выглядит, как легитимное лечение, однако некоторые не уверены в его актуальности для терапии против СПИД в целом.
Несколько компаний стремятся разработать такие генные терапии, но еще не достигли успеха. Изменения должны быть нацелены на нужное количество клеток и в нужном месте – например, только в костном мозге, а не в головном мозге – и менять только гены, связанные с производством CCR5.
По словам доктора МакКьюна, сейчас над преодолением этих трудностей работает сразу несколько групп учёных.
В конце концов, у них может получиться вирусная система доставки, которая, после введения в организм, будет находить и удалять все рецепторы CCR5. А может быть, даже создадут стволовые клетки, устойчивые к ВИЧ, которые можно перенести любому пациенту.
Одним из важных предостережений для любого подхода является то, что пациент всё равно будет уязвим к форме ВИЧ X4, который использует другой белок, CXCR4, чтобы попасть в клетки.
Если у человека есть даже небольшое количество вируса X4, то его количество многократно увеличится в отсутствие конкуренции с его вирусными собратьями.
Существует как минимум один описанный случай пациента, которому пересадили “Дельта 32” от донора, но позже у него был найден вирус Х4. (В качестве предосторожности от вируса Х4 мистер Браун ежедневно принимает таблетки для предотвращения ВИЧ).
Читайте также:



