Стрептококк с конститутивным mlsb фенотипом что это
В настоящее время группа макролидов насчитывает более десяти различных антибиотиков. Все они имеют определенное структурное сходство с эритромицином, отличаясь от него по количеству атомов углерода в лактонном кольце и характеру боковых цепей. Макролиды можно классифицировать по химической структуре и по происхождению.
Химическая классификация предполагает разделение препаратов на 3 группы, в зависимости от числа атомов углерода в лактонном кольце - 14-, 15- и 16-членные, причем 15-членные препараты правильнее называть не макролидами, а азалидами, так как в кольцо включен атом азота (рис. 1).
Рис. 1. Классификация макролидов
В последнее время все большее внимание уделяют характеру сахаров, составляющих боковые цепи, так как они, например, определяют действие макролидов на синегнойную палочку.
По происхождению макролиды подразделяются на природные, полусинтетические и пролекарства. Последние представляют собой эфиры, соли и соли эфиров природных макролидов, которые характеризуются улучшенным вкусом, большей кислотоустойчивостью и более высокой и стабильной биодоступностью при приеме внутрь по сравнению с исходными продуктами, выпускаемыми в виде оснований.
Структурные особенности различных макролидов предопределяют прежде всего (1) различия в их фармакокинетических характеристиках, (2) особенности антибактериальной активности, (3) переносимости и (4) возможности взаимодействия с другими лекарствами. В то же время все макролидные антибиотики обладают одинаковым механизмом антимикробного действия и имеют в целом близкие спектры активности. Механизмы развития резистентности микрофлоры к ним также являются близкими, но тем не менее есть различия между 16-членными и другими макролидами.
Антимикробное действие макролидов обусловлено нарушением синтеза белка на этапе трансляции в клетках чувствительных микроорганизмов. Молекула антибиотика способна обратимо связываться с каталитическим пептидил-трансферазным центром (P-site) рибосомальной 50S-субъединицы и вызывать отщепление комплекса пептидил-тРНК (представляющего собой растущую пептидную цепь) от рибосомы. При этом нарушается цикличность последовательного присоединения пептидной цепи к пептидил-трансферазному центру (P-site) и акцепторному аминоацил-тРНК-центру (A-site) 50S-субъединицы, то есть ингибируются реакции транслокации и транспептидации (рис. 2). В результате приостанавливается процесс формирования и наращивания пептидной цепи. Связывание макролидов с 50S-субъединицей возможно на любой стадии рибосомального цикла [1,2]. Выявлено, что 14- и 16-членные макролиды отличаются по особенностям связывания с различными доменами пептидил-трансферазного центра (рис. 3).
Рис. 2. Механизм синтеза белка в рибосоме микробной клетки.
(M - точка приложения действия макролидов)
По P. Vanuffel, C. Cocito (1996) [2]
Связывание с 50S-субъединицами рибосом характерно также для таких антибиотиков, как линкосамиды*, стрептограмины** и хлорамфеникол. Несмотря на то, что по особенностям связывания с доменами пептидил-трансферазного центра данные антибиотики отличаются от макролидов, при одновременном назначении между ними возможна конкуренция и ослабление антимикробного эффекта [4].
ВИР-S - виргиниамицин-S; ЭРИТ - эритромицин; ВИР-М - виргиниамицин-М; СПИР - спирамицин; ЛИН - линкомицин
Рис. 3. Участки связывания различных антибиотиков с 50S-субъединицей рибосомы.
По M.Di Giambattista и соавт. (1987) [3]
* К линкосамидам относятся линкомицин и клиндамицин.
** Стрептограмины - новый класс антибиотиков, имеющих некоторое структурное сходство с макролидами. Наиболее перспективным является комбинированный препарат хинупристин/дальфопристин (Synercid ® ), обладающий in vitro высокой активностью против множественнорезистентных штаммов стафилококков и ванкомицинрезистентных E.faecium.
Характер антимикробного действия макролидов обычно является бактериостатическим. Тем не менее в определенной степени он зависит от концентрации антибиотика в очаге инфекции, вида микроорганизма, фазы его развития и степени микробной обсемененности. В высоких концентрациях (в 2-4 раза превышающих МПК) и особенно в отношении тех микроорганизмов, которые находятся в фазе роста, макролиды могут оказывать бактерицидное действие. Подобным образом они действуют на b -гемолитический стрептококк группы А, пневмококк, менингококк, возбудителей коклюша и дифтерии [5,6]. В то же время против золотистого стафилококка макролиды в большинстве случаев проявляют бактериостатический эффект.
Микробиологическая активность макролидных антибиотиков in vitro зависит от ряда факторов, во-первых, от рН среды. При этом изменение активности может быть связано не с нарушением химической структуры макролидов, а с их ионизацией в условиях повышенной кислотности, следствием чего является снижение проницаемости через цитоплазматическую мембрану бактерий. Поскольку макролиды являются слабыми основаниями, их активность возрастает в щелочной среде (рН 5,5-8,5), так как при этом они меньше ионизируются и лучше проникают внутрь микробной клетки [7]. Оптимальный эффект эритромицина, кларитромицина и особенно азитромицина проявляется при рН > 7,5, в то время как при рН 7,5 и наименее - при рH b -гемолитических стрептококков и пневмококков (использовали среду АГВ с 5% дефибринированной человеческой крови) диаметры зон подавления роста вокруг дисков с мидекамицином на среде АГВ не отличаются от полученных на агаре Мюллер-Хинтон. При тестировании штаммов гемофильной палочки на средах, приготовленных на основе АГВ (шоколадный агар, агар с дрожжевым экстрактом и факторами Х и V), диаметры зон значительно отличались от полученных на НТМ.
Таким образом, необходимо проведение дальнейших исследований, направленных на изучение возможности использования отечественной среды АГВ вместо агара Мюллер-Хинтон для определения чувствительности различных бактерий к современным макролидам, разработку критериев интерпретации результатов, а также стандартных методик тестирования микроорганизмов со сложными питательными потребностями.
В большинстве случаев отмечается полная перекрестная резистентность к макролидным антибиотикам. Поэтому на практике обычно определяют чувствительность грамположительных микроорганизмов (стрептококков и стафилококков) только к одному антибиотику из группы макролидов - обычно к эритромицину. Однако в отношении штаммов стафилококков, обладающих индуцибельной резистентностью к эритромицину, связанной с метилированием 23S фрагмента 50S-субъединицы рибосом, 16-членные макролиды (джосамицин, спирамицин, мидекамицин) проявляют активность in vitro и считаются возможной альтернативой в клинической практике. Для определения типа резистентности к макролидам у стафилококков (индуцибельный или конститутивный) используют диско-диффузионный тест для выявления антагонизма между линкомицином и эритромицином in vitro - специфического признака индуцибельного типа резистентности к макролидам, линкосамидам и стрептограминам (MLSB-тип резистентности). В этом случае штамм считается резистентным к 14- и 15-членным макролидам, но чувствительным к 16-членным макролидам и линкосамидам. В случае конститутивного типа MLSB резистентности штаммы стафилококков резистентны ко всем без исключения макролидам и линкосамидам.
В приложении I-II приведена суммарная информация по определению чувствительности к макролидным антибиотикам диско-диффузионным методом. Приведенная информация в основном соответствует стандартам NCCLS 1997 года, часть данных приведена из Доклада комитета по антибиотикам Французского общества микробиологов (SFM) в 1996 году.
Эритромицин, являющийся "золотым стандартом" среди антибиотиков класса макролидов, обладает высокой активностью прежде всего против грамположительных кокков, таких как b -гемолитический стрептококк группы A (S.pyogenes), пневмококк (S.pneumoniae), золотистый стафилококк (S.aureus), исключая метициллинорезистентные штаммы последнего.
Кроме того, он хорошо действует на возбудителя коклюша (B.pertussis), дифтерийную палочку (C.diphtheriae), моракселлу (M.catarrhalis), легионеллы (Legionella spp.), кампилобактеры (Campylobacter spp.), листерии (Listeria spp.), хламидии (C.trachomatis, C.pneumoniae), микоплазмы (M.pneumoniae), уреаплазмы (U.urealyticum).
Эритромицин умеренно активен против гемофильной палочки (H.influenzae), боррелий (B.burgdorferi) и некоторых бактероидов, включая B.fragilis. В то же время он практически не действует на грамотрицательные бактерии семейства Enterobacteriaceae, Pseudomonas spp. и Acinetobacter spp., поскольку не проникает через оболочку клеток данных микроорганизмов [24].
Другие макролиды, имея в целом сходство по спектру и выраженности антимикробной активности с эритромицином, обладают некоторыми отличительными особенностями. С практической точки зрения представляет интерес сопоставление их эффекта в отношении следующих категорий микроорганизмов [25]:
-
1) активность против быстро размножающихся пиогенных кокков, чувствительных, как правило, к b -лактамным антибиотикам (особенно бензилпенициллину) и эритромицину: стафилококков, стрептококков, энтерококков, гонококков и анаэробных кокков;
-
2) активность против грамотрицательных бактерий, резистентных к бензилпенициллину и эритромицину, таких как Enterobacteriaceae и Pseudomonas spp.; к этой категории может также быть отнесен H.influenzae, поскольку вопрос о его чувствительности к эритромицину остается дискутабельным, а также грамотрицательные анаэробы;
-
3) активность против внутриклеточных возбудителей, вызывающих инфекции, при которых традиционно назначаются эритромицин или тетрациклины: Chlamydia spp., Mycoplasma spp., U.urealyticum, Campylobacter spp., Legionella spp.;
-
4) активность против микроорганизмов, борьба с которыми с помощью антибактериальных препаратов остаётся затруднительной, и поэтому есть все основания оценить эффект новых макролидов; представителями такой микрофлоры является токсоплазмы (T.gondii) и атипичные микобактерии;
-
5) активность против микроорганизмов, не входящих ни в одну из перечисленных групп.
Действия отдельных макролидных антибиотиков на быстро размножающиеся пиогенные кокки не имеет принципиальных различий (табл. 1).
Таблица 1. Активность макролидов против пиогенных кокков (МПК50, мг/л)
По J.D. Williams, A.M. Sefton (1993) [25]
|
Обращает на себя внимание превосходство азитромицина над другими препаратами по активности против N.gonorrhoeae. Наиболее слабым действием на гонококк обладает диритромицин.
В отношении S.aureus (чувствительного к метициллину) наилучший эффект проявляет кларитромицин, несколько слабее действует эритромицин и азитромицин, а наименее выраженной активностью обладает джосамицин и спирамицин. Ни один из макролидов практически не действует на штаммы S.aureus, устойчивые к эритромицину [26].
Коагулазонегативные стафилококки обладают примерно одинаковой чувствительностью к эритромицину, диритромицину и миокамицину [27,28]
Кларитромицин превосходит другие макролиды по действию на S.pyogenes, второе место по эффективности занимает эритромицин. Согласно данным Bauernfeind (1993), кларитромицин проявляет также наиболее выраженный, по сравнению с другими препаратами, эффект против стрептококков группы В (S.agalactiae) [26].
Все препараты обладают примерно равноценным по выраженности действием против пневмококка. Согласно некоторым данным, 16-членные макролиды - спирамицин и джосамицин - могут действовать на штаммы пневмококка, резистентные к пенициллину и эритромицину [29].
Активность макролидов против зеленящих стрептококков, выделенных у больных с нейтропенией в период с 1988 по 1994 год, в целом оказалась низкой, особенно в отношении пенициллинрезистентных штаммов (табл. 2), что ставит под сомнение рекомендации об их применении у таких пациентов для профилактики бактериемии [30].
Таблица 2. Активность макролидов против зеленящих стрептококков, выделенных у пациентов с нейтропенией.
По F. Alcaide и соавт. (1995) [30]
|
S - штаммы, чувствительные к пенициллину; I - штаммы, умереннорезистентные к пенициллину;
R - штаммы, резистентные к пенициллину
Энтерококк проявляет наибольшую чувствительность к спирамицину, а наименее чувствителен к рокситромицину, азитромицину и джосамицину. Однако это не имеет большого клинического значения, так как макролиды при лечении инфекций, вызванных энтерококками, не применяется.
Против анаэробных кокков наиболее активными являются кларитромицин, азитромицин, джосамицин и спирамицин, а наименее - диритромицин.
Метициллинорезистентные штаммы S.aureus устойчивы к любым макролидам [19,26]
Азитромицин превосходит другие макролиды по действию на грамотрицательные бактерии, в частности, по активности против H.influenzae, M.catarrhalis (табл. 3) и P.multocida. Ампициллинорезистентные штаммы H.influenzae могут быть несколько более устойчивыми к макролидам, чем ампициллинчувствительные [26].
Таблица 3. Активность макролидов против грамотрицательных микроорганизмов (МПК* in vitro)
По J.D. Williams (1993), A.M. Sefton (1993) [25], A. Bauernfeind (1993) [26], J.F. Desnottes (1996) [31]
|
* для B.fragilis указаны значения МПК50, для других микроорганизмов - диапазон МПК
Все макролиды, кроме диритромицина, активны против Bacteroides spp. В отношении B.fragilis умеренной активностью обладают эритромицин, кларитромицин, азитромицин, и джосамицин. Рокситромицин и спирамицин действует на него слабо, а к диритромицуну B.fragilis полностью устойчив.
Микроорганизмы семейства Enterobacteriaceae, Pseudomonas spp. и Acinetobacter spp. обладают природной устойчивостью к макролидам.
Азитромицин является наиболее активным среди макролидных антибиотиков против C.jejuni - МПК90 его равна 0,5 мг/л. Величины МПК90 эритромицина, кларитромицина и рокситромицина составляют 4,4 и 16 мг/л соответственно. Никаких различий в действии макролидов на хинолончувствительные и хинолонрезистентные штаммы кампилобактера не установлено [32]. Кларитромицин превосходит другие макролиды по действию на L.pneumophila и H.pylori [33,34].
Макролиды обладают довольно высокой активностью против хламидий, микоплазм и уреаплазм (табл. 4). Исключение составляют генитальные микоплазмы (M.hominis), в отношении которых наиболее отчетливой микробиологической активностью обладает только мидекамицин (миокамицин). Кларитромицин проявляет наиболее сильный среди других препаратов эффект против C.trachomatis. Диритромицин и мидекамицин слабо действуют на C.psittaci.
Таблица 4. Активность макролидов против внутриклеточных возбудителей (МПК in vitro)

Стафилококк признан одним из наиболее распространенных возбудителей различных инфекций человека. Устойчивость к антимикробным препаратам среди стафилококков является растущей проблемой. Это привело к возобновлению интереса к использованию макролидов, линкозамидов и стрептограминов [6, 7]. Макролиды, линкозамиды и стрептограмины были объединены в одну группу (МЛС), это связано с общностью их механизмов действия и резистентности к ним микроорганизмов. Устойчивость к препаратам группы МЛС может быть связана с модификацией мишени действия, их активным выведением и быстрой инактивацией [4].
Наиболее распространенным и клинически важным механизмом резистентности стафилококков является метилирование. Известны два основных типа экспрессии устойчивости, связанной с метилированием: конститутивный и индуцибельный. При конститутивном типе синтез фермента метилазы (соответственно модификация мишени) происходит постоянно и не зависит от внешних условий, и бактерии проявляют перекрестную устойчивость ко всем макролидам, линкозамидам и стрептограминам. При индуцибельном – фермент синтезируется только в ответ на появление в окружающей среде антибиотиков. Штаммы с индуцибельным характером экспрессии метилаз, устойчивые к 14- и 15-членным макролидам, сохраняют чувствительность к 16 -членным макролидам и стрептограминам [4].
В последнее время, клиндамицин из-за его активного проникновения в ткани, является одним из наиболее эффективных антибиотиков в лечении инфекций, вызванных Staphylococcus aureus, особенно кожи и мягких тканей и остеомиелита [8].
Тем не менее выявленные чувствительные к клиндамицину стафилококки могут проявить индуцибельную резистентность во время проводимого лечения. На основании проведенных исследований было сделано заключение, что резистентные к эритромицину и чувствительные к клиндамицину стафилококки в ходе антибиотикотерапии могут приобретать резистентность, что и приводит к неэффективности проводимого лечения. Исходя из этого, возникает необходимость определения индуцибельного типа резистентности к клиндамицину с помощью постановки диско-диффузионого D-теста, для выявления антагонизма между клиндамицином и эритромицином [9, 10].
Материалы и методы исследования
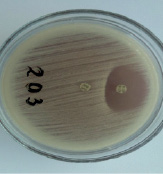
Рис. 1. Д-зона ингибирования вокруг диска с клиндамицином указывает на индуцибельный тип резистентности
Методика постановки D-теста и интерпритация результатов осуществлялась следующим образом: суспензию Staphylococcus spp. мутностью 0,5 McFarland наносили на поверхность Мюллера-Хинтон агара в чашке Петри, затем помещали диски с эритромицином (15 мкг) и клиндамицином (2 мкг) на расстоянии между ними 15 мм. После инкубации при 37°C в течение 18–24 часов уплощение зоны (D-образные) вокруг клиндамицина указывало на индуцибельный тип резистентности к клиндамицину (рис. 1). Если D-тест положительный (D+), то изолят следует считать устойчивым к клиндамицину, если отрицательный (D-), то чувствительным.
Результаты исследования и их обсуждение
По результатам идентификации установлено, что видовой состав выявленных стафилококков включал: коагулазоположительный вид S. aureus – 174 шамма и ряд коагулазонегативных видов (S. epidermidis, S. hyicus, S. auricularis, S. haemolyticus, S. hominis, S. capitis, S. saprophyticus) – 56 штаммов. Среди выявленных стафилококков S. aureus встречался в три раза чаще (рис. 2).
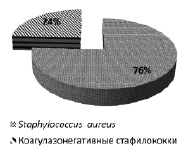
Рис. 2. Частота выявления Staphylococcus aureus и коагулазонегативных стафилококков из ран и свищей у больных хроническим остеомиелитом
Проведена сравнительная характеристика восприимчивости стафилококков к эритромицину и клиндамицину (рис. 3). Было установлено, что чаще встречаются штаммы, резистентные к эритромицину, причем у метициллинрезистентных коагулазонегативных стафилококков (MRCNS) эта разница составляла 36,4 %.
Среди метициллинрезистентных штаммов устойчивых к клиндамицину и эритромицину лидирующее положение занимает S. aureus, среди метициллинчувствительных – коагулазонегативные стафилококки (CNS).
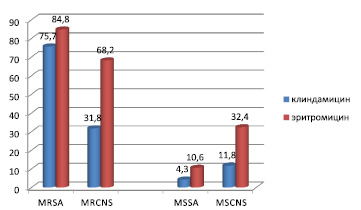
Рис. 3. Сравнительная характеристика резистентности эритромицина и клиндамицина к стафилококкам. Примечание. MRSA – метициллинрезистентные Staphylococcus aureus, MRCNS – метициллинрезистентные коагулазонегативные стафилококки, MSSA – метициллинчувствительные Staphylococcus aureus, MSCNS – метициллинчувствительные коагулазонегативные стафилококки
Сравнение различных типов восприимчивости стафилококка к клиндамицину и эритромицину
Многие слышали о существовании стрептококковой инфекции и даже с ней сталкивались. Но мало кто серьезно задумывался, что собой представляет стрептококк, что это такое? А ведь знание особенностей жизни и деятельности врага – это уже половина победы. Стрептококками занимается наука микробиология. В ней, как и в любой другой области знаний, много сложных и непонятных терминов. В данной статье мы попробуем доступным языком рассказать о том, чем опасен стрептококк, что это такое, можно и нужно ли с ним бороться и какими методами осуществляется терапия.
Человек ежедневно и ежесекундно сталкивается с тысячами микроорганизмов, рассмотреть которые можно только под микроскопом. Ярким представителем этой огромной армии паразитов является и стрептококк. Что это такое, а может, кто? К какому типу живых существ его отнести? Начнем по порядку.
- анаэробные (т. е. прекрасно обходятся без кислорода);
- грамположительные (термин имеет отношение не к весу, а к окрашиванию бактерии по методу ученого Грама) – это свойство используют для диагностики заболеваний;
- хемоорганотрофные (питаются органикой);
- аспорогенные (не образуют спор);
Особенности жизнедеятельности
Самый большой вред от стрептококков состоит в том, что они выделяют очень опасные токсины, вызывающие отравление организма жертвы и даже способные привести к смерти.
Какие бывают стрептококки
Есть несколько общепризнанных классификаций. По Брауну и Шоттмюллеру, вся армия стрептококков делится на 3 основные группы:
Стрептококки группы А
Гемолитический стрептококк: что это такое
- ангину;
- скарлатину;
- рожу;
- импетиго (болезнь кожи);
- эндокардит инфекционный;
- абсцессы (брюшной полости, головного мозга);
- менингит, сепсис новорожденных;
- постродовой сепсис;
- различные инфекции мочеполовой системы.
Также существует альфа-гемолитический стрептококк. Что это такое? Это тот же гемолитический стрептококк (зеленящий), только он разрушает эритроциты частично. Может показаться, что этот вид менее опасен. На самом деле он вызывает такие опаснейшие заболевания, как:
- абсцессы брюшины и головного мозга;
- периодонтит;
- эндокардит инфекционный;
- пневмония;
- менингит.
Эти стрептококки, как уже говорилось выше, умеют менять цвет среды с красного на зеленый.
Есть еще гамма-гемолитический стрептококк. Что это такое? Так назвали бактерии, которые совсем не разрушают эритроциты и не меняют вокруг себя среду агара (так называемые негемолитические). Но и они способны вызвать ряд заболеваний:
- эндокардит инфекционный;
- синусит;
- инфекции в ранах.

Стрептококковая ангина
Вообще, ангина – понятие широкое, означающее любое воспаление горла. Оно может быть вызвано не только стрептококками, но и другими вирусными и бактериальными возбудителями. Давайте обсудим, что делать, если обнаружен стрептококк в горле, что это такое и как не ошибиться с диагностикой, ведь от этого зависит способ лечения. Точный вердикт может вынести только врач по результатам микробиологического анализа (мазок). Он берется стерильным тампоном из зева. Кроме этого, есть два экспресс-теста, но мазок является самым точным. Заразиться стрептококковой ангиной можно только при контакте с больным, если не соблюдаются меры предосторожности. Основные симптомы:
- боли в горле, особенно во время глотания;
- температура;
- общая слабость, озноб;
- болезненность шейных узлов;
- отек слизистых;
- белый или гнойный налет на миндалинах и в горле;
- в редких случаях боли в животе.
Заболевание при правильном лечении длится до 5 дней. Лекарства нужно подобрать таким образом, чтобы не страдали почки и суставы.
Чаще всего больным выписывают антибиотики перорально, а в особых случаях подкожно. Для уменьшения болей в горле используют спреи или полоскания антисептиками, отварами ромашки, раствором соды пищевой.
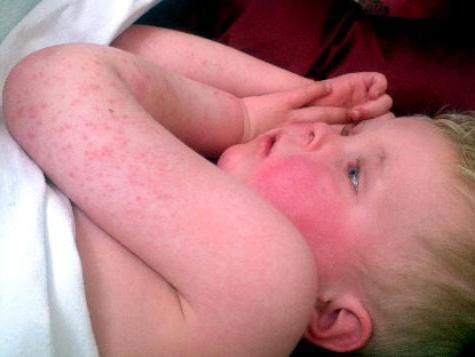
Стрептококковые заболевания кожи
Некоторых пациентов врачи направляют сдать анализ на стрептококк СПП. Что это такое? Да все те же бактерии-кокки. Правильнее эту группу назвать Streptococcus SPP. В нее входят уже знакомые нам пиогенные стрептококки, являющиеся причиной возникновения очень многих заболеваний, а также Streptococcus pneumoniae, вызывающий пневмонию, менингит, бронхит, заражение крови, и Streptococcus mutans, ответственный за возникновение кариеса и эндокардита.
К стрептококковым болезням кожи относятся импетиго и рожа.
Рожу также вызывают пиогенные стрептококки. Заболевание возникает вследствие проникновения бактерий в подкожную клетчатку. Причины – различные нарушения целостности кожи, от порезов до укусов насекомых. Симптомы:
- покраснение, болезненность, опухание пораженного участка кожи;
- озноб;
- лихорадка.
Одним из неприятнейших свойств патологии является возможность рецидивов спустя много лет после кажущегося излечения.

Пневмония
Данное заболевание имеет несколько разновидностей, в зависимости от возбудителя. Стрептококковая пневмония – одна из самых опасных. Вызывается она проникновением в легкие стрептококков Pneumoniae. Подхватить заразу можно, вдыхая воздух, в котором содержатся патогенные бактерии. Начинается пневмония внезапно, но бывают случаи ее постепенного развития. Симптомы:
- высокая температура;
- кашель;
- боли в груди;
- одышка;
- лихорадка;
- гнойный выпот (скопление гноя в легких) – этот процесс имеет стойкую тенденцию нарастать, и если срочно не принять меры, в легких образуются спайки.
Диагностируют пневмонию рентгенографией, а также тестированием выделяемых мокрот. Лечат антибиотиками и кортикостероидами, как правило, необходим комплексный подход. Схему терапии разрабатывает только квалифицированный специалист! Без правильного лечения пневмония нередко приводит к смерти.
Стрептококк агалактия: что это такое

- сонливость;
- вялое сосание;
- дыхательная недостаточность;
- гипотония артерий;
- бактериемия (в крови присутствие бактерий);
- пневмония либо менингит.
У рожениц стрептококковый сепсис проявляется в болезненности и вздутии живота, бактериемии. Иногда начинаются менингит и/или эндокардит инфекционный.
У всех категорий граждан стрептококки группы В вызывают такие болезни:
- менингит;
- бронхопневмония;
- артрит гнойный;
- воспаления органов мочеполовой системы;
- остеомиелит;
- абсцессы таза, брюшины и другие.
Стрептококки групп С и D
В незначительном количестве у людей обнаруживаются стрептококки других групп. Бактерии, принадлежащие к группе С, являются бета-гемолитическими и вызывают те же болезни, что и патогены A-группы. К группе D относят и стрептококки, и энтерококки. Они вызывают заболевания в основном у пожилых, ослабленных болезнями людей и у тех, кто благодаря бесконтрольному приему антибиотиков нарушил в организме баланс микрофлоры.
Читайте также:


