Сепсис при циррозе печени

Сепсис и септический шок закономерно относятся к наиболее тяжелым заболеваниям, показатели смертности при которых варьируют от 30 % до 50 % [10]. Эволюция взглядов на причины, механизмы развития, клинические проявления и формы сепсиса служит поводом для проведения регулярных согласительных конференций и выполнения дальнейших клинико-экспериментальных исследований. Согласно решениям третьего международного консенсуса по определению сепсиса и септического шока (сепсис – 3), сепсис является опасной для жизни дисфункцией органов, развившейся вследствие дизрегуляторной реакции макроорганизма на инфекцию [19]. То есть в настоящее время основным проявлением сепсиса считается наличие органной недостаточности.
Среди основных органов-мишеней, поражаемых при сепсисе, особое место занимает печень, обеспечивающая защиту организма от развития инфекционных заболеваний и являющаяся важным звеном формирования синдрома полиорганной недостаточности [5, 11].
Цель работы: анализ данных литературы о роли печени в развитии и прогрессировании сепсиса.
Как известно, печень участвует в регуляции практически всех основных путей метаболизма, что обеспечивается наличием различных типов клеток. Паренхима органа представлена гепатоцитами, составляющими порядка 60 % от общего количества клеток. Остальные – это в основном так называемые синусоидальные клетки, представленные, в частности, эндотелиальными клетками, звездчатыми макрофагоцитами (клетками Купфера) и перисинусоидальными (звездчатыми) клетками (клетками Ито).
И гепатоциты и клетки Купфера могут быть активированы при помощи патоген-ассоциированных молекулярных паттернов (PAMPs) (в частности, эндотоксином), вследствие чего запускается секреция ряда провоспалительных цитокинов, обеспечивающих повышенное поступление нейтрофилов для обезвреживания бактерий и / или бактериальных продуктов, циркулирующих в кровотоке. В условиях инфекции и при развитии сепсиса гепатоциты участвуют в регуляции иммунного ответа и сдвига метаболизма в сторону глюконеогенеза [3, 11]. В результате взаимодействия рецепторов гепатоцитов с растворимыми медиаторами сепсиса, включая эндотоксин, цитокины, вазоактивные вещества, происходит изменение их метаболизма в сторону повышения захвата аминокислот, мочевинообразования, увеличения синтеза факторов свертывания крови, системы комплемента, а также белков острой фазы воспаления. Паренхиматозные клетки печени являются также продуцентами и реактивных радикалов кислорода.
Клетки Купфера, составляющие порядка 25 % от всех резидентных макрофагов организма человека, осуществляют элиминацию циркулирующих бактерий и эндотоксина. В этой связи пациенты с хроническими заболеваниями печени характеризуются не только нарушенным клиренсом эндотоксина, но и более высокой восприимчивостью к инфекции [17].
Установлено, что клетки Купфера способны продуцировать целый ряд провоспалительных медиаторов, включая фактор некроза опухоли альфа (ФНО-α), известный как ключевой цитокин развития синдрома системной воспалительной реакции, а также белки острой фазы и оксид азота (No). Взаимодействие клеток Купфера с циркулирующими клетками крови (лейкоцитами, тромбоцитами, эритроцитами) приводит к развитию так называемых лейкостазов в печеночных синусоидах и усилению провоспалительных реакций. Так, в печени пациентов без признаков инфекционного поражения лейкоциты составляют порядка 1–2 % от общего числа непаренхиматозных клеток, а при сепсисе их количество увеличивается в 10–20 раз в течение нескольких часов. Эндотелиальные клетки печеночных синусоидов регулируют обмен веществ и молекул между циркулирующей кровью и перисинусоидным пространством Диссе. В условиях же сепсиса эндотелиоциты приобретают прокоагулянтную способность, обеспечивающую адгезию, активацию и миграцию лейкоцитов [16]. Одновременно с этим в эндотелиоцитах отмечается секреция провоспалительных цитокинов (интерлейкинов 1 и 6), а также оксида азота и оксида углерода, что приводит к нарушениям системной и внутрипеченочной гемодинамики.
К сожалению, развивающиеся при сепсисе нарушения функции печени не однозначны, в связи с чем выделяют два основных варианта клинических проявлений [12, 23]. Первый – это гипоксический гепатит, развивающийся главным образом в результате нарушений кровотока в магистральных сосудах. Второй – это желтуха или сепсис-индуцированный холестаз, обусловленный преимущественно внутрипеченочными повреждениями.
Частота выявления гипоксического гепатита при септическом шоке составляет, по данным [12], 32 % от всех случаев его развития у пациентов отделений реанимации и интенсивной терапии, в ряде наблюдений он может привести к фульминантной печеночной недостаточности. При кардиогенном шоке гипоксический гепатит считается вторичным, поскольку развивается из-за уменьшения сердечного выброса и снижения доставки кислорода. Вместе с тем нарушения гемодинамики в печени не всегда приводят к развитию гипоксического гепатита. Важную роль в его развитии отводят зндотоксину и провоспалительным цитокинам. Авторами в экспериментах по моделированию системной эндотоксинемии у собак было установлено снижение напряжения кислорода в ткани печени. Имеются также указания о роли реоксигенации в развитии гипоксического гепатита, обусловленного процессами ишемии / реперфузии, а также окислительного стресса, ранней активации клеток Купфера и вторичной активации циркулирующих нейтрофилов [23].
Клинико-биохимические проявления гипоксического гепатита характеризуются первоначальным (в первые 24 часа) повышением в сыворотке крови уровней активности трансаминаз и лактатдегидрогеназы с последующим снижением их уровней через 2–3 дня и нормализацией показателей примерно через две недели.
Согласно данным литературы [12], в основе диагностики гипоксического гепатита лежат три критерия:
● клинические признаки сердечной, сосудистой или дыхательной недостаточности;
● длительное или транзиторное повышение в сыворотке крови активности амино-трансфераз (в 20 раз по сравнению с верхней границей нормальных показателей);
● исключение других возможных причин развития некроза ткани печени.
В качестве характерного признака используется и значительное снижение количества протромбина, ответственного за развитие геморрагического синдрома [14]. У 65 % пациентов отмечается повышение в сыворотке крови концентрации креатинина (более 20 мг/л или 177 мкмоль/л), которое, скорее всего, связано с формированием уже почечной недостаточности в условиях нарушения системного кровообращения. Несомненно, что при гипоксическом гепатите может наблюдаться и повышение уровня билирубина, но в большинстве случаев без визуальных признаков желтухи.
Признаки желтухи выявляются примерно у 20 % больных, страдающих сепсисом и / или внепеченочными инфекциями [23]. Кроме того, она может наблюдаться у пациентов, перенесших тяжелую травму и имеющих признаки синдрома системной воспалительной реакции. Считается, что любая разновидность системной инфекции (бактериальная, вирусная, простейшими) может привести к развитию желтухи, но чаще всего она проявляется при грамотрицательной бактериальной инфекции. Наиболее часто желтуха отмечается при внутрибрюшных инфекциях, в частности при перитоните, дивертикулите, аппендиците. Такие заболевания, как пневмония, инфекционный эндокардит, менингит и инфекции мочевыводящих путей, также способствуют ее развитию.
Обычно признаки желтухи определяются через 2–7 дней после начала бактериемии [13]. Тем не менее бактериемия не является четким предвестником развития печеночной дисфункции или холестаза. Так, примерно одна треть пациентов с сепсисом имеет признаки холестатической желтухи за 1–9 дней до первых положительных результатов посева крови. Наиболее часто такое наблюдается у пациентов с недостаточностью кишечного барьера (из-за сепсиса, шока, воспалительных или инфекционных поражений кишечника), что приводит к развитию бактериальной транслокации из просвета кишечника в систему воротной крови при отсутствии клинически выявляемой бактериемии.
Наиболее характерным биохимическим показателем считается гипербилирубинемия (75–80 % конъюгированного) по сравнению с небольшим повышением уровней щелочной фосфатазы и трансаминаз в сыворотке крови. Концентрация билирубина в сыворотке крови составляет, как правило, от 85 до 170 ммоль/л, но может превышать и 500 ммоль/л. Повышение уровня билирубина в сыворотке крови при сепсисе отмечается, как правило, в случаях развития уже полиорганной недостаточности, при этом высокие его концентрации сочетаются с плохим прогнозом. Однако следует добавить, что в подобных случаях должны быть исключены другие причины нарушения функций печени, в частности ишемический и медикаментозный гепатит.
Согласно данным литературы, сепсис-индуцированную дисфункцию печени подразделяют на раннюю и позднюю [20] или первичную и вторичную [21]. Ранняя (первичная) печеночная дисфункция возникает в первые часы сепсиса и связана с гипоперфузией гепатоспланхнической области. Важную роль при этом играют нарушения микроциркуляции, в том числе вследствие развития синдрома диссеминированного свертывания крови [11]. Именно ишемия и гипоксия вызывают повреждение клеток печени, проявляющееся повышением концентрации сывороточных маркеров повреждения печени (трансаминаз, лактатдегидрогеназы, билирубина). При этом развивающиеся нарушения способны к восстановлению при адекватной интенсивной терапии. Поздняя печеночная дисфункция считается более тяжелым и коварным процессом. Она обусловлена синергическим действием микроорганизмов, эндотоксинов, медиаторов воспаления и характеризуется выраженными нарушениями структуры и функции печени с формированием полиорганной недостаточности [22]. В качестве подтверждения G. Szabo с соавт. [22] приводят данные о нарушении функций печени после инфузии эндотоксина или фактора некроза опухоли при отсутствии выраженных изменений циркуляции крови.
Вместе с тем из анализа данных литературы можно заключить, что на сегодняшний день не существует четкого однозначного критерия развития печеночной дисфункции и ее недостаточности, что, соответственно, не позволяет провести и объективный анализ частоты ее развития при сепсисе. Так, K.E. Sands c соавт. [18] определяют печеночную недостаточность при наличии комплекса изменений: увеличения в сыворотке крови содержания общего билирубина более 2 мг/дл (> 34 мкмоль/л) и повышения уровня щелочной фосфатазы или аминотрансфераз более чем в два раза по сравнению с нормальными показателями. При изучении 1342 наблюдений сепсис-синдрома печеночная недостаточность отмечалась у 12 % больных в течение 28 дней от начала заболевания [18]. В то же время, согласно данным D.C. Angus с соавт. [8], печеночная недостаточность фигурировала лишь в 1,5 % наблюдений при анализе кодов патологических состояний и заболеваний, согласно МКБ-9, выявленных у 192980 больных с тяжелым сепсисом в семи штатах США.
При обследовании 312 пациентов с септическим шоком [9] установили развитие печеночной недостаточности в 20 % наблюдений в течение 72 часов от начала лечения. Печеночная недостаточность определялась по наличию как минимум двух из трех критериев:
● содержание общего билирубина более 2,5 мг/ дл (> 43 мкмоль/л),
● уровень аланинаминотрансаминазы в сыворотке в крови более чем в два раза превышает верхнюю границу нормы,
● протромбиновое время или международное нормализованное отношение более чем в 1,5 раза превышает контрольные значения [9].
Согласно решениям Международной конференции по определению сепсиса [15], для диагностики полиорганной недостаточности рекомендуется использовать шкалу Sepsis-related Organ Failure Assessment (SOFA) и Logistic Organ Dysfunction System (LODS) шкалу. Рекомендованные системы основаны на количественной оценке степени выраженности дисфункции отдельных органов, в том числе и печени. В шкале SOFA в качестве маркера используется билирубин, в системе LODS – билирубин и протромбин.
Другим важным моментом, сдерживающим выяснение роли печени в развитии сепсиса, является, на наш взгляд, относительно малое количество работ, посвященных морфологическому изучению органов и тканей, включая печень, у больных, страдающих и / или погибших от сепсиса. Более того, большинство работ по патологии сепсиса в последнее время выполнены в экспериментах на животных либо посвящены молекулярным исследованиям.
Тем не менее при аутопсийном исследовании тел больных, погибших от сепсиса и особенно от септического шока, наблюдается увеличение размеров и массы печени. В случае присоединения ДВС-синдрома печень, как со стороны капсулы, так и на разрезе, имеет пёстрый вид за счёт множественных кровоизлияний. При микроскопическом изучении препаратов ткани печени отмечаются отложения фибрина и скопления нейтрофилов в синусоидах [6]. Повреждения и некрозы гепатоцитов локализуются преимущественно в III зоне ацинусов (центральных отделов долек) [5]. К характерным признакам также относятся повреждения и уменьшение количества эндотелиоцитов и клеток Купфера, что более наглядно проявляется при иммуногистохимических исследованиях с антителами к CD 31, CD 34 и CD 68 [1, 2]. Наличие явлений холестаза при отсутствии внепеченочной обструкции служит дополнительным критерием поражения печени при сепсисе [7].
Таким образом, печень играет важную роль в развитии и прогрессировании сепсиса. Выполняя функции детоксикации и элиминации циркулирующих микроорганизмов, клетки печени способны вырабатывать разнообразные провоспалительные цитокины и биологически активные вещества, усугубляющие повреждение ткани печени и прогрессирование заболевания. Клиническими вариантами развития печеночной дисфункции при сепсисе считаются гипоксический гепатит и сепсис-индуцированный холестаз. Относительно малое количество работ, посвященных морфологическому изучению органов и тканей, включая печень, у больных, страдающих и / или погибших от сепсиса, свидетельствует о необходимости проведения полноценных клинико-патологоанатомических сопоставлений для выяснения звеньев патогенеза печеночной и полиорганной недостаточности.
Бактериальные осложнения у больных циррозом печени на стадии декомпенсации (класс В и С по Чайлд-Пью) явление нередкое. Исследования, проведенные в Южной Америке, показали, что частота инфекционных осложнений у данной категории пациентов составляет 47%, что служит непосредственной причиной смерти приблизительно у 1/4 больных. Высокая летальность при бактериальных осложнениях обусловлена, как правило, слабой выраженностью, а нередко и полным отсутствием симптоматики микробной инфекции (лихорадки, озноба, лейкоцитоза). В ряде случаев единственным проявлением спонтанной бактериемии, перитонита или пневмонии является появление или усиление печеночной энцефалопатии. Наиболее часто встречающиеся инфекционные осложнения:
- спонтанный бактериальный перитонит (СБП),
- пневмония,
- спонтанная бактериальная эмпиема плевры,
- инфекция мочевых путей,
- сепсис,
- бактериальный эндокардит.
Другие бактериальные инфекции, к которым относятся менингит, легочные и внелегочные формы туберкулеза, гнойный холангит, наблюдаются редко.
В 72% случаев этиологическим фактором указанных осложнений является грамотрицательная бактериальная флора.
Наиболее частым инфекционным осложнением цирроза является спонтанный бактериальный перитонит. Данное осложнение выявляется у 8-32% больных. Общая смертность в течение 1-го года после первого эпизода спонтанного бактериального перитонита достигает 61-78% несмотря на успехи современной терапии.
Указанное осложнение чаще возникает у больных с декомпенсированным циррозом (класс С по Чайлд-Пью) при развитии резистентного к диуретикам асцита. Истинная рефрактерность асцита к терапии встречается крайне редко (в 5% случаев). Значительно чаще развивается мнимая рефрактерность к диуретикам, которая может быть обусловлена следующими причинами:
- Больной не ограничивает поступление натрия с пищей и лекарственными препаратами.
- У больного развивается гипонатриемия, при этом он не ограничивает употребление жидкости.
- У больного с циррозом печени нарушается функция почек, что может быть обусловлено как развитием гепаторенального синдрома, так и приемом аминогликозидов, нестероидных противовоспалительных препаратов, метоклопрамида.
- Асцит обусловлен не патологией печени, а другими причинами: асцит при злокачественных новообразованиях, туберкулезном перитоните, панкреатогенный асцит и т. д.
Описаны также случаи дебюта спонтанного бактериального перитонита у больных без асцита, который быстро возникает с развитием спонтанного бактериального перитонита. Этиология цирроза принципиального значения не имеет. Основным фактором риска развития спонтанного бактериального перитонита считается низкое содержание белка в асцитической жидкости. Высокие уровни сывороточного билирубина и креатинина, низкие асцитические концентрации иммуноглобулинов А и G, С3 компонента комплемента, фибронектина в настоящее время также рассматриваются как факторы риска развития спонтанного бактериального перитонита. Таким образом, основными факторами риска развития спонтанного бактериального перитонита являются:
- цирроз печени класса С по Чайлд-Пью,
- белок асцитической жидкости 2,5 мг%,
- сывороточный креатинин > 2 мг%.
Основным источником инфицирования асцитической жидкости служит микрофлора толстой кишки, проникающая в брюшную полость вследствие повышенной проницаемости кишечной стенки (транслокация кишечной флоры). Заражение может происходить в случае гематогенного распространения инфекции при персистирующей бактериемии, быть результатом инфицирования при парацентезе или наложении перитонеовенозного шунта.
При бактериологическом исследовании асцитической жидкости у больных со спонтанным бактериальным перитонитом чаще выявляется грамотрицательная бактериальная флора. В 2/3 случаев этиологическим фактором при спонтанном бактериальном перитоните является Escherichia coli, в 55% - Klebsiella pneumoniae, в 27% - Aeromonas hydrophila. У 10% больных высевается смешанная флора. Streptococcus pneumoniae и Streptococcus faecalis - следующие по частоте выявляемости возбудители (13% случаев). Этиологическим фактором спонтанного бактериального перитонита могут служить и анаэробы. Микобактерия туберкулеза и грибковая (Cryptococcus neoformans) флора как причина спонтанного бактериального перитонита регистрируются в единичных случаях.
В ряде случаев (до 14%) начальная симптоматика спонтанного бактериального перитонита слабо выражена или отсутствует, и заболевание выявляется случайно при исследовании асцитической жидкости. Диагностика спонтанного бактериального перитонита в классических случаях несложна. У больных внезапно появляются признаки бактериального перитонита: лихорадка, боли в животе, положительные перитонеальные симптомы.
Таблица.
Клиника спонтанного бактериального перитонита
| Клинические признаки | Частота встречаемости указанных признаков, % |
| Боли в животе | 76-82 |
| Симптомы печеночной энцефалопатии | 46-71 |
| Лихорадка | 69-82 |
| Рвота | 10-14 |
| Диарея | 10-11 |
| Парез кишечника | 6-8 |
| Шок | 3-10 |
Спонтанный бактериальный перитонит может дебютировать септическим шоком, когда у больного с декомпенсированным циррозом печени АД составляет ниже 90 мм рт. ст., появляется тахикардия более 100 ударов в 1 мин, развивается олигурия (диурез менее 20 мл в 1 ч).
Решающее диагностическое значение принадлежит исследованию асцитической жидкости. Выделяют собственно спонтанный бактериальный перитонит и культуронегативный нейтрофильный асцит. Диагноз спонтанного бактериального перитонита основан на положительном результате посева асцитической жидкости, количестве нейтрофилов более 250 в 1 мм 3 (либо более 500 в 1 мм 3 независимо от результата посева) и отсутствии интраабдоминального источника инфицирования. Культуронегативный нейтрофильный асцит диагностируется по количеству нейтрофилов более 250 в 1 мм 3 при отрицательном результате посева и отсутствии антибиотикотерапии в течение 30 предшествующих дней.
Парацентез целесообразно производить при подозрении спонтанного бактериального перитонита и в случаях рефрактерного к диуретикам асцита с лечебной и диагностической целью.
Наиболее серьезным осложнением спонтанного бактериального перитонита является почечная недостаточность, которая развивается у 1/3 больных и проявляется повышением уровня сывороточного креатинина более 1,5 мг% и/или остаточного азота более 30 мг%. В качестве факторов риска рассматриваются исходно низкие показатели АД и сывороточной концентрации натрия, высокий уровень билирубина и нейтрофилез крови. Смертность больных со спонтанным бактериальным перитонитом, осложненным почечной недостаточностью, составляет 54-87%, что позволяет рассматривать ее как основной прогностический признак спонтанного бактериального перитонита. Прогрессирующая почечная недостаточность характеризуется резистентностью к терапии. Однако в 25% случаев наблюдается спонтанное восстановление функции почек.
Стартовую эмпирическую антибактериальную терапию спонтанного бактериального перитонита целесообразно начинать с назначения цефалоспоринов 3-го поколения (цефтриаксон по 1 г 2 раза в сут, цефотаксим в дозе 2 г 3 раза в сут в течение 5-10 дней). При отсутствии эффекта лечения, что оценивается клинически или по результатам повторного парацентеза, целесообразно в схему терапии на 2-3-и сут включить метронидазол в дозе 0,5 г 3 раза в сут. Поскольку все бактериальные инфекции утяжеляют проявления печеночной энцефалопатии, лечение целесообразно дополнить препаратами лактулозы.
Для предупреждения развития спонтанного бактериального перитонита у больных, относящихся к группе риска, рекомендуется назначать ципрофлоксацин в дозе 750 мг (per os) 1 раз в неделю в течение 6 мес. При циррозе, осложнившемся желудочно-кишечным кровотечением, целесообразно применение норфлоксацина в дозе 400 мг 2 раза в сут, что снижает риск развития спонтанного бактериального перитонита на 62%.
Пневмония как бактериальное осложнение цирроза наблюдается у 4-21% больных. Нередко развитие пневмонии осложняет кровотечение из варикозно расширенных вен пищевода, особенно при длительном применении зонда Блэкмора. В таких случаях летальность достигает 40%. В качестве этиологического фактора пневмонии чаще всего выступают:
- Klebsiella pneumoniae
- Haemophilus influenzae
- Streptococcus pneumoniae
Клиническая картина в большинстве случаев стертая: субфебрильная температура, малопродуктивный кашель, аускультативно - жесткое дыхание или его ослабление, мелкокалиберные или крепитирующие хрипы над областью поражения, умеренный лейкоцитоз (или повышение числа нейтрофилов на фоне лейкопении). Возможна манифестация заболевания только усилением общих симптомов интоксикации или печеночной энцефалопатии. В диагностике ведущая роль принадлежит физикальным и рентгенологическим методам исследования. Особые затруднения вызывает диагностика пневмонии при наличии гидроторакса. Терапия пневмонии у данной категории больных проводится антибиотиками широкого спектра действия из группы цефалоспоринов (цефотаксим, цефтизоксим, цефтриаксон и др.), а также препаратами группы карбапенемов.
Спонтанная бактериальная эмпиема плевры развивается как бактериальное осложнение гидроторакса. Она возникает у 13% больных циррозом печени и в 67% случаев ассоциирована со спонтанным бактериальным перитонитом. Из плевральной жидкости чаще всего высевается Escherichia coli, а также Klebsiella pneumoniae, Pseudomonas stutzeri, Streptococcus pneumoniae. Клиническая симптоматика слабо выражена, поэтому рекомендуется выполнение плевральной пункции с посевом у всех больных циррозом печени, осложнившимся гидротораксом. Лечение проводится по правилам ведения больных с гнойным плевритом. Смертность на фоне терапии составляет около 20%.
Инфекция мочевых путей встречается у 5-25% больных. В 70% случаев этиологическим возбудителем является Escherichia coli. Инфекция мочевыводящих путей, как правило, не является причиной летального исхода у больных с циррозом печени, однако она может быть этиологическим источником бактериемии (до 50%), спонтанного бактериального перитонита (20%) и бактериального эндокардита. В качестве первого курса этиотропной терапии рекомендуется использование препаратов фторхинолонового ряда. Мочекаменная болезнь у больных циррозом печени должна рассматриваться как фактор риска развития хронического пиелонефрита и септицемии, поэтому данной группе показан ежемесячный контроль мочи по Нечипоренко, посев мочи на флору при лейкоцитурии, а также при всех лихорадочных состояниях и резком немотивированном усилении проявлений энцефалопатии.
Сепсис встречается у 7-20% больных циррозом печени. Этиологическим фактором при бактериемии чаще всего выступают:
- грамположительная флора: St. aureus и стрептококки (β-гемолитический, Streptococcus pneumoniae, Streptococcus viridans)
- грамотрицательная флора: Escherichia coli, Klebsiella pneumoniae, Proteus
Источником бактериемии наиболее часто служат инфекции дыхательных и мочевыводящих путей; возможно также спонтанное инфицирование крови при кишечной транслокации. Клиническая картина нередко проявляется лишь внезапным усугублением энцефалопатии. В классических случаях возможен подъем температуры, ознобы, лейкоцитоз. Идентифицировать возбудитель позволяет бактериологическое исследование крови. Общая летальность достигает 70%.
Стартовую эмпирическую терапию сепсиса у больных циррозом печени целесообразно проводить цефалоспоринами 3-го поколения в комбинации с фторхинолонами или карбапенемами с последующей коррекцией схемы в зависимости от результатов бактериологического исследования крови.
Бактериальный эндокардит - редкое осложнение цирроза, наблюдающееся в 0,34-1,33% случаев. Этиологическим агентом при данной патологии чаще всего являются грамотрицательные микроорганизмы, St. aureus и стрептококки. Нередко бактериальный эндокардит развивается на фоне пневмококковой бактериемии, при этом кроме эндокардита у больного наблюдается клиника менингита и пневмонии. Поражается преимущественно митральный клапан (обычно на фоне врожденного или приобретенного порока). Летальность у больных с бактериальным эндокардитом на фоне цирроза печени достигает 80%. Учитывая это, рекомендуется проведение антибиотикопрофилактики всем больным циррозом с наличием порока или протезирования клапанов сердца. При желудочно-кишечном кровотечении, спонтанном бактериальном перитоните, мочевой инфекции и пневмонии, сепсисе, а также при немотивированном прогрессировании печеночной энцефалопатии целесообразно УЗИ сердца с целью исключения бактериального эндокардита.
Субфебрилитет, немотивированное прогрессирование энцефалопатии, асцит (резистентный к диуретической терапии), гидроторакс всегда должны акцентировать внимание врача на возможности бактериальных осложнений, при этом необходим посев крови и назначение антибактериальной терапии.
Таким образом, бактериальные осложнения у больных циррозом печени встречаются достаточно часто и требуют пристального внимания и неотложных терапевтических мероприятий, поскольку данная патология значительно увеличивает процент летальности.
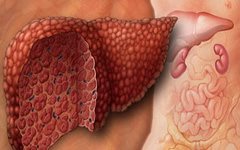
Избыточное образование фиброзной ткани нарушает структуру печени и в конечном счете приводит к циррозу.
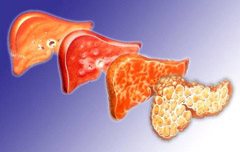
Фиброзная ткань образуется вследствие воспалительных процессов в печени.
Развитие цирроза может долгое время протекать бессимптомно.
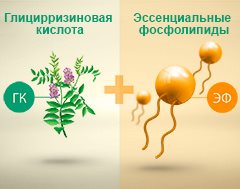
Сочетание глицирризиновой кислоты и эссенциальных фосфолипидов способствует устранению воспаления печени и уменьшению степени фиброза.

- оптимальный состав активных компонентов;
- достоверное уменьшение воспаления в печени и степени фиброза;
- благоприятный профиль безопасности.
Использование гепатопротекторов, обладающих фиксированной доступной ценой, — возможность не переплачивать в процессе лечения.
Цирроз печени — это серьезное заболевание, требующее тяжелого и длительного лечения. Однако, причинами данной патологии могут быть совершенно разные факторы, многие из которых поддаются если не лечению, то контролю. В данной статье мы подробно разберем причины возникновения цирроза печени и методы его профилактики.
Характеристика заболевания и стадии развития цирроза печени
Это поражение является конечной стадией различных хронических заболеваний печени. Данный диагноз ставится, когда патологические изменения в клетках органа (гепатоцитах) становятся необратимыми. При циррозе гепатоциты погибают вследствие воспалительного процесса, а на их месте образуется фиброзная (соединительная) ткань. В целом данный процесс можно назвать иммуновоспалительным. В результате структура печени серьезно нарушается.
Разрушение гепатоцитов — крайне опасный процесс, так как данные клетки выполняют множество важных функций: они участвуют в обменных процессах и секреторной деятельности (выделение желчи и переработанных веществ в кишечник), обезвреживают токсины и другие вредные вещества. В результате печень перестает выполнять свои функции в полной мере: вредные вещества попадают в кровеносную систему, вызывая интоксикацию организма.
Гепатоциты — клетки паренхимы печени (печеночной ткани), на основе которых формируются печеночные дольки — структурно-функциональные единицы печени.
В развитых странах цирроз печени входит в шестерку основных причин смерти пациентов от 35 до 60 лет. Во всем мире от него ежегодно умирают 40 миллионов человек, в Европе — порядка 170 тысяч. За последнее десятилетие количество смертельных исходов возросло на 12%. В России частота возникновения цирроза печени составляет 20–35 случаев на 100 000 населения. Стоит сказать, что это в первую очередь мужская болезнь. Сильный пол страдает ей в три раза чаще, чем женщины. Данное заболевание обычно развивается после 40 лет.
Цирроз печени имеет стадийное течение. Каждая стадия отличается степенью патологических изменений, симптомами и необходимым лечением. Для определения стадии используется специально разработанная для этого шкала по Чайлд-Пью. Для верной оценки требуется сдать некоторые анализы, а также учесть клинические проявления заболевания на текущий момент времени.
Первая степень практически не имеет симптомов, так как болезнь компенсирована. Анализы крови характеризуются снижением уровня билирубина, а также уменьшением протромбинового индекса до 60–80 единиц. При этом воспалительные процессы уже начались и погибшие гепатоциты замещаются соединительной тканью.
На второй стадии заболевания начинают появляться первые неспецифичные симптомы: слабость, апатия, головные боли, тошнота и поносы, слабый аппетит, дискомфорт в правом подреберье, кровотечения из носа и кровоточивость десен. У мужчин возможно облысение и увеличение молочных желез. Начинают проявляться печеночная энцефалопатия и асцит. Данная стадия называется субкомпенсированным циррозом, так как болезнь еще можно вернуть в стадию компенсации.
Печеночная недостаточность — комплекс симптомов, который характеризуется нарушением одной или нескольких функций печени.
Асцит — одно из осложнений цирроза, проявляется скоплением свободной жидкости в брюшной полости.
Далее следует терминальная стадия, на которой энцефалопатия и асцит прогрессируют, кожные покровы обретают желтоватый цвет, наблюдается мышечная атрофия и анемия. Данная стадия опасна развитием серьезных осложнений, которые могут привести к летальному исходу. Среди таких осложнений: печеночная кома, тромбоз воротной вены, рак печени, внутренние кровотечения, а также инфекционные осложнения.
Как можно узнать о состоянии печени? Раньше для этого требовалось проведение биопсии, однако сейчас оценка возможна с помощью специального комплекса расчетных тестов, в которых используются результаты исследований крови и минимальные анамнестические данные, однако золотым стандартом остается биопсия. Специально разработанные алгоритмы определяют стадию фиброза (F0, F1, F2, F3, F4) и степень некровоспалительного процесса (А0, А1, А2, А3) по международной общепринятой системе METAVIR. Данная шкала включает в себя анализ 6 показателей: возраст, индекс массы тела, гипергликемия, количество тромбоцитов, уровень альбумина, отношение ферментов аспартатаминотрансферазы и аланинаминотрансферазы.
В зависимости от степени цирроза печени можно спрогнозировать продолжительность жизни пациента. В среднем более 7 лет живут около половины всех заболевших. При компенсированной стадии цирроза не менее 50% пациентов живут 7–10 лет. Субкомпенсированная стадия дает показатель пятилетней выживаемости около 40%. На стадии декомпенсации около 3 лет живут 10–40% пациентов.
Цирроз может быть вызван разными причинами, а самая распространенная из них — вирусы гепатита. Наиболее опасным для печени является гепатит С, так как он приводит к развитию цирроза в 97% случаев. Алкогольная форма развивается в результате неконтролируемого употребления спиртных напитков. Лекарственный тип возникает из-за длительного употребления гепатотоксических препаратов. Врожденная форма цирроза — результат некоторых генетических патологий (гемохроматоз, тирозиноз, галактоземия и др.). При недостаточном кровообращении и длительном венозном застое в печени диагностируется застойная форма заболевания. Обменно-алиментарный цирроз развивается в результате метаболических нарушений. Вторичный билиарный цирроз — следствие нарушения оттока желчи (болезнь развивается через 3–18 месяцев после нарушения проходимости желчных протоков). Если причина болезни не выяснена, такой цирроз называется криптогенным. Первичный билиарный цирроз также относится к категории заболевания неясной этиологии.
Как уже упоминалось, симптомы цирроза печени зависят от стадии заболевания. Основными из них, независимо от этиологии, являются: пониженная трудоспособность, неприятные ощущения в животе, повышенная температура тела, боли в суставах. При осмотре выявляется умеренное увеличение селезенки, увеличение и уплотнение печени, деформация ее поверхности. На более серьезных стадиях наблюдается вздутие живота, тошнота и рвота, возможна диарея при употреблении жирной пищи, тяжесть и боль в правом подреберье. На терминальной стадии могут возникать желтуха, асцит, отеки ног, варикозное расширение вен пищевода. В некоторых случаях развивается геморрой. При обнаружении тех или иных заболеваний печени необходимо обращаться к врачу гастроэнтерологу-гепатологу.
Лечение цирроза — процесс длительный, и он представляет собой не столько лечение, сколько вторичную профилактику. При этом назначается специальная диета, гепатопротекторные препараты и комплекс витаминов, исключается прием гепатотоксических лекарственных средств, алкоголя. В целом сформировавшийся цирроз печени является необратимым состоянием и считается неизлечимым. Этиотропная терапия для большинства форм цирроза печени на данный момент отсутствует, исключением является вирусный гепатит, при котором могут назначаться противовирусные препараты.
При заболеваниях печени пациентам, как правило, назначают так называемую диету № 5, направленную на нормализацию функций органа и улучшение желчеотделения. Пищу необходимо принимать небольшими порциями 5–6 раз в день, при этом следует полностью исключить жареное и жирное. Предпочтение следует отдать вареной и приготовленной на пару пище. Обязательно употреблять достаточное количество воды — не менее 1,5 литров в день. Следует полностью отказаться от алкоголя. Количество белков ограничивается сотней граммов в день, соли —10-ю граммами в день. При асците назначают бессолевую диету.
Продукты, запрещенные к употреблению:
- любые химические пищевые добавки, в том числе консервы;
- жареное, соленое, маринованное, копченое;
- кондитерские изделия, шоколад, мороженое;
- животные жиры, маргарин, жирные мясо и мясные бульоны;
- соленые сыры, молочные продукты с высокой жирностью;
- бобовые, редька, шпинат, редис, щавель, чеснок, лук;
- кислые фрукты и ягоды;
- сладкие газированные напитки, крепкий чай и кофе.
Наиболее популярны при лечении заболеваний печени такие гомеопатические средства, как:
- Phosphor 6, 12;
- Magnesia Muriatica 6;
- Lycopodium 6;
- Nux Vomica 6;
- Mercur dulcis 6 и др.
Кроме того, в гомеопатических препаратах можно встретить вытяжки из майского чистотела Chelidonium majus. Действительно, взятые за основу растения известны как народные средства для восстановления печени. Однако не стоит забывать, что гомеопатия как таковая официальной доказательной медициной не признана, и ее методы не проходят серьезных клинических испытаний. До сих пор не существует веских доказательств того, что она действует за счет заявленных полезных компонентов, а не за счет эффекта плацебо. Далеко не все пациенты гомеопатов отмечают улучшение своего самочувствия. В любом случае, гомеопатическое лечение печени — процесс длительный, занимающий не один месяц. Распад гепатоцитов и рост фиброзной ткани могут развиваться быстрее. Если говорить о циррозе печени, то у больного просто нет времени на рискованное лечение.
При компенсированном и субкомпенсированном циррозе назначается поддерживающая терапия – строгая диета и гепатопротекторы (лекарства на основе глицирризиновой кислоты, фосфолипидов, аминокислот, расторопши (Silybum marianum Carduus marianus) и других компонентов, способствующих восстановлению функций печени). При вирусном циррозе используется противовирусная терапия (ПВТ). Однако, справедливо заметить, что специфического лечения цирроза нет.
Глицирризиновая кислота — это биологически активное вещество, которое в природе встречается в корне солодки (Glycyrrhiza glabra), по имени этого растения оно и получило свое название. Однако гепатопротекторные функции глицирризиновой кислоты были изучены не так давно, поэтому до сих пор ее можно встретить далеко не в каждом лекарственном препарате против заболеваний печени. Особенно эффективен комплекс глицирризиновой кислоты и фосфатидилхолина — многочисленные клинические исследования показали его противовоспалительное, гепатопротекторное и антифибротическое действие.
На декомпенсированной стадии цирроза медикаментозная терапия мало эффективна и необходимо ставить вопрос о трансплантации (пересадке) печени. , Таким образом, лечение цирроза – крайне непростая задача, поэтому лучше его предотвратить. С этой целью при заболевании печени невирусной природы или вирусном гепатите и недоступной ПВТ, врачи могут назначить российский препарат на основе глицирризиновой кислоты, который приемлем по цене и почти не имеет противопоказаний (за исключением стандартных: аллергических реакций на компонент, беременности и периода лактации). Компоненты препарата защищают печеночные клетки от повреждения, уменьшают воспаление, разрастание соединительной ткани и способствуют восстановлению органа.
Если вышеуказанные методы лечения не помогают, проводят трансплантацию (пересадку) печени. Хирургическое вмешательство необходимо на последней, декомпенсированной, стадии заболевания, когда печень уже не выполняет своих функций. Кроме того, часть печени может быть взята у родственника больного или другого человека, который выразил свое согласие на эту операцию.
К числу профилактических мероприятий можно отнести любые процедуры по предупреждению заражения гепатитом, который является частой причиной цирроза печени. Рекомендуется вести здоровый образ жизни, отказаться от алкоголя и соблюдать сбалансированную диету, не увлекаться жареными и жирными продуктами. Следует с осторожностью относиться к чрезмерному приему лекарственных средств, многие из которых являются токсичными для печени. Стоит также позаботиться о нивелировании неблагоприятных экологических условий окружающей среды, которые могут оказывать негативное влияние на клетки печени — больше отдыхайте на свежем воздухе.
Один из эффективных методов предупреждения цирроза — прием гепатопротекторных препаратов при заболеваниях печени. Они защищают клетки печени, восстанавливают их структуру, уменьшают степень воспаления, нормализуют белковый и липидный обмены, приостанавливают развитие фиброза. Так, глицирризиновая кислота обладает антиоксидантной и мембраностабилизирующей активностью, потенцирует действие эндогенных глюкокортикостероидов, оказывая противовоспалительное действие при неинфекционных поражениях печени. Положительный эффект данного соединения был доказан в ходе 54 клинических исследований, из них 31 — рандомизированное. Испытания проводились на разных категориях пациентов, в том числе больных гепатитом и алкогольной болезнью печени. Во всех этих исследованиях профиль безопасности глицирризиновой кислоты был оценен как благоприятный, что позволило включить ее в рекомендации Азиатско-Тихоокеанской ассоциации по изучению печени (APASL) и разрешить для медицинского применения человеком Европейским медицинским агентством (EMA).
Итак, прием современных гепатопротекторов — надежный и безопасный способ улучшить клиническую картину болезни печени, однако любое самолечение недопустимо, и, несмотря на то, что многие лекарственные препараты допущены к продаже без рецепта, обязательно проконсультируйтесь с врачом.

Цирроз печени — тяжелое заболевание, негативно влияющее на работу всего организма, требующее длительного и сложного лечения. Поэтому, если у вас выявлено то или иное заболевание печени, необходимо сделать все возможное, чтобы затормозить патологические процессы и максимально восстановить функции печени. Многое зависит от вас. Начните с самодисциплины, взяв под тотальный контроль ваше питание, распорядок дня и прием лекарств, назначенных врачом — уже только это способно значительно улучшить прогноз.
Читайте также:


